Известия РАН. Серия биологическая, 2019, № 1, стр. 7-18
Общие закономерности и особенности морфогенеза катехоламинергических систем у гастропод и немертин, эволюционные аспекты
О. В. Зайцева a, *, А. Н. Шумеев a, С. А. Петров a
a Зоологический институт РАН
199034 Санкт-Петербург, Университетская наб., 1, Россия
* E-mail: ovzaitseva@inbox.ru
Поступила в редакцию 14.05.2018
После доработки 31.07.2018
Принята к публикации 31.07.2018
Аннотация
Представлены данные по распределению катехоламинсодержащих регуляторных клеток и иннервации ими различных частей тела и органов у представителей гастропод и немертин. Показаны общие и специфические закономерности морфогенеза катехоламинергических нейроэндокринных систем, приведены данные, свидетельствующие в пользу универсальности ряда принципов их организации и функций. Отмечено, что результаты исследования позволяют предположить участие катехоламинергических систем в осуществлении механосенсорных функций, локомоции и других двигательных актов, в регуляции работы пищеварительной системы, в работе связанных с половыми функциями эндокринных желез, в выполнении центральных интегративных функций, а также в реализации различных форм защитно-оборонительного поведения.
Нейроны, синтезирующие биогенные амины (катехоламины (КА) и серотонин), – важные составляющие периферической и центральной нервной систем всех исследованных к настоящему времени беспозвоночных и позвоночных животных. Моноаминергические нейроны одни из первых появляются в ходе эволюции и онтогенеза животных и играют важную роль в их морфогенезе (Сахаров, 1974; Hay-Schmidt, 1990; Joffe, Kotikova, 1991; Croll et al., 1997; Voronezhskaya et al., 1999; Dickinson et al., 2000; Welsh, Willams, 2004; Croll, 2006; Baratte, Bonnaud, 2009). Наиболее распространенный катехоламин у беспозвоночных – дофамин. Показано, что у позвоночных животных дофамин- и серотонинергические системы осуществляют регуляцию нейроэндокринных, репродуктивных, пищеварительных и поведенческих функций (Овсянников, 2005; Пущина, 2009). Есть сведения о том, что эти системы играют сходную роль и у представителей беспозвоночных (Solon, Koopowitz, 1981; Schlawny et al., 1991; Smith et al., 1998; Croll et al., 1999; Faccioni-Heuser et al., 2004; Wyeth, Croll, 2011). Отмечено важное для регуляции поведения у животных разного уровня организации паракринное действие этих веществ (Овсянников, 2005; Дьяконова, 2012). Интересно, что КА и серотонин (5-HT), по всей видимости, выступают в качестве антагонистов при формировании основных форм поведения у животных (защитно-оборонительного и пищевого, связанного с поисковыми реакциями). Повышенные концентрации 5-HT приводят к преобладанию у представителей разных по уровню организации животных пищевого поведения над защитно-оборонительным (Дьяконова, 2012). Для дальнейшего понимания функциональной роли и становления моноаминергических систем в ходе фило- и онтогенеза животных необходимы сведения по беспозвоночным, которые в этом плане остаются мало изученными. Прежде всего, это относится к катехоламинергическим (КАе) системам, выявление которых сопряжено с рядом методических трудностей.
Цель работы – анализ и обобщение собственных экспериментальных данных по особенностям и общим закономерностям становления и развития КАе регуляторных систем в ходе исторического развития у ряда разных по общему уровню организации, среде обитания, образу жизни и систематическому положению представителей брюхоногих моллюсков и немертин.
Особое внимание в работе уделено КАе клеткам периферической нервной системы, где концентрируются сенсорные и эффекторные элементы нервной системы. Исследование локализации и особенностей распределения отростков, содержащих КА клеток в различных участках тела и органах с известной функцией, может способствовать пониманию роли КА в жизнедеятельности исследованных животных.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве объектов исследования были выбраны взрослые, а в отдельных случаях и ювенильные особи представителей брюхоногих моллюсков из подкласса морских Opisthobranchia из отр. Doridida – Cadlina laevis (L., 1758) сем. Chromodorididae, а из отр. Nudibranchia – Nudibranchus rupium (Müller,1842) сем. Eubranchidae, Coryphella verrucosa (M. Sars, 1829) сем. Flabellinidae и Aeolidia papillosa (Linnaeus, 1761) сем. Aeolidiidae. Кроме этого исследовались представители наземных легочных улиток и слизней из отр. Stylommatophora – Achatina fulica (Bowdich, 1822) сем. Achatinidae и Lehmannia valentiana (Férussac, 1821) сем. Limacidae, а также в качестве представителей немертин – Lineus ruber (Müller, 1774) (Anopla: Pilidiophora).
Морских представителей моллюсков собирали на Белом море на биологической станции “Картеш” ЗИН РАН и содержали в лабораторных условиях, максимально приближенных к естественным. Слизней брали из оранжереи Ботанического института им. В.Л. Комарова РАН, а улиток – из лабораторной культуры лаборатории эволюционной морфологии ЗИН РАН.
Выявление КА осуществляли с помощью формальдегид-глутаральдегидного флуоресцентно-гистохимического метода (FaGlu) Фернесса с соавт. (Furness et al., 1977) в модификации Воронежской с соавт. (Voronezhskaya et al., 1999), а также с помощью гистохимического метода GIF вызванной флуоресценции КА с помощью глиоксиловой кислоты (De la Torre, Surgeon, 1976).
Для выявления КА методом FaGlu животных фиксировали 2–4 ч при комнатной температуре в 4%-ном растворе параформальдегида и 0.5%-ном растворе глутаральдегида в 0.01 М фосфатно-солевом буфере (PBS) с рН 7.3. После фиксации объекты размещали на предметном стекле, высушивали под вентилятором 2 ч при комнатной температуре и заключали в 80%-ный глицерин на PBS. Для изучения использовали тотальные препараты отдельных отпрепарированных частей тела и органов животных и целых небольших животных. Визуализацию свечения КА осуществляли с помощью микроскопа Leica DM 4000B с флуоресцентным фильтром Leica E4 и камерой Leica DFC350FX. После использования фиксатора с pH 7.3 выявлялись только КА (Wreford et al., 1982), которые обладали характерным голубым свечением. 5-НТ, который также может выявляться методом FaGlu и иметь желто-зеленоватое свечение, не обнаруживался на исследованных препаратах, поскольку для его выявления используется обычно фиксация в более щелочной среде с рН 10 (Wreford et al., 1982).
Выявление КА с помощью глиоксиловой кислоты (GA) методом GIF проводили путем фиксации живых объектов в свежеприготовленном рабочем растворе GA (1 ч при 4°С). После этого объекты размещали на предметных стеклах и высушивали (30 мин при комнатной температуре под вентилятором, затем 30 мин при 60°С). Высушенные объекты заключали в вазелиновое масло. Рабочий раствор GA готовили по прописи: растворить 92 мг GA (Sigma-Aldrich, Германия, кат. № G10601) в 1 мл дистиллированной воды (финальная концентрация 1 M), добавить 92 мг NaHCO3, после окончания нейтрализации добавить HEPES (финальная концентрация 0.1 М) и 100 мг сахарозы (финальная концентрация 300 мМ).
Окрашенные методом GIF препараты, а также часть препаратов, окрашенных методом FaGlu, исследовали с помощью конфокального микроскопа Leica TCS SP5 центра коллективного пользования “Таксон” ЗИН РАН (http://www.ckp-rf.ru/ckp/3038/HYPERLINK“http://www.ckp-rf. ru/ckp/3038/)/”). Флуоресценцию КА возбуждали фиолетовым лазером (405 нм) и регистрировали в диапазоне 420–480 нм, что соответствует спектру эмиссии КА (Wreford et al., 1982).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
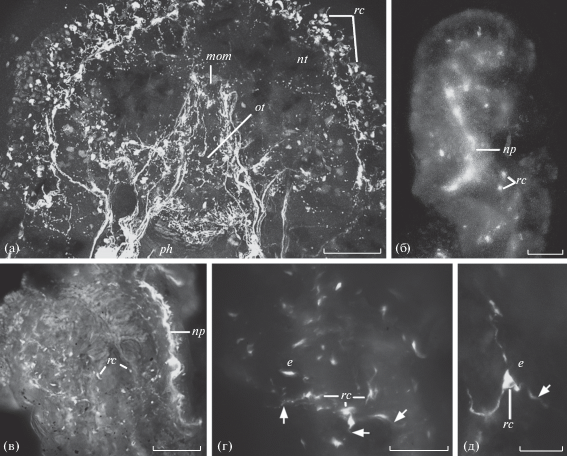
Большое число клеток, содержащих КА, выявляется у всех исследованных животных во всех ганглиях центральной нервной системы (ЦНС) и на периферии в стенке тела и во внутренних органах. Прежде всего, обращает на себя внимание достаточно равномерное и сходное распределение катехоламинсодержащих (КАс) клеток по всему кожному покрову у гастропод и немертин, включая стенку их тела, голову (головную лопасть у немертин), а также мантию и ногу у гастропод (рис. 1, 2). Все эти клетки обычно лежат по одной или однотипными небольшими группами и образуют сенсорные окончания на поверхности эпителия. Они в целом сходны по строению: имеют биполярную форму, их короткий чувствительный периферический отросток оканчивается на поверхности покровного эпителия небольшим расширением, несущим пучок ресничек, а центральные отростки образуют нервные сплетения в стенке тела или головы и направляются по соответствующим нервам к ЦНС.
Рис. 1.
Распределение катехоламинов в кожных покровах гастропод Cadlina laevis (а, б, е), Coryphella verrucosa (в), Nudibranchus rupium (д) и Aeolidia papillosa (г). Реконструкции по сделанным на разной глубине сериям оптических срезов, полученных на конфокальном (а, б, е) и флуоресцентном (в–д) микроскопах. Флуоресцентные гистохимические методы FaGlu (а, г, д) и GIF (б, в, е). cer.g. – церебральный ганглий, dg – пищеварительная железа, e – эпителий, ff и hf – передняя и задняя части подошвы ноги соответственно, nc – нервные клетки, nt – нотум, ped.g. – педальный ганглий, ped.n. – педальный нерв, rc – КАс рецепторные клетки, rh – ринофор, стрелками обозначены реснички на апикальной поверхности катехоламинсодержащих рецепторных клеток. Масштаб: 100 (а, в), 50 (б, д, е) и 5 (г) мкм.
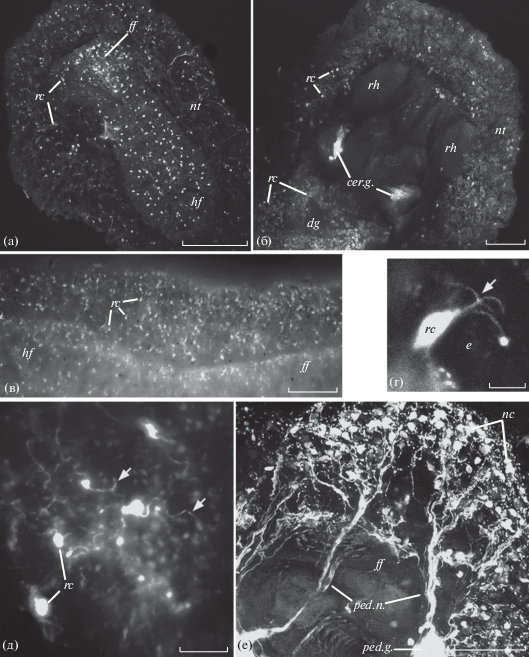
Рис. 2.
Распределение катехламинов у немертины Lineus ruber. а – головная лопасть; б, в – катехоламинсодержащие рецепторные клетки в кожных покровах головы и стенки тела соответственно; г – ретрактор хобота. Реконструкции по сделанным на разной глубине сериям конфокальных оптических срезов тотальных препаратов целого животного (а–в) и изолированного хобота с ретрактором (г). Методы GIF (а–в) и FaGlu (г). cg – церебральные железы, lcs – латеральные церебральные щели, np – нервные отростки, остальные обозначения такие же, как на рис. 1. Масштаб: 100 (а, б) и 25 (в, г) мкм.
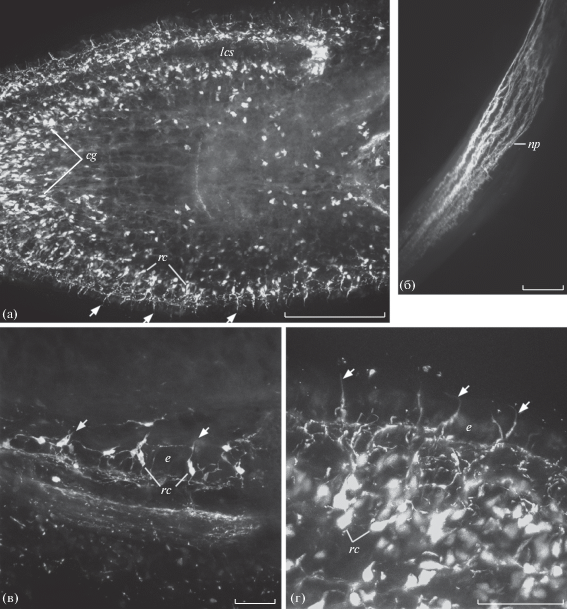
Реснички КАс клеток также проявляют характерную для КА голубую флуоресценцию, однако вследствие малого количества в них КА быстро выгорают при наблюдении в микроскоп. Различия между указанными рецепторными клетками заключаются только в их расположении по отношению к покровному эпителию и выраженности периферического отростка. Клетки, тела которых лежат под эпителием, имеют более длинные периферические отростки. У расположенных в эпителии КАс клеток периферические отростки более короткие и в отдельных случаях могут отсутствовать. Тогда реснички располагаются на суженной у поверхности эпителия апикальной поверхности клетки (рис. 1г). Такие различия, очевидно, не связаны с разной функцией клеток, а отражают происходящие в ходе эволюции у всех животных процессы постепенного погружения нервных элементов под эпителий (Беклемишев, 1964). Они были показаны ранее на рецепторных клетках брюхоногих моллюсков разных таксономических групп (Zaitseva 1984, 1994, 1997, 1998, 1999; Зайцева, 2000) и выявлены у представителей нескольких видов немертин (Markosova et al., 2007; Zaitseva et al., 2007). В отдельных местах кожных покровов исследованных животных описанные выше КАс рецепторные клетки располагаются немного плотнее. К ним относятся область рта у моллюсков и немертин, латеральные церебральные щели немертин (рис. 2а), вентральная поверхность передних и фронтальная поверхность задних головных щупалец у представителей моллюсков из отр. Nudibranchia. В подошве ноги всех исследованных моллюсков и в стенке тела немертин обнаруживается некоторое количество КАс субэпителиальных биполярных рецепторных клеток с ветвящимся в эпителии периферическим чувствительным отростком.
Значительное количество КАс нервных клеток, судя по распределению терминальных ветвлений их отростков, участвует в иннервации мускулатуры стенки тела, хобота (особый орган для ловли добычи и защиты) и его ретрактора у немертин (рис. 2б). У всех исследованных моллюсков большое количество КАс нейронов обнаруживается в ноге, где их отростки образуют нервные сплетения в мускулатуре (рис. 1е). Эти нейроны располагаются в ноге тремя парными симметричными группами по числу нервов педальных ганглиев, в которые уходит часть их отростков. Первая пара этих групп локализуeтся и иннервируeт переднюю часть ноги, вторая – среднюю, а третья – заднюю. Активное участие КАс клеток в иннервации мускулатуры у всех исследованных животных свидетельствует о важной роли КА в регуляции локомоции и других двигательных актов.
Хотя данные по распределению КАс регуляторных клеток у других беспозвоночных немногочисленны, можно отметить, что наличие большого числа КАс рецепторных клеток в кожных покровах, включая область рта, и участие КА в иннервации мускулатуры тела были выявлены и у других видов немертин (Zaitseva et al., 2007; Zaitseva, Petrov, 2013), у брюхоногого моллюска Lymnaea stagnalis (Croll et al., 1999; Wyeth, Croll, 2011), у представителей плоских червей (Joffe, Kotikova, 1991; Welsh, Williams, 2004), у аннелид (Фоминых, 1982; Schlawny et al., 1991) и у мшанок (Shunkina et al, 2014). Рядом исследователей была показана КАе иннервация ноги у брюхоногих и двустворчатых моллюсков уже на ранних стадиях их развития (Croll et al., 1997, 1999; Smith et al., 1998; Dickinson et al., 2000; Faccioni-Heuser et al., 2004; Croll, 2006). Участие КА в регуляции мышечных сокращений хобота у немертин доказано электрофизиологическими методами на примере немертины Paranemertes peregrina (Solon, Koopowitz, 1981). Электрофизиологическими методами показано также участие дофамина в активации перистальтики мускулатуры стенки тела у дождевого червя. При этом основнаю роль в активации этой перистальтики играют дофоаминергические сенсорные системы (Bieger, Hornykiewicz, 1972).
Значительное число КАе клеток обнаружено нами в церебральных железах у немертин (рис. 2а). Им приписывают эндокринную функцию и участие в регуляции полового поведения (Ferraris, 1985). КАс нервные сплетения и отдельные клетки нам удалось обнаружить и в органах половой системы исследованных моллюсков. КАе отростки и тела нейронов были ранее описаны в органах мужской и женской половых систем и у моллюска L. stagnalis (Croll et al., 1999).
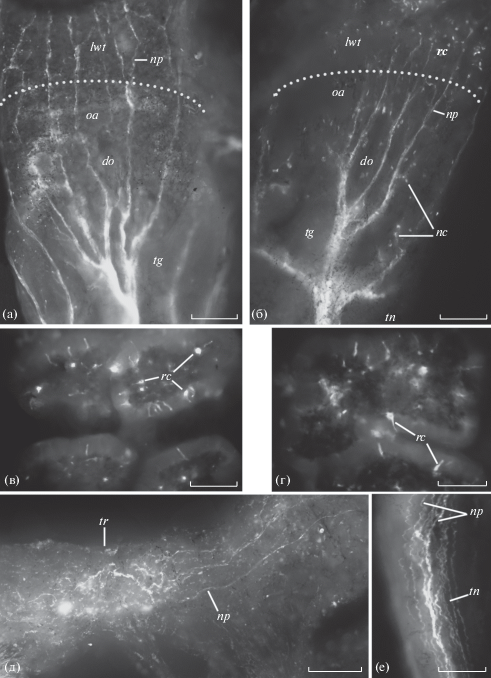
В специализированных обонятельных тентакулярных органах у наземных легочных моллюсков A. fulica и L. valentiana присутствует относительно небольшое число КАс нервных элементов. Следует отметить, что они полностью отсутствуют в вершине щупалец, где, как известно, у наземных легочных улиток и слизней, располагаются тела первично чувствующих обонятельных клеток (Chase, 1986; Zaitseva, 1991, 1994, 2004, 2016). Головные щупальца наземных легочных моллюсков при опасности способны целиком вворачиваться и втягиваться внутрь головного синуса за счет мощных ретракторов. Ретракторы крепятся к вершине щупальца (рис. 3). КАс рецепторные клетки обнаруживаются только в кожных покровах боковой стенки щупалец, которым присуща только общая тактильная чувствительность (рис. 4). Эти клетки сходны по расположению относительно эпителия и своей морфологии с описанными выше КАс рецепторным клетками кожных покровов тела и головы моллюсков. Аксоны КАс рецепторных клеток боковой поверхности щупалец в виде отдельных пучков проходят по соответствующим пальцевидным выростам тентакулярного ганглия в его нейропиль, не заходя в область локализации обонятельных клеток, и далее, по всей видимости, уходят в тентакулярный нерв к церебральным ганглиям (рис. 4а, б, е). Иннервация боковой поверхности щупалец через тентакулярный ганглий была показана с помощью ретро- и антероградного транспорта пероксидазы хрена (Zaitseva, 2004). К КАе системе головных щупалец можно отнести и несколько нейронов, расположенных в тентакулярном ганглии недалеко от места выхода тентакулярного нерва (рис. 4б), а также нервное сплетение в ретракторе щупальца (рис. 4д). Судя по крупным размерам и распределению КАс нервные отростки, осуществляющие иннервацию ретрактора, тела нейронов, которым они принадлежат, скоре всего располагаются в ЦНС. Следует отметить, что в области преимущественной локализации обонятельных клеток головного щупальца (ринофора) у моллюска C. laevis КАс рецепторные клетки также не обнаруживаются (рис. 1б).
Рис. 3.
Схема организации ввернутого обонятельного головного щупальца наземных легочных моллюсков. do – пальцевидные выросты тентакулярного ганглия (tg), lwt – боковая стенка щупальца, m – мышцы и n – нервы в ней; oa – область обонятельных клеток, tn – тентакулярный нерв, tr – тентакулярный ретрактор.
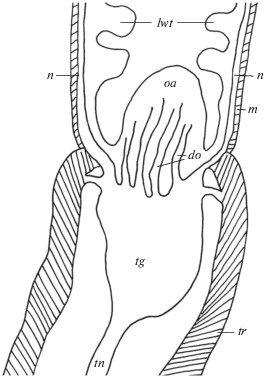
Рис. 4.
Распределение катехоламинов в головном щупальце наземных легочных моллюсков Achatin. fulica (а, в, д, е) и Lehmannia valentiana (б, г). а, б – дорсальная и вентральная стороны вершины ввернутого головного щупальца; в, г – кожные складки боковой стенки щупальца с катехоламинсодержащими рецепторными клетками; д, е – участки тентакулярного ретрактора и нерва соответственно. Метод FaGlu, реконструкции по сделанным на разной глубине сериям оптических срезов тотальных препаратов изолированных головных щупалец, полученных с помощью флуоресцентного микроскопа. Пунктиром обозначена вершина ввернутого щупальца. Остальные обозначения такие же, как на рис. 1–3. Масштаб: 200 (а), 100 (б, д) и 50 (в, г, е) мкм.
У всех исследованных животных КА, по всей видимости, принимают активное участие в регуляции работы пищеварительной системы. КАс интра- и субэпителиaльные рецепторные клетки равномерно распределены вдоль всего пищеварительного тракта у моллюсков и немертины L. ruber (рис. 5а, 5в, г). Выявляются они также в слюнных и пищеварительной железах у гастропод (рис. 5б, д). Они в целом сходны по морфологии с КАс рецепторными клетками кожных покровов, но в пищеварительном тракте преобладают интраэпителиальные рецепторные клетки. В нервах, иннервирующих стенку пищеварительного тракта и слюнные железы, наблюдается значительное число КАе нервных волокон. Их большая часть приходит из ЦНС и образует в мышечной стенке пищеварительного тракта сплетения (рис. 5а–в). Наиболее мощные КАе сплетения обнаруживаются в мускулистых глотке и желудке. КАс нервные сплетения с телами нейронов хорошо видны на тотальных препаратах ювенильных C. laevis в области челюстей и радулярного аппарата глотки, что дает возможность предположить участие КА в регуляции работы мускулатуры, обеспечивающей функционирование радулярного аппарата, заглатывание и продвижение по тракту пищи.
Рис. 5.
Распределение катехоламинов в пищеварительной системе гастропод Cadlina laevis (а), Lehmannia valentiana (б, д) и Achatina fulica (в, г). а – передний отдел пищеварительной системы, включая рот (mom), ротовую трубку (ot) и глотку (ph) на тотальном препарате целого моллюска; б, д – тотальные препараты слюнной и пищеварительной желез соответственно; в, г – внутренняя поверхность изолированного и разрезанного вдоль пищевода. Методы GIF (а) и FaGlu (б–д), реконструкции по сделанным на разной глубине сериям оптических срезов, полученных на конфокальном (а) или флуоресцентном (б–д) микроскопах. Остальные обозначения такие же, как на рис. 1 и 2. Масштаб: 100 (в), 50 (а, б, г) и 25 (д) мкм.
Возможное участие КА в регуляции работы пищеварительного тракта было показано рядом авторов и у других беспозвоночных – представителей плоских червей (Joffe, Kotikova, 1991; Welsh, Williams, 2004), аннелиды Ophryotrocha puerilis (Schlawny et al., 1991), моллюска L. stagnalis (Croll et al., 1999) и ряда видов немертин (Markosova et al., 2007; Zaitseva, Petrov, 2013).
Подводя итог, следует прежде всего отметить безусловно важную роль КА в осуществлении сенсорных функций и разнообразных двигательных актов, включая локомоцию у всех исследованных в настоящее время беспозвоночных. КА с удивительным постоянством обнаруживаются в первично чувствующих рецепторных клетках тех участков кожных покровов исследованных животных, которые не специализированы на выполнение сенсорных функций, но обладают общей механической чувствительностью, а также в нервных элементах, осуществляющих иннервацию локомоторного аппарата и основных ретракторов у животных. Эти закономерности проявляются независимо от принадлежности животных к разным таксономическим группам, различий в строении их тела и в способах передвижения, а также от среды их обитания и образа жизни.
Проведенные ранее многочисленные морфофизиологические и поведенческие исследования сенсорных систем представителей гастропод позволили не только выявить их чувствительность к ряду стимулов разной модальности (Сахаров, 1974; Janse, 1974; Chase, 1986; Zaitseva et al., 1987, 1993; Shuvalova, Zaitseva, 1988; Gervais et al., 1996), но и описать у них с помощью импрегнации серебром методом Гольджи–Коланье и электронной микроскопия несколько типов рецепторных клеток в покровах стенки тела и хемосенсорных органах (Zaitseva, Bocharova, 1981; Zaitseva, 1984, 1994, 1997, 1998, 1999). Описанная преимущественная локализация отдельных морфологических типов клеток в зонах с разными преобладающими видами чувствительности позволила связать морфологию клеток с определенной модальностью (Zaitseva, 1984, 1994). В области рта, на вентральной поверхности губ и передних (губных) щупальцах, к которым приурочена вкусовая и высокая тактильная чувствительность, у разных видов моллюсков преобладают клетки, отнесенные ранее (Zaitseva, 1994) к первому и третьему типам соответственно (рис. 6б и в соответственно). В обонятельных головных щупальцах (задние головные щупальца, омматофоры, ринофоры) у моллюсков наблюдается высокая плотность рецепторных клеток второго типа (рис. 6а). Апикальная поверхность этих клеток во многом сходна с сенсорной поверхностью обонятельных клеток позвоночных. Именно такие клетки образуют основную массу рецепторных клеток обонятельных вершин головных щупалец наземных легочных улиток и слизней (рис. 4). В остальных кожных покровах головы и тела моллюсков, где преобладает общая механическая чувствительность, основная масса рецепторных клеток представлена клетками третьего и пятого (с ветвящимся в эпителии чувствительным отростком) типов (Zaitseva, 1994). Выявленные нами в кожных покровах моллюсков и немертин КАс рецепторные клетки (рис. 6г) сходны по своей морфологии с клетками третьего и пятого типов. Этот факт, а также их локализация в покровах с преобладающей тактильной чувствительностью и их полное отсутствие в зонах локализации обонятельных клеток позволяют рассматривать их в качестве механорецепторных. В пользу этого же косвенно может свидетельствовать участие дофаминергических рецепторных клеток в регуляции локомоторных перистальтических движений изолированных сегментов тела у дождевого червя (Bieger, Hornykiewicz, 1972).
Рис. 6.
Сводная схема разных типов рецепторных клеток, выявленных у гастропод и немертин на основании более ранних исследований с помощью импрегнации азотно-кислым серебром методом Гольджи–Колонье иммуноцитохимии и электронной микроскопии (а–в), а также описанных нами с помощью выявления катехоламинов (г). а – обонятельные, б – вкусовые, в – механорецепторные, e – эпителий.
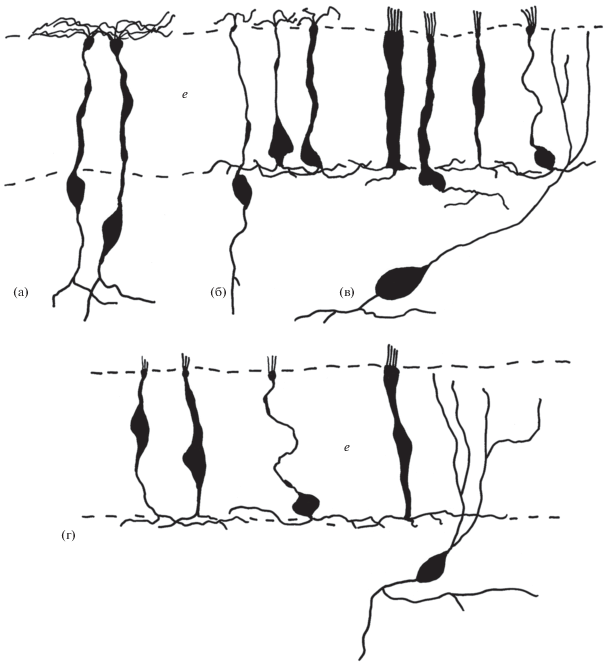
Как известно, механическая чувствительность присуща и пищеварительному тракту животных (Овсянников, 2005). Обнаруженные нами в эпителии пищеварительного тракта немертин и моллюсков КАс рецепторные клетки сходны с описанными выше КАс рецепторными клетками кожных покровов и также могут представлять собой механорецепторы (рис. 6г). Это не означает, что все механорецепторные клетки у исследованных беспозвоночных являются КАе. С помощью импрегнации серебром методом Гольджи–Коланье и сканирующей электронной микроскопии в кожных покровах тела, сенсорных органах и в стенке пищеварительного тракта у моллюсков обнаруживается число рецепторных клеток, значительно превосходящее таковое при выявлении КА (Zaitseva, 1984, 1994, 1997, 1998, 1999, 2006, Zaitseva et al., 2004). Среди них отмечены рецепторные клетки, обладающие холинэстеразной (холинтрансферазной) и NADPH-диафоразной активностью, содержащие FMRFамид, нейротензин, субстанцию Р, 5-HT, GABA и другие регуляторные вещества (Suzuki et al., 1997; Зайцева, Кузнецова, 2008; Zaitseva et al., 2009, 2015; Zaitseva, Shumeev, 2017). Аналогичные данные получены и на немертинах (Zaitseva et al., 2004, 2007; Markosova et al., 2007; Zaitseva, Markosova, 2009).
ЗАКЛЮЧЕНИЕ
Представленные данные демонстрируют сходство в распределении в периферической нервной системе регуляторных КАс клеток и иннервации ими различных частей тела и органов у брюхоногих моллюсков и немертин. К ним в первую очередь можно отнести многочисленные первично чувствующие суб- и интраэпителиальные рецепторные клетки с собранными в виде кисточек на апикальной поверхности ресничками. Эти клетки равномерно распределяются в кожных покровах всего тела, головы (головной лопасти у немертин) и в стенке всего пищеварительного тракта. Они отсутствуют в обонятельных отделах головных щупалец, но образуют более плотные скопления в области рта, где, как известно, кроме вкусовой чувствительности хорошо развита и тактильная.
Анализ полученных данных позволяет сделать предположение о механосенсорной функции КАе рецепторных клеток. Наряду с этим выявлена иннервация КАс нейронами мускулатуры стенки тела, ноги (у моллюсков), хобота (у немертин) и всех основных ретракторов. Эти данные свидетельствуют о возможности участия КАе систем в восприятии и реализации общей механической чувствительности путем регуляции локомоции и других двигательных актов, связанных, в том числе, с осуществлением различных форм защитно-оборонительного поведения. КА могут выполнять у исследованных животных также эндокринные функции, регуляцию полового поведения и участвовать в выполнении центральных интегративных функций. Эти результаты в целом согласуются с полученными ранее данными по локализации и возможной роли КАе систем у представителей других филогенетических ветвей животных. Все это свидетельствует о раннем и параллельном развитии КАе нейроэндокринных систем в ходе эволюции у разных групп многоклеточных, а также об универсальности основных принципов их организации и функций.
Авторы благодарят А.В. Мартынова (Зоологический музей МГУ им. М.В. Ломоносова) за помощь в уточнении видовой принадлежности используемых в работе голожаберных моллюсков и за предоставление живых ювенильных особей моллюска C. laevis.
Работа выполнена в рамках темы государственного задания АААА-А17-117030110029-3 и поддержана РФФИ (гранты 15-29-02650офи_м и 18-04-01213а).
Список литературы
Беклемишев В.Н. Основы сравнительной анатомии беспозвоночных. Т. 2. М.: Наука, 1964. 446 с.
Дьяконова В.Е. Нейротрансмиттерные механизмы контекст-зависимого поведения // Журн. высш. нерв. деятельности им. И.П. Павлова. 2012. Т. 62. № 6. С. 664–680.
Зайцева О.В. Доминантные структурно-функциональные адаптации дистантных хемосенсорных систем в филогенезе брюхоногих моллюсков // Рос. физиол. журн. им. И.М. Сеченова. 2000. Т. 86. № 8. С. 995–1006.
Зайцева О.В., Кузнецова Т.В. Распределение ацетилхолинэстеразной активности в стомато-гастрической системе брюхоногих моллюсков Littorina littorea и Achatina fulica // Морфология. 2008. Т. 133. № 1. С. 55–59.
Овсянников В.И. Нейромедиаторы и гормоны в желудочно-кишечном тракте. СПб.: ФИН РАН, 2005. 136 с.
Пущина Е.В. Тирозин-гидроксилаза в ядрах конечного и промежуточного мозга горчака Rhodeus sericeus (Cyprynidae) // Цитология. 2009. Т. 51. № 1. С. 63–77.
Сахаров Д.А. Генеалогия нейронов. М.: Наука, 1974. 165 с.
Фоминых М.Я. Чувствительные нервные клетки в эпителии и субэпителиальной соединительной ткани туловищных сегментов полихет Nephthys hombergii и Harmathoe imbricata // Журн. эволюц. биохимии и физиологии. 1982. Т. 18. № 52. С. 507–513.
Baratte S., Bonnaud L. Evidence of early nervous differentiation and early catecholaminergic sensory system during Sepia officinalis embryogenesis // J. Comp. Neurol. 2009. V. 517. P. 539–549.
Bieger D., Hornykiewicz 0. Preliminary note dopamine in the earthworm, Lumbricus terreszxis: enhancement of rhythmic contractile activity // Neuropharmacology. 1972. V. 11. P. 745–748 .
Chase R. Lessons from snail tentacles // Chem. Sci. 1986. V. 11. P. 411–426.
Croll R.P. Development of embryonic and larval cells containing serotonin, catecholamines and FMRFamide-related peptides in the gastropod mollusk Phestilla sibogae // Biol. Bull. 2006. V. 211. P. 232–247.
Croll R.P., Jackson D.L., Voronezhskaya E.E. Catecholamine containing cells in larval and postlarval bivalve molluscs // Biol. Bull. 1997. V. 193. P. 116–124.
Croll R.P., Voronezhskaya E.E., Hiripi L., Elekes K. Development of catecholaminergic neurons in the pond snail, Lymnaea stagnalis: II. Postembryonic development of central and peripheral cells // J. Comp. Neurol. 1999. V. 404. P. 297–309.
De la Torre J.C., Surgeon J.W. A methodological approach to rapid and sensitive monoamine histofluorescence using a modified glyoxylic acid technique: the SPG method // Histochemistry. 1976. V. 49. № 2. P. 81–93.
Dickinson A.J., Croll R.P., Voronezhskaya E.E. Development of embryonic cells containing serotonin, catecholamines, and FMRFamide-related peptides in Aplysia californica reference // Biol. Bull. 2000. V. 199. P. 305–315.
Faccioni-Heuser M.C., Zancan D.M., Achaval M. Monoamines in the pedal plexis of the land snail Megalobulimus oblongus (Gastropoda, Pulmonata) // Brazil. J. Med. Biol. Res. 2004. V. 37. P. 1043–1054.
Ferraris J.D. Putative neuroendrocrine devices in the nemertina - an overview of structure and function // Amer. Zoologist. 1985. V. 25. № 1. P. 73–85.
Furness J.B., Costa M., Wilson A.J. Water-stable fluorophores, produced by reaction with aldehyde solutions, for the histochemical localization of catechol- and indolethylamines // Histochemistry. 1977. V. 52. № 2. P. 159–170.
Gervais R., Kleinfeld D., Delaney K.R., Gelperin A. Central and reflex responses elicited by odor in a terrestrial mollusk // J. Neurophysiol. 1996. V. 76. P. 1327–1339.
Hay-Schmidt A. Distribution of catecholamine-containing, serotonin-like and neuropeptide FMRFamide-like immunoreactive neurons and processes in the nervous system of the actinotroch larva of Phoronis muelleri (Phoronida) // Cell Tiss. Res. 1990. V. 259. №. 1. P. 105–118.
Janse C. A neurophysiological study of the peripheral tactile system of the pond snail Lymnaea stagnalis L. // Neth. J. Zool. 1974. V. 24. P. 93–161.
Joffe B.I., Kotikova E.F. Distribution of catecholamines in turbellarians (winh a discussion of neuronal homologues in the Platyhelminthes) // Studies Neurosci. 1991. № 13. P. 77–112.
Markosova T.G., Zaitseva O.V., Smirnov R.V. Monoamine- and peptide- containing elements in the nemertine digestive tract // J. Evol. Biochem. Physiol. 2007. V. 43. № 1. P. 69–79.
Schlawny A., Hamann T., Miiller M.A., Pfannenstiel H.D. The catecholaminergie system of an annelid (Ophryotrocha puerilis, Polychaeta) // Cell Tiss. Res. 1991. V. 265. P. 175–184.
Shunkina K.V., Zaitseva O.V., Starunov V.V., Ostrovsky A.N. Sensory elements and innervation in the freshwater Bryozoan Cristatella mucedo lophophore // Dokl. Biol. Sci. 2014. V. 455. P. 125–128.
Shuvalova N.E., Zaitseva O.V. Morphological features and responses of neurons in the right parietal ganglion of Lymnaea stagnalis to stimulation of sensory structures // J. Evol. Biochem. Physiol. 1988. V. 24. № 5. P. 538–543.
Smith S.A., Nason J., Croll R.P. Distribution of catecholamines in the sea scallop, Placopecten magellanicus // Can. J. Zool. 1998. V. 76. P. 1254–1262.
Solon M.H., Koopowitz H. Neuromuscular control systems in the proboscis of Paranemertes peregrina // Mar. Freshwater Behav. Physiol. 1981. V. 7. P. 331–343.
Suzuki H., Kimura T., Sekiguchi T., Mizukami A. FMRFamide-like-immunoreactive primary sensory neurons in the olfactory system of the terrestrial mollusc, Limax marginatus // Cell Tiss. Res. 1997. V. 289. № 2. P. 339–345.
Voronezhskaya E.E., Hiripi L., Elekes K., Croll R.P. Development of catecholaminergic neurons in the pond snail, Lymnaea stagnalis: I. Embryonic development of dopamine-containing neurons and dopamine-dependent behaviors // J. Comp. Neurol. 1999. V. 404. № 3. P. 285–296.
Welsh J.H., Williams L.D. Monoamine-containing Neurons in Planaria // J. Comp. Neurol. 2004. V. 138. P. 103–116.
Wreford N.G.M., Singhaniyom W., Smith G.C. Microspectrofluorometric characterization of the fluorescent derivatives of biogenic amines produced by aqueous aldehyde (Faglu) fixation // Histochem. J. 1982. V. 14. № 3. P. 491–505.
Wyeth R.C., Croll R.P. Peripheral sensory cells in the cephalic sensory organs of Lymnaea stagnalis // J. Comp. Neurol. 2011. V. 519. P. 1893–1913.
Zaitseva O.V. Innervation of the integument of Pulmonata // Neurosci. Behav. Physiol. 1984. V. 78. № 5. P. 23–29.
Zaitseva O.V. Structural organization of the tentacular sensory system in land pulmonates // Studies Neurosci. 1991. № 13. P. 238–258.
Zaitseva O.V. Structural organization of sensory systems of the snail // Neurosci. Behav. Physiol. 1994. V. 24. № 1. P. 47–57.
Zaitseva O.V. Structural organization receptor elements and organs of the land mollusks Pomatias elegans (Prosobranchia) // Neurosci. Behav. Physiol. 1997. V. 27. № 5. P. 533–540.
Zaitseva O.V. Structure of sensory organs and skin innervation in the mollusc Pomacea paludosa, Prosobranchia // J. Evol. Biochem. Physiol. 1998. V. 34. № 3. P. 233–242.
Zaitseva O.V. Principles of the structural organization of the chemosensory systems of freshwater gastropod mollusks // Neurosci. Bechav. Physiol. 1999. V. 29. № 5. P. 581–593.
Zaitseva O.V. Comparative study of nerve elements and their relationships with endocrine glands and muscle retractors in ommatophores of snails and slugs // J. Evol. Biochem. Physiol. 2004. V. 40. № 6. P. 683–697.
Zaitseva O.V. Nerve cells in the digestive tract epithelium of Gastropods // Dokl. Biol. Sci. 2006. V. 408. P. 220–222.
Zaitseva O. V. Stability, variability, and parallelisms in the development of distant sensory systems: olfactory and visual systems in the phylogeny and ontogeny of gastropods // Biol. Bull. 2016. V. 43. № 3. P. 195–207.
Zaitseva O.V., Bocharova L.S. Sensory cells in the head skin of pond snails. Fine structure of sensory endings // Cell Tiss. Res. 1981. V. 220. P. 797–807.
Zaitseva O.V., Markosova T.G. Choline acetyltransferase and NADPH-diaphorase activity in the nervous system and receptor organs of Nemerteans // Dokl. Biol. Sci. 2009. V. 428. № 5. P. 710–712.
Zaitseva O.V., Petrov S.A. Biogenic amines in the nervous system of nemerteans // Dokl. Biol. Sci. Gen. Biol. 2013. V. 451. P. 228–230.
Zaitseva O.V., Shumeev A.N. Distribution of monoamines and neuropeptides in the digestive system of juvenile Cadlina laevis (Nudibranchia) // Invertebrate Zool. 2017. V. 14. № 2. P. 226–233.
Zaitseva O.V., Kovalev V.A., Shuvalova N.E. Morpho-functional study of the central sections of the chemosensory system in head tentacles of the pond snail Lymnaea stagnalis // J. Evol. Biochem. Physiol. 1987. V. 23. № 3. P. 220–226.
Zaitseva O.V., Kovalev V.V., Shuvalova N.E. Study of specific damage to chemoreceptor processes in behavioral search reactions of model objects affected by different doses of main classes of toxicants // Sensory Systems. 1993. V. 7. № 1. P. 58–62.
Zaitseva O.V., Kuznetsova T.V., Markosova T.G. NADPH-diopharase activity in the digestive system of Gastropod mollusks Achatina fulica and Littorina littorea // J. Evol. Biochem. Physiol. 2009. V. 45. № 1. P. 110–121.
Zaitseva O.V., Markosova T.G., Smirnov R.V. Monoamine- and peptide-containing elements in the body wall and nervous cords in nemerteans // Biol. Morya. 2007. V. 33. № 4. P. 291–298.
Zaitseva O.V., Marcosova T.G., Smirnov R.V., Soboleva V.V. Investigation of cell composition of the intestinal nervous system in Gastropods, Nemertins and Priapulids // Proc. Zool. Inst. Russ. Acad. Sci. St. Petersburg. 2004. V. 300. P. 171–180.
Zaitseva O.V., Shumeev A.N., Korshunova T.A., Martynov A.V. Heterochronies in the formation of the nervous and digestive systems in early postlarval development of opisthobranch mollusks: organization of major organ systems of the arctic dorid Cadlina laevis // Biol. Bull. 2015. V. 42. № 3. P. 186–195.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


