Известия РАН. Серия биологическая, 2019, № 2, стр. 115-126
Термостабильный токсин бактерии Yersinia pseudotuberculosis дизрегулирует функциональную активность двух типов фагоцитов голотурии Eupentacta fraudatrix
Л. С. Долматова 1, *, О. А. Уланова 1, Н. Ф. Тимченко 2
1 Тихоокеанский океанологический институт им. В.И. Ильичева
690041 Владивосток, ул. Балтийская, 43, Россия
2 НИИ эпидемиологии и микробиологии им. Г.П. Сомова
690087 Владивосток, ул. Сельская, 1, Россия
* E-mail: dolmatova@poi.dvo.ru
Поступила в редакцию 05.03.2018
После доработки 27.03.2018
Принята к публикации 27.03.2018
Аннотация
Изучено влияние термостабильного токсина Yersinia pseudotuberculosis по сравнению с дексаметазоном на функциональные различия двух типов фагоцитов, Ф1 и Ф2, у голотурии Eupentacta fraudatrix. Показано, что маркер интактных Ф1-клеток – высокий уровень NO, а Ф2-клеток – высокая активность аргиназы. Отмечено, что уровень антиоксидантной защиты в Ф1-типе превышал таковой в Ф2, при этом токсин подавлял функциональную активность (продукцию активных форм кислорода) фагоцитов Ф1 через 1 ч инкубации и вызывал преимущественную стимуляцию активности фагоцитов Ф2 по сравнению с Ф1-клетками через 24 ч. Установлено, что в отличие от дексаметазона, который стимулировал только трансформацию фенотипа Ф1 в Ф2, токсин через 24 ч способствовал приобретению каждым из двух типов фагоцитов фенотипических признаков другого типа. Проанализировано наличие аналогии между фагоцитами Ф1 и Ф2 голотурии и макрофагами М1 и М2.
Голотурии (Holothuroidea, Echinodermata) – обычные обитатели шельфовых вод Мирового океана. Многие виды голотурий представляют интерес как источники получения биологически активных веществ, выращиваются в аквакультуре или имеют перспективу искусственного разведения (Ковалев и др., 2016). В связи с этим изучение механизмов их иммунитета, особенно при бактериальных инфекциях, имеет как фундаментальное, так и практическое значение.
Бактерии Yersinia pseudotuberculosis широко распространены в природе и могут долго выживать в морской воде. Установлено, что они вызывают гибель голотурий, что делает их потенциально опасными для выращиваемых в аквакультуре особей. Один из факторов вирулентности этих бактерий – термостабильный токсин (ТсТYp), белок с молекулярной массой 45 кДа (Тимченко и др., 2004).
Считается, что голотурии, как и другие иглокожие, имеют только врожденный иммунитет, который обеспечивает высокую эффективность защиты (Smith, Davidson, 1992). Эволюционная близость иглокожих как вторичноротых к позвоночным предполагает, что некоторые иммунные механизмы у этих двух типов животных могут быть гомологогичны/аналогичны (Rast, Messier-Solek, 2008). При этом иммунитет голотурий остается недостаточно изученным. Так, например, известно, что основные клетки их иммунной системы фагоциты – аналоги макрофагов позвоночных – разделяются при градиентном центрифугировании на две фракции (Chia, Xing, 1996), однако функциональные роли клеток отдельных фракций остаются неясными.
Сходным образом ранее авторами были выделены в результате градиентного центрифугирования две фракции фагоцитов (Ф1 и Ф2) голотурии Eupentacta fraudatrix (Djakonov et Baranova, 1958) (Долматова и др., 2004). Было установлено также, что ТсТYp способен модулировать оксидантно-антиоксидантный баланс в фагоцитах голотурии E. fraudatrix (Dolmatova et al., 2003), однако сравнительное изучение действия ТсТYp на функциональную активность двух типов фагоцитов не проводилось.
Между тем известно, что у позвоночных макрофаги могут существовать в двух и более состояниях, имеющих различные фенотипы и функции, в зависимости от микроокружения и состояния метаболизма. М1-макрофаги (“классически” активируемые интерфероном (ИФН)-γ или липополисахаридами бактерий) синтезируют значительное количество NO, интерлейкина (ИЛ)-12, фактора некроза опухолей (ФНО)-α по сравнению с альтернативно активируемыми макрофагами М2, которые в свою очередь характеризуются более высокой активностью аргиназы и синтезом антивоспалительных цитокинов и низким уровнем ФНО-α, присутствием ряда других маркеров (Trav´es et al., 2012). При этом классически активированные макрофаги инициируют и поддерживают воспаление, а также защиту организма хозяина от инфекционных агентов, а макрофаги М2 участвуют преимущественно в удалении паразитов, ремоделировании тканей и модуляции иммунитета. Один из часто используемых в экспериментах на позвоночных индукторов активации макрофагов М2 – синтетический глюкокортикоидный гормон дексаметазон (Fraternale et al., 2015).
В фагоцитах двух типов голотурии E. fraudatrix дексаметазон вызывал различные и даже противоположные изменения содержания ИЛ-1α-подобных веществ и апоптоза (Dolmatova, Ulanova, 2015). Эти данные указывали на то, что, возможно, фагоциты Ф1 и Ф2 играют в иммунном ответе противоположные функциональные роли, подобно макрофагам М1 и М2 позвоночных.
Необходимо отметить, что роль бактериальных белковых токсинов в поляризации макрофагов значительно менее изучена, чем роль, например, бактериальных липополисахаридов. Последние способны вызывать воспалительную реакцию, что проявляется, в частности, увеличенным синтезом провоспалительных цитокинов, как показано для экзотоксинов Vibrio cholerae (Tsai, Wu, 2013) и Staphylococcus aureus (Merriman et al., 2015). При действии же белковых токсинов может происходить как снижение содержания одних провоспалительных цитокинов (ИФН-γ, ФНО-α и ИЛ-2), так и рост количества других (ИЛ-17) (Tsai, Wu, 2013). Вместе с тем имеются данные, что некоторые белковые токсины вызывают сдвиг поляризации макрофагов по второму типу (Benoit et al., 2008).
Известно также, что функционирование макрофагов связано с высоким уровнем продукции активных форм кислорода (АФК) и, соответственно, с высокой активностью ферментов антиоксидантной системы. При этом АФК могут регулировать фенотип макрофагов (He, Carter, 2015).
В связи с этим изучение особенностей влияния ТсТYp на продукцию АФК и активность антиоксидантной ферментной защиты в отдельных типах фагоцитов голотурии E. fraudatrix наряду с определением в них содержания известных маркеров функциональной активности двух типов макрофагов может быть полезным для понимания механизмов действия токсина, а также для выявления роли отдельных типов фагоцитов голотурии в противобактериальной защите.
Цель данного исследования – сравнительное изучение влияния ТсТYp и дексаметазона в качестве позитивного контроля на оксидантно-антиоксидантный баланс, а также на содержание оксида азота и активность аргиназы в двух типах фагоцитов голотурии E. fraudatrix.
МАТЕРИАЛЫ И МЕТОДЫ
Сбор голотурий E. fraudatrix проводили в бух. Восток (зал. Петра Великого Японского моря) в феврале легководолазным методом. В работе использовали особей с длиной тела от 4 до 6 см. До начала экспериментов животные находились в аквариуме с проточной аэрируемой морской водой с температурой, соответствующей сезонной, в течение двух недель.
Отбор целомической жидкости и выделение двух фракций фагоцитов методом центрифугирования в градиенте плотности фиколл-верографина проводили так, как описано ранее (Долматова, Заика, 2007). Голотурий надрезали скальпелем, целомическую жидкость отбирали в сосуд с антикоагулирующим раствором (30 мМ ЭДТА, 31 г/л NaCl, 50 мМ Tris-HCl, pH 7.6) в соотношении объемов целомичесой жидкости и антикоагулирующего раствора 1 : 1. Для последующего исследования интактных свежевыделенных клеток при центрифугировании объединяли образцы от четырех особей (три независимых эксперимента), а для проведения исследований in vitro – целомическую жидкость от 15 голотурий (два независимых эксперимента). Наслаивали 2 мл образца на градиент фиколл-верографина, состоявший из ступеней с объемным соотношением фиколл-верографина и антикоагулирующего раствора 1 : 1 (1-я ступень) и 1 : 2 (2-я ступень). После 15 мин центрифугирования при 300 g отбирали клеточную фракцию в интерфазе между образцом и 2-й ступенью (фагоциты Ф1) и между 1-й и 2-й ступенями (фагоциты Ф2). Полученные суспензии клеток отмывали дважды в фосфатно-солевом буфере (ФСБ), pH 7.6, с добавлением 36 г/л NaCl (ФСБН) и ресуспендировали в модифицированной среде 199. Концентрацию клеток определяли в камере Горяева.
ТсТYp изолировали из штамма 512 I серовара Y. pseudotuberculosis из коллекции НИИ эпидемиологии и микробиологии им. Г.П. Сомова. Выделение и очистку ТсТYp проводили так, как описано ранее (Тимченко и др., 2004).
Инкубацию клеток (1 × 106 кл./мл) проводили в круглодонных планшетах при комнатной температуре в течение 1 или 24 ч. ТсТYp использовали в концентрациях 0.2, 0.5 и 2 мкг/мл, дексаметазон (KRKA, Словения) – в концентрации 100 мкМ. В контрольные лунки вместо исследуемых препаратов вводили ФСБН. Каждое воздействие проводили дважды.
По окончании инкубации из лунок, а также из образцов свежевыделенных интактных клеток отбирали аликвоту клеток и немедленно определяли содержание АФК, часть суспензии клеток замораживали и хранили при –80°С до последующих анализов. Суспензии клеток после размораживания при комнатной температуре гомогенизировали ультразвуком, как описано ранее (Долматова, Заика, 2007), центрифугировали при 1000 g в течение 5 мин, и определяли в полученных супернатантах активность антиоксидантных ферментов и содержание NO. Продукцию супероксидного анион-радикала определяли колориметрическим методом (Мельников, 1991) с использованием калибровочных значений содержания нитросинего тетразолия (НСТ).
Активность антиоксидантных ферментов определяли спектрофотометрическими методами, как описано ранее (Долматова и др., 2004): активность супероксиддисмутазы (СОД, КФ 1.15.1.1) – по подавлению восстановления НСТ супероксидными анион-радикалами, образующимися в реакционной смеси ксантина и ксантиноксидазы при длине волны 540 нм, активность каталазы (КФ 1.11.1.6) – по скорости снижения поглощения перекиси водорода при длине волны 240 нм, активность глутатионредуктазы (ГР, КФ 1.6.4.2) – по скорости уменьшения поглощения восстановленного никотинамидадениндинуклеотидфосфата (НАДФН) при длине волны 340 нм. Активность глутатионтрансферазы (ГТ, КФ 2.5.1.18) измеряли с использованием в качестве субстрата 1-хлор-2,4-динитробензола при длине волны 340 нм (Habig et al., 1974). Концентрацию белка в пробах измеряли с красителем Кумасси G250 методом Брэдфорд (Bradford, 1976).
При определении содержания NO измеряли количество его стабильного метаболита $\left( {{\text{NO}}_{{\text{2}}}^{ - }} \right)$ с использованием реактива Грисса (Torika et al., 2016) при 540 нм. Концентрацию NO определяли по калибровочной кривой с NaNO2 (5–300 мкмоль/мл).
Активность аргиназы (КФ 3.5.3.1) определяли в лизатах клеток по количеству мочевины, образующейся из аргинина (Elnekave et al., 2003), при окрашивании п-диметиламинобензальдегидом (Oboh et al., 2015). Концентрацию мочевины измеряли при 450 нм, для расчета использовали данные калибровочной кривой (5–50 ммоль/мл).
Полученные данные (средние значения ± средняя ошибка измерений) анализировали с использованием t-теста Стьюдента. Разницу между группами считали достоверной при p < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влияние ТсТYp и дексаметазона на содержание НСТ. При фагоцитозе происходит многократный рост продукции АФК, который обеспечивает выполнение фагоцитами киллерной функции, поэтому уровень АФК – важный показатель функциональной активности фагоцитов (Земсков и др., 2013). У позвоночных макрофаги обоих типов обладают способностями к синтезу АФК и фагоцитозу (Mendoza-Coronel, Ortega, 2017).
Измерение количества НСТ в интактных фагоцитах Ф1 и Ф2 голотурии не выявило различий между ними (рис. 1а). Значения НСТ были одинаковы также в контрольных фагоцитах Ф1 и Ф2 через 1 ч инкубации. Через 24 ч содержание НСТ в Ф1-клетках уже превышало таковое в клетках Ф2-типа в 1.6 раза. Это свидетельствует о более высокой функциональной активности Ф1-фагоцитов при стрессе, вызванном условиями инкубации. Сравнение с макрофагами, для которых показаны снижение продукции АФК при поляризации по M2-пути, а также меньшая фагоцитирующая спообность М2-клеток по сравнению с M1-типом (Koren-Gluzer et al., 2015), свидетельствует о наличии сходства между фагоцитами Ф1 и макрофагами М1, а также между фагоцитами Ф2 и макрофагами М2. При воздействии такого внешнего модулятора клеточной активности, как ТсТYp, достоверные изменения содержания НСТ в фагоцитах Ф1 происходили только при концентрации 0.5 мкг/мл (через 1 ч – снижение на 38%, через 24 ч – увеличение в 3 раза по сравнению с контролем). В фагоцитах Ф2 при концентрации ТсТYp 0.5 мкг/мл была отмечена тенденция к возрастанию содержания НСТ уже через 1 ч, а через 24 ч уже все концентрации ТсТYp стимулировали рост содержания НСТ, при этом концентрация 2 мкг/мл индуцировала максимальное увеличение в 11.7 раза по сравнению с контролем (рис. 1б, в). Таким образом, в ранний период инкубации ТсТYp подавлял восстановление НСТ в фагоцитах Ф1 и стимулировал ее в Ф2-типе клеток, а через 24 ч стимулировал ее в обоих типах фагоцитов, причем в наибольшей степени во втором типе. Известно, что подавление продукции АФК снижает противобактериальный иммунный ответ (Break et al., 2012). Снижение функциональной активности фагоцитов Ф1 и рост активности Ф2-типа через 1 ч инкубации с ТсТYp могут быть связаны с осуществлением бактериальной стратегии на подавление иммунного ответа клеток организма хозяина, которая описана для многих бактерий и реализуется с участием белковых факторов последних (Nguyen et al., 2017).
Рис. 1.
Концентрация нитросинего тетразолия в фагоцитах Ф1 и Ф2 типов голотурии Eupentacta fraudatrix в контроле (а) и при воздействии термостабильного токсина Yersinia pseudotuberculosis (ТсТYp) и дексаметазона через 1 (б) и 24 ч (в). Экспериментальные группы: 1–3 – 0.2, 0.5, 2 мкг/мл ТсТYp соответственно, 4 – 100 мкМ дексаметазона. * – P < 0.05 по сравнению со свежевыделенными клетками (0 ч) для (а) и по сравнению с контролем (без добавления ТсТYp и дексаметазона) для (б) и (в).
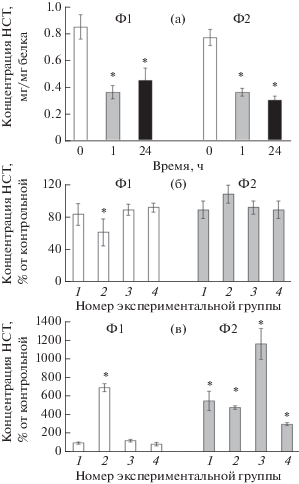
Значительно более выраженное увеличение концентрации НСТ в фагоцитах Ф2 по сравнению с таковым в Ф1-типе через 24 ч не отменяет вышеуказанного предположения о функциональном сходстве между фагоцитами Ф2 и макрофагами М2, поскольку описаны случаи более высокой фагоцитирующей активности (тесно связанной с продукцией НСТ) в макрофагах М2 по сравнению с таковой у M1-типа (Tan et al., 2016). По-видимому, АФК необходимы для поляризации как по М1-, так и по М2-пути (Tan et al., 2016; Mendoza-Coronel, Ortega, 2017).
Известно, что еще один механизм избегания влияния иммунитета хозяина (позвоночного) на бактерии – это дизрегуляция иммунного ответа бактериальными белковыми токсинами. При этом действие бактериальных токсинов и бактерий приводит к сдвигу поляризации макрофагов по второму типу (Tsai, Wu, 2013; Merriman et al., 2015). Значительно более высокое содержание НСТ в контрольных фагоцитах Ф1 по сравнению с Ф2-типом и направленность действия ТсТYp в сторону преимущественной активации фагоцитов Ф2 свидетельствуют о способности ТсТYp дизрегулировать функциональную активность фагоцитов и подтверждают предположение о наличии аналогии между двумя типами фагоцитов голотурии и двумя типами макрофагов. Об этом же свидетельствуют и данные, полученные при оценке воздействия дексаметазона на содержание НСТ в двух типах фагоцитов (рис. 1а, б). При одночасовой инкубации с дексаметазоном (100 мкМ) не обнаружено достоверного влияния последнего на содержание НСТ в клетках Ф1 и Ф2 по сравнению с контролем. Через 24 ч дексаметазон также не оказывал достоверного влияния на восстановление НСТ в фагоцитах Ф1, но стимулировал его в 3 раза в фагоцитах Ф2 (рис. 1в). Сходным образом дексаметазон стимулировал продукцию АФК в макрофагах М2 (Kraaij et al., 2011).
Влияние ТсТYp и дексаметазона на активность антиоксидантных ферментов. Антиоксидантные ферменты в фагоцитах ограничивают повреждающее действие АФК на сами клетки. Так, СОД осуществляет дисмутацию супероксидного анион-радикала с образованием Н2О2 и воды, а каталаза в свою очередь обезвреживает избыток перекиси водорода (Долматова и др., 2004). ГР обеспечивает восстановление окисленного глутатиона, что необходимо, в частности, для работы ГТ, обезвреживающей токсичные для организма чужеродные молекулы (Habig et al., 1974). Соответственно, активность этих ферментов может оказывать влияние на поляризацию макрофагов. В частности, отмечено, что у мышей, не имеющих СОД (СОД–), частота встречаемости макрофагов М2 была значительно ниже, чем у мышей СОД+ (He, Carter, 2015).
В интактных свежевыделенных фагоцитах Ф1 голотурии активности СОД и ГТ в 1.8 и 3.5 раза соответственно превышали таковые в фагоцитах Ф2. При этом активности каталазы и ГР в двух типах фагоцитов достоверно не различались (табл. 1).
Таблица 1.
Активность антиоксидантных ферментов в контрольных условиях инкубации (без добавления исследуемых препаратов)
| Активность фермента |
Фагоциты Ф1 | Фагоциты Ф2 | ||||
|---|---|---|---|---|---|---|
| 0 ч | 1 ч | 24 ч | 0 ч | 1 ч | 24 ч | |
| СОД, усл. ед./мг белка |
546.1 ± 20.5 |
443.7 ± 8.6 |
192.8 ± 7.2** |
298.9 ± 1 2.9* |
311.2 ± 6.7 |
147.7 ± 4.9** |
| Каталаза, мкмоль/(мин · мг белка) |
78.4 ± 3.9 | 45.1 ± 6.9** | 26.8 ± 5.9** | 87.5 ± 12.9 | 103.8 ± 5.2 | 63.9 ± 5.4** |
| ГР, нмоль/(мин · мг белка) | 2217 ± 30 | 2617 ± 107** | 249.5 ± 22.4** | 2340 ± 82 | 2030 ± 98 | 933.9 ± 35.3** |
| ГТ, нмоль/(мин · мг белка) | 1421 ± 29 | 1090 ± 24** | 1220 ± 21** | 410.1 ± 22.9* | 251.5 ± 11.8** | 452.7 ± 18.8** |
По-видимому, более высокая активность СОД в интактных фагоцитах Ф1 свидетельствует о повышенной продукции супероксидного анион-радикала в Ф1-клетках по сравнению с таковой в клетках Ф2. Однако сходные количества НСТ в интактных фагоцитах Ф1 и Ф2, продемонстрированные выше, свидетельствуют в пользу того, что СОД в фагоцитах Ф1 эффективно обезвреживает супероксидный анион-радикал. Соответственно, в клетках Ф1 и Ф2 поддерживаются близкие концентрации перекиси водорода, что подтверждается сходными значениями активности каталазы. Кроме того, повышенная активность ГТ в фагоцитах Ф1 по сравнению с таковой в Ф2-клетках на фоне близких значений активности ГР в обоих типах фагоцитов может свидетельствовать о большей обеспеченности клеток Ф1 восстановленным глутатионом.
Через 1 ч инкубации активность СОД в обеих контрольных фракциях клеток снижалась по сравнению со значениями в свежевыделенных фагоцитах, по-видимому, вслед за снижением содержания НСТ. Через 24 ч снижение активности фермента продолжилось в обоих типах фагоцитов. В процессе инкубации активность каталазы в фагоцитах Ф1 также значительно снижалась по сравнению с таковой в свежевыделенных фагоцитах: в 1.7 раза через 1 ч и в 2.9 раза через 24 ч. В фагоцитах Ф2 изменения активности каталазы были менее значительны: она практически не изменялась через 1 ч, а через 24 ч уменьшалась в 1.4 раза.
Активность ГР через 1 ч возрастала на 18% (P < 0.05) в фагоцитах Ф1, но практически не менялась в фагоцитах Ф2 по сравнению с исходным контролем. Через 24 ч она, напротив, снижалась в фагоцитах Ф1 и Ф2 в 8.9 и в 2.5 раза соответственно по сравнению с исходной.
Активность ГТ в фагоцитах Ф1 через 1 ч снижалась в 1.3, а в Ф2 – в 1.6 раза по сравнению с исходным контролем. Через 24 ч она в Ф1-клетках приближалась к исходному уровню, а в Ф2-клетках практически возвращалась к нему.
Таким образом, в фагоцитах Ф1 и Ф2 изменения активности всех ферментов в отсутствие воздействия исследуемых веществ носили преимущественно однонаправленный характер с различной степенью выраженности.
ТсТYp в фагоцитах Ф1 через 1 ч значительно ингибировал активность антиоксидантных ферментов: СОД (рис. 2а) – при всех концентрациях (максимально в 4.3 раза при концентрации 0.2 мкг/мл), каталазы (рис. 2б) – в 2.3 раза (только при концентрации 0.5 мкг/мл), ГР (рис. 2в) и ГТ (рис. 2г) – при концентрациях 0.5–2 мкг/мл (максимальное ингибирование активностей ГР и ГТ в 2.7 и 1.8 раза при концентрациях 0.5 и 2 мкг/мл соответственно). Однако активность каталазы при концентрации ТсТYp 0.2 мкг/мл даже возрастала. Такая противоположная направленность изменений активностей СОД и каталазы при концентрации ТсТYp 0.2 мкг/мл связана, по-видимому, с перекрестной регуляцией этих ферментов инактивируемыми ими ${\text{О }}_{{\text{2}}}^{ - }$ и Н2О2 (Доценко и др., 2010), при которой накопление в среде перекиси водорода ведет к инактивации СОД (Чеснокова и др., 2006). Очевидно, ТсТYp в этой концентрации еще не подавляет респираторный взрыв. Ингибирование уже всех ферментов при возрастании концентраций ТсТYp, учитывая полученные данные о достоверном снижении содержания НСТ при концентрации ТсТYp 0.5 мкг/мл в этот период, можно рассматривать как следствие снижения продукции АФК, по-видимому, через ингибирование активации НАДФН-оксидазного ферментного комплекса, как показано для ряда токсинов (Nguyen et al., 2017).
Рис. 2.
Активность cупероксиддисмутазы (а), каталазы (б), глутатионредуктазы (в) и глутатионтрансферазы (г) в фагоцитах Ф1 и Ф2 при воздействии термостабильного токсина Yersinia pseudotuberculosis (ТсТYp) и дексаметазона. По оси абсцисс – тип фагоцитов. Экспериментальные группы: 1–3 – 0.2, 0.5, 2 мкг/мл ТсТYp соответственно, 4 – 100 мкМ дексаметазона. * – P < 0.05 по сравнению с контролем (отсутствие ТсТYp или дексаметазона).
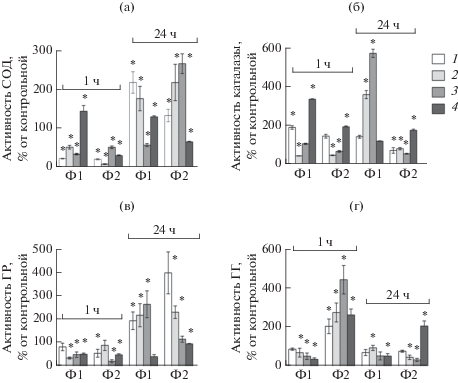
Сходное действие ТсТYp оказывал через 1 ч в фагоцитах Ф2, ингибируя СОД (максимально в 4.5 раза при концентрации 0.5 мкг/мл) и каталазу (максимально в 2 раза при концентрации 0.5 мкг/мл), а также ГР в концентрациях 0.2 и 2 мкг/мл (максимально в 4.2 раза при концентрации 2 мкг/мл), но стимулировал ГТ при всех концентрациях (максимально в 4.5 раза при концентрации 2 мкг/мл). При концентрации ТсТYp 0.5 мкг/мл, при которой отмечен рост содержания НСТ в Ф2-фагоцитах, активность ГР не изменялась по сравнению с контрольной. На фоне повышения активности ГТ и снижения активности каталазы и особенно СОД это свидетельствует о недостаточной активности ферментативного звена обезвреживания АФК при этой концентрации ТсТYp, что, по-видимому, и приводит к наблюдаемому росту концентрации НСТ. Принимая во внимание, что ГР обеспечивает поддержание пула восстановленного глутатиона, такие изменения активности антиоксидантных ферментов могут сопровождаться и снижением концентрации последнего, который участвует в неферментативном обезвреживании АФК (Чеснокова и др., 2006).
Дексаметазон оказывал разнонаправленное действие на активность СОД в двух типах фагоцитов (возрастание в 1.5 раза в фагоцитах Ф1 и ингибирование в 3.2 раза в Ф2-клетках) и ГТ (снижение в 2.6 раза в фагоцитах Ф1 и увеличение в 2.7 раза в Ф2-клетках) через 1 ч, однако его действие на каталазу (стимуляция в 3.4 и 2 раза в фагоцитах Ф1 и Ф2 соответственно) и ГР (ингибирование в 1.9 и 2 раза соответственно) было сходным в обоих типах клеток. Таким образом, в фагоцитах Ф1 увеличение активности СОД и каталазы при сниженных активностях глутатионзависимых ферментов и в отсутствие увеличения концентрации НСТ свидетельствует о том, что дексаметазон в этот период стимулирует функциональную активность Ф1-клеток, но антиоксидантная ферментная защита достаточна для предотвращения роста продукции АФК. А в фагоцитах Ф2 в этот период, хотя также не обнаружено возрастания концентрации НСТ, снижение активности СОД на фоне возрастания активности каталазы свидетельствует о том, что дексаметазон стимулировал в этих клетках образование Н2О2 как основного типа АФК. При этом соотношение активностей ГР и ГТ свидетельствует о том, что содержание восстановленного глутатиона, по-видимому, уменьшалось.
Таким образом, дексаметазон, как и ТсТYp, через 1 ч не вызывал разбалансировку активности антиоксидантных ферментов в фагоцитах Ф1, но снижал ферментативную антиоксидантную защиту в Ф2-клетках.
Через 24 ч ТсТYp в концентрациях 0.2–0.5 мкг/мл в фагоцитах Ф1 уже стимулировал активность СОД в обратной концентрационной зависимости (максимально в 2.2 раза) и в концентрации 2 мкг/мл уже ингибировал ее в 1.7 раза. ТсТYp стимулировал активность каталазы и ГР в прямой концентрационной зависимости (в 5.9 и 2.7 раза соответственно при концентрации 2 мкг/мл), а активность ГТ снижалась в прямой концентрационной зависимости (максимально в 1.8 раза).
Обратная концентрационная зависимость активности СОД при воздействии 0.2–0.5 мкг/мл ТсТYp соответствует повышению содержания НСТ в прямой концентрационной завиимости и объясняется, по-видимому, истощением активности фермента в связи с ростом продукции АФК. Наряду с ростом активности каталазы и ГР это свидетельствует о возрастании функциональной активности Ф1-клеток в этот период. При концентрации ТсТYp 2 мкг/мл происходило уже снижение содержания НСТ, однако соотношение активностей СОД и каталазы свидетельствует о том, что в клетках могла преимущественно накапливаться Н2О2.
В Ф2-клетках через 24 ч все исследуемые концентрации ТсТYp стимулировали активность СОД (максимально в 2.7 раза), но ингибировали каталазу (максимально в 1.8 раза) и ГТ (максимально в 2.8 раза) в прямой концентрационной зависимости. При этом ТсТYp в концентрациях 0.2–0.5, но не 2 мкг/мл стимулировал ГР в обратной концентрационной зависимости (максимально в 4 раза).
Обнаруженные изменения в активности СОД соответствуют возрастанию концентрации НСТ в этот период, причем снижение ативности каталазы и изменения активностей глутатионзависимых ферментов свидетельствуют о возможном снижении запаса восстановленного глутатиона в клетке с возрастанием концентрации ТсТYp.
Необходимо отметить, что к этому времени противоположная направленность изменений активности антиоксидантных ферментов, как и концентрации НСТ, в фагоцитах двух типов при воздействии ТсТYp становится наиболее выраженной.
Дексаметазон в фагоцитах Ф1 через 24 ч стимулировал активность СОД в 1.3 раза, ингибировал ГР в 2.3 раза и ГТ в 1.6 раза, но не влиял на каталазу. Таким образом, изменения активности ферментов через 24 ч были еще менее выражены, чем через 1 ч, и, по-видимому, обеспечивали поддержание концентрации НСТ на контрольном уровне, продемонстрированном ранее.
В фагоцитах Ф2 через 24 ч дексаметазон ингибировал СОД в 1.5 раза, стимулировал активность каталазы и ГТ в 2 раза, снижал активность ГР в 3.8 раза. Это действие было сходно с таковым через 1 ч. Однако активность ГР была снижена в большей степени, чем через 1 ч, что на фоне разбалансировки активностей СОД и каталазы индуцировало увеличение концентрации НСТ (рис. 1в), возможно, в связи с более значительным снижением содержания восстановленного глутатиона.
Особого внимания заслуживает противоположная концентрационно-зависимая направленность изменений активности ГР в двух типах фагоцитов при действии ТсТYp. В последнее время показано, что содержание восстановленного глутатиона играет важную роль в иммунном ответе. Так, его увеличение было обнаружено при активации макрофагов М1 (Fraternale et al., 2015), и оно имело критическое значение для активации М1-зависимого клеточного ответа для защиты от Mycobacterium tuberculosis (Almeida et al., 2014).
Полученные данные о значительно более высокой антиоксидантной ферментативной активности в фагоцитах Ф1 по сравнению с таковой в фагоцитах Ф2 при действии как ТсТYp, так и дексаметазона, обеспечивающей в большей мере поддержание оксидантно-антиоксидантного баланса в Ф1-, но не в Ф2-типе, позволяют предположить, что количество восстановленного глутатиона поддерживается в фагоцитах Ф1 на более высоком уровне по сравнению с таковым в Ф2-клетках. Это также свидетельствует в пользу предположения о том, что фагоциты Ф1 и Ф2 могут быть аналогами макрофагов М1 и М2 позвоночных соответственно.
Влияние ТсТYp и дексаметазона на содержание NO и активность аргиназы. Исследование концентрации NO, являющегося маркером макрофагов М1 (Trav’es et al., 2012), в свежевыделенных фагоцитах выявило, что в Ф1-клетках она в 8.8 раза превышала таковую в Ф2-клетках (рис. 3а). Тем не менее концентрации NO через 1 ч инкубации имели сходные значения в контрольных фагоцитах Ф1 и Ф2. Через 24 ч концентрации NO вновь приближались к значениям в интактных клетках, при этом уровень NO в фагоцитах Ф1 оставался значительно выше, чем в фагоцитах Ф2. Это свидетельствует о том, что в исходном состоянии NO – маркер Ф1-клеток, но в динамике инкубации соотношение его содержания в двух типах фагоцитов может меняться.
Рис. 3.
Концентрация NO в Ф1 и Ф2 фагоцитах в контроле (а) и при воздействии термостабильного токсина Yersinia pseudotuberculosis (ТсТYp) и дексаметазона (б). Экспериментальные группы: 1–3 – 0.2, 0.5, 2 мкг/мл ТсТYp соответственно, 4 – 100 мкМ дексаметазона. Здесь и для рис. 4 * – P < 0.05 по сравнению со свежевыделенными (0 ч) фагоцитами Ф1, ** – P < 0.05 по сравнению со свежевыделенными (0 ч) клетками для (а); * – P < 0.05 по сравнению с контролем (отсутствие ТсТYp или дексаметазона) для (б).
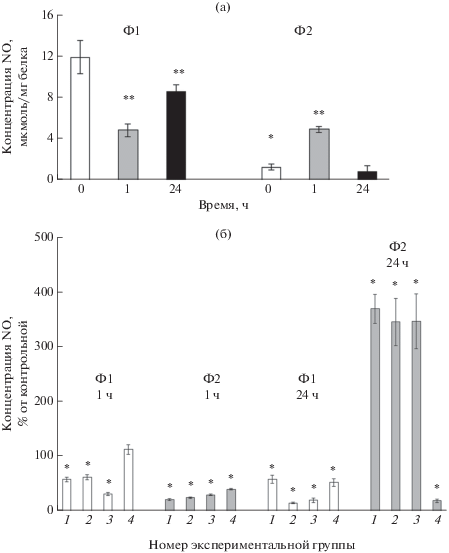
ТсТYp значительно снижал концентрацию NO через 1 ч инкубации в фагоцитах Ф1 в прямой концентрационной зависимости, максимально в 3 раза при концентрации 2 мкг/мл, а в Ф2 – в обратной концентрационной зависимости, максимально в 4.5 раза при концентрации 0.2 мкг/мл. Через 24 ч в фагоцитах Ф1 происходило снижение содержания NO также в прямой концентрационной зависимости, максимально в 6 раз при концентрации ТсТYp 0.5 мкг/мл, а в фагоцитах Ф2 – возрастание в обратной концентрационной зависимости, максимально в 3.7 раза при концентрации ТсТYp 0.2 мкг/мл (рис. 3б). Таким образом, ТсТYp вызывал в обоих типах фагоцитов изменение фенотипа, при котором клетки приобретали свойства другого типа клеток, что было особенно выражено через 24 ч. Так, появлению в фагоцитах Ф2 признака, характерного для фенотипа Ф1‑клеток, соответствовало повышение их функциональной активности (рост концентрации НСТ) на фоне дисбаланса между активностью СОД и каталазы, продемонстрированного выше (рис. 2), что сходно с данными, полученными на клетках позвоночных, об ингибирующем влиянии NO на активность каталазы (Brown, 1995; Dobashi et al., 1997) и стимулирующем – на СОД при поляризации макрофагов по M1-типу (Dobashi et al., 1997).
Дексаметазон не влиял достоверно на содержание NO в фагоцитах Ф1 через 1 ч, а через 24 ч снижал его концентрацию в 1.9 раза. Однако в Ф2-клетках значительное снижение содержания NO (в 2.4 раза) происходило уже в первый час инкубации, а через 24 ч происходило еще большее ингибирование его продукции.
Таким образом, в отличие от действия ТсТY, эффект дексаметазона в целом был направлен на снижение содержания NO в фагоцитах обоих типов. Сходный эффект дексаметазона был показан также в макрофагах (Korhonen et al., 2002). При этом в фагоцитах Ф2 содержание NO было значительно ниже, чем в фагоцитах Ф1. Соответственно, фагоциты Ф2 сохраняли свой исходный фенотип, а в Ф1-клетках происходила трансформация во второй тип. Необходимо отметить, что также в отличие от действия ТсТYp при воздействии дексаметазона имелось расхождение между изменениями концентраций NO и НСТ в фагоцитах Ф2, при этом снижение содержания NO сопровождалось разбалансировкой активностей СОД и каталазы с ингибированием первой и активацией второй, что также могло приводить к росту концентрации НСТ в Ф2-клетках. Случаи подобного расхождения между изменениями содержания NO и НСТ описаны также и при поляризации макрофагов (Zheng et al., 2016).
В интактных свежевыделенных фагоцитах активность второго известного маркера поляризации макрофагов – аргиназы – была вдвое выше в фагоцитах Ф2 по сравнению с таковой в фагоцитах Ф1 (рис. 4а). Через 1 ч активность фермента снижалась в фагоцитах Ф1, но не в фагоцитах Ф2 по сравнению с таковой в интактных клетках, так что в этот период инкубации в контрольных Ф2‑клетках она была уже почти в 4 раза выше, чем в Ф1-клетках. Через 24 ч активность фермента снижалась в обоих типах фагоцитов, но в фагоцитах Ф2 превышала таковую в фагоцитах Ф1 в 1.9 раза. Таким образом, высокая активность аргиназы характеризует фагоциты Ф2, причем ее значительное превалирование в этих фагоцитах по сравнению с Ф1-клетками сохранялось в течение всего периода инкубации.
Рис. 4.
Активность аргиназы в двух типах фагоцитов (Ф1 и Ф2) в контроле (а) и при воздействии термостабильного токсина Yersinia pseudotuberculosis и дексаметазона (б). Экспериментальные группы: 1–3 – 0.2, 0.5, 2 мкг/мл ТсТYp соответственно, 4 – 100 мкМ дексаметазона.
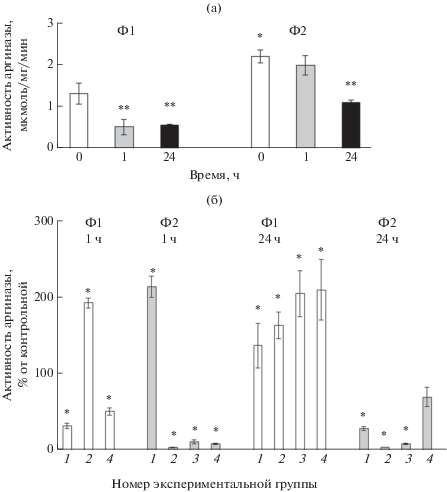
При этом ТсТYp в концентрации 0.2 мкг/мл через 1 ч ингибировал, а в концентрации 2 мкг/мл уже стимулировал активность фермента в фагоцитах Ф1 в 3 и 2 раза соответственно (рис. 4б). В Ф2-клетках ТсТYp, напротив, стимулировал аргиназу в концентрации 0.2 мкг/мл (в 2 раза), а в концентрации 0.5–2 мкг/мл практически полностью ингибировали фермент. Через 24 ч инкубации ТсТYp в Ф1-клетках стимулировал активность аргиназы при всех концентрациях в прямой концентрационной зависимости, максимально в 2 раза при концентрации 2 мкг/мл. В фагоцитах Ф2, напротив, активность фермента значительно снижалась в прямой концентрационной зависимости, максимально в 20 раз при концентрации 0.5 мкг/мл.
Таким образом, в исследованные сроки инкубации ТсТYp оказывал противоположное влияние на активность аргиназы в фагоцитах Ф1 и Ф2.
Такие изменения активности аргиназы наряду с данными о влиянии ТсТYp на содержание NO свидетельствуют о том, что токсин стимулировал приобретение фагоцитами Ф1 функционального фенотипа фагоцитов Ф2 и наоборот стимулировал в фагоцитах Ф2 изменения маркеров в сторону проявления фенотипа Ф1. Эти изменения были особенно выражены к 24 ч инкубации. Можно предполагать, что при достижении определенного порога оксидантного стресса в клетках начинает работать механизм обратной связи, индуцирующий трансформацию одного типа фагоцитов в другой. В связи с этим заслуживает внимания тот факт, что макрофаги М1 и М2 помимо основной могут выполнять и функцию, считающуюся характерной для другого типа макрофагов (Сарбаева и др., 2016). Вместе с тем роль таких изменений в противобактериальной защите нуждается в дальнейших исследованиях. При этом необходимо учитывать, что в организме голотурии результирующий эффект может зависеть от соотношения концентраций отдельных типов фагоцитов в целомической жидкости.
Дексаметазон через 1 ч снижал активность аргиназы в Ф1-клетках в 2 раза, а в Ф2-клетках – в 7.3 раза. Через 24 ч дексаметазон стимулировал увеличение активности аргиназы в фагоцитах Ф1 в 2 раза, а в Ф2-клетках не влиял на ее активность.
Таким образом, дексаметазон к 24 ч индуцировал трансформацию фенотипа Ф1 в направлении приобретения признаков второго типа клеток, но практически не влиял на фенотип фагоцитов Ф2, что, по-видимому, может способствовать увеличению в организме количества клеток с фенотипом Ф2. С учетом свойствa дексаметазона индуцировать поляризацию макрофагов по второму типу (Fraternale et al., 2015) эти данные также подтверждают наличие аналогии между фагоцитами Ф2 и макрофагами М2.
В целом в данной работе впервые показано, что фагоциты Ф1 и Ф2 голотурии исходно обладают разными уровнями функциональной активности и фенотипически различны. Введение в среду инкубации дексаметазона или ТсТYp вызывало в двух типах фагоцитов разнонаправленные изменения оксидантно-антиоксидантного баланса, а также содержания NO и активности аргиназы. Действие ТсТYp в первый час инкубации было направлено на подавление функциональной активности фагоцитов Ф1, а через 24 ч он, как и дексаметазон, стимулировал преимущественно функциональную активность фагоцитов Ф2 (возрастание концентрации НСТ). Характер изменений активности антиоксидантных ферментов, особенно глутатионзависимых, свидетельствует в пользу представления о более высокой резистентности фагоцитов Ф1 к оксидантному стрессу и, по-видимому, меньшего истощения запаса восстановленного глутатиона по сравнению с таковыми в Ф2-типе клеток при воздействии препаратов. Совокупность этих данных свидетельствует о том, что фагоциты Ф1 и Ф2 подобно макрофагам М1 и М2 соответственно могут играть разные роли в про- и антивоспалительных реакциях у голотурий. При этом при воздействии ТсТYp оба типа фагоцитов могут приобретать фенотипические признаки другого типа клеток, и такая дизрегуляция, с преимущественной стимуляцией функциональной активности фагоцитов Ф2, может быть одним из механизмов подавления иммунитета голотурий бактериями Y. рseudotuberculosis. В отличие от ТсТYp дексаметазон вызывал одностороннюю трансформацию фенотипа Ф1 в фенотип Ф2.
Полученные данные обусловливают новый взгляд на эволюцию иммунитета и могут лечь в основу получения новых методов антибактериальной терапии, а также разработки модели для изучения сложных механизмов поляризации макрофагов in vitro и in vivo. Необходимы дальнейшие исследования роли двух типов фагоцитов в иммунном ответе голотурий, их метаболических особенностей и регуляции фенотипической пластичности.
Список литературы
Долматова Л.С., Заика О.А. Апоптозмодулирующее действие простагландина Е2 в целомоцитах голотурии Eupentacta fraudatrix зависит от антиоксидантного ферментного статуса клеток // Изв. РАН. Сер. биол. 2007. № 2. С. 273–282.
Долматова ЛС., Елисейкина М.Г., Ромашина В.В. Антиоксидантная ферментная активность целомоцитов дальневосточной голотурии Eupentacta fraudatrix // Журн. эволюц. биохимии и физиологии. 2004. Т. 40. № 2. С. 104–111.
Доценко О.И., Доценко В.А., Мищенко А.М. Активность супероксиддисмутазы и каталазы в эритроцитах и некоторых тканях мышей в условиях низкочастотной вибрации // Физика живого. 2010. Т. 18. С. 107–113.
Земсков В.М., Барсуков А.А., Гнатенко Д.А., Шишкина Н.С., Куликова А.Н., Козлова М.Н. Фундаментальные и прикладные аспекты анализа кислородного метаболизма фагоцитарных клеток // Успехи соврем. биологии. 2013. Т. 133. С. 469–480.
Ковалев Н.Н., Пивненко Т.Н., Ким Г.Н. Анализ рынка биологически активной продукции из промысловых голотурий (Echinodermata: Holothuroidea): сырье и технологии // Рыб. хоз-во. 2016. № 2. С. 112–116.
Мельников В.П. Тест восстановления нитросинего тетразолия мононуклеарными фагоцитами // Лаб. дело. 1991. № 8. С. 51–53.
Сарбаева Н.Н., Пономарева Ю.В., Милякова М.Н. Макрофаги. Разнообразие фенотипов и функций, взаимодействие с чужеродными материалами // Гены и клетки. 2016. Т. 11. № 1. С. 9–17.
Тимченко Н.Ф., Недашковская Е.П., Долматова Л.С., Сомова-Исачкова Л.М. Токсины Yersinia pseudotuberculosis. Владивосток: Примполиграфкомбинат, 2004. 219 с.
Чеснокова Н.П., Понукалина Е.В., Бизенкова М.Н. Молекулярно-клеточные механизмы инактивации свободных радикалов в биологических системах // Успехи соврем. естествознания. 2006. № 7. С. 29–36.
Almeida P.E., Roque N.R., Magalhães K.G., Mattos K.A., Teixeira L., Maya-Monteiro C., Almeida C.J., Castro-Faria-Neto H.C., Ryffel B., Quesniaux V.F., Bozza P.T. Differential TLR2 downstream signaling regulates lipid metabolism and cytokine production triggered by Mycobacterium bovis BCG infection // Biochim. Biophys. Acta. 2014. V. 1841. P. 97–107.
Benoit M., Desnues B., Mege J.L. Macrophage polarization in bacterial infections // J. Immunol. 2008. V. 181. P. 3733–3739.
Bradford M.M. A rapid and sensitive method for quantitation of microgram quantities of protein utilizing the principle of protein-dye binding // Analyt. Biochem. 1976. V. 72. P. 248–254.
Break T.J., Jun S., Indramohan M., Carr K.D., Sieve A.N., Dory L., Berg R.E. Extracellular superoxide dismutase inhibits innate immune responses and clearance of an intracellular bacterial infection // J. Immunol. 2012. V. 188. P. 3342–3350.
Brown G.C. Reversible binding and inhibition of catalase by nitric oxide // J. Biochem. 1995. V. 232. P. 188–191.
Chia F.-S., Xing J. Echinoderm coelomocytes // Zool. Studies. 1996. V. 35. P. 231–254.
Dobashi K., Pahan K., Chahal A., Singh I. Modulation of endogenous antioxidant enzymes by nitric oxide in rat C6 glial cells // J. Neurochem. 1997. V. 68. P. 1896–1903.
Dolmatova L.S., Ulanova O.A. Dexamethasone treatment in vitro resulted in different responces of two fractions of phagocytes of the holothurian Eupentacta fraudatrix // Rus. J. Marine Biol. 2015. V. 41. P. 503–506.
Dolmatova L.S., Eliseykina M.G., Timchenko N.F., Kovaleva A.L., Shitkova O.A. Generation of reactive oxygen species in the different fractions of the coelomocytes of holothurian Eupentacta fraudatrix in response to the thermostable toxin of Yersinia pseudotuberculosis in vitro // Chinese J. Oceanol. Limnol. 2003. V. 21. P. 293–304.
Elnekave K., Siman-Tov R., Ankri S. Consumption of L-arginine mediated by Entamoeba histolytica L-arginase (EhArg) inhibits amoebicidal activity and nitric oxide production by activated macrophages // Parasite Immunol. 2003. V. 25. P. 597–608.
Fraternale A., Brundu S., Magnani M. Polarization and repolarization of macrophages // J. Clin. Cell. Immunol. 2015. V. 6. P. 2–12.
Habig W.H., Pabst M.J., Jackoby W.B. Glutathione S-transferase. The first enzymatic step in mercapturic acid formation // J. Biol. Chem. 1974. V. 249. P. 7130–7139.
He C., Carter A.B. The metabolic prospective and redox regulation of macrophage polarization // J. Clin. Cell. Immunol. 2015. V. 6. Pii: 371.
Koren-Gluzer M., Rosenblat M., Hayek T. Paraoxonase 2 induces a phenotypic switch in macrophage polarization favoring an M2 anti-inflammatory state // Int. J. Endocrinol. 2015. V. 2015. ID 915243. 9 p.
Korhonen R., Lahti A., Hämäläinen M., Kankaanranta H., Moilanen E. Dexamethasone inhibits inducible nitric-oxide synthase expression and nitric oxide production by destabilizing mRNA in lipopolysaccharide-treated macrophages // Mol. Pharmacol. 2002. V. 62. P. 698–704.
Kraaij M.D., van der Kooij S.W., Reinders M.E., Koekkoek K., Rabelink T.J., van Kooten C., Gelderman K.A. Dexamethasone increases ROS production and T cell suppressive capacity by anti-inflammatory macrophages // Mol. Immunol. 2011. V. 49. P. 549–557.
Mendoza-Coronel E., Ortega E. Macrophage polarization modulates FcγR- and CD13-mediated phagocytosis and reactive oxygen species production, independently of receptor membrane // Front. Immunol. 2017. V. 8. P. 303.
Merriman J.A., Klingelhutz A.J., Diekema D.J., Leung D.Y. Novel Staphylococcus aureus secreted protein alters keratinocyte proliferation and elicits a proinflammatory response in vitro and in vivo // Biochemistry. 2015. V. 54. P. 4855–4862.
Nguyen G.T., Green E.R., Mecsas J. Neutrophils to the ROScue: Mechanisms of NADPH oxidase activation and bacterial resistance // Front. Cell. Infect. Microbiol. 2017. V. 7. P. 373.
Oboh G., Ademiluyi A.O., Ademosun A.O., Olasehinde T.A., Oyeleye S.I., Boligon A.A., Athayde M.L. Phenolic extract from Moringa oleifera leaves inhibits key enzymes linked to erectile dysfunction and oxidative stress in rats’ penile tissues // Biochem. Res. Int. 2015. V. 2015. ID 175950. 8 p.
Rast J.P., Messier-Solek C. Marine invertebrate genome sequences and our evolving understanding of animal immunity // Biol. Bull. 2008. V. 214. P. 274–283.
Smith L.C., Davidson E.H. The echinoid immune system and the phylogenetic occurrence of immune mechanisms in deuterostomes // Immunol. Today. 1992. V. 13. P. 356–362.
Tan H., Wang N., Li S., Hong M., Wang X., Feng Y. The reactive oxygen species in macrophage polarization: reflecting its dual role in progression and treatment of human diseases // Oxid. Med. Cell Longev. 2016. ID 2795090. 16 p.
Torika N., Asraf K., Danon A.A., Apte R.N., Fleisher-Berkovich S. Telmisartan modulates glial activation: in vitro and in vivo studies // PLoS One. 2016. V. 11. P. e0155823.
Trav’es P.G., Luque A., Hortelano S. Macrophages, inflammation, and tumor suppressors: ARF, a new player in the game // Mediators Inflamm. 2012. ID 568783. 11 p.
Tsai H.C., Wu R. Cholera toxin directly enhances IL-17A production from human CD4+ T cells // J. Immunol. 2013. V. 191. P. 4095–4102.
Zheng W., Umitsu M., Jagan I., Tran C.W., Ishiyama N., BeGora M., Araki K., Ohashi P.S., Ikura M., Muthuswamy S.K. An interaction between Scribble and the NADPH oxidase complex controls M1 macrophage polarization and function // Nat. Cell Biol. 2016. V. 18. P. 1244–1252.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


