Известия РАН. Серия биологическая, 2019, № 2, стр. 189-196
Влияние холецистокинина на активность пептидаз и гликозидаз слизистой оболочки кишечника карпа Cyprinus carpio
В. В. Кузьмина *
Институт биологии внутренних вод им. И.Д. Папанина РАН
152742 Ярославская обл., Некоузский р-н, пос. Борок, 109, Россия
* E-mail: vkuzmina@ibiw.yaroslavl.ru
Поступила в редакцию 17.01.2018
После доработки 03.04.2018
Принята к публикации 05.03.2018
Аннотация
Исследовано влияние холецистокинина (ХЦК) на активность пептидаз (АП) и гликозидаз (АГ) слизистой оболочки кишечника молоди карпа Cyprinus carpio. Установлено, что динамика активности ферментов разных цепей под влиянием гормона различна. Показано, что под влиянием экзогенного ХЦК АП по сравнению с интактными рыбами снижается через 0.25. 0.5, 120, 144 и 168, АГ – через 0.5, 48 и 96 ч. Обнаружено снижение АП под влиянием ХЦК по сравнению с контролем через 0.5 и 120, АГ – через 0.5, 48, 96, 120 и 144 ч после введения. Обсуждаются механизмы влияния ХЦК на АП и АГ слизистой оболочки кишечника рыб.
Известно, что процессы пищеварения у рыб наряду с другими звеньями экзотрофии находятся под сложным нейрогуморальным контролем (Шпарковский, 1986; De Pedro, Bjornsson, 2001; Кузьмина, 2005, 2015; Volkoff, 2016). Один из пептидов, участвующих в регуляции различных этапов экзотрофии, – холецистокинин (ХЦК). ХЦК выполняет разнообразные функции: в кишечнике – гормона, в мозге – нейротрансмиттера. ХЦК-подобные пептиды связываются с двумя подтипами рецепторов: рецептором CCK-A (или CCK-1), расположенным в основном в желудочно-кишечном тракте, и рецептором CCK-B (или CCK-2), расположенным в основном в головном мозге (Volkoff et al., 2005). ХЦК снижает аппетит и вызывает чувство сытости (Himick, Peter, 1994; Volkoff et al., 2003; Rubio et al., 2008), тогда как антагонисты ХЦК вызывают увеличение потребления пищи (Gelineau, Boujard, 2001).
На периферии ХЦК у рыб блокирует желудочную секрецию, влияет на гладкую мускулатуру, вызывает задержку опорожнения желудка, сокращение желчного пузыря и увеличение его подвижности, стимулирует секрецию липазы, трипсина и химотрипсина (Holstein, 1982; Aldman, Holmgren, 1987; Jonsson et al., 1987; Honkanen et al., 1988; Rajjo et al., 1988; Aldman et al., 1992; Einarsson et al., 1997; Olsson et al., 1999; Olsson, Holmgren, 2001; Tillner et al., 2014). При исследовании млекопитающих доказано, что ХЦК расслабляет сфинктер Одди, увеличивает секрецию желчи, уменьшает абсорбцию воды, Na+, K+ и Cl– в кишечнике, усиливает электрическую активность мышц желудка и кишки, а также влияет на моторику кишечника (Уголев, 1978; Климов, 1983; Коротько, 2005).
ХЦК идентифицирован в центральной нервной системе и периферических тканях у ряда видов хрящевых и костистых рыб: акулы Squalus acanthias (Holmgren, Nelsson, 1983), ската Raja ocellata (MacDonald, Volkoff, 2009а), золотых рыбок Carassius auratus (Peyon et al., 1998, 1999), радужной форели Salmo gairdneri (Holmgren et al., 1982) и Oncorhynchus mykis (Jensen et al., 2001), атлантической сельди Clupea harengus (Ronnestad et al., 2007), фугу Tetraodon nigroviridis и камбалы Paralichthys olivaceus (Kurokawa et al., 2003), а также камбалы Pseudopleuronectes americanus (MacDonald, Volkoff, 2009b), атлантического лосося Salmo salar (Murashita et al., 2009) и учанского леща Megalobrama amblycephala (Ji et al., 2015). Установлено, что в желудочно-кишечном тракте личинок сельди C. harengus секрецию гормона запускает появление пищи в кишечнике (Koven et al., 2002). Стимуляторы секреции ХЦК – поступающие из желудка пептиды и аминокислоты, особенно L-фенилаланин и триптофан (Уголев, 1978; Koven et al., 2002), жиры, особенно отличающиеся наличием длинноцепочных жирных кислот (Rayford et al., 1976), а также ХЦК-рилизинг-фактор, или ХЦК-рилизинг-пептид (Коротько, 2005).
У рыб ХЦК выявляется в первые сроки перехода личинок на экзогенное питание. Однако содержание его низкое. У атлантической сельди C. harengus содержание ХЦК в пищеварительной системе составляет <10% общего содержания в личинках (Rojas-García et al., 2011). У атлантического палтуса Hippoglossus hippoglossus через 1 нед. после начала экзогенного питания содержание кишечного ХЦК составляло лишь 2% общего количества в личинках, уже через 4 нед. оно постепенно увеличивалось до 62% (Rojas-García, Rønnestad, 2002). Секреция ХЦК не обязательно связана с экспрессией гена. Известно, что бомбезин стимулирует секрецию ХЦК без изменения содержания мРНК ХЦК в кишечнике (Ronnestad, 2002).
При исследовании количества ХЦК в кишечнике камбалы P. americanus в разные сезоны года более низкое его содержание было отмечено зимой. Поскольку летом голодание вызвало уменьшение количества ХЦК в кишечнике, было предположено, что ХЦК играет важную роль в регуляции питания камбалы и влияет на сезонные колебания ее аппетита (MacDonald, Volkoff, 2009а, b).
Сведения о влиянии ХЦК на активность пищеварительных пептидаз рыб немногочисленны (Einarsson et al., 1997; Tillner et al., 2013, 2014). При исследовании личинок атлантической трески Gadus morhua было показано, что с 21-х сут после начала экзогенного питания количество ХЦК в течение 1 сут было относительно постоянным, но увеличивалось в период, когда активность трипсина была низкой. По мнению авторов, это свидетельствует о существовании механизма отрицательной обратной связи между количеством ХЦК и активностью трипсина (Tillner et al., 2013). Однако изучение содержания ХЦК и активности трипсина в кишечнике у 23-суточных личинок морского окуня Dicentrarchus labrax на фоне суточных флуктуаций показателей не выявило зависимости изменения количества ХЦК от режима питания. Это дало возможность предположить, что изменения содержания ХЦК в кишечнике личинок морского окуня следуют естественному эндогенному ритму (Tillner et al., 2014). Опубликованные данные о динамике активности пищеварительных гидролаз под влиянием введенного ХЦК отсутствуют.
Цель работы – изучение влияния ХЦК на динамику активности пептидаз (АП) и гликозидаз (АГ) слизистой оболочки кишечника у пресноводных костистых рыб на примере молоди карпа.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования – молодь карпа обыкновенного Cyprinus carpio L. (масса 9.2 ± 0.4 г). В опытах использовано 115 особей карпа, выведенных на экспериментальной прудовой базе ИБВВ РАН “Сунога”. Рыбы в конце сентября были перевезены в лабораторию, где их содержали в 200-литровом аквариуме с проточной водопроводной водой. Температура воды в аквариуме колебалась незначительно (16–18°С). Рыб кормили 2 раза в неделю желированным кормом (5% массы тела) с преобладанием белковых компонентов (17.3% белка, 1.7% липидов и 0.1% углеводов в расчете на сырую массу). За 2 нед до опыта рыб пересаживали в непроточные аквариумы объемом 40 л (площадь дна 30 × 60 см) с принудительной аэрацией (температура воды 20 ± 2°С). Режим кормления сохранялся. За 2 сут до начала опыта рыб переставали кормить.
Предварительно отбирали материал у 5 экз. интактных особей. Затем 110 экз. рыб из опытной группы внутрибрюшинно вводили 0.1 мл раствора ХЦК, CCK-33 (Sigma, США), в дозе 100 нг/кг массы тела, приготовленного на растворе Рингера для холоднокровных животных (103 мM NaCl, 1.9 мM KCl, 0.45 мM CaCl2, 1.4 мM MgSO4, рН 7.4). Рыбам контрольной группы (110 экз.) вводили равное количество раствора Рингера. Через определенные промежутки времени (0.25, 0.5, 1, 3, 24, 48, 72, 96, 120, 144 и 168 ч) у 5 экз. рыб из опытной группы и 5 экз. рыб из контрольной группы на холоду вскрывали брюшную полость, изымали висцеральные органы, которые помещали на ледяную баню (2–4°С). Кишечник быстро очищали от жира, разрезали вдоль, изымали содержимое и специальным скребком снимали слизистую оболочку. Затем отбирали аликвоту материала для приготовления исходного гомогената. Навески слизистой гомогенизировали в стеклянном гомогенизаторе с небольшим количеством раствора Рингера при 0–2°С. Затем полученный гомогенат разводили раствором Рингера (1 : 99). Рыб во время опыта не кормили.
АП, преимущественно активность трипсина, КФ 3.4.21.4, химотрипсина, КФ 3.4.21.1, карбоксипептидаз, КФ 3.4.16, аминопептидаз, КФ 3.4.11, и дипептидаз, КФ 3.4.13, определяли по приросту тирозина методом Ансона (Anson, 1938) в некоторой модификации. АГ – суммарная активность α-амилазы, КФ 3.2.1.1, глюкоамилазы, КФ 3.2.1.3, и ферментов группы мальтаз, КФ 3.2.1.20 – определяли методом Нельсона, модифицированным Уголевым и Иезуитовой (1969). В качестве субстратов использовали 1%-ные растворы казеина и растворимого крахмала. Инкубацию гомогената и субстрата осуществляли в течение 30 мин при непрерывном перемешивании. Активность ферментов в каждой временнóй точке определяли у каждой особи отдельно в двух повторностях с учетом фона (количество тирозина или гексоз в исходном гомогенате). Об уровне ферментативной активности судили по приросту продуктов реакции (тирозина и гексоз) за 1 мин инкубации субстрата и ферментативно-активного препарата в расчете на 1 г сырой массы ткани, мкмоль/(г мин). Интенсивность окрашивания определяли на фотоколориметре (КФК-2) при красном светофильтре, λ = 670 нм.
Результаты были обработаны статистически с помощью стандартного пакета программ (Microsoft Office’2007, приложение Excel). Степень различия средних арифметических рассчитывали с помощью t-критерия Стьюдента для малых выборок р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Влияние ХЦК на АП слизистой оболочки кишечника молоди карпа. У интактных рыб АП слизистой оболочки кишечника составляла 1.14 ± 0.1 мкмоль/(г мин). Под влиянием раствора Рингера и ХЦК АП слизистой волнообразно изменялась на протяжении всего эксперимента (рис. 1а). Через 0.25 ч у рыб контрольной (раствор Рингера) и опытной (ХЦК) групп АП достоверно снижалась (до 0.34 ± 0.03 и 0.61 ± 0.09 мкмоль/(г мин) соответственно). Через 0.5 и 1 ч у контрольных рыб был отмечен последовательный подъем АП до 2.39 ± 0.06 мкмоль/(г мин), более чем в 7 раз по сравнению с АП в первом сроке. У рыб опытной группы через 0.5 ч наблюдалось незначительное увеличение, а через 1 ч – резкое увеличение АП до 2.63 ± 0.04 мкмоль/(г мин), максимальное значение. После этого у рыб обеих групп наблюдалось постепенное снижение показателя (у контрольных вплоть до конца эксперимента, у рыб опытной группы – недостоверное увеличение показателя через 144 и 168 ч по сравнению с предыдущим сроком до 0.91 ± 0.05 и 0.9 ± 0.05 мкмоль/(г мин)). Следует отметить, что под влиянием ХЦК АП достоверно изменялась в течение всего эксперимента как по сравнению с интактными рыбами, так в большинстве случаев и по сравнению с контрольными рыбами (исключение 24, 48 и 72 ч).
Рис. 1.
Влияние холецистокинина на активность пептидаз (а) и гликозидаз (б) слизистой оболочки кишечника карпа. 1 – контроль, 2 – опыт. * – различия достоверны по сравнению с контролем.
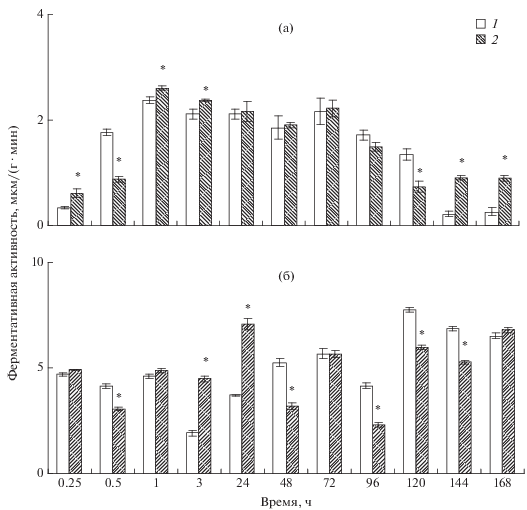
Влияние ХЦК на АГ слизистой оболочки кишечника молоди карпа. У интактных рыб АГ слизистой оболочки кишечника составляла 4.04 ± 0.12 мкмоль/(г · мин) (рис. 1б). Динамика АГ у рыб обеих групп также носит колебательный характер. Через 0.25 ч после инъекций ферментативная активность возрастает как у контрольных, так и у опытных рыб (4.7 ± 0.08 и 4.91 ± 0.03 мкмоль/(г · мин) соответственно). Через 0.5 ч АГ снижается у рыб обеих групп, особенно у рыб опытной группы, до 3.06 ± 0.1 мкмоль/(г · мин). Однако через 1 ч после инъекций отмечалось увеличение АГ, через 3 ч – снижение показателя, а через 24 ч – резкий подъем, достигающий у рыб опытной группы максимума (7.07 ± 0.27 мкмоль/(г · мин)). Затем следовали спады и новые подъемы ферментативной активности, достигающие устойчиво высоких значений в конце эксперимента. Динамика АГ у рыб контрольной группы в большинстве случаев была близка к таковой у рыб опытной группы.
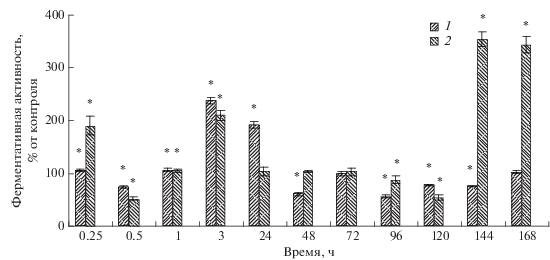
Влияние ХЦК на относительную АП и АГ слизистой оболочки кишечника карпа. Для выявления особенностей влияния ХЦК на активность ферментов цепей пептидаз и гликозидаз были сопоставлены данные по их относительной активности по отношению к контролю, принятому за 100% (рис. 2). Расчеты позволили отчетливее выявить различия влияния ХЦК на исследованные ферменты. Через 0.25 ч после введения гормона АГ изменялась незначительно, АП увеличивалась на 79.4% по отношению к контролю. Через 0.5 ч АГ снижалась на 26.6%, АП – на 50.6%. Через 1 ч АГ и АП у рыб опытной группы слабо отличались от аналогичных активностей у контрольных рыб. В последующие два срока (3 и 24 ч) наблюдалось более значительное изменение АГ по сравнению с изменением АП. Так, через 3 ч после введения гормона АГ увеличилась на 140, через 24 ч – на 91.7%. Через 48 ч было отмечено снижение ферментативной активности на 38.5%, через 72 ч – подъем до контрольных значений, а через 96 ч – новое снижение на 47% и постепенное возвращение к контрольным значениям в конце эксперимента. Значения относительной АП после увеличения через 3 и 24 ч в течение 3 сут были близки к контрольным. Однако через 120 ч наблюдалось достоверное снижение (на 56.8%) АП по сравнению с контролем, а через 144 и 168 ч – значительный рост АП (на 262 и 254% соответственно).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Как известно, регуляция процессов пищеварения у рыб и других позвоночных очень сложна и включает в себя контроль нервной и эндокринной систем. При этом ХЦК рассматривается как один из важнейших гормонов, участвующих в регуляции экзокринной части поджелудочной железы (Уголев, 1978; Климов, 1983; Rønnestad, 2002; Коротько, 2005; Rønnestad et al., 2007). При исследовании млекопитающих было показано, что трипсин вовлечен в контроль обратной связи высвобождения ХЦК из синтезирующих его клеток в области щеточной каймы энтероцитов. Важную роль при этом играет ХЦК-релизинг-фактор, который у млекопитающих секретируется слизистой оболочной проксимального отдела двенадцатиперстной кишки под контролем блуждающего нерва как стимулятора его секреции. Концентрация ХЦК-релизинг-фактора в дуоденальном содержимом повышается после приема пищи и введения в кишку ингибиторов пептидаз. Поскольку трипсин дезактивирует ХЦК-релизинг-фактор, стимулирование секреции ХЦК осуществляется только в отсутствие трипсина (Коротько, 2005).
Полученные данные свидетельствуют о том, что введенный внутрибрюшинно ХЦК влияет на активность ферментов, синтезируемых поджелудочной железой. Это хорошо согласуется с ранее полученными данными (Honkanen et al., 1988; Einarsson et al., 1997). В наших опытах не только ХЦК, но и раствор Рингера значительно влияют на АП и АГ. По всей вероятности, это обусловлено стрессом, вызванным хэндлингом и уколами. Стресс также может вызывать голодание рыб (Wendelaar-Bonga, 1997).
Известно, что уровни экспрессии мРНК ХЦК в головном мозге и кишечнике белого амура Ctenopharyngodon idellus снижаются после голодания в течение 2, 7 и 15 сут по сравнению с контролем. При возобновлении питания уровни экспрессии мРНК ХЦК возвращаются к уровню контроля в течение 7–15 сут (Feng et al., 2012). Голодание данио Danio rerio в течение 16 сут наряду с другими изменениями вызывает повышение количества мРНК трипсина. При этом кратковременное голодание активирует экспрессию генов синтеза глюкозы, длительное – снижение количества мРНК ферментов распада глюкозы и генов пентозофосфатного шунта (Tian et al., 2015). 7-суточная пищевая депривация вызывает у линя Tinca tinca значительное снижение содержания глюкозы в плазме крови, гликогена в печени и гормонов щитовидной железы (Т3 и Т4), а также увеличение содержания в гипоталамусе норэпинефрина и дофамина (De Pedro et al., 2003).
Активности ферментов разных цепей различны. АГ слизистой оболочки кишечника карпа под действием раствора Рингера и ХЦК характеризуется поочередными спадами и подъемами, в то время как АП плавно увеличивается до максимального значения и затем снижается до исходного. Важно отметить, что, несмотря на использование единого контроля, наблюдаются различия динамики АП и АГ слизистой оболочки у контрольных рыб. Характер изменения АП в контроле, как правило, совпадает с таковым в опыте, в случае АГ наблюдаются некоторые различия. По всей вероятности, это связано с различиями в реакции ацинусов на стресс.
Важно отметить, что не только степень изменения, но и характер влияния ХЦК в целом ряде случаев отличаются от таковых у раствора Рингера. Так, АП после введения ХЦК достоверно увеличивается по сравнению с контролем через 0.25, 1, 3, 144 и 168, АГ – через 3 и 24 ч. Ингибирующее влияние ХЦК на АП наблюдается через 0.5, 96 и 120, на АГ – через 0.5, 48, 96, 120 и 144 ч после введения. В настоящее время не представляется возможным однозначно ответить на вопрос о причинах наблюдаемых различий. Частично они могут быть обусловлены тем, что на фоне стимулирования ацинарных клеток поджелудочной железы и повышения секреции пищеварительных ферментов под действием локально циркулирующего ХЦК (Климов, 1983) существуют другие, неконтролируемые факторы, которые вносят коррективы в стимуляцию секреции ферментов разных цепей. В частности, известно, что в стимуляции секреции α-амилазы участвует NO-эргический механизм (Коротько, 2005).
Определенную роль при этом могут играть взаимодействия эндогенного и введенного ХЦК с другими гормонами и нейропептидами. Так, бомбезин стимулирует не только секрецию ХЦК в кишечнике (Ronnestad, 2002), но и высвобождение гормона роста в переднем мозге (Canosa et al., 2004). У пещерной рыбы Astyanax fasciatus mexicanus внутрибрюшинные инъекции ХЦК индуцируют снижение экспрессии апелина в мозге (Penney, Volkoff, 2014), а голодание вызывает увеличение экспрессии мРНК апелина в мозге у костистой рыбы Schizothorax prenanti и пираньи Pygocentrus nattereri (Volkoff, 2016). Есть сведения о взаимодействии ХЦК и лептина: экспрессия мРНК ХЦК в гипоталамусе возрастает после введения лептина (Volkov et al., 2005). Введение ХЦК может повлиять на его взаимоотношения с другими гормонами и изменить энтерогипоталамический контур регуляции.
Помимо этого важную роль могут играть разные молекулярные массы ферментов: 40–50 кДа в случае α-амилазы и 25 кДа в случае трипсина. Эти различия могут влиять на скорость транспорта молекул ферментов через плазматические мембраны ациноцитов, причем благодаря меньшей массе транспорт трипсина имеет почти двукратное преимущество. В результате этого АГ в течение 7 сут по сравнению с контролем повышается лишь 1 раз (через 3 ч после введения ХЦК) и сохраняется в течение 1 сут. АП в течение 7 сут по сравнению с контролем увеличивается 3 раза (через 0.25, 3 и 144 ч после введения ХЦК). При этом влияние последовательно возрастает и сохраняется еще в течение 1 сут. Последнее может быть связано с деградацией молекулы ХЦК (CCK-33) и высвобождением под действием пептидаз более активного октапептида (CCK-8). Действительно, макромолекула ХЦК состоит из 33 аминокислот, причем биологическая активность обусловлена С-концевым участком октапептида (CCK-8). Под действием пептидаз ХЦК расщепляется на ряд биологически активных фрагментов (ССК-пептидов), причем на долю октапептида (ССК-8) приходится 60–70% (Blanke et al., 1993).
Поскольку часть секретируемых поджелудочной железой ферментов поступает в кровь (Rothman, 1977; Коротько, 2005), многократное увеличение АП в слизистой оболочке кишечника может быть обусловлено не только деградацией ХЦК, но и поступлением ферментов из крови в железу и повторным их участием в гидролизе белковых компонентов пищи, установленном ранее для млекопитающих (Rothman, 1977).
Таким образом, экзогенный ХЦК влияет на АП и АГ слизистой оболочки кишечника молоди карпа. Активности ферментов разных цепей различны. По сравнению с интактными рыбами АП под влиянием экзогенного ХЦК снижается через 0.25. 0.5, 120, 144 и 168, АГ – через 0.5, 48 и 96 ч. В значительной мере эти различия обусловлены стрессом, вызванным хэндлингом и инъекцией. Изменения АП и АГ под влиянием ХЦК по сравнению с контролем также различны. Наибольшее стимулирующее влияние ХЦК на АП наблюдается через 0.25, 1, 3, 144 и 168, на АГ – через 3 и 24 ч после введения. Наибольшее ингибирующее влияние ХЦК на АП наблюдается через 0.5 и 120, на АГ – через 0.5, 48, 96, 120 и 144 ч после введения. Следовательно, гормон в большей степени стимулирует синтез и факторы, влияющие на АП, по сравнению с АГ. Помимо разной молекулярной массы α-амилазы и трипсина на способность ферментов преодолевать плазматические мембраны ациноцитов и скорость транслокации могут влиять различные стимуляторы и ингибиторы ХЦК, в том числе ХЦК-релизинг-фактор.
Автор выражает благодарность А.В. Докучаевой за участие в проведении опытов.
Список литературы
Климов П.К. Пептиды и пищеварительная система. Л.: Наука, 1983. 273 с.
Коротько Г.Ф. Секреция поджелудочной железы. Краснодар: Изд-во. Кубанск. гос. мед. ун-та, 2005. 312 с.
Кузьмина В.В. Физиолого-биохимические основы экзотрофии рыб. М.: Наука, 2005. 300 с.
Кузьмина В.В. Процессы экзотрофии у рыб. Организация. Регуляция. Адаптации. М.: Полиграф-Плюс, 2015. 260 с.
Уголев А.М. Энтериновая (кишечная гормональная) система. Л.: Наука, 1978. 315 с.
Уголев А.М., Иезуитова Н.Н. Определение активности инвертазы и других дисахаридаз // Исследование пищеварительного аппарата у человека. Обзор современных методов. Л.: Наука, 1969. С. 169–173.
Шпарковский И.А. Физиология пищеварения рыб. Двигательная функция. Л.: Наука, 1986. 176 с.
Aldman G., Holmgren S. Control of gallbladder motility in the rainbow trout, Salmo gairdneri // Fish Physiol. Biochem. 1987. V. 4. P. 143–155.
Aldman G., Grove D., Holmgren S. Duodenal acidification and intra-arterial injection of CCK8 increase gallbladder motility in the rainbow trout, Oncorhynchus mykiss // Gen. Comp. Endocrinol. 1992. V. 86. P. 20–25.
Anson M. The estimation of pepsin, trypsin, papain and cathepsin with hemoglobin // J. Gen. Physiol. 1938. V. 22. P. 79–83.
Blanke S.E., Johnsen A.H., Rehfeld J.F. N-terminal fragments of intestinal cholecystokinin: evidence for release of CCR-8 by cleavage on the carboxyl side of Arg (74) in proCCK // Regul. Pept. 1993. V. 46. P. 575–582.
Canosa L.F., Peter R. Effects of cholecystokinin and bombesin on the expression of preprosomatostatin-encoding genes in goldfish forebrain // Regul. Pept. 2004. V. 121. P. 99–105.
De Pedro N., Bjornsson B.T. Regulation of food intake by neiro-peptides and hormones // Food intake in fish. Ch. 12 / Eds Houlihan D., Boujard T., Jobling M. Oxford: Blackwell Sci., 2001. P. 269–296.
De Pedro N., Delgado M.J., Gancedo B., Alonso-Bedate M. Changes in glucose, glycogen, thyroid activity and hypothalamic catecholamines in tench by starvation and refeeding // J. Comp. Biochem. Physiol. 2003. V. 173. P. 475–481.
Einarsson S., Davies P.S., Talbot C. Effect of exogenous cholecystokinin on the discharge of the gallbladder and the secretion of trypsin and chymotrypsin from the pancreas of the Atlantic salmon, Salmo salar L. // Comp. Biochem. Physiol. 1997. V. 117 C. P. 63–67.
Feng K., Zhang G.-R., Wei K.-J., Xiong B.-X., Liang T., Pin H.-C. Molecular characterization of cholecystokinin in grass carp (Ctenopharyngodon idellus): cloning, localization, developmental profile, and effect of fasting and refeeding on expression in the brain and intestine // Fish Physiol. Biochem. 2012. V. 38. Iss. 6. P. 1825–1834.
Gelineau A., Boujard T. Oral administration of cholecystokinin receptor antagonists increase feed intake in rainbow trout // J. Fish Biol. 2001. V. 58. P. 716–724.
Himick B.A., Peter R.E. CCK/gastrin-like immunoreactivity in brain and gut, and CCK suppression of feeding in goldfish // Am. J. Physiol. 1994. V. 267. P. R841–R851.
Holmgren S., Nelsson S. Bombesin-, gastrin/CCK-, 5-hydroxytryptamini-, neurotensin-, somatostatin-, and VIP-like immunoreactivity and catecholamine fluorescence in the gut of elasmobranch, Squalus acanthias // Cell Tiss. Res. 1983. V. 234. P. 595–618.
Holmgren S., Vaillant C., Dimaline R. VIP-, gastrin/CCK-, bombesin-, somatstatin-, and glucagon-like immunoreactivities in the gut of the rainbow trout, Salmo gairdneri // Cell Tiss. Res. 1982. V. 223. P. 141–153.
Holstein B. Inhibition of gastric acid secretion in the Atlantic cod, Gadus morhua, by sulphated and desulphated gastrin, caerulein, and CCK-octapeptide // Acta Physiol. Scand. 1982. V. 114. P. 453–459.
Honkanen R.E., Crim J.W., Patton J.S. Effects of cholecystokinin peptides on digestive enzymes in killifish in vivo // Comp. Biochem. Physiol. 1988. V. 89A. P. 655–660.
Jensen H., Rourke I.J., Moller M., Jonson L., Johnsen A.H. Identification and distribution of CCK-related peptides and mRNAs in the rainbow trout // Biochem. Biophys. Acta. 2001. V. 1517. P. 190–201.
Ji W., Ping H.C., Wei K.J., Zhang G.R., Shi Z.C., Yang R.B., Zou G.W. Ghrelin, neuropeptide Y (NPY) and cholecystokinin (CCK) in blunt snout bream (Megalobrama amblycephala): cDNA cloning, tissue distribution and mRNA expression changes responding to fasting and refeeding // Gen. Comp. Endocrinol. 2015. V. 223. P. 108–119.
Jonsson A.C., Holmgren S., Holstein B. Gastrin/CCK-like immunoreactivity in endocrine cells and nerves in the gastrointestinal tract of the cod, Gadus morhua, and the effect of peptides of gastrin/CCK family on cod gastrointestinal smooth muscle // Gen. Comp. Endocrinol. 1987. V. 66. P. 190–202.
Koven W., Rojas-Garcia C.R., Finn R.N., Tandler A., Rønnestad I. The stimulatory effect of ingested protein and/or free amino acids on the secretion of the gastro-endocrine hormone, cholecystokinin (CCK) and the protease, trypsin, in first feeding herring larvae, Clupea harengus // Mar. Biol. 2002. V. 140. P. 1241–1247.
Kurokawa T., Suzuki T., Hashimoto H. Identification of gastrin and multiple cholecystokinin genes in teleost // Peptides. 2003. V. 24. P. 227–235.
MacDonald E., Volkoff H. Neuropeptide Y (NPY), cocaine- and amphetamine-regulated transcript (CART) and cholecystokinin (CCK) in winter skate (Raja ocellata): cDNA cloning, tissue distribution and mRNA expression responses to fasting // Gen. Comp. Endocrinol. 2009a. V. 161. P. 252–261.
MacDonald E., Volkoff H. Cloning, distribution and effects of season and nutritional status on the expression of neuropeptide Y (NPY), cocaine and amphetamine regulated transcript (CART) and cholecystokinin (CCK) in winter flounder (Pseudopleuronectes americanus) // Hormon. Behav. 2009b. V. 56. Iss. 1. P. 58–65.
Murashita K., Kurokawa T., Nilsen T.O., Ronnestad I. Ghrelin, cholecystokinin, and peptide YY in Atlantic salmon (Salmo salar): molecular cloning and tissue expression // Gen. Comp. Endocrinol. 2009. V. 160. P. 223–235.
Olsson C., Holmgren S. The control of gut motility // Compar. Biochem. Physiol. 2001. V. 128. № 3. P. 481–503.
Olsson C., Aldman G., Larsson A., Holmgren S. Cholecystokinin affects gastric emptying and stomach motility in the rainbow trout Oncorhynchus mykiss // J. Exp. Biol. 1999. V. 202. P. 161–170.
Penney C.C., Volkoff H. Peripheral injections of cholecystokinin, apelin, ghrelin and orexin in cavefish (Astyanax fasciatus mexicanus): Effects on feeding and on the brain expression levels of tyrosine hydroxylase, mechanistic target of rapamycin and appetite-related hormones // Gen. Comp. Endocrinol. 2014. V. 196. P. 4–40.
Peyon P., Lin X.W., Himick B.A., Peter R.E. Molecular cloning and expression of cDNA encoding brain preprocholecystokinin in goldfish // Peptides. 1998. V. 19. P. 199–210.
Peyon P., Saied H., Lin X., Peter R. E. Postprandial, seasonal and sexual variations in cholecystokinin gene expression in goldfish brain // Brain Res. Mol. Brain Res. 1999. V. 74. P. 190–196.
Rajjo I.M., Vigna S.R., Crim J.W. Cholecystokinin immunoreactivity in the digestive tract of bowfin (Amia calva), bluegill (Lepomis macrochirus), and a bullfog (Rana catesbeiana) // Gen. Comp. Endocrinol. 1988. V. 70. P. 133–144.
Rayford P.L., Miller T.A., Thompson J.C. Secretin, Cholecystokinin and newer gastrointestinal hormones // New Engl. J. Med. 1976. V. 296. P. 1093–1101.
Rojas-García C.R., Rønnestad I. Cholecystokinin and tryptic activity in the gut and body of developing Atlantic halibut larvae: evidence for participation in the regulation of protein digestion // J. Fish Biol. 2002. V. 61. P. 973–986.
Rojas-García C.R., Morais S., Rønnestad I. Cholecystokinin (CCK) in Atlantic herring (Clupea harengus L.). Ontogeny and effects of feeding and diurnal rhythms // Compar. Biochem. Physiol. 2011. V. 158A. P. 455–460.
Rønnestad I. Control and efficiency of digestive function of marine fish larvae // Avances en Nutricion Acuicola VI. Memorias del VI Simposium Internacional de Nutricion Acuicola. 3 al 6 de Septiembre del 2002 / Eds Cruz-Suarez L.E., Ricque-Marie D., Tapia-Salazar M., Gaxiola-Cortés M.G., Simoes N. Mexico: Cancun.Quintana Roo, 2002. P. 152–165.
Rønnestad I., Kamisaka Y., Conceição L.E.C., Morais S., Tonheim S.K. Digestive physiology of marine fish larvae: hormonal control and processing capacity for proteins, peptides and amino acids // Aquaculture. 2007. V. 268. P. 82–97.
Rothman S.S. The digestive enzymes of the pancreas: a mixture of inconstant proportions // Ann. Rev. Physiol. 1977. V. 39. P. 373–389.
Rubio V.C., Sánchez-Vázquez F.J., Madrid J.A. Role of cholecystokinin and its antagonist proglumide on macronutrient selection in European sea bass Dicentrarchus labrax, L. // Physiol. Behav. 2008. V. 93. № 4–5. P. 862–869.
Tian J., He G., Mai K., Liu C. Effects of postprandial starvation on mRNA expression of endocrine-, amino acid and peptide transporter-, and metabolic enzyme-related genes in zebrafish (Danio rerio) // Fish Physiol. Biochem. 2015. V. 41. Iss. 3. P. 773–787.
Tillner R., Ronnestad I., Dhert P., Ueberschar B. The regulatory loop between gut cholecystokinin and tryptic enzyme activity in sea bass (Dicentrarchus labrax) larvae is influenced by different feeding regimes and trigger substances // Aquaculture. 2014. V. 420. P. 139–146.
Tillner R., Ronnestad I., Harboe T., Ueberschar B. Hormonal control of tryptic enzyme activity in Atlantic cod larvae (Gadus morhua): involvement of cholecystokinin during ontogeny and diurnal rhythm // Aquaculture. 2013. V. 402. P. 133–140.
Volkoff H. The neuroendocrine regulation of food intake in fish: A review of current knowledge // Frontiers Neurosci. 2016. V. 10. P. 540–570.
Volkoff H., Eykelbosh A.J., Peter R.E. Role of leptin in the control of feeding of gold fish Carassius auratus: interactions with cholecystokinin, neuropeptide Y and orexin A, and modulation by fasting // Brain Res. 2003. V. 972. P. 90–109.
Volkoff H., Canosa L.F., Unniappan S., Cerda-Reverter J.M., Bernier N.J., Kelly S.P. Neuropeptides and the control of food intake in fish // Gen. Comp. Endocrinol. 2005. V. 142. P. 3–19.
Wendelaar-Bonga S.E. The stress response in fish // Physiol. Rev. 1997. V. 77. P. 591–625.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая