Известия РАН. Серия биологическая, 2019, № 3, стр. 273-283
Пролиферация и дифференцировка: два последовательных этапа активности пролиферативных центров в грибовидных телах эмбрионов сверчков Gryllus bimaculatus и Acheta domesticus и пустынной саранчи Schistocerca gregaria (Insecta: Orthoptera)
А. А. Панов *
Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
* E-mail: tortrix@yandex.ru
Поступила в редакцию 25.12.2017
После доработки 12.01.2018
Принята к публикации 01.02.2018
Аннотация
Впервые установлено, что у трех прямокрылых насекомых, сверчков Gryllus bimaculatus и Acheta domesticus, а также саранчового Schistocerca gregaria, стволовые клетки эмбриональных центров формирования клеток Кеньона проходят два последовательных этапа развития. Найдено, что на первом этапе они представлены симметрично делящимися пронейробластами, за счет деления которых увеличивается пул стволовых клеток, а в начале второго этапа пронейробласты превращаются в настоящие асимметрично делящиеся нейробласты грибовидных тел. Показано, что, как и у одиночных нейробластов, продукты их деления – дочерний нейробласт и ганглиозная материнская клетка, в результате равномерного деления которой образуются две клетки, дифференцирующиеся в клетки Кеньона. Считается, что обнаруженная картина нейрогенеза в грибовидных телах изученных прямокрылых напоминает ранее описанную в зрительных центрах насекомых.
У большинства насекомых клетки Кеньона, собственные нейроны грибовидных тел мозга насекомых, образуются, как и большинство других нейронов ЦНС насекомых, в результате митотической активности особых стволовых клеток, называемых одиночными нейробластами. Число одиночных нейробластов таксоноспецифично и в значительной степени определяет основную архитектуру грибовидных тел (Панов, 1957).
Однако у насекомых некоторых систематических групп в грибовидных телах обнаружены не одиночные нейробласты, а целые группы нейробластов. Наиболее сильного развития группы нейробластов достигают у перепончатокрылых (Bauer, 1904; Панов, 1957: Malun, 1998; Farris et al., 1999) и прямокрылых. Среди последних группы нейробластов были обнаружены в грибовидных телах некоторых кузнечиков (Панов, 1957) и у домового сверчка (Панов, 1966; Cayre et al., 1994). При этом у имаго домового сверчка в каждом грибовидном теле было найдено 150 ± 6 нейробластов (Cayre et al., 1994), а у эмбрионов непосредственно перед выходом из яйца – 100–110 нейробластов (Malaterre et al., 2002). У предкуколки медоносной пчелы внутри каждой чашечки было насчитано до 500 нейробластов (Farris et al., 1999). Эти группы нейробластов Феррис с соавт. назвала пролиферативными центрами. Так они будут называться для краткости и здесь, хотя, как будет показано ниже, в них протекают процессы не только пролиферации, но и дифференцировки.
Каким образом формируются такие большие группы стволовых клеток, до сих пор точно не известно. Для домового сверчка было предположено, что их образование может быть связано с деятельностью некоторых одиночных нейробластов (Malaterre et al., 2002). У медоносной пчелы в группах нейробластов грибовидных тел были описаны как асимметричные деления стволовых клеток, которые в конечном итоге приводят к дифференциации клеток Кеньона, так и симметричные, определяющие рост пула стволовых клеток (Панов, 1957; Malun, 1998; Farris et al., 1999).
Цель работы – выяснение клеточных механизмов формирования многоклеточных пролиферативных центров в грибовидных телах прямокрылых, начиная с ранних этапов эмбрионального нейрогенеза, поскольку у домового сверчка многочисленные асимметрично делящиеся нейробласты были найдены уже в середине эмбрионального периода (Панов, 1966; Malaterre et al., 2002).
МАТЕРИАЛЫ И МЕТОДЫ
Были изучены эмбрионы двупятнистого сверчка Gryllus bimaculatus Deg. и домового сверчка Acheta domesticus L., а также пустынной саранчи Schistocerca gregaria Forsk. Сверчки обоих видов были приобретены в зоомагазине и затем разводились в лаборатории, а кубышки саранчи были получены в инсектарии Московского зоопарка. Развитие яиц происходило во влажном песке или торфе при 25–28°С. Чтобы извлечь эмбрионы из хориона, яйца помещали в забуференный рингер PBS и для уничтожения тургора накалывали в месте, максимально удаленном от эмбриона или его головы. После этого отрезали наколотую часть яйца и выдавливали эмбрион из хориона. Фиксировали эмбрионы в жидкости Буэна в течение 2–3 сут и затем хранили в 70-градусном этаноле. Стадии развития эмбрионов сверчков определяли по таблицам Донахью и Экставор (Donoughe, Extavour, 2016), а эмбрионов саранчи – по Бентли с соавт. (Bentley et al., 1979). Срезы толщиной 10 мкм окрашивали железным гематоксилином по Гейденгайну (Ромейс, 1953). Цифровые изображения были получены с помошью микроскопа Leica DMR (Германия), снабженного камерой JVCKYF55B (Япония). Все изображения были обработаны с помощью программы Adobe Photoshop CS4.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Gryllus bimaculatus. Начиная приблизительно с эмбриональной стадии 7.5–8.5 (эмбрион в амниотической полости, грудные конечности короткие и приблизительно одинаковой длины), в областях протоцеребрума, которые впоследствии будут занимать тела клеток Кеньона, были обнаружены две симметричные группы, состоявшие каждая из 10–20 клеток и имевшие в целом вид конуса, основание которого совпадало с поверхностью мозга, а вершина была направлена в сторону нейропиля. Клетки, формирующие эти группы, резко отличались как от одиночных нейробластов, так и от соседних уже образовавшихся нейронов клеточной коры. Клетки в целом и их ядра были существенно мельче, чем у одиночных нейробластов, но были крупнее соседних протоцеребральных нейронов. Как и у одиночных нейробластов, ядра найденных клеток были окружены заметным слоем цитоплазмы и содержали очень крупные ядрышки, чем они резко отличались от соседних нейронов коры. Эти клетки назовем пронейробластами в соответствии с их местом в цепи нейрогенетических процессов, описываемых ниже, а все образование в целом – пролиферативным центром грибовидного тела. Ни у одного из эмбрионов, еще находившихся в амниотической полости, не было найдено делящихся пронейробластов. Группы пронейробластов были как бы встроены в слой одиночных нейробластов, причем как одиночные нейробласты, так и пронейробласты тесно примыкали к покрову головы эмбриона (рис. 1а).
Рис. 1.
Пролиферативный центр грибовидного тела эмбрионов Gryllus bimaculatus (сагиттальные срезы, передняя сторона головы эмбриона – слева). а – эмбриональная стадия 8–9, б – 10-я эмбриональная стадия, в – ранняя 11-я эмбриональная стадия, г – поздняя 11-я эмбриональная стадия, д – эмбриональная стадия 11–12 (на вставке показан асимметричный митоз нейробласта грибовидного тела), е – эмбриональная стадия 12–14. aM – асимметричное деление нейробласта грибовидного тела, GMC – ганглиозные материнские клетки, GMCM – делящиеся ганглиозные материнские клетки, KC – клетки Кеньона, NbMB – нейробласты грибовидного тела, PNb – пронейробласты, PNbM – делящиеся пронейробласты, sM – симметричный митоз пронейробласта, sNb – одиночные нейробласты, sNbM – делящиея одиночные нейробласты; для рис. 1–4. Масштаб: 10 (а, в–д) и 20 (б, е) мкм.
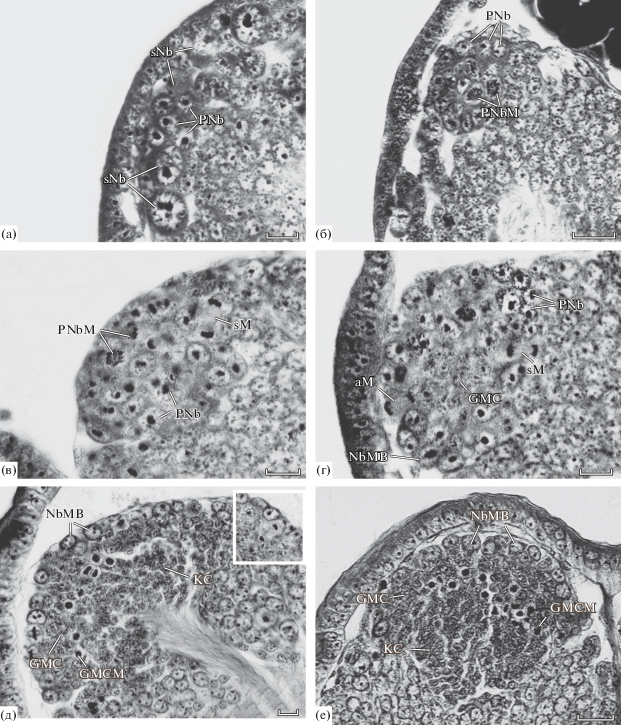
К стадии кататрепсиса (10-я стадия эмбриогенеза) число пронейробластов в каждом пролиферативном центре достигает ~50. У некоторых эмбрионов были обнаружены клетки в состоянии митоза, причем в основном встречались лишь метафазные пластики различной ориентации (рис. 1б). Кроме того, попадались также единичные митозы на стадии анафазы, свидетельствующие о симметричности делений. Таким образом, можно считать, что при делении пронейробластов образуются два одинаковых дочерних пронейробласта, причем внутри группы дочерние клетки расходятся в различных направлениях.
В поверхностном слое клеточной коры пролиферативный центр со всех сторон окружен одиночными нейробластами, делящимися асимметрично. Их потомки (материнские ганглиозные клетки и дифференцирующиеся нейроны) образуют колонны, местами обособленные одна от другой и только ближе к нейропилю сливающиеся в единую клеточную кору. Благодаря обособлению колонн дочерних клеток одиночных нейробластов отчетливо видно, что одиночные нейробласты, соседние с пронейробластами, по крайней мере на этой стадии развития не имеют к последним никакого отношения.
Эмбрионы 11-й стадии, во время которой длина эмбрионов составляет 1/2–2/3 длины яйца, были нами подразделена на две группы: эмбрионов с более короткими антеннами, что соответствует приблизительно 15-й яйцевой стадии, и эмбрионов с более длинными антеннами (приблизительно 16-я яйцевая стадия). У эмбрионов 1-й группы происходит еще более сильное увеличение размеров пролиферативных центров за счет интенсивного размножения пронейробластов. У значительной части исследованных эмбрионов были видны их многочисленные митозы, которые были однотипны, несмотря на некоторые различия в размере не делившихся клеток. Как и на предыдущей стадии, оси веретен делений пронейробластов были различно ориентированы, а митозы в анафазе подтверждали симметричность делений (рис. 1в).
К 16-й яйцевой стадии происходит быстрая и резкая перестройка деятельности пролиферативных центров. У менее продвинутых эмбрионов центр продолжает состоять преимущественно из пронейобластов, которые продолжают равномерно делиться. Однако клетки, образующие поверхностный слой в передней части центра, увеличиваются в объеме, округляются и начинают располагаться более рыхло, чем клетки его центра и задней части, которые сохраняют черты пронейробластов. Более того, у этих эмбрионов в пролиферативных центрах обнаружены митозы двух типов: симметричные, сосредоточенные среди пронейробластов в задней части пролиферативного центра, и митозы с более крупной метафазной пластинкой, ось веретена которых всегда перпендикулярна слою клеток, а поздние анафазы митозов свидетельствовали об их асимметричности. Таким образом, эти изменившиеся клетки стали вести себя как типичные одиночные нейробласты, отличаясь от них лишь меньшими размерами.
У более продвинутых эмбрионов той же стадии развития зона, занимаемая изменившимися пронейробластами, расширяется, и под ними постепенно накапливаются продукты их асимметричных митозов, ганглиозные материнские клетки (рис. 1г). У еще более продвинутых эмбрионов 16‑й яйцевой стадии на границе слоя ганглиозных материнских клеток и тел нейронов клеточной коры появляются симметричные митозы ганглиозных материнских клеток, однако на этой стадии развития клетки, образовавшиеся в результате этих делений, найдены не были.
Окончательное преобразование пролиферативных центров происходит к 17–18-й яйцевым (11–12-й эмбриональным) стадиям развития, когда остатки желтка образуют над головой лишь небольшую шапочку, или он уже полностью втягивается внутрь эмбриона. На этой стадии зачатки глаз слабо пигментируются.
Только на этой стадии эмбриогенеза складывается четырехслойная организация пролиферативного центра, описанная у Acheta domesticus (Malaterre et al., 2002). На этой стадии на препаратах начинают встречаться тела клеток, образовавшихся в результате равномерного деления ганглиозных материнских клеток, а у наиболее продвинутых эмбрионов от тел этих клеток уже отходят отростки, собирающиеся в единый толстый пучок, идущий в нейропиль. Так формируется многослойная клеточная структура, которая в почти неизменном виде продолжает функционировать у поздних эмбрионов, нимф и даже у имаго (Cayre et al., 1994, 1996).
Поверхностный слой центра образуют трансформированные пронейробласты, которые теперь назовем настоящими нейробластами грибовидных тел. В целом они образуют вид купола из 1–2 слоев клеток, вершинная часть которого граничит с оболочкой мозга. Края купола несколько погружены в клеточную кору и более многослойны. Под куполом собираются материнские ганглиозные клетки, начинающие делиться лишь на некотором расстоянии от нейробластов, но очень интенсивно. Наконец, внутренний слой образуют тела клеток Кеньона (рис. 1д, е). Первоначально, когда клеток Кеньона еще немного, все потомки нейробластов умещаются под куполом. Однако по мере роста грибовидных тел относительные размеры купола из нейробластов существенно снижаются, и клетки Кеньона далеко распространяются за его пределы.
Как происходит превращение плотной сплошной клеточной группы из пронейробластов в куполообразную структуру из нейробластов грибовидных тел? Можно предположить, что материнские ганглиозные клетки, смещающиеся под слой нейробластов, раздвигают нейробласты, находящиеся внутри центра, в стороны и ближе к поверхности мозга. Этот процесс наиболее активен в антеродорсальной части центра, где раньше происходит превращение пронейробластов в нейробласты и где раньше появляются материнские ганглиозные клетки. В задней части центра трансформация пронейробластов происходит позже, и они дольше находятся в виде сплошной плотной клеточной группы (рис. 1г).
Acheta domesticus. Эмбрионы домового сверчка были исследованы, начиная с эмбриональной стадии 7.2–8, когда эмбрион еще находится внутри амниотической полости и имеет частично сегментированные грудные конечности равной длины. На этой стадии в мозге уже можно идентифицировать пролиферативные центры грибовидных тел, состоящие из пронейробластов с приблизительно теми же морфологическими характеристиками, как и у G. bimaculatus. Число пронейробластов, подсчитанное у нескольких эмбрионов, колебалось от 20 до 50. Как и у двупятнистого сверчка, пролиферативный центр располагался в каждом полушарии в поверхностном слое клеточной коры протоцеребрума и со всех сторон был окружен одиночными нейробластами. На этой стадии развития деления пронейробластов встречались очень редко (рис. 2а).
Рис. 2.
Пролиферативный центр грибовидного тела эмбрионов Acheta domesticus (начало) (ориентировка срезов такая же, как на рис. 1). а – эмбриональные стадии 7.2–8; б–г – 10-я, 11-я и 12-я эмбриональные стадии соответственно. Масштаб: 20 мкм.
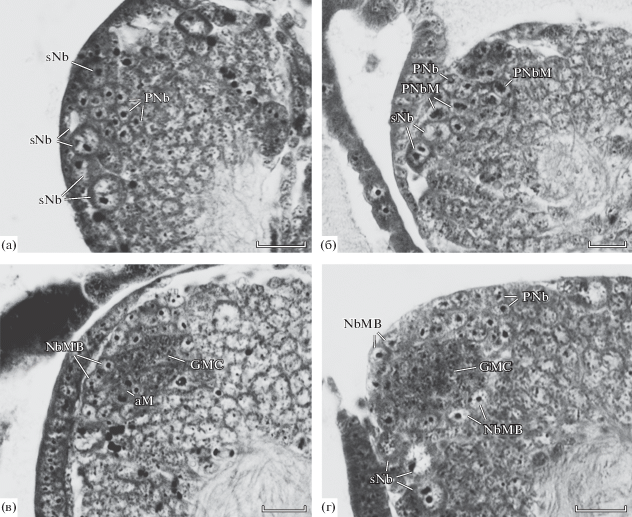
К этапу кататрепсиса (эмбриональная стадия 10) размер пролиферативных центров несколько возрастает, но они продолжают состоять только из плотного скопления пронейробластов, сохраняющих свои морфологические характеристики неизменными. У некоторых эмбрионов наблюдались многочисленные деления пронейробластов, веретена которых имели различную ориентировку (рис. 2б). Метафазные пластинки у пронейробластов были существенно мельче, чем у одиночных нейробластов.
В начале эмбриональной стадии 11 (длина эмбрионов равна 1/2–2/3 длины яйца) пролиферативные центры продолжают состоять из плотно расположенных пронейробластов, которые интенсивно делятся, причем, как и на предыдущей стадии, ориентировка веретен делений очень разнообразна. Благодаря обилию делений были встречены митозы на фазе поздней анафазы, которые подтвердили равномерность делений пронейробластов. На границе пролиферативных центров с клеточной корой были отмечены многочисленные картины пикноза. Однако остается неизвестным, указывает ли это на частичную дегенерацию пронейробластов, поскольку внутри пролиферативных центров картины пикноза никогда не наблюдались.
Уже на этой стадии эмбриогенеза у некоторых эмбрионов происходит размерная дифференциация клеток пролиферативных центров таким образом, что в поверхностном слое центра оказываются наиболее крупные клетки. По-видимому, это указывает, как и у двупятнистого сверчка, на начало процесса превращения пронейробластов в настоящие нейробласты грибовидных тел и связанную с этим перестройку деятельности пролиферативных центров. Это предположение подтверждается и тем, что в центральной части центров у таких эмбрионов начинают встречаться мелкие клетки, подобные ганглиозным материнским клеткам, найденным в центрах на более поздних стадиях развития, а также редкими находками асимметричных митозов (рис. 2в).
К стадиям 11–12 эмбриогенеза, когда над головой эмбриона остается только немного желтка, а глаза начинают пигментироваться, процесс трансформации пролиферативных центров существенно прогрессирует. У наименее продвинутых эмбрионов этих стадий развития, подобно тому, что наблюдалось у двупятнистого сверчка, трансформация пронейробластов происходит только в передней части пролиферативных центров. Они становятся крупнее, богаче цитоплазмой и выстраиваются в 1–2 слоя вдоль мозговой поверхности, несколько вдаваясь в глубину мозга по краям центра. В передней части пролиферативных центров встречаются асимметричные митозы и сосредоточены вновь образованные ганглиозные материнские клетки. Деления последних отсутствуют или очень редки. Задняя часть центров представлена плотным скоплением более мелких пронейробластов, которые подолжают делиться симметрично.
В наиболее продвинутых эмбрионах завершается процесс превращения пронейробластов в настоящие нейробласты грибовидных тел. Как и у двупятнистого сверчка, нейробласты образуют структуру типа купола с подвернутыми краями, граничащего с мозговой оболочкой. Этот купол накрывает все остальные клетки центра, расположенные поэтажно: под нейробластами лежат неделящиеся ганглиозные материнсткие клетки, далее располагается слой делящихся ганглиозных материнских клеток, тела дифференцирующихся клеток Кеньона и, наконец, пучок отростков последних, уходящий в нейропиль (рис. 3а, б). Хотя ранее было показано, что у эмбрионов домового сверчка первыми дифференцируются клетки Кеньона, связанные с задней чашечкой (Malaterre et al., 2002), новообразование клеток Кеньона, судя по расположению делящихся ганглиозных материнских клеток, носит круговой характер и не приурочено только к задней части центра, тем более что формирование нейробластов в ней происходит позднее, чем в передней части.
Рис. 3.
Пролиферативный центр грибовидного тела эмбрионов Acheta domesticus (окончание). а, б – ранняя 12-я эмбриональная стадия (б – стрелкой указан пучок отростков дифференцирующихся клеток Кеньона), в – 14-я эмбриональная стадия, г – молодое имаго (а – сагиттальный срез, передняя сторона – слева, б–г – фронтальные срезы). Масштаб: 20 мкм.
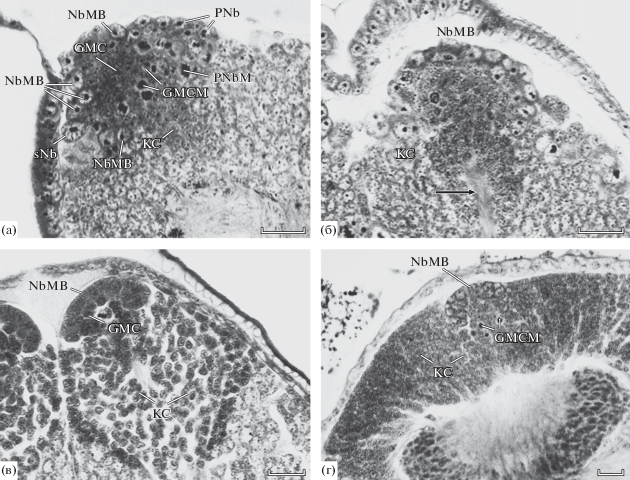
На эмбриональных стадиях 12–14 окончательно завершается перестройка работы пролиферативного центра. Постепенно уменьшаются размеры нейробластов, уменьшается размер ядрышек, нейробласты сильно обедняются цитоплазмой, реже встречаются их деления. Наоборот, деления ганглиозных материнских клеток очень интенсивны, из-за этого уменьшается пул этих клеток и зона их делений приближается к слою нейробластов. Напротив, сильно вырастает часть мозга, занимаемая дифференцирующимися клетками Кеньона, которые выходят за пределы купола из нейробластов (рис. 3в). Пролиферативные центры грибовидных тел сверчков функционируют в течение всего нимфального развития и у имаго (Панов, 1962, 1966; Cayre et al., 1994, 1996). За это время происходит формирование ~50 тыс. клеток Кеньона (Schürmann, 1973), а сам пролиферативный центр грибовидного тела приобретает вид весьма незначительного образования (рис. 3г).
Schistocerca gregaria. У схистоцерки пронейробласты морфологически слабее отличаются от окружающих клеток, чем у сверчков. Поэтому пролиферативные центры удалось идентифицировать только у эмбрионов на стадии кататрепсиса (45% эмбриогенеза). В это время пролиферативные центры уже становятся многоклеточными образованиями. Пронейробласты лишь слегка крупнее соседних клеток коры, но явно мельче одиночных нейробластов. У них мало цитоплазмы, и ядра поэтому тесно примыкают одно к другому. Ядрышки небольшие и слабо выделяются среди глыбок хроматина. Пролиферативные центры либо контактируют с формирующейся оболочкой мозга, либо иногда бывают отделены от нее одиночными нейробластами. На этой стадии очень часто встречаются асимметричные деления одиночных нейробластов, а митозы пронейробластов редки (рис. 4а).
Рис. 4.
Пролиферативный центр грибовидного тела Schistocerca gregaria (сагиттальные срезы, передняя сторона головы эмбрионов – слева). а, б – 45% эмбриогенеза, в, г – 55% эмбриогенеза, д – 60–65% эмбриогенеза, е – новорожденная нимфа 1-го возраста. Масштаб: 20 мкм.
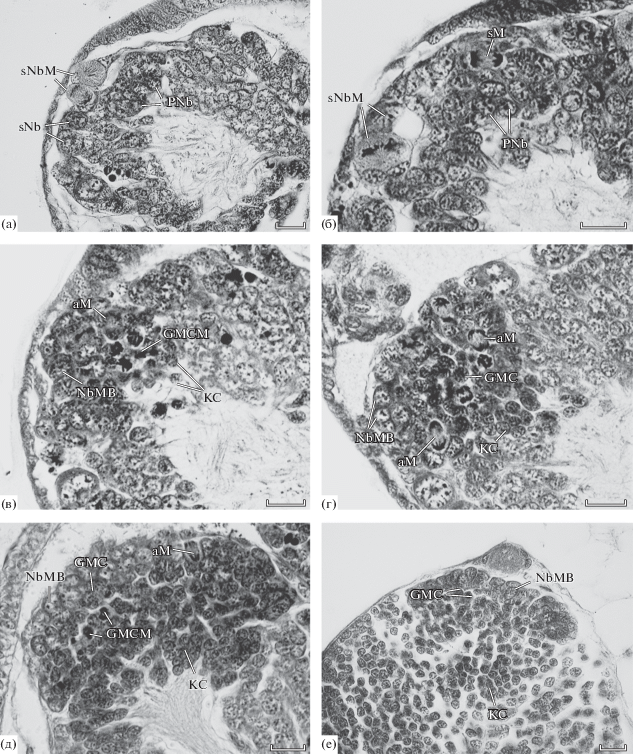
У эмбрионов, только что вышедших на вентральную сторону яйца, размеры центров сильно увеличиваются, пронейробласты по всему центру кажутся одинаковыми, они обогащаются цитоплазмой, увеличивается размер ядрышек. Многочисленны деления пронейробластов, причем митозы на стадии анафазы свидетельствуют о равномерности делений (рис. 4б).
К стадии, когда длина эмбрионов составляет ~2/3 длины яйца, в пролиферативных центрах происходят разительные перемены. У наименее продвинутых эмбрионов, фиксированных на этой стадии, еще частично сохраняются типичные пронейробласты, но бόльшая часть пронейробластов превращается в настоящие нейробласты грибовидных тел, делящиеся асимметрично. В противоположность сверчкам, начальный этап трансформации пролиферативных центров не включает у схистоцерки выстраивание нейробластов в виде 1–2-клеточного поверхностного слоя, и все они образуют плотную группу. Поэтому не удается также выделить особый слой ганглиозных материнских клеток, но их митозы отчетливы. Даже у таких эмбрионов уже можно различить продукты деления ганглиозных материнских клеток, тела будущих клеток Кеньона (рис. 4в). У более продвинутых эмбрионов той же стадии трансформация пролиферативных центров оказывается еще более наглядной. Нейробласты увеличиваются в объеме, они еще более обогащаются цитоплазмой, многочисленны асимметричные митозы нейробластов, появляется слой симметрично делящихся ганглиозных материнских клеток, сильно возрастает число клеток Кеньона (рис. 4г).
Четырехслойная структура пролиферативных центров, описанная выше у сверчков, складывается у эмбрионов схистоцерки, когда весь желток втягивается внутрь эмбриона, эмбрион занимает всю длину яйца и начинает пигментироваться задний край глаз. Нейробласты выстраиваются в 1–2-клеточный слой, а ось веретена делений нейробластов всегда бывает перпендикулярной плоскости слоя. Под нейробластами располагаются еще не делящиеся ганглиозные материнские клетки, затем следует клеточный слой, богатый их митозами, а еще далее внутрь – скопление тел клеток Кеньона. Процесс дифференцировки последних оказывается уже далеко зашедшим, о чем свидетельствует толстый пучок отростков, отходящий от собрания тел клеток Кеньона (рис. 4д) У новорожденной нимфы такая структура центров сохраняется, однако уменьшается число наблюдаемых делений нейробластов, резко сокращается пул ганглиозных материнских клеток, а число клеток Кеньона резко возрастает (рис. 4е).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Термину “нейробласт” почти 130 лет. В опубикованной в 1891 г. статье сообщалось, что у одного из прямокрылых насекомых в ходе эмбриогенеза нервная система формируется из потомков особых клеток, названных нейробластами, которые выходят из слоя нейроэктодермы и в результате многочисленных асимметричных митозов дают начало нервным клеткам (Wheeler, 1891). В наше время при изучении эмбрионального нейрогенеза у дрозофилы было установлено, что в эмбриональной нейроэктодерме, соответствующей брюшной нервной цепочке, имеются особые участки, состоящие из 5–7 эквипотентных клеток, из которых одна клетка увеличивается, выходит из слоя нейроэктодермальных клеток и становится нейробластом. Было показано, что процессы формирования одного нейробласта и подавление потенций других клеток определяются клеточными взаимодействиями на основе экспрессии ряда регуляторных белков (Doe et al., 1985; Skeath, Carroll, 1992). У дрозофилы сходным образом может происходить, по-видимому, и образование одиночных нейробластов грибовидных тел (Kunz et al., 2012).
Формирование грибовидных тел за счет деятельности ограниченного числа одиночных нейробластов – явление, широко распространенное среди насекомых (Панов, 1957). Однако, поскольку “производительность” одиночных нейробластов низка, в ходе эволюции насекомых сформировались иные пути нейрогенеза, увеличивающие продукцию клеток Кеньона. Самый простой из них – формирование каждого глобулуса не одним, а несколькими одиночными нейробластами. Такой путь реализуется, например, у некоторых жуков-листоедов (Панов, 2012). Еще один способ продукции клеток Кеньона был обнаружен у жука-плавунца Cybister lateralimarginalis (Панов, 2014), у которого при делении трех нейробластов, формирующих три глобулуса грибовидного тела, образуются не ганглиозные материнские клетки, а клетки, очень похожие на промежуточные прогениторные клетки, открытые в центральном мозге дрозофилы (Bello et al., 2008; Boone, Doe, 2008). И наконец, у перепончатокрылых и прямокрылых формируются настоящие полинейробластные пролиферативные центры.
Показано, что исследованным трем видам прямокрылых свойствен единый тип активности пролиферативного центра грибовидного тела. Сначала происходит пролиферация стволовых клеток, когда в результате равномерных делений пронейробластов существенно увеличивается их числo. После превращения пронейробластов в нейробласты наступает второй этап, этап дифференцировки, когда нейробласты путем асимметричных делений через ганглиозные материнские клетки начинают продуциовать клетки Кеньона. Сверчки и саранчовые в системе прямокрылых находятся в наиболее удаленных одна от другой ветвях филогенетического древа (Zhang et al., 2013). Поэтому сходство процессов нейрогенеза клеток Кеньона, обнаруженное у двух видов сверчков и пустынной саранчи, позволяет предположить, что такой тип нейрогенеза характерен и для грибовидных тел прямокрылых в целом.
Описанный ход нейрогенеза в грибовидных телах исследованных прямокрылых напоминает течение нейрогенеза в зрительных центрах насекомых. Уже Шрадер (Schrader, 1938) обнаружил, что в зачатках зрительных центров гусениц мельничной огневки Ephestia kühniella имеются делящиеся клетки двух категорий. У гусениц первых двух возрастов зачатки сложены из клеток, названных им “протонейробластами”, которые многократно делятся равномерно с образованием двух одинаковых дочерних протонейробластов. За счет таких делений происходит сильное увеличение объема зачатков. У предкуколок и куколок эти клетки в краевой зоне зачатка превращаются в настоящие нейробласты. Как и одиночные нейробласты клеточной коры, эти нейробласты делятся неравномерно с образованием дочернего нейробласта и ганглиозной материнской клетки. Последняя в результате равномерного деления дает начало двум клеткам, дифференцирующимся в нейроны зрительных ганглиев. Позднее такой же способ формирования зрительных интернейронов был обнаружен у медоносной пчелы, капустной белянки Pieris brassicae, стрекозы Aeschna (Панов, 1960) и у Drosophila melanogaster (Hofbauer, Campos-Ortega, 1990). На примере дрозофилы в последние годы было доказано, что “протонейробласты” (у дрозофилы называемые нейроэпителиальными клетками) действительно превращаются в неравномерно делящиеся нейробласты, а не являются вместе с ними просто двумя различными популяциями клеток (Egger et al., 2007). Было также показано, что превращение одного вида клеток с особым типом делений в клетки другого вида с совершенно иным типом делений осуществляется под действием некоторой “пронейральной волны”, молекулярная основа которой – зависимая от времени экспрессия сложных каскадов регуляторных белков (Egger et al., 2007; Yasugi et al., 2008, 2010).
Поскольку пронейробласты пролиферативных центров грибовидных тел прямокрылых тесно связаны на первых этапах своего существования с дерматогенными клетками подобно одиночным нейробластам и как бы вклиниваются в их слой, можно предположить, что при отделении одиночных нейробластов от нейроэктодермы какие-то нейроэктодермальные клетки, выселяясь из слоя, сохраняют в течение некоторого времени первоначальную способность нейроэктодермальных клеток делиться равномерно и становятся пронейробластами.
Однако, несмотря на предполагаемое принципиальное сходство процессов нейрогенеза в грибовидных телах прямокрылых и в зрительных долях насекомых, они в этих нервных центрах существенно различаются пространственно. Зачатки зрительных долей имеют вид сложного поляризованного клеточного пласта с наименее дифференцированными клетками на одном краю и клетками-продуктами деятельности зачатка на другом. Это определяет направление оси веретена деления нейроэпителиальных клеток вдоль пласта. Пронейробласты грибовидных тел формируют первоначально неполяризованную плотную группу клеток, в которой веретена делений клеток ориентированы в разных направлениях. Поэтому в зачатках грибовидных тел слабее выражена пространственная направленность процесса трансформации структуры. Различаются и продолжительности периода превращения клеток. Этот период занимает длительный отрезок онтогенеза в зрительных долях, что связано с продолжительностью формирования сложных глаз и зрительной системы в целом. В зачатке грибовидного тела предполагаемая “пронейральная волна” распространяется спереди назад быстро и, по-видимому, отсутствуют механизмы, позволяющие длительно сохраняться, размножаясь, пронейробластам. Их превращение в нейробласты происходит также быстро, что определяет наступление периода продукции клеток Кеньона всей совокупностью нейробластов.
Автор благодарит Т.В. Компанцеву (Московский зоопарк) за предоставление кубышек саранчи-схистоцерки.
Список литературы
Панов А.А. Строение головного мозга насекомых на последовательных этапах постэмбрионального развития // Энтомол. обозрение. 1957. Т. 36. Вып. 2. С. 269–284.
Панов А.А. Строение головного мозга насекомых на последовательных этапах постэмбрионального развития. 3. Зрительные доли // Энтомол. обозрение. 1960. Т. 39. Вып. 1. С. 86–105.
Панов А.А. Характер размножения клеток в центральной нервной системе нимфы домового сверчка (Gryllus domesticus L., Orthoptera) // Докл. АН СССР. 1962. Т. 143. № 2. С. 471–474.
Панов А.А. Соотношение онтогенетического развития центральной нервной системы домового сверчка Gryllus domesticus L. и обыкновенной медведки Gryllotalpa gryllotalpa L. (Orthoptera, Grylloidea) // Энтомол. обозрение. 1966. Т. 45. Вып. 2. С. 326–340.
Панов А.А. Жуки-листоеды (Coleoptera: Chrysomelidae): упрощение грибовидных тел в ходе прогрессивной эволюции семейства // Изв. РАН. Сер. биол. 2012. № 1. С. 35–42.
Панов А.А. Новый, необычный (по крайней мере для жуков) способ продуцирования клеток Кеньона, найденный у жука-плавунца Cybister lateralimarginalis Deg. (Coleoptera: Dytiscidae) // Изв. РАН. Сер. биол. 2014. № 2. С. 150–154.
Ромейс В. Микроскопическая техника. М.: Изд-во иностр. лит., 1953. 718 с.
Bauer V. Zur inneren Metamorphose des Zentralnervensystems der Insekten // Zool. Jb. Anat. 1904. Bd 20. H. 1. S. 123–152.
Bello B.C., Izergina N., Caussinus E., Reichert H. Amplification of neural stem cell proliferation by intermediate progenitor cells in Drosophila brain development // Neural Dev. 2008. V. 3. Iss. 5. P. 1–17.
Bentley D., Keshishian H., Shankland M., Toroian-Raymond A. Quantitative staging of embryonic development of the grasshopper, Schistocerca nitens // J. Embryol. Exp. Morph. 1979. V. 54. P. 47–74.
Boone J.Q., Doe C.Q. Identification of Drosophila type II neuroblast lineages containing transit amplifying ganglion mother cells // Dev. Neurobiol. 2008. V. 68. № 9. P. 1185–1195.
Cayre M., Strambi C., Strambi A. Neurogenesis in an adult insect brain and its hormonal control // Nature. 1994. V. 368. P. 57–59.
Cayre M., Strambi C., Charpin P., Augier P., Meyer M.R., Edwards J.S., Strambi A. Neurogenesis in adult insect mushroom bodies // J. Comp. Neurol. 1996. V. 371. P. 300–310.
Doe C.Q., Kuwada J.Y., Goodman C.S. From epithelium to neuroblasts to neurons: the role of cell interactions and cell lineage during insect neurogenesis // Philos. Trans. Roy. Soc. Lond. B. 1985. V. 312. P. 67–81.
Donoughe S., Extavour C.G. Embryonic development of the cricket Gryllus bimaculatus // Dev. Biol. 2016. V. 411. Iss. 1. P. 140–156.
Egger B., Boone J.Q., Stevens N.R., Brand A.H., Doe C.Q. Regulation of spindle orientation and neural stem cell fate in the Drosophila optic lobe // Neural Dev. 2007. V. 2. Iss. 1. P. 1–14.
Farris S.M., Robinson G.E., Davis R.L., Fahrbach S.E. Larval and pupal development of the mushroom bodies in the honey bee, Apis mellifera // J. Comp. Neurol. 1999. V. 414. P. 97–113.
Hofbauer A., Campos-Ortega J.A. Proliferation pattern and early differentiation of the optic lobes in Drosophila melanogaster // Rouxʹs Arch. Dev. Biol. 1990. V. 198. P. 264–274.
Kunz T., Kraft K.F., Technau G.M., Urbach R. Origin of Drosophila mushroom body neuroblasts and generation of divergent embryonic lineages // Development. 2012. V. 139. Iss. 14. P. 2510–2522.
Malaterre J., Strambi C., Chiang A.-Sh., Aouane A., Strambi A., Cayre M. Development of cricket mushroom bodies // J. Comp. Neurol. 2002. V. 452. P. 215–227.
Malun D. Early development of mushroom bodies in the brain of the honey bee Apis mellifera as reveaded by BrdU incorporation and ablation experiments // Learn. Mem. 1998. V. 5. № 1. P. 90–101.
Schrader K. Untersuchungen über die Normalentwicklung des Gehirns bei der Mehlmotte Ephestia kühniella Zeller nebst einiger Bemerkungen über die Corpus allatum // Biol. Zentralbl. 1938. Bd 58. S. 52–90.
Schürmann F.-W. Über die Struktur der Pilzkörper des Insektenhirns. III. Die Anatomie der Nervenfasern in der Corpora pedunculata bei der Acheta domesticus L. (Orthoptera): Eine Golgi-Studie // Zeitschr. Zellforsch. 1973. Bd 145. S. 247–285.
Skeath J.B., Carroll S.B. Regulation of proneural gene expression and cell fate during neuroblast segregation in the Drosophila embryo // Development. 1992. V. 114. P. 939–946.
Wheeler W.M. Neuroblasts in the arthropod embryo // J. Morpol. 1891. V. 4. № 3. P. 337–344.
Yasugi T., Sugie A., Umetsu D., Tabata T. Coordinated sequential action of EGFR and Notch signaling pathways regulates proneural wave progression in the Drosophila optic lobe // Development. 2010. V. 137. P. 3193–3203.
Yasugi T., Umetsu D., Murakami S., Sato M., Tabata T. Drosophila optic lobe neuroblasts triggered by a wave of proneural gene expression that is negatively regulated by JAK/STAT // Development. 2008. V. 135. P. 1471–1480.
Zhang H.-L., Huang Y., Lin L.-L., Wang X.-Y., Zheng Z.-M. The phylogeny of the Orthoptera (Insecta) as deduced from mitogenomic gene sequences // Zool. Stud. 2013. V. 52. Iss. 37. P. 1–13.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


