Известия РАН. Серия биологическая, 2019, № 3, стр. 246-254
Выделение и идентификация бактерий из образцов жильного льда ледового комплекса Мамонтовой горы (Центральная Якутия)
С. Н. Филиппова 1, *, Н. А. Сургучева 1, Т. В. Колганова 2, М. Ю. Чербунина 3, А. В. Брушков 3, А. Л. Мулюкин 1, В. Ф. Гальченко 1
1 Институт микробиологии им. С.Н. Виноградского, ФИЦ биотехнологии РАН
119071 Москва, Ленинский просп., 33, стр. 2, Россия
2 Институт биоинженерии, ФИЦ биотехнологии РАН
119071 Москва, Ленинский просп., 33, стр. 2, Россия
3 Московский государственный университет им. М.В. Ломоносова, геологический ф-т
119991 Москва, Ленинские горы, 1, Россия
* E-mail: svfilipova@mail.ru
Поступила в редакцию 30.10.2017
После доработки 13.06.2018
Принята к публикации 13.06.2018
Аннотация
Проведен анализ аэробной гетеротрофной составляющей бактериальных сообществ образцов малоизученных природных объектов − древних ледяных жил разреза Мамонтова гора Центральной Якутии. Отмечено, что численность колониеобразующих (КОЕ) клеток аэробных гетеротрофных бактерий, выявленных при высевах талых образцов на агаризованные питательные среды, варьировала от 103 до 104 КОЕ/мл, причем общее число интактных клеток было лишь на 1−2 порядка выше. По результатам анализа последовательностей генов 16S рРНК определено таксономическое положение бактерий, которые представлены филумами Actinobacteria, Firmicutes и Proteobacteria. Обнаружено, что физиологическая особенность выделенных штаммов − температурный диапазон роста 8–20°С, характерный для психротолерантных бактерий. Установлено, что большинство бактерий чувствительны к широкому спектру антибиотиков.
К настоящему времени доказана возможность длительного сохранения жизнеспособных микроорганизмов в древних объектах криосферы Арктики – грунтах различного возраста (от нескольких тысяч до 2–3 млн лет) и генезиса (Gilichinsky et al., 2008). Однако для других уникальных объектов Арктической криолитозоны – подземных льдов – имеются лишь немногочисленные данные о численности микроорганизмов и составе микробных сообществ.
Широкое распространение на территории вечной мерзлоты получили повторно-жильные льды (ПЖЛ), которые возникают в результате процессов морозобойного трещинообразования мерзлых пород в течение геологически длительного времени (Ершов, 2002). Особенности состава и строения жильных льдов, отсутствие процессов протаивания предполагают наличие в них микроусловий, способствующих консервации и сохранению жизнеспособности разнообразных форм микроорганизмов. Так, численность микроорганизмов в ПЖЛ лишь ненамного меньше таковой в мерзлых осадочных породах. По данным ряда исследователей, численность культивируемых гетеротрофных микроорганизмов в жильных льдах выше, чем в других ледовых структурах, включая другие типы подземных льдов, а также ледниковый лед, ледовый покров озер и ледяной наст на поверхности снежного покрова (Katayama et al., 2007; Lacelle et al., 2011; Wilhelm et al., 2012). По своему составу микробное сообщество жильных льдов в определенной степени отражает микробное разнообразие лежащего над ними почвенного слоя (Wilhelm et al., 2012).
Цель работы − выделение и изучение культивируемых аэробных хемоорганотрофных (гетеротрофных) бактерий из образцов реликтовых ледяных жил голоценового и плейстоценового возраста ледового комплекса Мамонтовой горы Центральной Якутии.
МАТЕРИАЛЫ И МЕТОДЫ
Регион исследований. Одно из широко известных обнажений древних ПЖЛ ледового комплекса Центральной Якутии – Мамонтова гора, расположенная на левом берегу р. Алдана, в 500 км от ее устья. Эта река вскрывает неоген-плейстоценовую толщу аллювиальных отложений (возрастом от нескольких тысяч до 16 млн. лет), характеризующую весь период плейстоценовых оледенений. Мощность отложений с ПЖЛ достигает 10 м.
Для полевых исследований был выбран район речной террасы р. Алдана высотой 50 м с наиболее развитыми верхнечетвертичными отложениями с ПЖЛ. В результате протаивания льдистых мерзлых пород и вытаивания подземного льда в склонах формируются амфитеатровидные углубления – термоцирки.
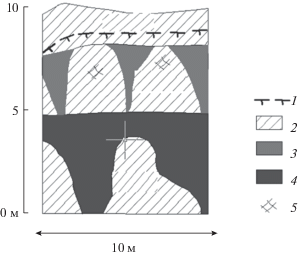
Образцы ПЖЛ отбирали из стен обнажений термоцирков № 1 (62°59.720′ с.ш., 133°58.261′ в.д.) и № 2 (62°58.975′ с.ш., 133°57.112′ в.д.) в верхней части разреза Мамонтовой горы (рис. 1). Стенку обнажения термоцирка № 1 составляли жильные льды плейстоценового возраста. Мощность отложений с ПЖЛ составляла 7–10 м. Термоцирк № 2 – активно таящая структура, где ледовый комплекс имеет двухъярусное строение. Общая мощность отложений с ПЖЛ достигает 8−10 м. Нижний горизонт представлен сильнольдистыми суглинками, вмещающими широкие ледяные жилы плейстоценового возраста; их видимая вертикальная мощность составляет ~5 м. Верхний горизонт представлен жилами голоценового возраста − более тонкими и менее мощными; их длина <3 м, ширина до 1 м в верхней части жилы.
Рис. 1.
Термоцирк № 2; разрез Мамонтовой горы (верхняя часть 50-метровой террасы). 1 – сезонно-талый слой; 2 – льдистые суглинки, вмещающие и перекрывающие ледяные жилы; 3 – жильный молочно-белый лед (голоцен); 4 – жильный мутный лед (плейстоцен); 5 – включения органики (растительные остатки).
Отбор образцов и контроль за возможностью контаминации. В полевых условиях образцы жильного льда ненарушенной структуры массой 4−5 кг отбирались с помощью стерилизованных спиртом и обожженных в пламени инструментов. Для удаления чужеродной микрофлоры поверхность отобранных монолитов обрабатывали пламенем газовой горелки, а затем помещали в предварительно простерилизованные пакеты и хранили в мерзлом состоянии при температуре, близкой к естественной (−5°C). Транспортировка проб в лабораторию также осуществлялась без их оттаивания в термоконтейнерах с хладагентами. Образцы льда до проведения экспериментов хранили при −20°C. Было отобрано по три образца. Описание образцов приведено в табл 1.
Таблица 1.
Описание образцов жильного льда
| Образец | Геологический возраст | Описание | Термоцирк |
|---|---|---|---|
| 1 | Плейстоцен (>30 тыс. лет) | Жильный лед, непрозрачный, мутно-серого цвета. Структура льда зернистая, пузырчатая | № 1 |
| 2 | Голоцен (<12 тыс. лет) | Жильный лед с тонкими прожилками грунтовых примесей. Структура льда зернистая, пузырчатая, цвет молочно-белый | № 2 (верхний горизонт) |
| 3 | Плейстоцен (>30 тыс. лет) | Жильный лед, непрозрачный, мутно-серого цвета, содержит многочисленные цепочки пузырьков | № 2 (нижний горизонт) |
В связи с особыми требованиями к соблюдению асептического отбора образцов льда и риском возможной контаминации посторонней микрофлорой в процессе отбора нами проведены контрольные эксперименты в полевых и лабораторных условиях по ранее описанной методике (Brouchkov et al., 2017). При отборе образцов ПЖЛ на поверхность участка (200 см2) наносили суспензию (2 мл) маркерного штамма Yarrowia lipolytica Y-3603, меченного красным флуоресцентным белком с высокой численностью клеток (108 кл./мл), и проводили дальнейший отбор проб по вышеописанной методике. Эти образцы, как и целевые, транспортировали и исследовали в лаборатории.
В лабораторных условиях из центральной части целевого образца с помощью раскаленных стальных инструментов извлекали пробу массой ~50 г при соблюдении стерильности. Извлеченный образец помещали в 70%-ный водный раствор этанола, после чего поверхность образца обжигали для удаления с поверхности остатков этанола и исключения контаминации посторонней микрофлорой. Второй контроль чистоты отбора проб в лабораторных условиях с нанесением суспензии маркерного микроорганизма на поверхность льда осуществляли, как описано выше. Об эффективности соблюдения условий асептического отбора проб в полевых условиях и пробоподготовки в лаборатории судили по результатам прямых микроскопических учетов клеток в образцах, проверяемых на контаминацию, и посевов на агаризованные питательные среды.
Прямое определение численности клеток. Подсчет клеток проводили методом люминесцентной микроскопии с использованием флуоресцентных красителей: акридинового оранжевого (Matheson, Coleman & Bell Manufacturing Chemists, Norwood, США) для оценки общей численности и красителя Live/Dead Baclight (Invitrogen/ThermoFisher Scientific, Канада) для дифференциации неповрежденных (интактных) и мертвых клеток по зеленой и красной эпифлуоресценции соответственно. Клетки из проб талых образцов льда концентрировали, осаждая на поликарбонатных фильтрах диаметром 25 мм, размером пор 0.22 мкм (GE Polycarbonate, Black, 100/Pk) фильтрацией под вакуумом. Осажденные клетки окрашивали 0.1%-ным водным раствором акридинового оранжевого. В люминесцентном микроскопе Axioplan (Carl Zeiss, Германия) просматривали окрашенные фильтры и подсчитывали клеточные формы (не менее 10 полей зрения). Число интактных и мертвых клеток определяли после окрашивания суспензий (в темноте при 37°С в течение 10 мин) красителем Live/Dead (не менее 15 полей зрения). Микроскопические исследования проводили на базе ЦКП “Коллекция уникальных и экстремофильных микроорганизмов (UNIQEM)” ФИЦ биотехнологии РАН.
Определение численности культивируемых клеток аэробных гетеротрофных бактерий с использованием набора различных питательных сред. Образцы ПЖЛ оттаивали при комнатной температуре в течение 20–30 мин, после чего аликвоты высевали на разбавленные стерильной дистиллированной водой (1 : 10) питательные среды ISP1 (Difco, США) с добавлением 1.8% агара, ISP3 (Difco) с 0.25% дрожжевого экстракта (Difco) и Plate count agar (PCA) (Difco) с добавлением агара (Difco) до конечной концентрации 1.8% в трех повторностях. Колониеобразующую способность (КОЕ/мл) определяли после 2 нед культивирования при 20 и 28°С и после 3–4 нед. при 8°С.
Выделение, идентификация и характеристика бактериальных изолятов. Выросшие колонии микроорганизмов характеризовали и группировали по колониально-морфологическим признакам, а также клеточной морфологии с дифференциацией на грамположительные и грамотрицательные. Изоляты бактерий каждой группы, поддерживаемые на агаризованных средах ISP1 и PCA, были включены в фонд коллекции UNIQEM.
Отношение выделенных культур микроорганизмов к различным температурам роста определяли, выращивая их при 8, 20 и 28°С в течение 2–4 нед.
Чувствительность культур бактериальных изолятов к антибиотикам определяли дискодиффузионным методом с использованием набора Sensitivity Disk Dispens-O-Discs (Difco). Культуры изолятов с содержанием клеток не менее 108 КОЕ/мл высевали газоном на агаризованную среду ISP1. На свежезасеянный газон накладывали бумажные диски, содержащие антибиотики: бензилпенициллин – пенициллин G (10 ед.), стрептомицин (10 мкг), неомицин (5 мкг), тетрациклин (30 мкг), окситетрациклин (30 мкг), хлортетрациклин (30 мкг), полимиксин (300 ед.), новобиоцин (30 мкг), рифампин (5 мкг), эритромицин (15 мкг), линкомицин (2 мкг). Инкубацию проводили при 20°С в течение 14 сут с ежедневным определением зон задержки роста вокруг дисков. Зоны подавления роста измеряли визуально с помощью прозрачной линейки со скошенным краем до ближайшего миллиметра. Результаты измерений были статистически обработаны с вычислением погрешностей прямых измерений.
Идентифицировали выделенные бактериальные изоляты на основе ПЦР-амплификации и секвенирования фрагментов генов 16S рРНК. ДНК выделяли модифицированным щелочным методом Бирнбойма−Доли (Birnboim, Doly, 1979) и Wizard-технологии (Promega, США).
Для проведения ПЦР и дальнейшего секвенирования ПЦР-фрагментов гена 16S рРНК использовали универсальные праймеры (Lane, 1991). Продукты амплификации секвенировали методом Сэнгера (Sanger et al., 1977) с помощью набора реактивов Big Dye Terminator v.3.1 (Applied Biosystems, Inc., США) на ген-анализаторе ABI 3730 (Applied Biosystems, Inc.). Бактерии идентифицировали путем сравнения нуклеотидных последовательностей ПЦР-фрагментов генов 16S рРНК с последовательностями, представленными в базе данных GenBank NCBI, по протоколам nBLAST6 и Ribosomal Database Project 7 (RDP), после чего осуществляли выборку уровня идентичности ≥98%. Нуклеотидные последовательности генов 16S рРНК бактериальных изолятов были депонированы в базе данных GenBank.
Полученные сиквенсные спектрограммы редактировали с помощью программы Chromas, версия 1.45 (http://www.techelysium.com.au./chromas.html). Определение последовательностей генов 16S рРНК и их филогенетический анализ были проведены на оборудовании ЦКП биоинженерия ФИЦ биотехнологии РАН.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Применение вышеуказанных “жестких” тестов контроля стерильности отбора образцов ПЖЛ с предварительным нанесением на поверхность льда суспензий маркерных дрожжей, удобных для детекции, позволило исключить риск контаминации целевых образцов для микробиологических исследований.
По результатам прямых микроскопических тестов установлено, что общая численность клеток в талых образцах ПЖЛ варьировала от 1.5 × 106 до 2.7 × 107 кл./мл. Доля жизнеспособных клеток в исследованных образцах льда была достаточно высокой (>70% общего числа клеток). Наибольшая доля жизнеспособных клеток была выявлена в образце 2 жильного льда голоценового возраста. Численность колониеобразующих клеток аэробных гетеротрофных бактерий, выявленных при высевах талых образцов на агаризованные питательные среды, составляла от 0.7–1 × 103 до 5–6.3 × × 103 КОЕ/мл (табл. 2). Для роста клеток в виде колоний наиболее оптимальной была инкубация посевов при 20°С. Число колониеобразующих бактерий, способных расти при 8°С, было несколько ниже, их колонии отличались повышенной пигментацией и меньшими размерами. Наиболее низкие значения численности колоний (примерно в 3–5 раз) были отмечены при температуре инкубации 28°С.
Таблица 2.
Численность аэробных клеток в образцах жильного льда ледового комплекса Мамонтовой горы
| Образец | Общая численность клеток, кл./мл | Доля “живых” клеток, % | Численность культивируемых аэробных гетеротрофных бактерий, КОЕ/мл |
|---|---|---|---|
| 1 | (1.5 ± 0.4) × 106 | 78 | (0.7 ± 0.3) × 103–(1 ± 0.2) × 103 |
| 2 | (2.7 ± 0.5) × 107 | 93 | (1 ± 0.2) × 103–(2.6 ± 0.2) × 103 |
| 3 | (5.1 ± 0.4) × 106 | 74 | (5 ± 0.3) × 103–(6.3 ± 0.4) × 103 |
Характеристика изолятов бактерий. Во всех изученных образцах ПЖЛ были выделены основные группы культивируемых аэробных гетеротрофных бактерий. В образце 1 жильного льда наиболее многочисленной группой (по численности КОЕ) оказались актинобактерии с характерной группировкой клеток, способных к ветвлению и в отдельных случаях к формированию мицелия. Численность актинобактерий составляла до 65% суммарного числа бактериальных колоний, выявленных при высеве образца 1. Колонии спорообразующих грамположительных палочковидных бактерий составляли не более 20%. Кроме того, были выявлены единичные оранжевоокрашенные колонии неспорообразующих кокковидных, подвижных грамположительных бактерий, а также колонии грамотрицательных бактерий.
В образцах жильного льда 2 и 3 группы аэробных гетеротрофных бактерий были представлены в основном грамположительными бактериями с клетками кокковидной и палочковидной форм, как неспорообразующими, так и способными к образованию спор. Колонии грамположительных бактерий составляли ~90%, а грамотрицательные палочковидные бактерии ~10%. В образце 3 актинобактерии были представлены единичными колониями.
Для исследований были отобраны 25 изолятов бактерий. Из образца 1 были выделены в чистую культуру и идентифицированы 11 штаммов актинобактерий: 2 штамма, идентифицированные как Dietzia sp. (100% идентичности; номера нуклеотидных последовательностей в GenBank – MF151763 и MF151764), 4 штамма, отнесенные к Kocuria sp. (100% идентичности; MF151749, MF151754, MF151758, MF151765), 4 штамма идентифицированные как Microbacterium sp. (99% идентичности; MF151743, MF151745, MF151760, MF151766), и один штамм Nocardioides sp. (99% идентичности; MF151762). Из этого же образца были выделены бактерии, представители фирмикутов: штамм, идентифицированный как Bacillus sp. (99% идентичности; MF151747), штамм, относящийся к роду Paenibacillus (99% идентичности; MF151753), и штамм, идентифицированный как Planococcus sp. (98% идентичности; MF151750). Был выделен штамм, отнесенный к альфа-протеобактериям, идентифицированный как Methylobacterium sp. (99% идентичности; MF151756). В образцах 2 и 3, отобранных из обнажения второго термоцирка, доля фирмикут была наибольшей. Из образца 2 были выделены штамм лактобацилл, идентифицированный как Carnobacterium sp. (99% идентичности; MF151761), штамм, отнесенный к роду Planococcus (98% идентичности; MF151759), штамм, идентифицированный как Staphylococcus sp. (100% идентичности; MF151755), а также штамм гамма-протеобактерий, отнесенный к роду Moraxella (100% идентичности; MF151757). Фирмикуты, выделенные из образца 3, были представлены штаммами, идентифицированными как Bacillus sp. (99% идентичности; MF151752), Carnobacterium sp. (99% идентичности; MF151751), Planococcus sp. (99% идентичности; MF151748), Staphylococcus sp. (99% идентичности; MF151746). Из единичных колоний (образец 3) были выделены актинобактерии, идентифицированные как Rothia sp. (99% идентичности; MF151744). Из этого же образца были выделены также гамма-протеобактерии, идентифицированные как Psychrobacter sp. (99% идентичности; MF151742).
При изучении роста культур изолятов при 8, 20 и 28°С установлено, что наиболее благоприятной была температура 20°С. При 8°С рост изолятов наблюдался на 3-и–4-е сут культивирования.
Изучение спектра чувствительности бактериальных изолятов к различным антибиотикам показало различия между грамположительными и грамотрицательными бактериями, а также между отдельными представителями внутри этих групп микроорганизмов. Так, грамотрицательные протеобактерии были устойчивы к линкомицину и мало чувствительны к бензилпенициллину. Полимиксин практически не оказывал действия на рост грамположительных бактерий, в то время как грамотрицательные бактерии оказались чувствительными к этому антибиотику. Зоны подавления роста под действием линкомицина были отмечены у всех изолятов грамположительных бактерий. Большая часть изолятов грамположительных бактерий проявила невысокую чувствительность к бензилпенициллину G, за исключением Staphylococcus sp. Л7-1 и Л8-3, Bacillus sp. Л8-6 и Paenibacillus sp. Л2-8. Культуры всех исследованных изолятов бактерий проявляли чувствительность к аминогликозидным антибиотикам (стрептомицин, неомицин), к антибиотикам тетрациклиновой группы (тетрациклин, хлортетрациклин, окситетрациклин), хлорамфениколу, новобиоцину, рифампицину и эритромицину (табл. 3).
Таблица 3.
Чувствительность к антибиотикам бактериальных изолятов, выделенных из образцов жильного льда ледового комплекса Мамонтовой горы
| Образец | Изоляты | Антибиотики (зоны угнетения роста, мм) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| пенициллин G | стрептомицин | неомицин | тетрациклин | окситетрациклин | хлортетрациклин | полимиксин | новобиоцин | рифампицин | эритромицин | линкомицин | хлорамфеникол | ||
| 1 | Dietzia sp. Л2-18 | 1.5 ± 0.5 | 4 ± 1 | 4 ± 1 | 10 ± 2 | 8 ± 1 | 10 ± 2 | 0 | 4 ± 1 | 15 ± 1 | 10 ± 2 | 5 ± 1 | 4 ± 1 |
| Л2-19 | 1 ± 0.5 | 5 ± 1 | 4 ± 1 | 12 ± 2 | 10 ± 2 | 15 ± 3 | 0 | 4 ± 1 | 15 ± 2 | 15 ± 2 | 2 ± 1 | 15 ± 3 | |
| Microbacterium sp. Л2-1 | 1.5 ± 0.5 | 4 ± 1 | 4 ± 1 | 3 ± 1 | 3 ± 1 | 4 ± 1 | 0 | 17 ± 3 | 1 ± 0.5 | 16 ± 3 | 8 ± 2 | 14 ± 2 | |
| Л2-2 | 1.5 ± 0.5 | 4 ± 1 | 3 ± 1 | 2 ± 1 | 6 ± 2 | 7 ± 1 | 0 | 18 ± 3 | 2 ± 1 | 20 ± 3 | 4 ± 1 | 14 ± 3 | |
| Л2-16 | 2 ±1 | 4 ± 1 | 4 ± 1 | 3 ± 1 | 5 ± 1 | 4 ± 1 | 0 | 15 ± 3 | 3 ± 1 | 10 ± 2 | 2 ± 1 | 5 ± 1 | |
| Л2-21 | 1 ± 0.5 | 4 ± 1 | 4 ± 1 | 4 ± 1 | 7 ± 2 | 7 ± 1 | 0 | 14 ± 2 | 3 ± 1 | 10 ± 2 | 4 ± 1 | 7 ± 2 | |
| Kocuria sp. Л2-4 | 2 ± 1 | 10 ± 1 | 4 ± 1 | 20 ± 3 | 6 ± 2 | 12 ± 2 | 0 | 7 ± 1 | 12 ± 2 | 4 ± 1 | 2 ± 1 | 10 ± 1 | |
| Л2-9 | 2.5 ± 1 | 5 ± 1 | 1.5 ± 1 | 10 ± 2 | 8 ± 2 | 10 ± 2 | 0 | 15 ± 2 | 20 ± 3 | 3 ± 1 | 2 ± 1 | 5 ± 1 | |
| Л2-15 | 2 ± 1 | 4 ± 1 | 4 ± 1 | 4 ± 1 | 5 ± 1 | 6 ± 1 | 0 | 17 ± 3 | 15 ± 3 | 14 ± 2 | 4 ± 1 | 15 ± 3 | |
| Л2-20 | 2 ± 1 | 2 ± 1 | 1.5 ± 1 | 5 ± 1 | 7 ± 2 | 7 ± 2 | 0 | 15 ± 2 | 15 ± 2 | 15 ± 2 | 2 ± 1 | 4 ± 1 | |
| Nocardioides sp. Л2-17 | 1.5 ± 0.5 | 6 ± 1 | 4 ± 1 | 7 ± 2 | 7 ± 2 | 10 ± 2 | 1.5 ± 1 | 9 ± 2 | 1 ± 0.5 | 2 ± 1 | 2 ± 1 | 5 ± 2 | |
| Bacillus sp. Л2-3 | 11.5 ± 0.5 | 5 ± 1 | 2 ± 1 | 14 ± 3 | 8 ± 2 | 8 ± 2 | 0 | 4 ± 1 | 3 ± 1 | 10 ± 2 | 2 ± 1 | 2 ± 1 | |
| Paenibacillus sp. Л2-8 | 4 ± 1 | 6 ± 1 | 3 ± 1 | 10 ± 2 | 10 ± 2 | 10 ± 2 | 1 ± 0.5 | 15 ± 2 | 15 ± 2 | 15 ± 2 | 1 ± 0.5 | 10 ± 2 | |
| Planococcus sp. Л2-5 | 1.5 ± 0.5 | 6 ± 1 | 3 ± 1 | 10 ± 2 | 8 ± 2 | 12 ± 2 | 1 ± 0.5 | 15 ± 2 | 15 ± 2 | 10 ± 2 | 1 ± 0.5 | 10 ± 2 | |
| Methylobacterium sp. Л2-10 | 1 ± 0.5 | 2 ± 1 | 0.5 ± 0.5 | 3 ± 1 | 5 ± 1 | 6 ±1 | 3 ± 1 | 10 ± 1 | 14 ± 2 | 10 ± 1 | 0 | 5 ± 1 | |
| 2 | Carnobacterium sp. Л7-5 | 2 ± 1 | 15 ± 2 | 10 ± 2 | 10 ± 2 | 8 ± 2 | 10 ± 2 | 0 | 10 ± 2 | 12 ± 2 | 15 ± 3 | 12 ± 2 | 15 ± 2 |
| Planococcus sp. Л7-4 | 1 ± 0.5 | 10 ± 2 | 7 ± 1 | 10 ± 2 | 8 ± 2 | 10 ± 2 | 1 ± 1 | 12 ± 2 | 12 ± 2 | 19 ± 2 | 3 ± 1 | 12 ± 1 | |
| Staphylococcus sp Л7-1 | 6 ± 1 | 16 ± 2 | 10 ± 2 | 15 ± 2 | 16 ± 2 | 16 ± 2 | 1 ± 0.5 | 15 ± 2 | 17 ± 2 | 8 ± 2 | 15 ± 3 | 4 ± 1 | |
| Moraxella sp. Л7-2 | 1 ± 0.5 | 6 ± 1 | 3 ± 1 | 15 ± 2 | 10 ± 1 | 12 ± 2 | 7 ± 1 | 12 ± 2 | 14 ± 2 | 17 ± 2 | 0 | 7 ± 1 | |
| 3 | Rothia sp. Л8-2 | 2 ± 1 | 4 ± 1 | 3 ± 1 | 2 ± 1 | 9 ± 1 | 5 ± 1 | 0 | 4 ± 1 | 10 ± 2 | 17 ± 3 | 12 ± 2 | 4 ± 1 |
| Bacillus sp. Л8-6 | 4 ± 1 | 10 ± 1 | 8 ± 1 | 11 ± 2 | 14 ± 2 | 11 ± 2 | 0 | 15 ± 3 | 15 ± 3 | 17 ± 2 | 18 ± 2 | 10 ± 1 | |
| Carnobacterium sp. Л8-5 | 3 ± 1 | 5 ± 1 | 6 ± 1 | 14 ± 2 | 10 ± 1 | 15 ± 2 | 0 | 12 ± 2 | 20 ± 3 | 17 ± 2 | 10 ± 2 | 12 ± 2 | |
| Planococcus sp. Л8-4 | 1 ± 1 | 13 ± 2 | 7 ± 1 | 12 ± 2 | 11 ± 2 | 12 ± 2 | 1 ± 0.5 | 14 ± 2 | 15 ± 2 | 17 ± 2 | 3 ± 1 | 15 ± 1 | |
| Psychrobacter sp. Л8-1 | 0.5 ± 0.1 | 13 ± 2 | 9 ± 2 | 5 ± 1 | 6 ± 1 | 4 ± 1 | 4 ± 1 | 6 ± 1 | 8 ± 1 | 10 ± 2 | 0 | 18 ± 2 | |
| Staphylococcus sp. Л8-3 | 4 ± 1 | 6 ± 1 | 3 ± 1 | 5 ± 1 | 5 ±1 | 7 ± 1 | 1 ± 0.5 | 12 ± 2 | 7 ± 1 | 7 ± 1 | 4 ± 1 | 1 ± 0.5 | |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты данного исследования показывают, что древние ПЖЛ разного геологического возраста отличаются по составу культивируемой аэробной гетеротрофной компоненты жизнеспособных бактериальных сообществ. Хотя группы бактерий, выделенных и культивируемых в определенных условиях, были представлены основными филумами Actinobacteria, Firmicutes и Proteobacteria, их соотношение в различных образцах ПЖЛ варьировало. Так, доля актинобактерий и спорообразующих фирмикутов была наибольшей в образцах наиболее древнего ПЖЛ плейстоценового возраста, что согласуется с опубликованными данными (Katayama et al., 2007; Wilhelm et al., 2012). В то же время процентные соотношения актинобактерий в исследованных образцах ПЖЛ 1 и 3 плейстоценового возраста были различными (табл. 3). Так, неспорообразующие актинобактерии – представители родов Dietzia, Microbacterium, Kocuria и Nocardioides − преобладали среди изолятов, выделенных из образца плейстоценого льда 1, в то время как в образце 3 были выявлены лишь единичные колонии актинобактерий Rothia sp. В этой связи важно отметить высокую устойчивость представителей нокардио- и коринеподобных актинобактерий к замораживанию, а также длительное сохранение ими жизнеспособности в условиях недостатка питательных веществ (Нестеренко и др., 1985). Интересно, что среди изолятов образца 1 был представитель факультативно-метилотрофных бактерий Methylobacterium sp., которые способны использовать в качестве единственного источника углерода окисленные или замещенные производные метана, что позволяет допустить возможность присутствия углеводородов в газовой компоненте образца.
Основную часть бактериальных изолятов, выделенных из образцов 2 и 3, составляли фирмикуты, представители родов Bacillus, Carnobacterium, Planococcus и Staphylococcus. Таксономический состав бактерий, выделенных из образцов жильного льда ледового комплекса Мамонтовой горы, сопоставим с данными о таксономическом разнообразии культивируемых бактерий, обнаруженных в жильных льдах других регионов криолитозоны (Katayama et al., 2007; Wilhelm et al., 2012). Они могут включать в себя представителей эндофитной микрофлоры, относящихся к родам Bacillus, Paenibacillus, Staphylococcus, Kocuria, Microbacterium, Rothia, Methylobacterium, привнесенных с растительными остатками (Rosenblueth, Martínez-Romero, 2006). Холодоадаптированные аэробные гетеротрофные бактерии родов Carnobacterium, Microbacterium, Planococcus, Psychrobacter также были обнаружены в ледяных жилах позднего плейстоцена в разрезе Фокс (Аляска) (Katayama et al., 2007) и в ледяных жилах голоценового возраста в районе Арктической станции McGill на о-ве Аксель Хейберг, Нунавут, Канада (Wilhelm et al., 2012).
Физико-химические свойства жильного льда как среды сохранения микробных сообществ могут оказывать определенное влияние на их состав и жизнеспособность. Жильный лед часто неоднороден по степени минерализации. Вместе с более минерализованным льдом реликтовой жилы плейстоценового возраста располагается менее минерализованная жила голоценового возраста, внедрившаяся позднее. Химический состав жильных льдов часто зависит от их местоположения и локальных особенностей формирования (Васильчук, 2016).
Невысокие значения численности выявленных культивируемых бактерий по сравнению с данными “прямого” подсчета жизнеспособных клеток могут указывать также на наличие большой доли некультивируемых форм в изучаемом микробном сообществе. Наиболее благоприятный температурный диапазон для роста выделенных бактерий 8−20°С. Выявленный диапазон роста бактериальных штаммов из ПЖЛ характерен для микроорганизмов низкотемпературных регионов Арктики и Антарктики (Steven et al., 2007; Романовская и др., 2012) и указывает на психротолерантный/психрофильный характер их роста.
Считается, что льды – малопригодная среда для сохранения жизнеспособных микроорганизмов (Воробьева и др., 1997). Однако по сравнению с другими типами ледовых сред жильные льды характеризуются более высокими значениями численности жизнеспособных микроорганизмов (Wilhelm et al., 2012). Основными элементами наряду с кристаллами льда, определяющими структуру подземных льдов, являются воздушные и органоминеральные включения. В жильных льдах большая часть органоминеральных веществ содержится в виде коллоидных соединений и скоагулировавшихся частиц (Ершов, 2002). Известно, что обволакивающее действие гидрофильных коллоидов, отсутствие их вредного воздействия на осмотическое состояние клеток способствуют сохранению целостности клеточных структур (Звягинцев, 1987). Распределение коллоидных соединений в виде сетчатой пленки было обнаружено вокруг клеток микроорганизмов, выявленных в прослойках сегрегационного льда в мерзлых суглинках Мамонтовой горы (Курчатова, Рогов, 2011). Установлено, что ледяные включения в мерзлых грунтах − наиболее комфортная среда для сохранения различных форм микроорганизмов (Мельников и др., 2011).
Была изучена антибиотикорезистентность выделенных бактерий. Это свойство характерно для современных природных, в том числе и клинических, штаммов микроорганизмов. Однако вопрос о происхождении разнообразия форм лекарственной устойчивости у микроорганизмов, включая патогенные формы, и его взаимосвязи с деятельностью человека остается спорным (Allen et al., 2010; Davies, Davies, 2010). В связи с этим отмечается повышенный интерес к исследованиям микробных сообществ вечномерзлых пород и древних почв, не подвергавшихся антропогенному воздействию. Так, в работах по изучению пород вечной мерзлоты Сибири приводятся данные, свидетельствующие об обнаружении резистентности среди грамположительных и грамотрицательных бактерий, в частности, к аминогликозидным антибиотикам, антибиотикам группы тетрациклина и хлорамфениколу (Миндлин и др., 2008). По результатам метагеномного анализа микробных сообществ древнего пермафроста Аляски обнаружены фрагменты ДНК, имеющие нуклеотидные последовательности, сходные с таковыми у генов, контролирующих устойчивость к тетрациклинам, бета-лактамным антибиотикам и ванкомицину у современных бактерий (D’Costa et al., 2011). Однако одно лишь наличие таких фрагментов еще не может считаться подтверждением проявления фенотипа устойчивости к антибиотикам у бактерий (Fuste et al., 2012; Perron et al., 2013). Результаты изучения бактериальных сообществ различных слоев пермафроста Канадского сектора Арктики с помощью функциональной метагеномики показали, что гены резистентности, выявленные у бактерий, выделенных из мерзлоты, характеризовались меньшей устойчивостью к антибиотикам по сравнению с аналогичными генами бактерий, выделенных из активного, надмерзлотного слоя. Полученные результаты позволили авторам прийти к заключению, что гены антибиотикорезистентности появились в процессе эволюции природных, функционально различных генов устойчивости бактерий в результате интенсивного использования человеком антибиотиков (Perron et al., 2013).
Проведенное нами исследование спектра чувствительности к антибиотикам бактериальных изолятов, выделенных из образцов жильного льда, показало, что большая часть изолятов оказалась чувствительной к опробованным антибиотикам. Полученные результаты согласуются с результатами ранее проведенных исследований, которые свидетельствуют о более низкой антибиотикорезистентности природных штаммов бактерий, выделенных из образцов мерзлых пород и воды полярных регионов Арктики и Антарктики, не подвергавшихся значительному антропогенному воздействию (Miller et al., 2009; Perron et al., 2013). Из исследованного набора изолятов штаммы протеобактерий практически не проявляли чувствительности к бета-лактамному антибиотику бензилпенициллину и линкомицину, но были чувствительны к полимиксину. Изоляты грамположительных бактерий, напротив, были устойчивы или показывали низкую чувствительность к действию полимиксина. Механизм устойчивости выявленных групп бактерий носил, по-видимому, природный характер, обусловленный отличительными особенностями клеточной организации и ферментативной активности грамположительных и грамотрицательных бактерий (Jacobs, 2009).
Выделенные нами бактерии по своему таксономическому положению близки к ранее описанным видам, выявленным в экстремально низкотемпературных экосистемах. Так, большое число видов психротолерантных актинобактерий, относящихся к родам Dietzia, Microbacterium, Kocuria и Nocardioides, было выделено из различных арктических регионов вечной мерзлоты (Fendrihan, Negoiţâ, 2017). У выделенных нами из образцов жильного льда бактерий была высокая (98–100%) доля сходства с ранее описанными видами психротолерантных и психрофильных бактерий Carnobacterium pleistocenium, выделенных из жильного льда Аляски (Pikuta et al., 2005), Planococcus antarcticus, Planococcus psychrophilus, Psychrobacter vallis и Psychrobacter aquaticus, выделенных из образцов цианобактериального мата антарктических озер в районе станции Мак-Мердо (Reddy et al., 2002; Shivaji et al., 2005).
Психротолерантные и психрофильные микроорганизмы − важный объект многих биотехнологических процессов. В частности, представители родов Dietzia, Microbacterium, Kocuria и Nocardioides обладают потенциальной способностью к биодеградации углеводородов при низких температурах и могут быть использованы для биоремидиации загрязненных нефтепродуктами территорий полярных регионов (Steven et al., 2007; Fendrihan, Negoiţâ, 2017). Многие психрофильные микроорганизмы − продуценты важных биоактивных соединений, особенно ферментов, которые могут быть использованы при низких температурах. Так, бактерии родов Moraxella, Psychrobacter, а также Staphylococcus warneri M известны как продуценты холодоактиваных липолитических ферментов (Yokoi et al., 2012; Fendrihan, Negoiţâ, 2017).
Особенности строения жильных льдов делают их перспективным источником выделения психрофильных микроорганизмов. Их последующие идентификация и изучение важны для понимания механизмов выживания микроорганизмов различных таксономических групп в экстремально низкотемпературных условиях, а также для оценки их биотехнологического потенциала.
Работа выполнена при частичной финансовой поддержке РФФИ (грант 16-05-00296), а работа по идентификации изолятов – при поддержке ФАНО в рамках Государственного задания на выполнение фундаментальных научных исследований ФИЦ биотехнологии РАН по теме “Коллекция уникальных и экстремофильных микроорганизмов биотехнологического назначения”.
Список литературы
Васильчук Ю.К. Геохимический состав подземных льдов севера Российской Арктики // Арктика и Антарктика. 2016. № 2. С. 99–115.
Воробьева Е.А., Гиличинский Д.А., Соина В.С. Жизнь в криосфере: взгляд на проблему // Криосфера Земли. 1997. Т. 1. № 2. С. 60–66.
Ершов Э.Д. Общая геокриология. М.: Изд-во МГУ, 2002. 682 с.
Звягинцев Д.Г. Значение анабиоза в жизни почвенных микроорганизмов // Торможение жизнедеятельности клеток / Ред. Беккер М.Е. Рига: Зинатне, 1987. С. 32–43.
Курчатова А.Н., Рогов В.В. Подземный лед как среда обитания микроорганизмов // Материалы 4-й конференции геокриологов России. М.: Университетская книга, 2011. С. 345–350.
Мельников В.П., Рогов В.В., Курчатова А.Н., Брушков А.В., Грива Г.И. Распределение микроорганизмов в мерзлых грунтах // Криосфера Земли. 2011. Т. 15. № 4. С. 86–90.
Миндлин С.З., Соина В.С., Петрова М.А., Горленко В.М. Выделение устойчивых к антибиотикам штаммов бактерий из многолетнемерзлых отложений Восточной Сибири // Генетика. 2008. Т. 44. № 1. С. 36–44.
Нестеренко О.А., Квасников Е.И., Ногина Т.М. Нокардиоподобные и коринеподобные бактерии. Киев: Наук. думка, 1985. 336 с.
Романовская В.А., Таширев А.Б., Гладка Г.В., Таширева А.А. Диапазон температур для роста антарктических микроорганизмов // Мiкробiол. журн. 2012. Т. 74. № 4. С. 13–19.
Allen H.K., Donato J., Wang H.H., Cloud-Hansen K.A., Davies J. Call of the wild: antibiotic resistance genes in natural environments // Nat. Rev. Micro. 2010. V. 8. P. 251–259.
Birnboim H.C., Doly J. A rapid alkaline extraction procedure for screening recombinant plasmid DNA // Nucl. Acids Res. 1979. V. 24. P. 1513–1523.
Brouchkov A., Kabilov M., Filippova S., Baturina O., Rogov V., Galchenko V., Mulyukin A., Fursova O., Pogorelko G. Bacterial community in ancient permafrost alluvium at the Mammoth Mountain (Eastern Siberia) // Gene. 2017. № 636. P. 48–53.
Davies J., Davies D. Origins and evolution of antibiotic resistance // Microbiol. Mol. Biol. Rev. 2010. V. 74. P. 417–433.
D’Costa V.M., King C.E., Kalan L., Morar M., Wilson W.L.S., Schwarz C., Froese D., Zazula G., Calmels F., Debruyne R., Poinar H.N., Wright G.D. Antibiotic resistance is ancient // Nature. 2011. V. 477. P. 457–461.
Fendrihan S., Negoiţâ T.Gh. Psychrophilic microorganisms as important source for biotechnological processes // Adaption of Microbial Life to Environmental Extremes / Eds Stan-Lotter H., Fendrihan S. N.Y.: Springer, 2017. P. 147–199.
Fuste E., Galisteo G.J., Jover L., Vinuesa T., Villa T.G. Comparison of antibiotic susceptibility of old and current Serratia // Future Microbiol. 2012. V. 7. P. 781–786.
Gilichinsky D., Vishnivetskaya T., Petrova M., Spirina E., Mamykin V., Rivkina E. Bacteria in permafrost // Psychrophiles: from Biodiversity to Biotechnology / Eds Margesin R., Schinner F., Marx J.-C., Gerday C. Berlin; Heidelberg: Springer-Verlag, 2008. Pt II. Ch. 6. P. 83–102.
Jacobs G.A. History of drug-resistant microbes // Antimicrobial drag Resistance. Mechanisms of drug resistance / Eds Mayers D.L., Sobel J.D., Ouellette M., Kaye K.S., Marchaim D. N.Y.: Humana Press, 2009. V. 1. P. 3–8.
Katayama T., Tanaka M., Moriizumi J., Nakamura T., Brouchkov A., Douglas T.A., Fukuda M., Tomita F., Asano K. Phylogenetic analysis of bacteria preserved in a permafrost ice wedge for 25000 years // Appl. Envir. Microbiol. 2007. V. 73. № 7. P. 2360–2363.
Lacelle D., Radtke K., Clark I.D., Fisher D., Lauriol B., Utting N., Whyte L.G. // Geomicrobiology and occluded O2–CO2–Ar gas analyses provide evidence of microbial respiration in ancient terrestrial ground ice // Earth. Planet. Sci. Lett. 2011. V. 306. P. 46–54.
Lane D.J. 16S/23S rRNA sequencing // Nucleic acid techniques in bacterial systematics / Eds Stackebrandt E., Goodfellow M. N.Y.: John Wiley & Sons, 1991. P. 115−175.
Miller R., Gammon K., Day M.J. Antibiotic resistance among bacteria isolated from seawater and penguin fecal samples collected near Palmer Station, Antarctica // Can. Microbiol. 2009. V. 55. P. 37–45.
Perron G.G., Whyte L.,Turnbaugh P.J., Hanage W.P., Dantas G., Desai M.M. Functional characterization of bacteria isolated from ancient Arctic soil exposes diverse resistance mechanisms to modern antibiotics // PLoS One. 2013. V. 10: e0069533.
Pikuta E.V. Marsic D., Bej A., Tang J., Krader P., Hoover R.B. Carnobacterium pleistocenium sp. nov., a novel psychrotolerant, facultative anaerobe isolated from permafrost of the Fox Tunnel in Alaska // Int. Syst. Evol. Microbiol. 2005. V. 55. P. 473−478.
Reddy G.S., Prakash J.S., Vairamani M., Prabhakar S., Matsumoto G.I., Shivaji S. Planococcus antarcticus and Planococcus psychrophilus spp. nov. isolated from cyanobacterial mat samples collected from ponds in Antarctica // Extremophiles. 2002. V. P. 253−261.
Rosenblueth M., Martínez-Romero E. Bacterial endophytes and their interactions with hosts // Mol. Plant-Microbe Interaction. 2006. V. 19. № 8. P. 827–837.
Sanger F., Nicklen S., Coulson A.R. DNA sequencing with chain-terminating inhibitors // Proc. Natl Acad. Sci. USA. 1977. V. 74. P. 5463–5467.
Shivaji S., Reddy G.S., Suresh K., Gupta P., Chintalapati S., Schumann P., Stackebrandt E., Matsumoto G.I. Psychrobacter vallis sp. nov. and Psychrobacter aquaticus sp. nov., from Antarctica // Int. J. Syst. Evol. Microbiol. 2005. V. 55. P. 757–762.
Steven B., Briggs G., McKay Ch.P., Pollard W.H., Greer Ch.W., Whyte L.G. Characterization of the microbial diversity in a permafrost sample from the Canadian high Arctic using culture-dependent and culture-independent methods // FEMS Microbiol. Ecol. 2007. V. 59. P. 513–523.
Wilhelm R.C., Radtke K.J., Mykytczuk N.C.S., Greer Ch.W., Whyte L.G. Life at the Wedge: the activity and diversity of Arctic Ice Wedge Microbial Communities // Astrobiology. 2012. V. 12. № 4. P. 347−360.
Yokoi K., Fujii A., Kondo M., Kuzuwa S., Kagaya S., Yamakawa A., Taketo A. Kodaira K.-I. Molecular properties and extracellular processing of the lipase of Staphylococcus warneri M // J. Mol. Microbiol. Biotechnol. 2012. V. 22. P. 167–176.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


