Известия РАН. Серия биологическая, 2019, № 3, стр. 302-311
Водные растения как фактор, меняющий трофические связи и структуру сообществ зоопланктона и микроперифитона
С. А. Курбатова 1, *, Н. А. Лаптева 1, С. Н. Быкова 1, И. Ю. Ершов 1
1 Институт биологии внутренних вод им. И.Д. Папанина РАН
152742 Ярославская обл., Некоузский р-н, пос. Борок, 109, Россия
* E-mail: kurb@ibiw.yaroslavl.ru
Поступила в редакцию 25.04.2017
После доработки 25.04.2018
Принята к публикации 28.05.2018
Аннотация
В искусственных экосистемах (микрокосмах) оценено развитие бактерий, фито- и зоопланктона, а также микроперифитона в присутствии водных растений, подавляющих водоросли (телореза Stratiotes aloides L.) и не оказывающих на них существенного влияния (стрелолиста Sagittaria sagittifolia L.). Отмечено, что в микрокосмах с телорезом при меньшей в 2–3 раза концентрации пигментов фитопланктона биомасса зоопланктона не снижалась, сохранялось обилие эупланктонных и увеличивалась численность литоральных и фитофильных Cladocera, но уменьшалась численность Diaptomidae. Предположено, что значительная биомасса зоопланктона создавалась в результате использования бактерий и простейших в качестве дополнительного к водорослям источника питания. Установлено, что в микрокосмах со стрелолистом в зоопланктоне возрастала доля бактериофагов. В экспериментальных экосистемах с растениями обоих видов увеличивалось число хищников и теснее становились трофические связи между зоопланктоном и микроперифитоном.
Высшие водные растения – важный компонент водных экосистем. Как автотрофы они в первую очередь оказывают влияние на состав и количество других первичных продуцентов – водорослей. Обильно развиваясь на мелководьях, высшие растения изменяют гидродинамику, освещение, гидрохимические показатели, поглощают из воды биогенные вещества и в то же время выделяют легкоусвояемые органические вещества, что отражается на функционировании и составе фитопланктона и фитоперифитона. Некоторые гидрофиты способны проявлять аллелопатию, в результате чего подавляется развитие отдельных видов и групп водорослей (Mulderij et al., 2005; Hilt, 2006). В ряде случаев действие высших водных растений на водоросли опосредовано через организмы-альгофаги (Burks et al., 2000). В силу особенностей морфологии, физиологии, биологии и экологии разных видов высших растений степень их влияния на альгофлору водоемов неодинакова.
Телорез Stratiotes aloides L. – евразиатский вид, заселяющий мелководные мезо- и эвтрофные водоемы. Это растение существенно ограничивает развитие водорослей. При благоприятных для него условиях телорез быстро занимает большую площадь поверхности водоема, сокращая проникновение солнечной энергии в толщу воды, и производит значительную продукцию (De Geus-Kruyt, Segal, 1973), конкурируя с водорослями за биогенные вещества. Телорез заметно влияет на химический состав воды (Brammer, Wetzel, 1984). Хорошо известно аллелопатическое действие телореза на водоросли планктона и перифитона (Mulderij et al., 2005; Hilt, 2006; Mohamed, Al-Shehri, 2010). Исследования зоопланктона и гетеротрофных организмов микроперифитона в зарослях телореза очень немногочисленны (Bittel, 1980; Strzałek, Koperski, 2009; Mieczan, 2010).
Стрелолист Sagittaria sagittifolia L. – растение, широко распространенное в водоемах со стоячей и медленно текущей водой, – часто образует обширные заросли. Стрелолист имеет более развитую, чем у телореза, корневую систему, и его питание в большей степени связано с грунтом, чем с водой. Таким образом, стрелолист в меньшей мере соперничает с фитопланктоном за биогенные вещества. Аллелопатическую активность у него не отмечают. Изменяя гидродинамику, стрелолист влияет на осаждение органического вещества и его ресуспензию (Kleeberg et al., 2010). Подводные листья стрелолиста могут создавать поверхность большой площади, что способствует повышению обилия и продуктивности перифитонных организмов (Fischer, Pusch, 2001). Существующие описания зоопланктона среди стрелолиста проведены в природе, когда фитоценоз, как правило, образован несколькими видами водных растений. В результате структуру зоопланктона определяет комплекс факторов. Действие отдельных видов растений на состав сообществ и взаимосвязи гидробионтов можно изучить, проводя эксперименты с использованием искусственных экосистем (микрокосмов), когда большинство условий контролируется исследователем.
Цель работы – определить, как высшие водные растения, подавляющие водоросли и не оказывающие на них существенного воздействия, влияют на структуру сообществ зоопланктона и микроперифитона и способствуют изменению трофических связей в водных экосистемах.
МАТЕРИАЛЫ И МЕТОДЫ
Микрокосмы создавали на открытом воздухе в квадратных (1 × 1 м) пластиковых лотках, которые для предотвращения резких суточных колебаний температур помещали в бетонный бассейн с водой. Емкости наполняли отфильтрованной через сеть с ячеей 64 мкм речной водой до уровня 0.3 м. Общий объем воды в каждом лотке составлял 300 л. В экспериментальных экосистемах развивались микроорганизмы и водоросли, которые попадали в них вместе с водой при первичном заполнении. Зоопланктон отлавливали из прудов и равномерно распределяли в опытные лотки, а через неделю в них помещали растения. Контролем служили лотки без растений. Телорез S. aloides L. и стрелолист S. sagittifolia L. брали из их естественных местообитаний за 2 нед. до будущего эксперимента и выдерживали с учетом его условий: телорез – в отдельной емкости без грунта, а стрелолист рассаживали в тазы с песком. В одни опытные лотки погружали по 10 экз. телореза, в другие – по 20 экз. растений стрелолиста (с учетом его меньшей массы), укорененных в тазах с грунтом. В микрокосмы контрольного варианта и с телорезом ставили такие же тазы с грунтом для унификации условий эксперимента. В начале эксперимента опытные растения находились в фазе цветения–начала плодоношения. Стрелолист первоначально имел погруженные, плавающие и воздушно-водные формы листьев, впоследствии – только плавающие и воздушно-водные. Каждый вариант опыта выполняли в трех повторностях. Для исследования формирования микроперифитона через 2 сут после посадки растений в микрокосмы помещали предметные стекла, удерживаемые вертикально на пенопластовых поплавках. Сверху лотки затягивали сеткой, чтобы исключить попадание насекомых, моллюсков и опада с деревьев. Эксперимент длился 60 сут (с 01.07.2010 по 29.08.2010).
Ежедневно в утренние часы (9:00–10:00) регистрировали температуру и рН. Ежедекадно определяли концентрации О2, биохимическое потребление кислорода (БПК5), перманганатную окисляемость, содержание в воде хлорофилла и структурно-функциональные характеристики бактериального сообщества. Каждые 5 сут измеряли концентрацию ортофосфатов и отбирали пробы зоопланктона. Для контроля развития микроперифитона 1 раз в неделю из каждого микрокосма изымали стекла.
Гидрохимические показатели (О2, БПК5, перманганатную окисляемость, ортофосфаты) определяли по методикам, описанным ранее (Алекин и др., 1973). Содержание пигментов фитопланктона измеряли спектрофотометрическим методом в ацетоновой вытяжке (Сиренко, Курейшевич, 1982). Приблизительную биомассу фитопланктона рассчитывали с помощью значений концентраций хлорофилла (Хл) а и коэффициента 0.4 (Минеева, Щур, 2012). Бактерии осаждали на ядерных фильтрах с диаметром пор 0.17 мкм (Дубна, Россия), окрашивали флуорохромом DAPI (Porter, Feig, 1980) и подсчитывали под эпифлуоресцентным микроскопом. Биомассу бактерий рассчитывали исходя из численности и средних размеров клеток. Удельную массу бактерий принимали за единицу. Первичную продукцию и деструкцию органического вещества оценивали по изменению кислорода в склянках на свету и в темноте (Кузнецов, Дубинина, 1989). Зоопланктон отбирали 0.5-литровым пробоотборником в шести точках лотка (интегральная проба составляла 3 л), фиксировали в 4%-ном формалине и обрабатывали общепринятыми гидробиологическими методами. Таксономический состав и численность организмов микроперифитона на стеклах определяли методом прямого микроскопирования неконцентрированных и нефиксированных проб с помощью микроскопа БИМАМ Р13 при увеличении ×280. Объектами исследования служили водоросли, простейшие и коловратки. Биомассу перифитонных организмов рассчитывали с учетом размеров и геометрической формы клеток, а удельную плотность принимали равной единице.
Предварительно до посадки растений в микрокосмы и в середине эксперимента проанализировали содержание нитратного и аммиачного азота, а также ортофосфатов в воде микрокосмов. Концентрации форм азота измеряли фотометрическим методом с применением салициловой кислоты и реактива Несслера для определения нитратного и аммиачного азота соответственно (Алекин и др., 1973; Cataldo et al., 1975). Первоначально концентрации N–NO3, N–NH4 и P–PO4 составляли 0.009, 0.14 и 0.017 мг/л соответственно. Учитывая предыдущий опыт проведения экспериментов, когда в микрокосмах с гидрофитами концентрация минерального азота снижалась быстрее, чем концентрация фосфора, для того чтобы исключить лимитирование роста высших растений и водорослей, дважды (в начале опыта и через 1 мес.) внесли азотные соединения, поддерживая соотношение N : P соответствующим таковому в мезотрофных водоемах (Даценко, 2007).
Принимая во внимание небольшой размер выборки экспериментальных данных, использовали непараметрические методы статистического анализа. Влияние растений на концентрацию Хл а, на обилие зоопланктона и микроперифитона анализировали с использованием теста Фридмана (ANOVA с повторными измерениями). Для попарного сравнения использовали тест Вилкоксона с поправкой Бонферрони. Расчеты проводили в программе PAST (Hammer et al., 2001). Связь между полученными в опыте параметрами оценивали с помощью коэффициента ранговой корреляции Спирмена в программе STATISTICA 6.0.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Параметры среды. В год проведения эксперимента лето характеризовалось нетипично высокими температурами. С 7-х по 47-е сут наблюдений в утренние часы ее значения в среднем составляли 24°С (рис. 1а), а днем достигали 30–31°С. Бóльшая концентрация растворенного в воде кислорода была отмечена в контрольных микрокосмах и составляла в среднем 9.2 мг/л, меньшая – в микрокосмах с телорезом (в среднем 6.7 мг/л) (рис. 1б). Средняя за опыт концентрация О2 в микрокосмах со стрелолистом была немного меньше контрольной (8.4 мг/л). Днем при максимальном прогреве воды содержание кислорода во всех лотках снижалось до 4.2–4.6 мг/л. Изменение значений рН проходило в соответствии с динамикой О2 (рис. 1в). В контроле и со стрелолистом была отмечена корреляция между концентрацией О2 и рН (коэффициент ранговой корреляции (R) 0.93, вероятность (p) 0.008, число наблюдений (n) 7 и R = 0.89, p = = 0.019, n = 7 соответственно). В варианте с телорезом была обнаружена обратная зависимость между концентрацией О2 и температурой (R = –0.83, p = = 0.042, n = 7).
Рис. 1.
Изменение температуры (а), концентрации кислорода (б) и рН (в) в эксперименте: в контрольных микрокосмах (1), в микрокосмах с телорезом (2) и со стрелолистом (3).
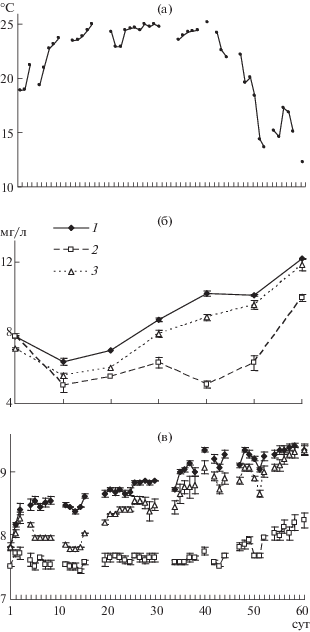
Концентрации минерального фосфора (Р ортофосфатов) в вариантах эксперимента мало различались. Среднее для контроля значение составляло 18.1, в воде микрокосмов со стрелолистом – 17.5, с телорезом – 15.1 мкг Р/л.
БПК5 и перманганатная окисляемость, свидетельствующие о содержании органического вещества, в микрокосмах с телорезом вдвое превышали контрольные значения в начале и в конце опыта. В остальное время эти показатели в воде лотков с телорезом были ниже, чем в контроле, или отличались недостоверно. Со стрелолистом, наоборот, в начале и в конце эксперимента значения БПК5 были меньше контрольных, а в остальное время превышали их, но с недостоверными различиями. В контроле значения БПК5 изменялись от 1.3 до 3.5 (среднее 2.2), со стрелолистом – от 1.1 до 4.4 (среднее 2.6), с телорезом – от 1.7 до 2.8 мг/л (среднее 2.2 мг/л). Перманганатная окисляемость в лотках без растений в среднем составила 10.1 (4.5–15.9), со стрелолистом – 10.6 (4.4–14.6), с телорезом – 11.1 мг/л (4–15.5 мг/л). Отношение БПК5 и перманганатной окисляемости в контроле и в микрокосмах с телорезом на протяжении всего эксперимента было <0.5. Это позволяет заключить, что в воде этих вариантов преобладало трудноусвояемое органическое вещество. В присутствии стрелолиста на 9-е сут отмечено увеличение этого показателя до 0.6. В контроле БПК5 тесно коррелировало с фотосинтезом фитопланктона (R = 0.93, p = 0.008, n = 6), а в микрокосмах, включающих в себя стрелолист, – в одинаковой мере с численностью бактерий и Copepoda (R = 0.89, p = = 0.019, n = 6). В лотках с телорезом достоверной зависимости БПК5 от других определяемых в эксперименте показателей не было выявлено.
Бактерии. Количественные характеристики бактерий в контроле и в микрокосмах с растениями не имели статистически значимых различий. Средняя за период наблюдений численность микроорганизмов составила 5, изменяясь от 3.4 до 8.2 млн. кл./мл, а биомасса – 0.7 мг/л (0.4–1.1 мг/л). В воде микрокосмов с растениями значительное число бактерий было агрегировано с детритными частицами, кроме того бактерии размещались на микропленках или объединялись в микроколонии. Бактериальное сообщество было представлено в основном мелкими палочками. Как с телорезом, так и со стрелолистом биомасса бактерий коррелировала с биомассой Copepoda (R = 0.86, p = 0.014, n = 7). Подъемы и спады деструкции совпадали во всех вариантах. Средняя за эксперимент деструкция в контроле составила 0.31 ± 0.07, с телорезом – 0.35 ± ± 0.05, со стрелолистом – 0.55 ± 0.09 мг О2/л. Максимум наблюдали на 30-е сут (конец июля): в контрольных микрокосмах распад органического вещества проходил со скоростью 0.64, в микрокосмах с телорезом и со стрелолистом – 0.74 и 1 мг О2/л соответственно. В присутствии стрелолиста деструкция органического вещества протекала в среднем вдвое активнее, чем в контроле (ANOVA Фридмана: p < 0.001) и в микрокосмах с телорезом (ANOVA Фридмана: p < 0.05).
Фитопланктон. В первые 40 сут эксперимента в воде микрокосмов с телорезом отмечали более низкие, чем в контроле, концентрации Хл a (рис. 2), Хл b и Хл с. Затем концентрации Хл a и Хл с в этом варианте увеличились, а в контроле снизились. Различия содержания Хл a и Хл b были достоверны (ANOVA Фридмана: p < 0.05). Несмотря на то что в присутствии телореза в большей части периода наблюдений фиксировали в 2–3 раза меньшую, чем в контроле, концентрацию пигментов, процесс фотосинтеза проходил не менее активно. Среднее значение первичной продукции как в контроле, так и с телорезом составляло 0.5 мг О2/л. Пик фотосинтеза в контроле приходился на 30-е сут (1.45 мг О2/л) и совпадал с максимумом содержания хлорофилла (4.4 мкг/л). Фотосинтез в контроле коррелировал с концентрацией фосфатов (R = 0.84, p = 0.036, n = 6). На кривых динамики этих показателей пик фосфатов появлялся позднее пика фотосинтеза. В микрокосмах с телорезом наибольшую скорость фотосинтеза регистрировали в первые сутки (0.73 мг О2/л) и затем при повышении концентрации пигментов – во второй половине эксперимента, на 40–50-е сут (0.66 мг О2/л). Достоверной связи скорости фотосинтеза с другими измеряемыми в опыте параметрами в этом варианте выявлено не было.
Рис. 2.
Концентрация хлорофилла а в воде микрокосмов: в контроле (1), с телорезом (2) и со стрелолистом (3). Показаны доверительные интервалы.
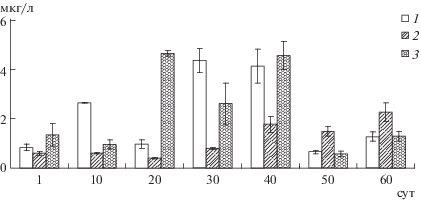
Содержание хлорофиллов в микрокосмах со стрелолистом отличалoсь от контроля в первые 30 сут эксперимента, затем различия стали статистически незначимыми. Концентрации Хл a в микрокосмах со стрелолистом и с телорезом различались в течение всего эксперимента (ANOVA Фридмана: p < 0.05). Динамика фотосинтеза была близка к контрольной, но с дополнительным пиком на 10-е сут (1.4 мг О2/л), в результате чего отмечали более высокое среднее значение первичной продукции (0.7 мг О2/л).
Пигментный индекс Е480/Е664 во все даты наблюдений во всех вариантах был <1.4, составлял в среднем в контроле 0.75, в микрокосмах с растениями обоих видов 0.67, что свидетельствует об отсутствии азотного дефицита для водорослей фитопланктона (Watson, Osborne, 1979).
Продукция планктоном органического вещества в экспериментальных экосистемах с высшими растениями превышала его деструкцию в большей степени, чем в микрокосмах без растений. В среднем за опыт отношение фотосинтеза к деструкции в контроле составило 1.7, в микрокосмах с телорезом и со стрелолистом – 2 и 2.1 соответственно. Максимальное значение этого показателя отмечали в контроле и в микрокосмах с телорезом на 40-е сут (3.4 и 5.3 соответственно), а в микрокосмах со стрелолистом на 60-е сут (5.7).
Микроперифитон. На стеклах обрастаний присутствовали водоросли отделов Cyanophyta, Bacillariophyta, Chlorophyta и Chrysophyta, простейшие типов Sarcomastigophora и Ciliophora, а также Rotifera. Таксономическое сходство микроперифитона (по индексу Серенсена) было довольно высоким: в среднем 65% между контролем и вариантом с телорезом, 70% между контролем и вариантом со стрелолистом и 64% между вариантами с растениями.
Численность водорослей в контроле колебалась от 18 до 585 тыс. кл./см2 (средняя 285 тыс. кл./см2), биомасса – от 0.1 до 1.4 мг/см2 (рис. 3) (средняя 0.5 мг/ см2). В начале эксперимента в контроле преобладали зеленые водоросли Coleochaete scutata Brebisson, Hormidium sp., из синезеленых отмечена Aphanizomenon flos-aquae (L.) Ralfs ex Born. et Flah. На 19-е сут по численности доминировала диатомовая Navicula pupula Kütz. var. pupula, но значительный вклад в биомассу вносили C. scutata и Synedra ulna (Nitzsch.) Ehr. var. ulna. Во вторую половину эксперимента массово развивались синезеленые Rivularia sp. Число таксонов составляло 4–11.
Рис. 3.
Биомасса синезеленых (1), зеленых (2) и диатомовых (3) водорослей микроперифитона в контроле (а), с телорезом (б) и со стрелолистом (в).
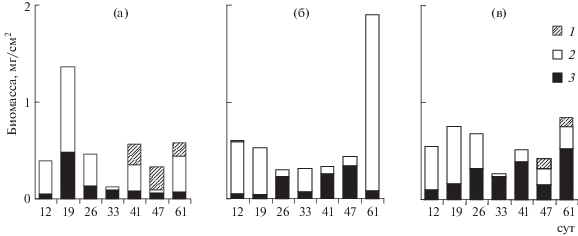
В микрокосмах с телорезом численность водорослей изменялась от 49 до 265 тыс. кл./см2 (средняя 156 тыс. кл./см2). Во второй половине эксперимента (41–61 сут) число клеток водорослей с телорезом было вдвое ниже контрольного. Биомасса водорослей колебалась от 0.3 до 0.6 мг/см2 (средняя 0.5 мг/см2) в течение 47 сут эксперимента и достигала пика (1.9 мг/см2) на 61-е сутки. Обычно в присутствии телореза на стеклах обрастаний регистрировали 8–11 видов водорослей, за исключением периода 33–47 сут, когда обнаруживали только 3–4 вида. В начале опыта были отмечены C. scutata, Stigeoclonium sp. и A. flos-aquae, а с 26-х сут преобладали диатомовые, особенно N. pupula var. pupula, а также S. ulna и Cocconeis placentula Her. var. placentula. В конце эксперимента (61-е сут) вновь произошло увеличение количества зеленых водорослей C. scutata. Численность и биомасса синезеленых водорослей значимо отличались от аналогичных контрольных показателей (ANOVA Фридмана: p < 0.01). Различия с контролем в количестве диатомовых не были достоверными (ANOVA Фридмана: p = 0.09).
В микрокосмах со стрелолистом численность водорослей составляла 16–265 тыс. кл./см2 (средняя 105 тыс. кл./см2), биомасса – 0.3–0.8 мг/см2 (средняя 0.6 мг/см2). Максимальное число видов (11) отмечали на 19-е сут. C. scutata и C. placentula вносили наибольший вклад в численность и биомассу водорослей перифитона в данном варианте в течение всего периода наблюдений. Биомасса диатомовых была значимо выше аналогичного контрольного показателя (ANOVA Фридмана: p < 0.05), но численность диатомовых водорослей была ниже таковой в микрокосмах с телорезом (ANOVA Фридмана: p < 0.05), где отмечали массовое развитие N. pupula. Синезеленых Rivularia sp. в конце эксперимента регистрировали в меньшем, чем в контроле, количестве (ANOVA Фридмана: p < 0.001).
Численность гетеротрофных организмов в контроле составляла 0.9–6.6 тыс. экз./см2 (средняя 2.9 тыс. экз./см2), биомасса – 0.01–0.97 мг/см2 (средняя 0.36 мг/см2). В микрокосмах со стрелолистом отмечали близкие значения показателей (1.6–6.8 тыс. экз./см2 (средняя 3.5 тыс. экз./см2) и 0.02–1.03 мг/см2 (средняя 0.35 мг/см2)). В присутствии телореза численность гетеротрофов в микроперифитоне была ниже (0.7–2.9 тыс. экз./см2 (средняя 1.7 тыс. экз./см2) и 0.02–0.49 мг/см2 (средняя 0.16 мг/см2)). Биомасса гетеротрофных организмов по группам показана на рис. 4. Значительную долю численности составляли жгутиконосцы, образующие малую биомассу. Во всех вариантах наиболее многочисленными были Desmarella irregularis Stokes, Codonosiga botrytis (Ehrenberg) Kent и Bodo saltans Ehrenberg, в конце эксперимента Anthophisa vegetans (O.F.M.) Stein. В микрокосмах со стрелолистом число жгутиконосцев значимо превышало их численность в микрокосмах с телорезом (ANOVA Фридмана: p < 0.05). В микрокосмах с телорезом бóльшую, чем в других вариантах, биомассу обеспечивала раковинная амеба Arcella sp. Ehrenberg. В микроперифитоне всех вариантов преобладали инфузории родов Vorticella Ehrenberg и Vaginicola Lamarck et Ehrenberg, среди телореза еще и Chilodonella uncinata Ehrenberg, а среди стрелолиста – Colpoda cucullus Müller. Численность и биомасса коловраток (Philodina acuticornis Murray и Ph. сitrina Ehrenberg) увеличились во вторую половину эксперимента, особенно в варианте со стрелолистом. Число коловраток в микрокосмах с телорезом было ниже, чем в контроле и в микрокосмах со стрелолистом (ANOVA Фридмана: p < 0.01).
Рис. 4.
Биомасса гетеротрофных организмов микроперифитона в контроле (а, г), с телорезом (б, д) и со стрелолистом (в, е). 1–4 – инфузории, коловратки, саркодовые и жгутиконосцы соответственно.
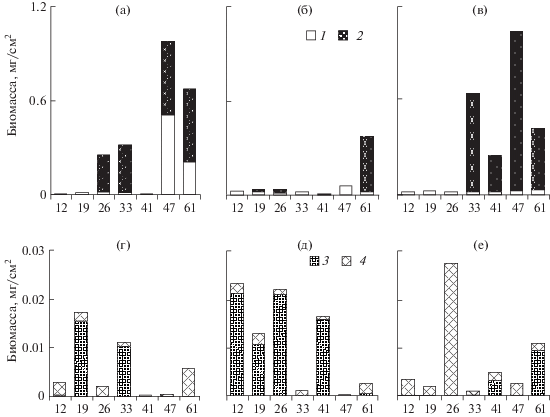
Зоопланктон. Всего в эксперименте зарегистрировали 52 вида зоопланктеров. Индекс видового сходства (Серенсена) между контролем и вариантом с телорезом в среднем за все время наблюдений составил 0.56, между контролем и микрокосмами со стрелолистом – 0.65, а между вариантами с растениями – 0.62. Индекс видового разнообразия Шеннона в присутствии телореза начал превышать контрольные значения с 35-х сут в среднем в 1.5 раза. В микрокосмах со стрелолистом индекс Шеннона, рассчитанный по биомассе, был больше контрольных показателей в течение всего эксперимента (в среднем на 66%). Средние численность и биомасса зоопланктона в контроле составляли соответственно 70 экз./л и 2 мг/л, в микрокосмах с телорезом – 86 и 2.7, а в микрокосмах со стрелолистом –116 и 1.8.
В присутствии телореза в сообществе увеличилась доля Cladocera (91% общей биомассы вместо 79% в контроле) (рис. 5). Как и в контроле, доминирование сохранялось за Daphnia longispina O.F. Müller. Значения численности и биомассы этого вида существенно не различались, составляя в среднем в контроле 36 экз./л и 1.8 мг/л, а в микрокосмах с телорезом – 38 экз./л и 2.2 мг/л. Начиная с 10-х сут, численность рачков сем. Chydoridae, преимущественно представленных Alona rectangula Sars, в микрокосмах с телорезом превышала таковую в контроле. Кроме A. rectangula развитие получали Alonella exigua (Lillijeborg), Graptoleberis testudinaria (Fischer) и Chydorus sphaericus (O.F. Müller). Биомасса хидорид коррелировала с численностью жгутиконосцев микроперифитона (R = –0.82, p = = 0.02, n = 7). С 40-х сут эксперимента в лотках с телорезом значительной численности (до 47 экз./л) достигала Ceriodaphnia quadrangula (O.F. Müller). Число C. quadrangula достоверно отличалось от наблюдаемого в контроле (ANOVA Фридмана: p < < 0.001). Была выявлена связь между численностью C. quadrangula и рН воды (R = 0.87, p = 0.001, n = 7), а также с концентрацией Хл а (R = 0.77, p = = 0.04, n = 7).
Рис. 5.
Изменение биомассы зоопланктона в разных вариантах эксперимента: в контроле (а), с телорезом (б), со стрелолистом (в). 1–3 – Rotifera, Cladocera и Copepoda соответственно.
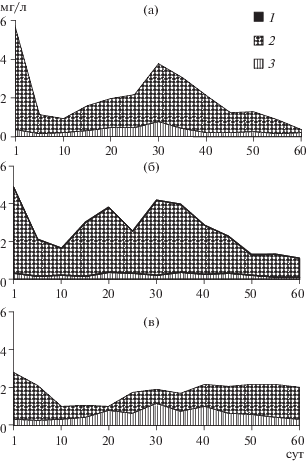
Как в контроле, так и в микрокосмах с телорезом средняя за опыт численность всех Copepoda составила 30 экз./л, а биомасса – 0.33 и 0.23 мг/л соответственно. В обоих вариантах основной вклад в численность Copepoda вносили ювенильные стадии Cyclopidae, а в биомассу – взрослые и копеподиты Diaptomidae (Eudiaptomus transylvanicus (Daday) и Acanthodiaptomus denticornis Wierzejski). Ход кривой динамики численности копеподитов калянид в экспериментальных экосистемах с телорезом повторял таковой в контроле, но с меньшими значениями в течение всего эксперимента (ANOVA Фридмана: p < 0.01). Биомасса взрослых калянид среди телореза также была ниже (ANOVA Фридмана: p < 0.001).
Численность и биомасса коловраток были невелики. Средняя биомасса в контроле составила 0.0006 мг/л, в микрокосмах с телорезом – 0.0011 мг/л. Для экспериментальных экосистем с гидрофитами было характерно большее разнообразие Rotifera (22 вида против 13 в контроле). Как в контроле, так и в микрокосмах с телорезом в пробах встречались Lecane luna (Müller), Polyarthra vulgaris Carlin, Keratella cochlearis (Gosse) и K. quadrata (Müller), в лотках с растениями дополнительно были отмечены Lecane (M.) bulla (Gosse), L. (M.) arcuata (Bryce), L. (M.) lunaris (Ehrenberg), Colurella obtuse (Gosse) и Testudinella patina (Hermann).
Хищники (взрослые Cyclopidae и Polyphemus pediculus (L.)) составляли в контроле в среднем 1% численности и 1.6% биомассы всего зоопланктона, в микрокосмах с телорезом – 2.3% как численности, так и биомассы.
В микрокосмах со стрелолистом в зоопланктоне увеличилась доля Copepoda (в среднем 35% биомассы вместо 21% в контроле). Численность и биомасса веслоногих рачков (66 экз./л и 0.58 мг/л) значимо превышали эти показатели в других вариантах (ANOVA Фридмана: p < 0.001). Достоверные различия в численности отмечали как для ювенильных, так и для взрослых Cyclopidae и Diaptomidae. Установлена связь численности и биомассы взрослых Diaptomidae с численностью бактерий (R = 0.79, p = 0.04, n = 7), а также численности и биомассы копеподитов Cyclopidae с биомассой инфузорий микроперифитона (R = – 0.93, p = 0.003, n = 7). Биомасса D. longispina (средняя 1.1 мг/л) была ниже контрольной и достоверно меньше таковой в микрокосмах с телорезом (ANOVA Фридмана: p < 0.01). Во второй половине эксперимента численность Cladocera выросла вдвое, составляя в среднем 64 вместо 31 экз./л в первые 30 сут. В этот период было отмечено увеличение численности рачков сем. Chydoridae, P. pediculus и Diaphanosoma brachyurum (Liévin) (ANOVA Фридмана: p < 0.01). Последняя отсутствовала в микрокосмах с телорезом. Численность D. brachyurum коррелировала с биомассой бактерий (R = 0.79, p = 0.04, n = 7). Значительного увеличения числа C. quadrangula, как в микрокосмах с телорезом, не происходило. Средняя биомасса коловраток составила 0.001 мг/л. В микрокосмах со стрелолистом зарегистрировали 18 видов Rotifera, из них общих с контролем – 12, общих с микрокосмами, включающими телорез, – 13. Filinia longiseta (Ehrenberg) была встречена только в данном варианте. Доля хищников в микрокосмах со стрелолистом составляла в среднем 1.8% численности и 3.9% биомассы зоопланктона.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Известно, что телорез вследствие конкуренции, затенения и аллелопатического действия снижает обилие водорослей (Brammer, 1979; Mulderij et al., 2005; Hilt, 2006). Закономерно ожидать, что это приведет к изменениям в структуре сообществ водных организмов, связанных с водорослями трофическими связями, и вызовет уменьшение численности и биомассы альгофагов зоопланктона.
В проведенном эксперименте было обнаружено снижение концентрации пигментов фитопланктона, однако уменьшения биомассы зоопланктона не произошло. Более того, оценка соотношения средних за период наблюдений биомасс планктонных групп (бактериопланктон : фитопланктон : зоопланктон) показала превышение доли зоопланктона на единицу биомассы фитопланктона более чем вдвое в экспериментальных экосистемах с телорезом по сравнению с контролем. В контроле это соотношение составляло 1 : 1.2 : 3, в микрокосмах с телорезом – 1.5 : 1 : 6.
В зоопланктоне не только увеличилась численность литоральных и фитофильных видов, но и облигатно-планктонный фильтратор D. longispina сохранил значительную численность и биомассу. Очевидно, что прирост биомассы зоопланктона обеспечивался как водорослями, так и дополнительными источниками питания. В микрокосмах с растениями бактерии в большей степени, чем в контроле, были объединены в колонии или связаны с детритными частицами, что повышало возможность их использования в пищу фильтраторами зоопланктона. Показано (Pace et al., 1990; Pace, Vaqué, 1994; De Eyto, Irvine, 2005), что в водных экосистемах, где Daphnia достигает большой численности, она эффективно потребляет бактериальную продукцию, а также продукцию простейших, направляя поток вещества и энергии из микробиальной петли на следующие трофические уровни. В ходе эксперимента было отмечено, что, несмотря на меньшую в присутствии телореза концентрацию пигментов фитопланктона, фотосинтез не снижался, а численность бактерий поддерживалось на сходном с контролем уровне. Это может свидетельствовать о том, что наряду с активным потреблением биомассы фито- и бактериопланктона, ее новообразование проходило с высокой скоростью.
В микрокосмах с телорезом в зоопланктоне выросла доля Cladocera, которые по типу питания преимущественно фильтраторы, однако статистически значимо снизилась численность других фильтраторов – Diaptomidae. Для диаптомид обнаружена бóльшая, чем для дафний, селективность в выборе объектов питания, в частности водорослей (DeMott, 1989), что объясняет их меньшее развитие в условиях сильного подавления фитопланктона.
Стрелолист не угнетал фитопланктон. Концентрация хлорофилла и скорость фотосинтеза несущественно отличались от аналогичных контрольных показателей. Одновременно в пищевых цепях возросло значение бактерий. В проведенном эксперименте в воде микрокосмов со стрелолистом наблюдали высокую активность бактерий: деструкционные процессы проходили вдвое быстрее, чем в контроле. Другие исследователи регистрировали значительную бактериальную продукцию в эпифитоне стрелолиста (Fischer, Pusch, 2001). В нашем опыте в зоопланктоне увеличилась доля Copepoda, питание которых прямо или опосредованно, через жгутиконосцев и инфузорий, связано с бактериями. Среди Cladocera значительного обилия достигала D. brachyurum (микрофильтратор, способный отфильтровывать одиночных бактерий (Коровчинский, 2004)), численность которой коррелировала с биомассой микроорганизмов. Коловратка F. longiseta, по спектру питания относящаяся к триптобактериофагам (Монаков, 1998), была отмечена только в данном варианте эксперимента.
Увеличение численности бактерий и их активности во многом было обусловлено поступлением в воду органических веществ в процессе жизнедеятельности высших растений (Wetzel, Manny, 1972) и при отмирании их частей. Водные растения существенно пополняют массу детрита в экосистемах. В результате возрастает значение пищевых цепей, в основе которых лежит детрит. Органическое вещество и энергия от деструкторов детрита (микроорганизмов и грибов) переходит к детритофагам и бактериофагам, к простейшим и зоопланктону (Moore et al., 2004). Соотношение биомасс планктонных групп в присутствии стрелолиста сохранялось близким к контрольному (1 : 1.2 : 2.5). Некоторое снижение доли зоопланктона объясняется структурными изменениями в сообществе: ростом численности Copepoda, в частности науплиусов и копеподитов, образующих меньшую биомассу.
Развитие высших растений, как правило, приводит к увеличению значения микроперифитона в продукционных процессах и трофических связях гидробионтов. Показано, что доля перифитона в первичной продукции мелководных озер может достигать 80–98% (Vadeboncoeur et al., 2003). Даже водные растения, обладающие аллелопатическим потенциалом, подавляют не все водоросли, а отдельные их группы, другие эпифитные водоросли могут образовывать значительную биомассу и служить пищевым ресурсом для животных, питающихся на субстрате. В проведенном эксперименте в микрокосмах с растениями обоих видов в микроперифитоне отмечено увеличение количества диатомовых водорослей. В зоопланктоне в присутствии растений возрастала численность их потенциальных потребителей – рачков сем. Chydoridae. Среди телореза обнаружена корреляционная связь между гетеротрофными жгутиконосцами микроперифитона и хидоридами. Питание некоторых хидорид можно считать облигатно-перифитонным (Masclaux et al., 2012).
Усложнение структурной организации пространства в экосистемах с высшими водными растениями ведет к большему видовому и размерному разнообразию различных групп гидробионтов. Наряду с появлением мелких форм увеличивается доля хищников. Хищные Copepoda захватывают своих жертв не только в толще воды, но и на поверхности субстратов, о чем косвенно свидетельствует выявленная коррелятивная связь их численности с биомассой инфузорий микроперифитона в экспериментальных экосистемах со стрелолистом.
ЗАКЛЮЧЕНИЕ
Высшие водные растения – существенный средообразующий фактор для организмов планктона и перифитона. Изменяя пространственную организацию среды, гидродинамику, освещенность, влияя на газовый режим, оборот биогенных веществ, выделяя в воду в процессе своего метаболизма органические вещества, а также составляя при отмирании значительную долю фитогенного детрита, растения участвуют в создании большого числа экологических ниш, способствуют увеличению видового разнообразия гидробионтов и усложнению трофических связей между ними. Конкурируя с планктонными и перифитонными водорослями за ресурсы, некоторые растения значительно снижают их обилие. Но, как было показано в проведенном исследовании на примере с телорезом, уменьшения биомассы фильтраторов зоопланктона не происходит. Нарушая классическую пищевую цепь между фитопланктоном и зоопланктоном, растения, подобные телорезу, содействуют большей передаче органического вещества из микробиальной петли от бактерий и простейших на следующий трофический уровень. В ассоциациях водных растений, не оказывающих значительного влияния на развитие водорослей, таких как стрелолист, также возрастает роль бактерий как пищевого объекта для зоопланктона. Это определяет видовую структуру зоопланктонного сообщества и биомассу его отдельных групп. Среди растений теснее становится связь между зоопланктоном и микроперифитоном. Рацион ракообразных дополняется автотрофными и гетеротрофными организмами микроперифитона, что подтверждается обнаруженными в работе коррелятивными связями.
Список литературы
Алекин О.А., Семенов А.Д., Скопинцев Б.А. Руководство по химическому анализу вод суши. Л.: Гидрометеоиздат, 1973. 272 с.
Даценко Ю.С. Эвтрофирование водохранилищ. Гидролого-гидрохимические аспекты. М.: Геос, 2007. 252 с.
Коровчинский Н.М. Ветвистоусые ракообразные отряда Ctenopoda мировой фауны (морфология, систематика, экология, зоогеография). М.: КМК, 2004. 410 с.
Кузнецов С.И., Дубинина Г.А. Методы изучения водных микроорганизмов. М.: Наука, 1989. 286 с.
Минеева Н.М., Щур Л.А. Содержание хлорофилла а в единице биомассы фитопланктона (обзор) // Альгология. 2012. Т. 22. № 4. С. 441–456.
Монаков А.В. Питание пресноводных беспозвоночных. М.: ИПЭЭ РАН, 1998. 322 с.
Сиренко Л.А., Курейшевич А.В. Определение содержания хлорофилла в планктоне пресных водоемов. Киев: Наук. думка, 1982. 52 с.
Bittel L. Zooplankton of Stratiotes aloides aggregations // Acta Univ. Nic. Copernici. Pr. Limnol. 1980. V. 12. P. 3–23.
Brammer E.S. Exclusion of phytoplankton in the proximity of dominant water soldier (Stratiotes aloides) // Freshwater Biol. 1979. V. 9. № 3. P. 233–249.
Brammer E.S., Wetzel R.G. Uptake and release of K+, Na+ and Ca2+ by the water soldier, Stratiotes aloides L. // Aquat. Bot. 1984. V. 19. № 1–2. P. 119–130.
Burks R.L., Jeppesen E., Lodge D.M. Macrophyte and fish chemicals suppress Daphnia growth and alter life history traits // Oikos. 2000. V. 88. № 1. P. 139–147.
Cataldo D.A., Maroon M., Schrader L.E., Youngs V.L. Rapid colorimetric determination of nitrate in plant tissues by nitration of salicylic acid // Comm. Soil Sci. Plant Anal. 1975. V. 6. № 1. P. 71–80.
De Eyto E., Irvine K. Variation in the biomass of functional groups comprising the open-water plankton of shallow lakes in Ireland // Biol. Envir.: Proc. Roy. Irish Acad. 2005. V. 105B. № 1. P. 53–58.
De Geus-Kruyt M., Segal S. Notes on the productivity of Stratiotes aloides in two lakes in the Netherlands. // Pol. Arch. Hydrobiol. 1973. V. 20. P. 195–205.
DeMott W.R. Optimal foraging theory as a predictor of chemically mediated food selection by suspension-feeding copepods // Limnol. Oceanogr. 1989. V. 34. № 1. P. 140–154.
Fischer H., Pusch M. Comparison of bacterial production in sediments, epiphyton and the pelagic zone of a lowland river // Freshwater Biol. 2001. V. 46. № 10. P. 1335–1348.
Hammer Ø., Harper D.A.T., Ryan P.D. PAST: Paleontological statistics software package for education and data analysis // Palaeontol. Electr. 2001. V. 4. P. 9–15.
Hilt S. Allelopathic inhibition of epiphytes by submerged macrophytes // Aquat. Bot. 2006. V. 85. № 3. P. 252–256.
Kleeberg A., Köhler J., Sukhodolova T., Sukhodolov A. Effects of aquatic macrophytes on organic matter deposition, resuspension and phosphorus entrainment in a lowland river // Freshwater Biol. 2010. V. 55. № 2. P. 326–345.
Masclaux H., Bec A., Bourdier G. Trophic partitioning among three littoral microcrustaceans: relative importance of periphyton as food resource // J. Limnol. 2012. V. 71. № 2. P. 261–266.
Mieczan T. The influence of emergent and submerged macrophyte beds on ciliate communities in a shallow lake // Oceanol. Hydrobiol. Stud. 2010. V. 39. P. 107–115.
Mohamed Z.A., Al-Shehri A.M. Differential responses of epiphytic and planktonic toxic cyanobacteria to allelopathic substances of the submerged macrophyte Stratiotes aloides // Inter. Rev. Hydrobiol. 2010. V. 95. P. 224–234.
Moore J.C., Berlow E.L., Coleman D.C., de Ruiter P.C., Dong Q., Hastings A., Johnson N.C., McCann K.S., Melville K., Morin P.J., Nadelhoffer K., Rosemond A.D., Post D.M., Sabo J.L., Scow K.M., Vanni M.J., Wall D.H. Detritus, trophic dynamics and biodiversity // Ecol. Lett. 2004. V. 7. P. 584–600.
Mulderij G.W., Mooij M., Smolders A.J.P., Van Donk E. Allelopathic inhibition of phytoplankton by exudates from Stratiotes aloides // Aquat. Bot. 2005. V. 82. № 4. P. 284–296.
Pace M.L., Vaqué D. The importance of Daphnia in determining mortality rates of protozoans and rotifers in lakes // Limnol. Oceanogr. 1994. V. 39. № 5. P. 985–996.
Pace M.L., McManus G.B., Findlay S.E.G. Planktonic community structure determines the fate of bacterial production in a temperate lake // Limnol. Oceanogr. 1990. V. 35. № 4. P. 795–808.
Porter K.G., Feig Y.S. The use of DAPI for identifying and counting of aquatic microflora // Limnol. Oceanogr. 1980. V. 25. № 5. P. 943–948.
Strzałek M., Koperski P. The Stratiotes aloides L. stand as a habitat in oxbow lake Bużysko // Aquat. Bot. 2009. V. 90. № 1. P. 1–6.
Vadeboncoeur Y., Jeppesen E., Vander Zanden M.J., Schierup H.-H., Christoffersen K., Lodge D.M. From Greenland to green lakes: Cultural eutrophication and the loss of benthic pathways in lakes // Limnol. Oceanogr. 2003. V. 48. № 4. P. 1408–1418.
Watson R.A., Osborne P.L. An algal pigment ratio as an indicator of the nitrogen supply to phytoplankton in three Norfolk broads // Freshwater Biol. 1979. V. 9. № 6. P. 585–594.
Wetzel R.G., Manny B.A. Secretion of dissolved organic carbon and nitrogen by aquatic macrophytes // Verh. Inter. Verein. Limnol. 1972. V. 18. Pt 1. P. 162–170.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


