Известия РАН. Серия биологическая, 2019, № 3, стр. 284-293
Изучение когнитивно-стимулирующей активности фторсодержащих производных карбазолов и поведенческих реакций у трансгенных мышей Tg6799 с моделью болезни Альцгеймера
Н. С. Николаева 1, *, А. В. Мальцев 1, Р. К. Овчинников 1, В. Б. Соколов 1, А. Ю. Аксиненко 1, Е. В. Бовина 1, А. С. Кинзирский 1
1 Институт физиологически активных веществ РАН
142432 Московская обл., Ногинский р-н, г. Черноголовка, Северный пр., 1, Россия
* E-mail: nikolaevans@bk.ru
Поступила в редакцию 06.06.2016
После доработки 23.04.2018
Принята к публикации 28.05.2018
Аннотация
Изучено когнитивно-стимулирующее, нейропротекторное действие перспективных фторсодержащих производных тетрагидрокарбазолов (СА-7043х и СА-7050х) на гиппокампзависимую память аутбредных мышей (CD1) и трансгенных мышей линии Tg6799, а также их влияние на тревожность, двигательную активность и ориентировочно-исследовательское поведение животных. Установлено, что оба соединения оказывают выраженное когнитивно-стимулирующее влияние на мышей CD1, но не осуществляют нейропротекторного действия на поддержание памяти у животных линии Tg6799. Отмечено, что в тесте “открытое поле” соединение СА-7050х положительно влияет на ориентировочное поведение, а СА-7043х – на исследовательскую реакцию на уровне нетрансгенного контроля.
Нарушение когнитивных функций – один из частых неврологических симптомов при разнообразных очаговых и диффузных поражениях головного мозга. В большинстве случаев когнитивные нарушения отмечаются в пожилом возрасте в виде деменции. Болезнь Альцгеймера (БА) – одна из самых распространенных форм деменции у людей старше 60 лет, которая приводит к нарушению когнитивных функций, в частности к нарушению памяти (Liu et al., 2015). Основные патологические признаки БА включают в себя накопление внеклеточных β-амилоидных бляшек и внутриклеточных нейрофибриллярных клубков (Howard et al., 2012; Lonskaya et al., 2014; Fu et al., 2016; Goozee et al., 2016). Выбор терапии когнитивных нарушений определяется их тяжестью и этиологией. При легких формах когнитивных нарушений терапия нацелена на предотвращение их прогрессирования, часто используют антиоксиданты, ноотропные препараты (ГАМК-ергические, пептидергические препараты, аминокислоты и т.д.) (Бачурин, 2001). В случае деменции, например, при БА основные препараты – ингибиторы ацетилхолинэстеразы (галантамин, ривастигмин, донепезил) (Mancuso et al., 2011) и антагонист NMDA-рецепторов – мемантин (Sonkusare et al., 2005), однако их эффект направлен на коррекцию только отдельных звеньев патологических процессов, присущих данному заболеванию. В результате отсутствия эффективного препарата для лечения нейродегенеративных заболеваний ведется поиск потенциальных лекарственных средств среди различных классов химических соединений, в частности среди соединений, содержащих в молекуле индольный остов: производные карбазола (Pieper et al., 2010; Nirogi et al., 2012; Zhu et al., 2013), тетрагидрокарбазолов (Соколов и др, 2014; Бачурин и др., 2015) и гамма-карболинов (Vignisse et al., 2011; Соколов и др., 2013, 2015; Peters et al., 2013). Ранее нами было установлено, что представители 9-[2-(5-фторпиридин-3-ил)этил]-2,3,4,9-тетрагидро-1H-карбазола (соединения СА-7043х и СА-7050х) оказывают когнитивно-стимулирующее и анксиолитическое действие в дозе 5 мг/кг (Николаева и др., 2015). Показана антагонистическая активность этих соединений в радиолигандном связывании с NMDA-рецепторами (Соколов и др., 2014).
Цель исследования – сравнительное изучение когнитивно-стимулирующей и общеповеденческой активности соединений СА-7043х и СА-7050х на аутбредных мышах (СD1) и на мышах Tg6799, моделирующих некоторые формы БА.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводились на самцах аутбредных мышей CD1 в возрасте 2.5–3 и 6 мес., а также на самцах в возрасте 3 и 6 мес. трансгенных мышей линии Tg(APPSwFlLon,PSEN1*M146L*L286V)6799Vas/J – (Tg6799 или 5xFAD), моделирующих определенные генетические нарушения, характерные для БА. У животных линии Tg6799 развивается прогрессирующий когнитивный дефицит с увеличением возраста. В геном Tg6799 мышей встроена трансгенная кассета под контролем Thy1-промотора, которая содержит тройную мутацию в гене, кодирующем белок-предшественник бета-амилоида (APP‑белок) – три аминокислотные замены (K670N/M671L, I716V, V717I) и двойную мутацию пресенилина, содержащую две аминокислотные замены (M146L, L286V), обнаруживаемые при наследственных формах БА (Oakley et al., 2006). Эта модель воспроизводит различные признаки БА (нарушение рабочей памяти, снижение тревожности, обширное образование внеклеточных амилоидных бляшек начиная с двухмесячного возраста), что делает ее подходящей исследовательской моделью для отдельных форм БА (Oakley et al., 2006; Ohno et al., 2007; Wirths et al., 2010; Jawhar et al., 2012; Shukla et al., 2013).
Животные содержались в стандартных условиях, с 12-часовым режимом дня, с неограниченным доступом к воде и корму. В экспериментах на аутбредных мышах в каждой группе было по 8–13 особей, при изучении действия соединений на память трансгенных (ТГ) животных – по 8–10 мышей в возрасте 3 мес. и по 6–9 особей в возрасте 6 мес.
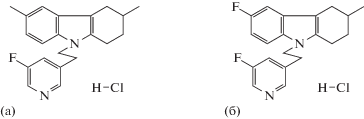
Изучаемые гидрохлориды 9-[2-(5-фторпиридин-3-ил)этил]-3,6-диметил-2,3,4,9-тетрагидро-1Н- карбазола (СА-7043х) и 9-[2-(5-фторпиридин-3-ил)этил]-3-метил-6-фтор-2,3,4,9-тетрагидро-1Н- карбазола (СА-7050х) (рис. 1) в виде суспензий с Twin-80 вводили внутрижелудочно.
Рис. 1.
Структурные формулы фторсодержащих производных тетрагидрокарбалозов СА-7043х (а), СА-7050х (б).
Аутбредным мышам CD1 вводили вещества в дозах 0.5, 0.1, 0.05, 0.01 мг/кг за 40 мин до эксперимента, а ТГ-мышам – в дозе 0.01 мг/кг 5 сут в неделю на протяжении 5 мес. В качестве препаратов сравнения использовали мемантин и димебон в дозах 5 и 0.01 мг/кг соответственно. Мемантин – одно из лекарственных средств, применяемых в клинической практике для лечения БА (Clerici et al., 2009; Boinpally et al., 2015; Tu et al., 2015), димебон – гамма-карболиновый структурный аналог веществ СА-7043х и СА-7050х, оказывающий выраженное когнитивно-стимулирующее и нейропротекторное действие (Doody et al., 2008; Zhang et al., 2010; Vignisse et al., 2011; Bachurin et al., 2012; Ustyugov et al,, 2012; Peters et al., 2013). Аутбредные мыши использовались для скрининга и поиска наиболее эффективной дозы исследуемых соединений, поэтому введение было однократным. При изучении влияния двух наиболее активных веществ (СА-7043х и СА-7050х) на образование амилоидных бляшек (данные не приводятся) соединения вводили многократно. На временны́х отрезках 3 и 6 мес. смотрели влияние многократного введения на поведенческие реакции ТГ-животных. Мышам группы контроля вводили дистиллированную воду. В эксперименте на ТГ-животных были две контрольные группы: нетрансгенные (НТГ) мыши (или мыши “дикого типа”, получаемые в одном помете с трансгенными, но не имеющие мутаций в своем геноме) и ТГ-мыши, содержащие в геноме пять мутаций семейной формы БА.
Тест “узнавание новой локализации известного объекта”. Эксперимент проводили по методике, описанной нами ранее (Николаева и др., 2015). Индекс узнавания для каждого объекта во время тестирования рассчитывали по формуле
Тест “открытое поле”. Эксперимент выполнялся на автоматизированной фотосенсорной установке TruScan (Coulbourn, СШA) (Malatynska et al., 2012). Животных помещали в левый дальний угол установки TruScan. В течение 3 мин регистрировали двигательную активность, неподвижный момент, дистанцию движения, скорость движения, дистанцию в периметре и центре, время в периметре и центре, число посещений центра, число и продолжительность вертикальных стоек, число и продолжительность обследованных отверстий.
Статистический анализ результатов проводили с помощью программы Prism 5.03 (GraphPad Software Inc., СШA). Проверку статистических гипотез распределения проводили с помощью критерия Шапиро–Уилка. При сравнении двух независимых групп использовали непараметрический критерий Манна–Уитни (U). Для множественного сравнения групп применяли тест “критерий Краскела–Уоллиса”, а затем U-тест (уровень достоверности 95%, p < 0.05).
В экспериментах на аутбредных животных сравнивали данные опытных и контрольной групп, на ТГ-мышах – данные ТГ-групп и НТГ-контролей для выявления разницы в поведении между мышами с признаками болезни БА и без них. Результаты группы мемантина и опытных групп сравнивали с результатами ТГ- и НТГ-контролей (с каждым отдельно) для выявления действия веществ на ТГ-мышей.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследование когнитивно-стимулирующего действия фторсодержащих производных тетрагидрокарбалозов СА-7043х, СА-7050х на аутбредных мышах CD1. Ранее нами было отмечено, что соединение СА-7043х в дозе 5 мг/кг оказывает анксиолитическое действие в тесте “открытое поле” и обусловливает когнитивно-стимулирующий эффект в тесте УНЛИО на мышах CD1, а вещество СА-7050х в тех же тестах влияет на ТГ-мышей 5xFAD (Николаева и др., 2015). В результате исследования соединений СА-7043х и СА-7050х в тесте УНЛИО в дозах 0.1, 0.5, 0.05 и 0.01 мг/кг показано, что после введения мышам в возрасте 3 мес. СА-7043х в дозах 0.05 и 0.01 мг/кг отмечается достоверное увеличение времени обследования объекта в новой локализации относительно известной (при 0.05 и 0.01 мг/кг р = 0.0274 и 0.001 соответственно), а также относительно контроля под действием дозы 0.01 мг/кг (р = 0.0289). Вещество СА-7050х стимулирует гиппокампзависимую память животных в дозах 0.1 и 0.01 мг/кг (при 0.1 мг/кг р < 0.0001 относительно известной локализации, р = 0.0244 относительно контроля; при дозе 0.01 мг/кг р = 0.0031 относительно известной локализации) (табл. 1).
Таблица 1.
Значение относительного времени обследования объектов в известной и новой локализациях в тесте “узнавание новой локализации известного объекта”
| Группа (доза, мг/кг) | n | Индекс предпочтения, % | |
|---|---|---|---|
| известная локализация | новая локализация | ||
| Контроль | 8 | 45.2 ± 5.82 | 54.8 ± 5.82 |
| СА-7043х (0.5) | 8 | 46.2 ± 7.5 | 53.8 ± 7.5 |
| СА-7050х (0.5) | 8 | 45.8 ± 6.64 | 54.2 ± 6.64 |
| Контроль | 8 | 57.2 ± 7.05 | 42.9 ± 7.05 |
| СА-7043х (0.1) | 9 | 56 ± 3.16 | 43.9 ± 3.16 |
| СА-7050х (0.1) | 9 | 39.3 ± 3.22 | 60.7 ± 3.22##* |
| Контроль | 11 | 55.4 ± 3.92 | 44.6 ± 3.92 |
| СА-7043х (0.5) | 13 | 43 ± 3.79 | 56.9 ± 3.79 |
| СА-7043х (0.1) | 13 | 41.4 ± 2.74# | 58.6 ± 2.74##* |
| Контроль | 10 | 51.8 ± 5.24 | 48.2 ± 5.24 |
| СА-7050х (0.5) | 10 | 48.5 ± 5.53 | 51.5 ± 5.53 |
| СА-7050х (0.1) | 11 | 39.3 ± 3.42 | 60.7 ± 3.42## |
Подобное исследовательское предпочтение свидетельствует о запоминании обстановки в день обучения, а также об улучшении контекстуальной гиппокампзависимой памяти мышей (Carey et al., 2009). Предпочтение животными нового объекта означает, что представление об известном объекте существует у них в памяти (Ennaceur, 2010).
При сравнении минимально эффективной дозы исследуемых соединений с эталонными препаратами нами установлено, что под действием обоих изучаемых соединений отмечается увеличение времени обследования объекта в новой локализации относительно известной (СА-7043х – р = 0.0003; СА-7050х – р = 0.0001), а также относительно контроля (СА-7043х – р < 0.05; СА-7050х – р < 0.01) (рис. 2а).
Рис. 2.
Относительные показатели времени (%) обследования аутбредными мышами в возрасте 2.5–3 мес. (а) и 6 мес. (б) объектов в известной (1) и новой (2) локализациях после введения исследуемых препаратов. а – контроль, мемантин, димебон (n = 9), СА-7043х, СА-7050х (n = 10); б – контроль, мемантин, СА-7043х, СА-7050х (n = 10). # – p < 0.05 относительно контроля; ** – p < 0.01; *** – p < 0.001 относительно известной локализации.
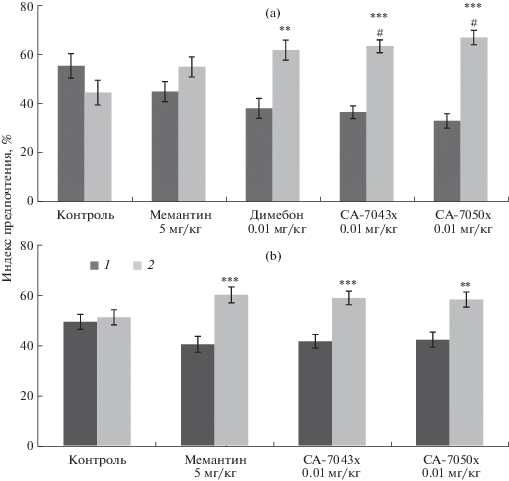
Следовательно, оба соединения стимулируют когнитивные функции, подобные таковым у мемантина и димебона. Подобное увеличение времени обследования указывает на стимулирование гиппокампзависимой памяти животных.
Также было изучено когнитивно-стимулирующее действие соединений на взрослых мышах в возрасте 6 мес. Показано, что при тестировании животные больше времени исследовали объект в новой локализации, чем в известной (рис. 2б) (СА-7043х – р = 0.0007; СА-7050х – р = 0.0029), а также на уровне препарата сравнения. Эти данные указывают на способность исследуемых соединений стимулировать долговременную память и у взрослых мышей в возрасте 6 мес.
Таким образом, изучаемые соединения оказывают когнитивно-стимулирующее влияние на аутбредных мышей CD1 в возрасте 3 и 6 мес., при этом оба действуют в минимально изученной дозе 0.01 мг/кг.
Исследование когнитивно-стимулирующего и нейропротекторного действия химических соединений СА-7043х и СА-7050х на трансгенных мышах 5xFAD. В тесте УНЛИО на ТГ-животных в возрасте 3 мес., которым с 2 мес. вводили соединения, не отмечалось значимых изменений при обследовании объекта в новой и известной локализациях в группах, которые получали СА-7043х и СА-7050х. В группе мышей, получавших мемантин в дозе 5 мг/кг, наблюдалась тенденция к увеличению времени обследования объекта в новой локализации относительно известной (р = 0.0503), что может указывать на стимулирование памяти у ТГ-животных (рис. 3а).
Рис. 3.
Относительные показатели времени (%) обследования трансгенными мышами 5xFAD в возрасте 3 (а) и 6 мес. (б) объектов в известной (1) и новой (2) локализациях после долговременного введения исследуемых препаратов в дозе 0.01 мг/кг. а – НТГ- и ТГ-контроль (n = 10), мемантин (n = 9), СА-7043х и СА-7050х (n = 8); б – НТГ-контроль (n = 9), ТГ-контроль (n = 6), мемантин и СА-7043х (n = 8), СА-7050х (n = 7).
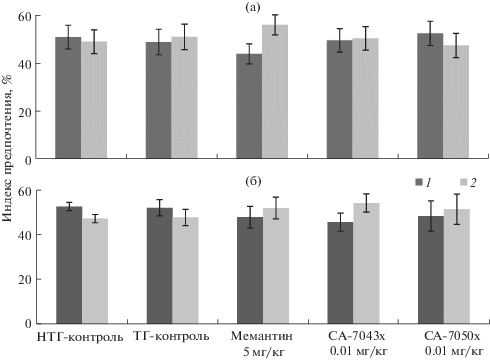
У контрольных ТГ-животных в этом тесте также не отмечается нарушений памяти в запоминании расположения объектов относительно НТГ-контроля. Отсутствие снижения памяти и обучения в этом тесте может быть связно с тем, что только с 6 мес. отмечается тенденция к снижению числа нейронов у 5xFAD мышей, а в более раннем возрасте потеря нейронов отсутствует (Eimer, Vassar, 2013).
При тестировании животных в возрасте 6 мес. ни в одной из опытных групп, в частности в группе ТГ-контроля и группе, получавшей мемантин, не выявлено отличий в исследовании объекта в новой и известной локализациях (рис. 3б). Нашими данными подтверждаются результаты работы Реуса и Джояшики (Réus et al., 2008; Joyashiki et al., 2011), где мемантин не оказывает когнитивно-стимулирующего действия на ТГ-мышей 5xFAD при 18-суточном внутрибрюшинном введении и на нормальных крысах Wistar.
Соединения в дозе 0.01 мг/кг не эффективны на ТГ-мышах из-за возможной низкой дозы соединений, тогда как ранее нами было показано положительное действие соединения СА-7050х в дозе 5 мг/кг на мышах данной линии (Николаева и др., 2015).
Изучение влияния соединений на тревожность, двигательную активность и ориентировочно-исследовательское поведение мышей 5xFAD. При тестировании мышей в возрасте 3 мес. в тесте “открытое поле” показано, что в группе ТГ-контроля время совершения как вертикальных стоек, так и заглядываний в отверстия достоверно меньше аналогичного времени в группе НТГ-контроля (р = 0.041 и 0.037 соответственно). Это указывает на снижение ориентировочно-исследовательской активности животных, что согласуется с результатами работы Шнайдера (Schneider et al., 2014), в которой была показана тенденция к снижению ориентировочной активности у ТГ-мышей 5xFAD в возрасте 3 и 6 мес. В группе мышей, которой вводили мемантин в дозе 5 мг/кг, значительно меньше дистанция и скорость движения относительно НТГ-контрольных показателей (р = 0.0057 и 0.0062 соответственно). Это, возможно, свидетельствует о снижении спонтанной двигательной активности под влиянием мемантина, вероятно, в результате стрессовой ситуации при помещении в незнакомую обстановку. Также мыши, получавшие мемантин, совершают меньшее число вертикальных стоек, а продолжительность совершаемых ими стоек меньше таковой у НТГ-животных (р = 0.0156 и 0.0198 соответственно). Это свидетельствует о снижении ориентировочной активности из-за возможного повышения тревожности и отражается на двигательной активности. Однако в этой группе отмечается увеличение продолжительности заглядывания в отверстия относительно ТГ-контроля (р = 0.0301), что свидетельствует о сохранении определенной исследовательской активности, сравнимой с данными НТГ-контроля.
Под действием вещества СА-7043х у мышей наблюдается увеличение числа заглядываний в отверстия и продолжительности обследования норок по сравнению с аналогичными показателями у ТГ-животных (р = 0.0162 и 0.0087 соответственно), что свидетельствует о поддерживании исследовательской активности на уровне НТГ-контроля. При этом отмечается снижение времени совершения вертикальных стоек относительно такового в НТГ-контроле (р = 0.0156), что, возможно, свидетельствует о снижении ориентировочной активности.
В группе животных, получавших СА-7050х, не наблюдалось никаких изменений параметров относительно ТГ- и НТГ-контролей, на основании чего можно предположить, что двигательная активность, уровень тревожности и ориентировочно-исследовательская активность находятся на уровне таковых в НТГ-контроле (табл. 2).
Таблица 2.
Показатели двигательной активности, уровня тревожности и ориентировочной активности трансгенных мышей в возрасте 3/6 мес. в тесте “открытое поле”
| Показатели | НТГ-контроль, n = 10/9 |
ТГ-контроль, n = 10/6 |
Мемантин 5 мг/кг, n = 9/8 |
СА-7043х
0.01 мг/кг, n = 8/8 |
СА-7050х 0.01 мг/кг, n = 8/7 |
|---|---|---|---|---|---|
| Двигательная активность | |||||
| Дистанция движения, см | $\frac{{677.6 \pm 40.11}}{{542.7 \pm 52.77}}$ | $\frac{{592.8 \pm 65.71}}{{434.3 \pm 59.21}}$ | $\frac{{526 \pm 31.62{\text{*}}}}{{533.6 \pm 71.31}}$ | $\frac{{625.4 \pm 75.2}}{{497.8 \pm 63.78}}$ | $\frac{{727 \pm 74.52}}{{580.5 \pm 69.84}}$ |
| Скорость движения, см/с | $\frac{{3.7 \pm 0.22}}{{2.9 \pm 0.29}}$ | $\frac{{3.3 \pm 0.37}}{{2.4 \pm 0.33}}$ | $\frac{{2.9 \pm 0.18{\text{*}}}}{{2.9 \pm 0.4}}$ | $\frac{{3.4 \pm 0.42}}{{2.7 \pm 0.35}}$ | $\frac{{3.9 \pm 0.42}}{{3.2 \pm 0.38}}$ |
| Неподвижный момент, с | $\frac{{19.7 \pm 1.72}}{{28.4 \pm 4.02}}$ | $\frac{{21.1 \pm 2.8}}{{28 \pm 3.92}}$ | $\frac{{20.3 \pm 1.58}}{{24.3 \pm 3.43}}$ | $\frac{{22.1 \pm 3.49}}{{39.3 \pm 7.88}}$ | $\frac{{18.6 \pm 2.48}}{{25.3 \pm 4.98}}$ |
| Уровень тревожности | |||||
| Дистанция, см | |||||
| в периметре | $\frac{{348.8 \pm 35.92}}{{204.6 \pm 33.41}}$ | $\frac{{333.3 \pm 44.6}}{{195.1 \pm 31.58}}$ | $\frac{{286 \pm 45.67}}{{200.9 \pm 36.48}}$ | $\frac{{312.6 \pm 49.45}}{{232.1 \pm 24.98}}$ | $\frac{{380.5 \pm 29.35}}{{291.2 \pm 22.88}}$ |
| в центре | $\frac{{110.5 \pm 22.33}}{{156.4 \pm 19.45}}$ | $\frac{{91.9 \pm 21.98}}{{115.4 \pm 19.02}}$ | $\frac{{96.5 \pm 21.41}}{{150.7 \pm 19.09}}$ | $\frac{{120.9 \pm 13.39}}{{88.2 \pm {{{17.53}}^{{}}}}}$ | $\frac{{95.4 \pm 14.19}}{{100.1 \pm 17.48{\text{*}}}}$ |
| Время, с | |||||
| в периметре | $\frac{{133.4 \pm 6.69}}{{106 \pm 7.73}}$ | $\frac{{137.2 \pm 9.3}}{{107.5 \pm 13.53}}$ | $\frac{{132.3 \pm 8.1}}{{99.4 \pm 10.74}}$ | $\frac{{127 \pm 5.32}}{{132.3 \pm {{{7.66}}^{{}}}}}$ | $\frac{{140.8 \pm 4.78}}{{135.9 \pm {{{7.32}}^{{}}}}}$ |
| в центре | $\frac{{46.6 \pm 6.69}}{{74 \pm 7.73}}$ | $\frac{{42.8 \pm 9.30}}{{72.5 \pm 13.53}}$ | $\frac{{47.7 \pm 8.1}}{{80.6 \pm 10.74}}$ | $\frac{{53 \pm 5.32}}{{47.8 \pm {{{7.66}}^{{}}}}}$ | $\frac{{39.3 \pm 4.78}}{{44.1 \pm {{{7.32}}^{{}}}}}$ |
| Число посещений центра, шт. | $\frac{{13.9 \pm 2.27}}{{15.7 \pm 2.06}}$ | $\frac{{12.4 \pm 2.1}}{{13.2 \pm 2.34}}$ | $\frac{{13.2 \pm 1.66}}{{16.3 \pm 1.72}}$ | $\frac{{15.3 \pm 1.74}}{{13.6 \pm 1.71}}$ | $\frac{{14.9 \pm 2.16}}{{14.1 \pm 2.89}}$ |
| Показатели ориентировочно-исследовательской активности | |||||
| Время, с | |||||
| вертикальных cтоек | $\frac{{48.9 \pm 3.44}}{{29 \pm 5.03}}$ | $\frac{{35.8 \pm {{{4.56}}^{{}}}}}{{10.7 \pm 0.61}}$ | $\frac{{30.3 \pm {{{4.62}}^{{}}}}}{{18.9 \pm 4}}$ | $\frac{{34.4 \pm {{{4.55}}^{{}}}}}{{18.9 \pm 3.82}}$ | $\frac{{42.8 \pm 5.28}}{{21.3 \pm 2.14}}$ |
| норок | $\frac{{11.5 \pm 1.55}}{{13.7 \pm 2.39}}$ | $\frac{{6.4 \pm {{{0.93}}^{{}}}}}{{6.3 \pm 1.33}}$ | $\frac{{11.6 \pm {{{1.36}}^{\# }}}}{{10 \pm 2.37}}$ | $\frac{{13.5 \pm {{{1.56}}^{{\# \# }}}}}{{8.6 \pm 1.19}}$ | $\frac{{12.9 \pm 3.66}}{{7.9 \pm {{{1.35}}^{{\# \# }}}}}$ |
| Число, шт. | |||||
| вертикальных стоек | $\frac{{27 \pm 2.47}}{{16.4 \pm 3.11}}$ | $\frac{{22.3 \pm 2.72}}{{8.3 \pm 0.99}}$ | $\frac{{17.4 \pm 2.28*}}{{12.6 \pm 2.38}}$ | $\frac{{20.4 \pm {{{2.32}}^{\# }}}}{{12 \pm 2.35}}$ | $\frac{{25.5 \pm 2.62}}{{15 \pm {{{1.51}}^{{\# \# }}}}}$ |
| норок | $\frac{{10.2 \pm 1.25}}{{9.9 \pm 1.64}}$ | $\frac{{6.2 \pm 0.85}}{{5.2 \pm 1.08{\text{*}}}}$ | $\frac{{9.6 \pm 1.26}}{{7.5 \pm 1.72}}$ | $\frac{{11.9 \pm 1.47}}{{7.4 \pm 0.96}}$ | $\frac{{10.3 \pm 2.02}}{{7 \pm 1.29}}$ |
Таким образом, в возрасте 3 мес. у мышей ТГ-контроля отмечается снижение ориентировочно-исследовательской активности. В группе животных, которым вводили мемантин в дозе 5 мг/кг, регистрируется снижение двигательной и ориентировочной активностей, но сохраняется исследовательская активность. Под действием вещества СА-7043х наблюдается поддержание исследовательской реакции, но снижается ориентировочное поведение.
После 5 мес. введения соединений, в группе ТГ-контроля животные по-прежнему затрачивают меньше времени при выполнении вертикальных стоек, а также совершают меньше заглядываний в отверстия относительно НТГ-контроля (р = 0.0129 и 0.0376 соответственно). Эти данные свидетельствуют о продолжении снижения ориентировочно-исследовательской активности у ТГ-животных.
В группе мышей в возрасте 6 мес., получавших мемантин в дозе 5 мг/кг, наблюдалось восстановление двигательной и ориентировочной активностей до уровня токовых в НТГ-контроле, что, вероятно, может быть связано с нейропротекторным действием препарата на мышей.
Мыши, которым вводили СА-7043х, находились больше времени в периметре установки и меньше в центре относительно НТГ-контроля (р = 0.0267 и 0.0267 соответственно). Кроме этого мыши данной группы проходили меньшую дистанцию в центре открытого поля по сравнению с НТГ-мышами (р = 0.0206) (табл. 2).
При многократном введении СА-7050х отмечалось снижение времени нахождения мышей в центре (р = 0.0197) и повышение времени нахождения в периметре (р = 0.0197) установки, а также уменьшение дистанции движения в центре (р = 0.0418) по сравнению с аналогичными параметрами в НТГ-контроле. Исходя из этих данных можно сделать заключение о повышении тревожности под действием соединения СА-7050х, однако мыши данной группы совершали большее число стоек (р = = 0.0097) и находились в них более длительное время, чем в ТГ-контроле (р = 0.0032), что может свидетельствовать об ориентировочной активности животных на уровне НТГ-контроля (табл. 2). Следовательно, можно предположить, что нахождение животных в периметре установки все-таки связано не с повышением тревожности, а с затраченным временем на совершение вертикальных стоек (Масликова, 2009).
Таким образом, у мышей, получавших СА-7043х, наблюдалось уменьшение дистанции движения по сравнению с таковым у “диких” мышей, а в группе животных, которым вводили СА-7050х, отмечалось поддержание ориентировочной активности животных на уровне НТГ-контроля.
Изучение влияния соединений на изменение массы трансгенных животных. Мы регистрировали массу тела животных с первых дней введения соединений, само введение при этом началось с двухмесячного возраста животных. В группе ТГ-контроля отмечается отставание прироста массы тела начиная с 56-х сут введения по сравнению с таковым у НТГ-животных (у НТГ-мышей прирост на 56-е сут составил 21.8%, а у ТГ-мышей – 15.3%). При введении мемантина отставание в приросте массы тела наблюдалось с 70-х сут введения (у НТГ-контроля прирост на 70-е сут составил 23.9%, а у получавших мемантин – 16.3%). У мышей, получавших СА-7050х, регистрировалось замедление прироста массы тела также с 70-х сут введения (прирост на 70-е сут у СА-7050х – 16.5%), а в группе, которой вводили СА-7043х, прирост в массе тела был равен приросту, наблюдаемому в группе НТГ-контроля. Таким образом, отмечается замедление прироста массы тела животных в группах ТГ-контроля, с мемантином и СА-7050х в конце четвертого месяца жизни животных, чего не отмечается в группе с СА-7043х. Ранее было показано, что потеря массы у мышей 5xFAD начинается только с 9 мес. (Jawhar et al., 2010). Отсутствие отставания в приросте массы тела может свидетельствовать о том, что соединение СА-7043х положительно влияет на такой интегральный показатель, как изменение массы тела животного (рис. 4).
Рис. 4.
Изменение прироста массы тела (%) при пятисуточном введении соединений в течение 5 мес. 1–5 – НТГ-контроль, ТГ-контроль, мемантин (5 мг/кг), СА-7043х (0.01 мг/кг), СА-7050х (0.01 мг/кг) соответственно. #p < 0.05; ##p < 0.01 относительно ТГ-контроля; * p < 0.05, ** p < 0.01 относительно НТГ-контроля.
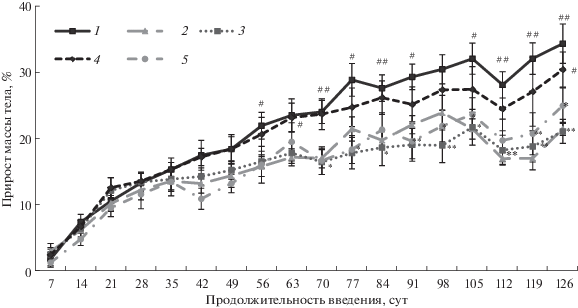
Выполненные исследования свидетельствуют о том, что фторсодержащие производные тетрагидрокарбазола СА-7043х и СА-7050х вызывают выраженный когнитивно-стимулирующий эффект у аутбредных мышей различных возрастных групп, но не оказывают нейропротекторного действия по поддержанию гиппокампзависимой памяти у трансгенных животных линии 5xFAD после долговременного введения в исследуемой дозе. Тем не менее в тесте “открытое поле” установлено положительное влияние на ориентировочную активность соединения СА-7050х, а другое производное сохраняет исследовательскую реакцию на уровне НТГ-контроля. СА-7043х способствует поддержанию прироста массы тела. Таким образом, исследуемые соединения можно рассматривать как перспективные ноотропные препараты.
Список литературы
Бачурин С.О. Медико-химические подходы к направленному поиску препаратов для лечения и предупреждения болезни Альцгеймера // Биомед. химия. 2001. Т. 47. № 2. С. 155–197.
Бачурин С.О., Соколов В.Б., Аксиненко А.Ю., Епишина Т.А., Горева Т.В., Габрельян А.В., Григорьев В.В. Молекулярное конструирование мультитаргетных нейропротекторов. Сообщение 1. Синтез и биологическая активность конъюгатов замещенных индолов и бис(диметиламино)фенотиазина // Изв. РАН. Сер. хим. 2015. № 6. С. 1354–1361.
Масликова Г.В., Буй Тхи, Минь Тху, Арльт А.В. Экспериментальное обоснование комбинированного применения натрия селенита и витамина Е при ишемии мозга, вызванной гравитационными перегрузками // Клин. фармакология и терапия. 2009. № 6. С. 279–281.
Николаева Н.С., Соколов В.Б., Аксиненко А.Ю., Овчинников Р.К., Бачурин С.О., Кинзирский А.С. Психотропная активность новых фторсодержащих производных тетрагидрокарбазолов // Бюл. эксперим. биологии и медицины. 2015. № 10. С. 455–459.
Соколов В.Б., Аксиненко А.Ю., Григорьев В.В., Бачурин С.О. Модификация биологически активных амидов и аминов фторсодержащими гетероциклами. Сообщение 8. γ-Карболины, модифицированные 2-(2-трифторметилимидазо[1,2-а]пиридин-6-ил)этильным фрагментом // Изв. РАН. Сер. хим. 2013. № 1. С. 200–202.
Соколов В.Б., Аксиненко А.Ю., Николаева Н.C., Григорьев В.В., Кинзирский А.С., Бачурин С.О. Модификация биологически активных амидов и аминов фторсодержащими гетероциклами. Сообщение 11. Тетрагидрокарбазолы, модифицированные 2-(5-фторпиридин-3-ил)этильным фрагментом // Изв. РАН. Сер. хим. 2014. № 5. С. 1137–1142.
Соколов В.Б., Аксиненко А.Ю., Епишина Т.А., Горева Т.В., Григорьев В.В., Габрельян А.В., Бачурин С.О. Синтез и биологическая активность N-замещенных тетрагидро-γ-карболинов, содержащих бис(диметиламино)-фенотиазиновый фрагмент // Изв. РАН. Сер. хим. 2015. № 3. С. 717–722.
Bachurin S.O., Shelkovnikova T.A., Ustyugov A.A., Peters O., Khritankova I., Afanasieva M.A., Tarasova T.V., Alentov I.I., Buchman V.L., Ninkina N.N. Dimebon slows progression of proteinopathy in gamma-synuclein transgenic mice // Neurotoxicol. Res. 2012. V. 22(1). P. 33–42.
Barker G.R., Warburton E.C. When is the hippocampus involved in recognition memory? // J. Neurosci. 2011. V. 31(29). P. 10721–10731.
Barker G.R., Warburton E.C. Object-in-place associative recognition memory depends on glutamate receptor neurotransmission within two defined hippocampal-cortical circuits: a critical role for AMPA and NMDA receptors in the hippocampus, perirhinal, and prefrontal cortices // Cereb. Cortex. 2015. V. 25(2). P. 472–481.
Boinpally R., Chen L., Zukin S.R., McClure N., Hofbauer R.K., Periclou A. A novel once-daily fixed-dose combination of Memantine extended release and Donepezil for the treatment of moderate to severe Alzheimer’s disease: two phase Istudies in healthy volunteers // Clin Drug Investig. 2015. V. 35(7). P. 427–435.
Carey A.N., Lyons A.M., Shay Ch.F., Dunton O., McLaughlin J.P. Endogenous kappa opioid activation mediates stress-induced deficits in learning and memory // J. Neurosci. 2009. V. 29(13). P. 4293–4300.
Clerici F., Vanacore N., Elia A., Spila-Alegiani S., Pomati S., Da Cas R., Raschetti R., Mariani C. Memantine in moderately-severe-to-severe Alzheimer’s disease: a postmarketing surveillance study // Drugs Aging. 2009. V. 26(4). P. 321–332.
Doody R.S., Gavrilova S.I., Sano M., Thomas R.G., Aisen P.S., Bachurin S.O., Hung D. Effect of dimebon on cognition, activities of daily living, behaviour, and global function in patients with mild-to-moderate Alzheimer’s disease: a randomised, double-blind, placebo-controlled study // Lancet. 2008. V. 372(9634). P. 207–215.
Eimer W.A., Vassar R. Neuron loss in the 5XFAD mouse model of Alzheimer’s disease correlates with intraneuronal Aβ42 accumulation and Caspase-3 activation // Mol. Neurodegener. 2013. V. 8. P. 1–12.
Ennaceur A. One-trial object recognition in rats and mice: methodological and theoretical issues // Behav. Brain Res. 2010. V. 215(2). P. 244–254.
Fu A.K., Hung K.W., Yuen M.Y., Zhou X., Mak D.S., Chan I.C., Cheung T.H., Zhang B., Fu W.Y., Liew F.Y., Ip N.Y. IL-33 ameliorates Alzheimer’s disease-like pathology and cognitive decline // Proc. Natl Acad. Sci. USA. 2016. V. 113(19). P. E2705–E2713.
Goozee K.G., Shah T.M., Sohrabi H.R., Rainey-Smith S.R., Brown B., Verdile G., Martins R.N. Examining the potential clinical value of curcumin in the prevention and diagnosis of Alzheimer’s disease // Br. J. Nutr. 2016. V. 115(3). P. 449–465.
Howard R., McShane R., Lindesay J., Ritchie C., Baldwin A., Barber R., Burns A., Dening T., Findlay D., Holmes C., Hughes A., Jacoby R., Jones R., Jones R., McKeith I., Macharouthu A., O’Brien J., Passmore P., Sheehan B., Juszczak E., Katona C., Hills R., Knapp M., Ballard C., Brown R., Banerjee S., Onions C., Griffin M., Adams J., Gray R., Johnson T., Bentham P., Phillips P. Donepezil and memantine for moderate-to-severe Alzheimer’s disease // N. Engl. J. Med. 2012. V. 366. P. 893–903.
Jawhar S., Trawicka A., Jenneckens C., Bayer T.A., Wirths O. Motor deficits, neuron loss, and reduced anxiety coinciding with axonal degeneration and intraneuronal Aβ aggregation in the 5XFAD mouse model of Alzheimer’s disease // Neurobiol. Aging. 2012. V. 33(1). P. 196.e29–196.e40.
Joyashiki E., Matsuya Y., Tohda C. Sominone improves memory impairments and increases axonal density in Alzheimer’s disease model mice, 5XFAD // Int. J. Neurosci. 2011. V. 121(4). P. 181–190.
Liu D.S., Pan X.D., Zhang J., Shen H., Collins N.C., Cole A.M., Koster K.P., Ben Aissa M., Dai X.M., Zhou M., Tai L.M., Zhu Y.G., La Du M., Chen X.C. APOE4 enhances age-dependent decline in cognitive function by down-regulating an NMDA receptor pathway in EFAD-Tg mice // Mol. Neurodegener. 2015. V. 10(7). P. 1–17.
Lonskaya I., Hebron M., Chen W., Schachter J., Moussa C. Tau deletion impairs intracellular β-amyloid-42 clearance and leads to more extracellular plaque deposition in gene transfer models // Mol. Neurodegener. 2014. V. 9(46). P. 1–16
Malatynska E., Steinbusch H.W., Redkozubova O., Bolkunov A., Kubatiev A., Yeritsyan N.B., Vignisse J., Bachurin S., Strekalova T. Anhedonic-like traits and lack of affective deficits in 18-month-old C57BL/6 mice: Implications for modeling elderly depression // Exp. Gerontol. 2012. V. 47(8). P. 552–564.
Mancuso C., Siciliano R., Barone E., Butterfield D.A., Preziosi P. Pharmacologists and Alzheimer disease therapy: to boldly go where no scientist has gone before // Exp. Opin. Investig. Drugs. 2011. V. 20(9). P. 1243–1261.
Nirogi R.V., Konda J.B., Kambhampati R., Shinde A., Bandyala T.R., Gudla P., Kandukuri K.K., Jayarajan P., Kandikere V., Dubey P.K. N,N-Dimethyl-[9-(arylsulfonyl)-2,3,4,9-tetrahydro-1H-carbazol-3-yl]amines as novel, potent and selective 5-HT6 receptor antagonists // Bioorg. Med. Chem. Lett. 2012. V. 22(22). P. 6980–6985.
Oakley H., Cole S.L., Logan S., Maus E., Shao P., Guillozet-Bongaarts A., Ohno M., Disterhoft J., Van Eldik L., Berry R., Vassar R. Intraneuronal beta-amyloid aggregates, neurodegeneration, and neuron loss in transgenic mice with five familial Alzheimer’s disease mutations: potential factors in amyloid plaque formation // J. Neurosci. 2006. V. 26. P. 10129–10140.
Ohno M., Cole S.L., Yasvoina M., Zhao J., Citron M., Berry R., Disterhoft J.F., Vassar R. BACE1 gene deletion prevents neuron loss and memory deficits in 5XFAD APP/PS1 transgenic mice // Neurobiol. Dis. 2007. V. 26(1). P. 134–145.
Peters O.M., Connor-Robson N., Sokolov V.B., Aksinenko A.Yu., Kukharsky M.S., Bachurin S.O., Ninkina N.N., Buchman V.L. Chronic administration of Dimebon ameliorates pathology in TauP301S transgenic mice // J. Alzheimer’s Dis. 2013. V. 33(3). P. 1041–1049.
Pieper A.A., Xie S., Capota E., Estill S.J., Zhong J., Long J.M., Becker G.L., Huntington P., Goldman S.E., Shen C.H., Capota M., Britt J.K., Kotti T., Ure K., Brat D.J., Williams N.S., MacMillan K.S., Naidoo J., Melito L., Hsieh J., De Brabander J., Ready J.M., McKnight S.L. Discovery of a proneurogenic, neuroprotective chemical // Cell. 2010. V. 142(1). P. 39–51.
Réus G.Z., Valvassori S.S., Machado R.A., Martins M.R., Gavioli E.C., Quevedo J. Acute treatment with low doses of memantine does not impair aversive, non-associative and recognition memory in rats // Naunyn–Schmiedeberg’s Arch. Pharmacol. 2008. V. 376(5). P. 295–300.
Schneider F., Baldauf K., Wetzel W., Reymann K.G. Behavioral and EEG changes in male 5xFAD mice // Physiol. Behav. 2014. V. 135. P. 25–33.
Shukla V., Zheng Y.L., Mishra S.K., Amin N.D., Steiner J., Grant P., Kesavapany S., Pant H.C. A truncated peptide from p35, a Cdk5 activator, prevents Alzheimer’s disease phenotypes in model mice // FASEB J. 2013. V. 27(1). P. 174–186.
Sonkusare S.K., Kaul C.L., Ramarao P. Dementia of Alzheimer’s disease and other neurodegenerative disorders-memantine, a new hope // Pharmacol. Res. 2005. V. 1(1). P. 1–17.
Tu Q., Zou Y., Zhang M., Cao Y., Yang W., Yu W., Lü Y. Application status of memantine in patients with dementia in the Chongqing area of Southwest China // JCGG. 2015. V. 6(3). P. 85–88.
Ustyugov A.A., Shelkovnikova T.A., Kokhan V.S., Khritankova I.V., Peters O., Buchman V.L., Bachurin S.O., Ninkina N.N. Dimebon reduces the levels of aggregated amyloidogenic protein forms in detergent-insoluble fractions in vivo // Bull. Exp. Biol. Med. 2012. V. 152(6). P. 731–733.
Vignisse J., Steinbusch H.W., Bolkunov A., Nunes J., Santos A.I., Grandfils C., Bachurin S., Strekalova T. Dimebon enhances hippocampus-dependent learning in both appetitive and inhibitory memory tasks in mice // Prog. Neuropsychopharmacol. Biol. Psychiatry. 2011. V. 35(2). P. 510–522.
Wirths O., Erck C., Martens H., Harmeier A., Geumann C., Jawhar S., Kumar S., Multhaup G., Walter J., Ingelsson M., Degerman-Gunnarsson M., Kalimo H., Huitinga I., Lannfelt L., Bayer T.A. Identification of low molecular weight pyroglutamate Aβ oligomers in Alzheimer’s disease: a novel tool for therapy and diagnosis // J. Biol. Chem. 2010. V. 285(53). P. 41517–41524.
Zhang S., Hedskog L., Petersen C.A., Winblad B., Ankarcrona M. Dimebon (latrepirdine) enhances mitochondrial function and protects neuronal cells from death // J. Alzheimers Dis. 2010. V. 21(2). P. 389–402.
Zhu D., Chen M., Li M., Luo B., Zhao Y., Huang P., Xue F., Rapposelli S., Pi R., Wen S. Discovery of novel N-substituted carbazoles as neuroprotective agents with potent anti-oxidative activity // Eur. J. Med. Chem. 2013. V. 68. P. 81–88.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


