Известия РАН. Серия биологическая, 2019, № 3, стр. 236-245
Экспрессия и функциональная характеристика генов у картофельной цистообразующей нематоды Globodera rostochiensis Woll. на различных этапах жизненного цикла
В. В. Займль-Бухингер 1, *, Е. М. Матвеева 1
1 Институт биологии КарНЦ РАН, ФИЦ “Карельский научный центр РАН”
185910 Петрозаводск, ул. Пушкинская, 11, Россия
* E-mail: victoria.v.lavrova@gmail.com
Поступила в редакцию 17.01.2017
После доработки 28.06.2018
Принята к публикации 28.06.2018
Аннотация
Проведено исследование экспрессии генов Ams-1, Pel-1, Eng-1.4, Cle, VAP-1, SPRYSEC-1, Tpx и Gpx у личинок Globodera rostochiensis на ранних этапах жизненного цикла. Отмечено, что у личинок, находящихся внутри цисты, низкая активность генов. Установлено, что переход к активной жизнедеятельности сопровождается активацией транскриптома. Обнаружено, что, когда в роли хозяина выступают восприимчивые растения, характеризующиеся медленным формированием защитных реакций, у личинок повышается экспрессия генов в зависимости от стадии развития, что обеспечивает успешное прохождение жизненного цикла нематоды. В случае растений, обработанных в предынвазионный период кратковременными снижениями температуры (ДРОП-обработка), у личинок отмечена сниженная транскрипция генов, что может приводить к подавлению развития нематоды.
Картофельная цистообразующая нематода Globodera rostochiensis Woll. – облигатный седентарный эндопаразит корневой системы растений семейства Solanacea. Нематода проходила длительную сопряженную эволюцию с дикими клубненосными видами картофеля в Южной Америке, в результате которой приобрела специализацию к данному виду растения. В настоящее время G. rostochiensis, широко распространенная в зонах картофелеводства многих стран, в том числе Российской Федерации, – объект внешнего карантина (PM 7/40…, 2017).
Жизненный цикл G. rostochiensis включает в себя стадию цисты (жесткая темноокрашенная кутикула мертвой самки, заполненная личинками I возраста (J1)), проходящую в почве, и паразитическую стадию в корнях растений, обеспечивающих оптимальные условия для питания, прохождения всех этапов развития (J2, J3, J4, самки и самцы) и размножения (Lilley et al., 2005). Особую роль в жизнедеятельности нематоды играют ранние этапы жизненного цикла, к которым относятся процесс вылупления личинок из яиц и массовый их выход из цист под влиянием факторов вылупления, присутствующих в корневых выделениях (диффузатах) растения-хозяина; проникновение личинок в корни хозяина и формирование на перецикле проводящей системы синцития – гипертрофированного многоядерного клеточного комплекса, обеспечивающего непрерывное поступление питательных веществ от хозяина к паразиту. Именно в этот период происходит становление характера отношений с хозяином (совместимые/несовместимые), а это ключевой момент в определении возможности дальнейшего развития паразита. Успешность прохождения ранних этапов зависит от многих факторов, среди которых основные – характер транскрипции генов у личинок нематоды и степень активности иммунитета хозяина.
Транскриптомный профиль фитопаразитических нематод меняется в зависимости от этапа жизненного цикла паразита (Palomares-Rius et al., 2012; Beneventi et al., 2013; Cotton et al., 2014). Так, выделяют несколько групп генов. Первая группа генов кодирует белки с сенсорной функцией – нахождение корней растения-хозяина. Вторая группа – гены, принимающие участие в деградации и модификации клеточных стенок растений для успешного внедрения и достижения центральной проводящей системы. Третья группа – гены, ответственные за репрограммирование клеточной специализации и метаболизма растений в целях формирования синцития. Особое значение имеют гены, вовлеченные, с одной стороны, в подавление иммунных реакций хозяина, с другой – в защиту личинок от окислительного стресса, возникающего в корнях в ходе паразитирования. Следует отметить, что, несмотря на современные исследования в области транскриптома фитопаразитических нематод, сведения об экспрессии генов носят фрагментарный характер, в результате чего отсутствует целостное представление о молекулярных событиях, происходящих при становлении отношений паразит–хозяин.
Успешное проникновение нематоды в организм растения и установление с ним совместимых взаимоотношений во многом зависят также от степени активности иммунитета хозяина – сложной и многоуровневой системы защитных процессов. У растений, обладающих природной (генетической) устойчивостью к нематоде, отмечается быстрое формирование каскада защитных реакций, среди которых ключевая – реакция сверхчувствительности – локальная гибель растительных клеток в области проникновения личинок, сопровождающаяся накоплением в них защитных соединений (PR-белки, фитоалексины) и приводящая к ограничению доступа паразита к питанию, а следовательно к подавлению его развития (Robinson et al., 1988; Bleve-Zacheo et al., 1990; Kombrink, Schmelzer, 2001). Восприимчивые растения характеризуются медленными процессами активации защиты при заражении, включая формирование обширных некрозов по всей корневой системе, не связанных с местом внедрения личинок (Giebel, 1974; Sheridan et al., 2004). Однако они могут обладать иммунным потенциалом, который реализуется при определенных условиях. Такие стимулирующие условия могут быть созданы различного рода экзогенными обработками, под влиянием которых изменяется направленность физиолого-биохимических процессов. Это может повлечь за собой модуляцию метаболических и иммунных реакций и в конечном итоге повлиять на характер отношений паразит–хозяин, а значит на процесс развития паразита.
На протяжении нескольких лет авторами проводятся исследования влияния часто встречающихся в природе и в условиях защищенного грунта кратковременных (часовых) ежесуточно повторяющихся действий низких положительных закаливающих температур (получивших название ДРОП, от англ. drop – падение) на физиологический и иммунный статус растений картофеля как перспективный подход к формированию индуцированной устойчивости к G. rostochiensis. Вопрос о действии переменных температур на растения актуален в связи с учащающимися перепадами температур, которые могут модулировать в значительной степени характер биотических взаимоотношений – изменить иммунный статус (восприимчивость/устойчивость) растений и степень агрессивности паразитов (вирулентность/авирулентность) (Lee et al., 2008). Установленные изменения физиологического (Сысоева и др., 2011, 2013; Лаврова и др., 2012, 2014) и иммунного (Лаврова и др., 2015, 2017) статусов растений картофеля, вызванные ДРОП-обработкой, позволяют своевременно активировать адекватную систему защиты при заражении и формировать несовместимый характер взаимоотношений с нематодой. На основе полученных результатов было выдвинуто предположение о создании в организме хозяина под действием переменных температур неблагоприятных условий для развития паразита. При этом вопрос о том, что происходит с личинками нематоды при развитии в корнях растений, обладающих индуцированной устойчивостью, остается неизученным.
Цель исследования – определение накопления транскриптов ключевых для жизнедеятельности нематоды генов на ранних этапах жизненного цикла в зависимости от типа отношений паразит–хозяин (совместимые/несовместимые).
МАТЕРИАЛЫ И МЕТОДЫ
Исследование уровня экспрессии генов G. rostochiensis проводилось на ранних стадиях онтогенеза: стадия цисты – стартовая точка жизнедеятельности нематоды, в которой находятся яйца с личинками I возраста (J1); стадия вылупившихся из яиц и вышедших из цист личинок II возраста (J2); паразитическая стадия, когда личинки проникают в корни растения и формируют синцитий. В соответствии с вышеуказанными этапами жизненного цикла G. rostochiensis схема эксперимента состояла из трех частей:
во-первых, изучения транскрипции генов у нематоды на стадии цисты. Цисты G. rostochiensis (патотип Ro1) получены путем культивирования локальной (Республика Карелия) полевой популяции в лабораторных условиях. Часть цист (n = 30) данной популяции зафиксировали в жидком азоте для проведения в дальнейшем молекулярного анализа, а часть использовали на последующих этапах эксперимента;
во-вторых, изучения транскрипции генов у личинок, вылупившихся из яиц и вышедших из цист. Для моделирования ситуации, когда цисты находятся в почве и подвергаются действию корневых диффузатов растения-хозяина, был поставлен эксперимент в лабораторных условиях. Перед началом эксперимента провели сбор корневых диффузатов с вегетирующих растений картофеля (сорт Невский, восприимчивый к G. rostochiensis) следующих вариантов: контрольные растения – растения, выращенные при оптимальных температурных условиях (23°С) без обработок, и ДРОП-обработанные растения (двухнедельные растения, обработанные в течение 6 сут ежесуточными снижениями температуры от 23°С до 5°С). Сбор корневых диффузатов проводили в течение 4–6 нед после посадки в грунт.
Эксперимент по вылуплению личинок проводили по стандартной методике (Мяги, 1974) – в дисках из органического стекла, в которые помещали цисты (взятые из первой части эксперимента) и добавляли корневые диффузаты контрольных или ДРОП-обработанных растений. Диски выдерживали во влажной камере при комнатной температуре. В каждом варианте использовали по 1 цисте/на диск в 10-кратной повторности. Вылупившихся личинок (n = 150) собирали, концентрировали в пробирке и фиксировали в жидком азоте для проведения в дальнейшем молекулярного анализа;
в-третьих, изучения транскрипции генов у личинок на стадии паразитирования в корнях растения-хозяина. Эксперимент провели в камере искусственного климата по следующей схеме: пророщенные на свету мини-клубни (сорт Невский, восприимчивый к G. rostochiensis, получен в ООО “Агроцентр Коренево”) высаживали в пластиковые сосуды со стерильным песком и выращивали в оптимальных условиях: при 23°С, фотопериоде (день/ночь) 16/8 ч, освещенности 10 клк и поливе питательным раствором с добавлением микроэлементов (рН 5.5–5.6) в течение 2 нед. Далее часть растений оставляли при 23°С (контрольный вариант, n = 10), а часть подвергали в течение 6 сут воздействию переменных температур, которое включало в себя ежесуточное снижение температуры от 23°С до 5°С на 2 ч в конце ночного периода (вариант ДРОП, n = 10). На следующий день после завершения температурных обработок растения всех вариантов заражали нематодой путем внесения цист в прикорневую зону и далее выращивали в камере искусственного климата в оптимальных для растений условиях в течение 7 нед. Для заражения использовали цисты из первой части эксперимента, которые были предварительно выдержаны в корневых диффузатах контрольных или ДРОП-обработанных растений, что отражает ситуацию второй части эксперимента. Доза заражения составляла 10 цист/раст.
На 10-е сут заражения личинок нематоды выделяли из корней растений в целях проведения молекулярного анализа. Данный период включает в себя процессы распознавания растением эффекторных молекул паразита, запуск сигнального каскада, формирование личинками нематоды синцития. Для экстракции личинок корни растений нарезали длиной ~1 см и измельчали с помощью блендера. Личинок отделяли от дебриса путем просеивания и центрифугирования в 35%-ном растворе сахарозы при 1000 об./мин в течение 5 мин (Smant et al., 1997). Выделенных личинок (n = 150) собирали, концентрировали в пробирке и фиксировали в жидком азоте.
Анализ уровня экспрессии генов у личинок нематоды, зафиксированных в жидком азоте, был проведен в ходе выполнения каждой части эксперимента. Внимание было сосредоточено на ключевых генах, необходимых для прохождения ранних этапов жизненного цикла G. rostochiensis: ген Ams-1 (кодирует сенсорный белок, принимающий участие в нахождении корней хозяина), гены Pel-1 и Eng-1,4 (кодируют пектатлиазу и 1,4-β-эндоглюканазу соответственно, функция которых заключается в разрушении клеточных стенок для проникновения личинок в корни хозяина), гены VAP-1 и SPRYSEC-1 (кодируют белки, ответственные за подавление иммунных реакций хозяина), ген Cle (кодирует белок, участвующий в формировании синцития), гены Tpx и Gpx (кодируют тиоредоксинпероксидазу и глутатионпероксидазу соответственно, участвующих в защите личинок от иммунных реакций хозяина).
Тотальную РНК (тотРНК) выделяли с помощью набора Extract RNA (Евроген, Россия). Количество и качество тотРНК определяли методом капиллярного электрофореза в системе Experion (Bio-Rad, США). ТотРНК обрабатывали ДНКазой (1 единица активности, е.а.) (Синтол, Россия). Первую цепь кДНК синтезировали с использованием набора для обратной транскрипции с MMLV-ревертазой и случайными гексапраймерами (Евроген). Количество и качество выделенной кДНК определяли спектрофотометрически на приборе SmartSpec Plus (Bio-Rad). Экспрессию генов оценивали с помощью полимеразной цепной реакции (ПЦР) в режиме реального времени на приборе iCycler с оптической приставкой iQ5 (Bio-Rad) с использованием набора для амплификации с интеркалирующим красителем SYBR Green (Синтол). Смесь для ПЦР объемом 25 мкл содержала 1 мкл кДНК (100 нг), 5 мкл реакционной смеси, по 1 пкМ прямого и обратного праймеров, 1 мкл MgCl2 и 16 мкл деионизованной воды, свободной от нуклеаз. Протокол ПЦР: денатурация кДНК 5 мин при 95°С; далее 40 циклов: денатурация 30 с при 95°С; отжиг 30 с при 58°С; элонгация 30 с при 72°С. Специфичность продуктов амплификации проверяли плавлением ПЦР-фрагментов. Эффективность ПЦР (98%) оценивали по стандартной кривой. Относительный уровень экспрессии генов вычисляли по формуле 2ΔCt, где ΔCt – разница значений пороговых циклов для референсного и исследуемого генов. В качестве референсного гена использовали актин.
Праймеры для проведения ПЦР представлены в табл. 1 и конструировались c использованием программы Primer3 (http://primer3plus.com). Синтез праймеров осуществляла фирма “Евроген”.
Таблица 1.
Праймеры для проведения ПЦР в режиме реального времени
| Ген | Праймер | Нуклеотидная последовательность (5' → 3') |
|---|---|---|
| Ams-1 | Прямой | tacaagatgccagcgagaaag |
| Обратный | cttaacttccgtttcgaccg | |
| Pel-1 | Прямой | tgatgtgaagaacggcaaga |
| Обратный | attagttgtgaggaccgaacc | |
| Eng-1.4 | Прямой | gtggccgaccatgataagaa |
| Обратный | gattaagaccgttaagacggc | |
| VAP1 | Прямой | cagtggctgctcagattaca |
| Обратный | attacaacgaataccgctcct | |
| SPRYSEC-1 | Прямой | gcgcaaagcgtatcgtaatg |
| Обратный | tcttcacttccgatgcgtatg | |
| Cle | Прямой | tgttctcgctctcgcattt |
| Обратный | ctttccagcctgctcaaca | |
| Tpx | Прямой | acggagtgttgatggaagaag |
| Обратный | gtctagtggtagttgctaaacg | |
| Gpx | Прямой | aataccaacccggtcctaaac |
| Обратный | aactccacctatgcaacctac | |
| Actin | Прямой | ccgtccacgatgaagatcaag |
| Обратный | gacaggtggaaggtcgttta |
Исследования выполнены на научном оборудовании Центра коллективного пользования Федерального исследовательского центра “Карельский научный центр Российской академии наук”. На рис. 1 приведены средние арифметические значения и их стандартные ошибки. Данные обработаны статистически с использованием пакета программ Statgraphics for Windows 7.0.
Рис. 1.
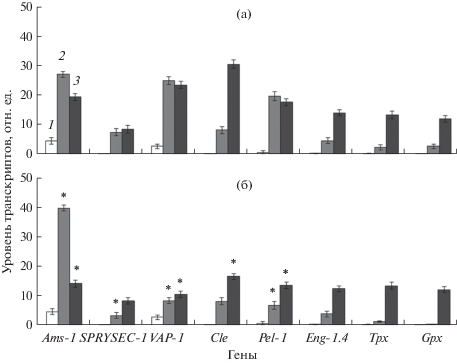
Уровень накопления транскриптов генов Ams-1, Pel-1, Eng-1.4, Cle, VAP-1, SPRYSEC-1, Tpx и Gpx у личинок G. rostochiensis на стадии цисты (1), на стадиях вылупления (2) и паразитирования (3) в корнях контрольных (восприимчивых) (а) и ДРОП-обработанных (б) растений. * – статистически достоверное отличие от контроля (Р ≤ 0.05).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Показано, что личинки G. rostochiensis на стадии цисты обладают активными генами Ams-1 и VAP-1, транскрипция которых проходит на низком уровне. В то же время гены SPRYSEC-1, Cle, Pel-1, Eng-1.4, Tpx и Gpx практически неактивны (рис. 1).
При переходе к стадии вылупления и далее к стадии паразитирования в корнях хозяина были отмечены изменения в экспрессии генов Ams-1, Pel-1, Eng-1.4, Cle, VAP-1, SPRYSEC-1, Tpx и Gpx. При этом характер транскрипции различался в зависимости от восприимчивости/устойчивости растения, т.е. степени активности фитоиммунитета хозяина.
У личинок, вылупившихся под действием корневых диффузатов контрольных растений, отмечена общая тенденция к активации транскрипции всех исследуемых генов (рис. 1а). Однако следует отметить разные уровни накопления транскриптов среди генов. Наиболее высокое содержание мРНК было отмечено у генов Ams-1, VAP-1 и Pel-1, экспрессия которых повысилась практически в 5 раз по сравнению со стадией цисты. Повышение уровня экспрессии было установлено также для генов Eng-1.4, Cle, SPRYSEC-1, Tpx и Gpx, но в гораздо меньшей степени (рис. 1а). В период, когда вылупившиеся личинки переходят на стадию паразитирования в корнях контрольных растений, было отмечено изменение в характере экспрессии генов. Так, уровень активности гена Ams-1, пик экспрессии которого отмечен на стадии вылупившихся личинок, в паразитический период снижался. На данном этапе установлено значительное усиление транскрипции генов Cle, Eng-1.4, Tpx и Gpx. Для генов VAP-1 и Pel-1 отмечено поддержание экспрессии на высоком уровне, сопоставимом с таковым на стадии вылупившихся личинок. Активность гена SPRYSEC-1 поддерживалась на том же уровне, что и на стадии вылупившихся личинок, но при этом данный ген имел самый низкий уровень экспрессии среди исследованных генов (рис. 1а).
Динамика экспрессии генов у личинок на этапах вылупления и паразитирования в корнях ДРОП-обработанных растений сходна с таковой у личинок контрольного варианта, т.е. установлена общая тенденция к повышению активности генов при переходе паразита к активной жизнедеятельности (рис. 1б). Однако были выявлены различия в накоплении транскриптов генов. Так, у вылупившихся личинок под действием корневых диффузатов ДРОП-обработанных растений были обнаружены более высокая активность гена Ams-1 и низкий уровень экспрессии генов Pel-1, Eng-1.4, VAP-1, SPRYSEC-1, Tpx и Gpx по сравнению с вылупившимися личинками контрольного варианта. Наиболее ярко различия в содержании транскриптов проявились в отношении генов Ams-1, VAP-1 и Pel-1. Уровень экспрессии гена Cle был сопоставим с контролем (рис. 1б). При переходе к паразитированию в корнях ДРОП-обработанных растений личинки характеризовались повышением активности генов SPRYSEC-1, Cle, Pel-1, Eng-1.4, Tpx и Gpx. Следует отметить, что уровень экспрессии генов SPRYSEC-1, Eng-1.4, Tpx и Gpx достигал уровня активности генов контрольных личинок, тогда как уровень транскрипции генов VAP-1, Cle, Pel-1 был значительно ниже по сравнению с контролем, несмотря на тенденцию к повышению экспрессии в целом. Для гена Ams-1 показано значительное снижение активности (рис. 1б).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
G. rostochiensis – узкоспециализированный облигатный эндопаразит, успешное развитие которого во многом зависит от характера событий, происходящих на ранних этапах жизненного цикла. От того, насколько личинки нематоды смогли успешно пройти начальные стадии становления отношений паразит–хозяин (вылупление личинок, нахождение растения-хозяина, проникновение в корни и формирование в них синцитий), зависит последующий период их паразитирования, связанный с прохождением основных этапов развития (J2, J3, J4, самки и самцы) и реализацией репродуктивного потенциала. Исследование активностей генов у нематоды в разные периоды жизненного цикла вносит вклад в понимание молекулярных механизмов взаимодействия паразита с хозяином, а соответственно, роли растения в развитии нематоды. Наше внимание сосредоточено на изучении характера экспрессии ключевых в жизнедеятельности G. rostochiensis генов на ранних этапах жизненного цикла в зависимости от степени активности фитоиммунитета, в случае когда в качестве хозяина выступают контрольные (восприимчивые) растения или ДРОП-обработанные растения (растения, обладающие индуцированной устойчивостью).
Результаты исследования показали, что экспрессия генов у G. rostochiensis определяется этапом жизненного цикла и во многом зависит от восприимчивости/устойчивости хозяина.
Онтогенез G. rostochiensis начинается со стадии цисты, основное предназначение которой – защита личинок от действия неблагоприятных факторов окружающей среды до момента появления корней растения-хозяина. В ходе проведенного исследования установлено, что у личинок на стадии цисты отсутствует транскрипция большинства изученных генов (SPRYSEC-1, Cle, Pel-1, Eng-1.4, Tpx и Gpx) на фоне низкой экспрессии генов Ams-1 и VAP-1. Это, вероятно, связано с тем, что в этот период личинки находятся в состоянии диапаузы (покоя) – пассивного периода жизненного цикла, характеризующегося пониженным уровнем жизнедеятельности и не требующего значительной активности изученных генов.
Переход личинок из состояния диапаузы в состояние активной жизнедеятельности (вылупление личинок) индуцируется сочетанием действия благоприятных абиотических факторов (температура и влажность почвы) и присутствия в почве корневых диффузатов растения-хозяина, содержащих специфические вещества, известные как факторы вылупления (Byrne et al., 2001). Результаты проведенного исследования показали, что процесс вылупления личинок сопровождается активацией генов SPRYSEC-1, Cle, Pel-1, Eng-1.4, Ams-1, VAP-1, Tpx и Gpx. Однако накопление их транскриптов зависело от того, какие растения выступали в качестве хозяина – контрольные или ДРОП-обработанные. Так, было показано, что личинки, которые прошли процесс вылупления в корневых диффузатах контрольных (восприимчивых) растений, обладают высокой экспрессией генов Ams-1, VAP-1 и Pel-1, что связано с функциями, которые выполняют продукты данных генов в этот период. После выхода из цист личинки II возраста (J2), для которых характерна активная работа сенсорных органов и субвентральной железы, находятся в поиске корней растения-хозяина. Основные хеморецепторные органы нематод – амфиды, расположенные симметрично в головном отделе. С помощью секретируемых амфидами белков личинки улавливают химические сигналы, поступающие от диффузатов корней растения, и распознают подходящего для развития хозяина (Bird, 1992; Bird et al., 2002; Chen et al., 2005; Зиновьева и др., 2012). Один из сенсорных белков, выделяемых амфидами у G. Rostochiensis, – Ams, кодируемый соответствующим геном Ams-1 (Chen et al., 2005). Секреты субвентральной железы имеют значение в процессе инвазии растений. Для проникновения в корень личинки выделяют ферменты, способствующие деградации клеточной стенки растений. К таким ферментам у личинок G. rostochiensis относятся 1,4-β-эндоглюканазы (целлюлазы) и пектатлиазы, кодируемые генами Eng-1.4 и Pel-1 соответственно (Jones et al., 1994). Таким образом, повышенная активность генов Ams-1 и Pel-1 позволяет личинкам находить хозяина и проникать в его корни, что в совокупности с высокой экспрессией VAP-1, связанного с подавлением иммунных реакций хозяина, определяет один из ключевых моментов успешного паразитирования нематоды в организме хозяина.
Личинки, вылупившиеся в корневых диффузатах ДРОП-обработанных растений, характеризуются активацией генов SPRYSEC-1, Cle, Pel-1, Eng-1.4, Ams-1, VAP-1, Tpx и Gpx. Однако в отличие от контроля не выявлены гены, которые выделялись бы ярко выраженным высоким накоплением транскриптов, т.е. экспрессии всех исследуемых генов на данной стадии в целом сходны. Исключение составил ген Ams-1, уровень экспрессии которого в 2 раза выше такового у личинок контрольного варианта. Полученные результаты свидетельствуют о более активном накоплении мРНК сенсорного белка, необходимого личинкам в процессе поиска корней растения-хозяина на фоне сниженной возможности и/или интенсивности процесса проникновения в корни (пониженной экспрессией генов Eng-1.4 и Pel-1).
Установленные различия в интенсивности экспрессии генов у вылупившихся личинок могут быть связаны с особенностями корневых диффузатов контрольных и ДРОП-обработанных растений. Известно, что как качественный состав корневых диффузатов (присутствие тех или иных факторов вылупления, ингибиторов вылупления, ионный состав), так и количественное соотношение факторов вылупления в диффузатах во многом определяют характер (индукция или ингибирование) вылупления личинок. В частности, присутствие альфа-соланина в корневых выделениях в низких концентрациях способствует более активному вылуплению личинок, тогда как высокое содержание вызывает противоположный эффект – ингибирование (Byrne et al., 1998). Качественный и количественный составы корневых диффузатов зависят от физиологического состояния растительного организма и стадии его развития. Ранее проведенные исследования (Марковская и др., 2009; Лаврова и др., 2011, 2012) показали, что ДРОП-обработка растений вызывает значительные количественные изменения в углеводном и липидном составах, а также изменения на уровне транскриптома. На основании этих данных можно предположить, что под влиянием низкотемпературного воздействия изменяется качественный состав корневых диффузатов растений либо меняется соотношение концентраций отдельных компонентов (ингибиторов и факторов вылупления) в корневых выделениях картофеля, что могло повлиять на характер процесса вылупления, а соответственно на молекулярные события (экспрессия генов) у личинок нематоды.
Следующий этап жизненного цикла G. rostochiensis связан с паразитированием личинок в корнях растения-хозяина: личинки проникают в корни, достигают проводящей системы растений и формируют синцитий. Это важный момент для дальнейшей жизнедеятельности нематоды, так как качество питания определяет успешность развития самок и реализацию в дальнейшем их репродуктивного потенциала. На данном этапе исследовался характер экспрессии генов у личинок, вылупившихся в корневых диффузатах и перешедших к паразитизму в корнях контрольных растений, и у личинок, вылупившихся в корневых диффузатах и паразитирующих в корнях ДРОП-обработанных растений. Результаты исследования выявили различия в характере экспрессии генов. Так, после внедрения в корни контрольных растений личинки нематоды характеризуются снижением экспрессии гена Ams-1, что связано с отсутствием необходимости в его продукте (сенсорный белок) на данном этапе. В то же время сохраняется высокая транскрипционная активность генов Pel-1 и Eng-1.4, что позволяет личинкам перемещаться между растительными клетками.
По мере достижения проводящей системы корней личинка на перецикле индуцирует образование синцития, представляющего собой гипертрофированный многоядерный клеточный комплекс, предназначенный для оттока ассимилятов от растения к паразиту в целях обеспечения его питательными веществами на протяжении всех последующих этапов развития, вплоть до формирования взрослой репродуктивной особи (Jones, 1981). В образовании синцития принимают участие секреторные белки дорсальной пищеводной железы нематоды. На данном этапе показано значительное повышение экспрессии гена Cle, кодирующего соответствующий белок, который участвует в формировании синцития. Функция этого белка подобна функции растительного белка CLAVA3, относящихся к семейству CLE-белков, – регуляция деления и дифференциации клеток меристемы. Таким образом, нематодный CLE-белок мимикрирует под растительный, что позволяет ему связываться с рецепторами растений и вызывать естественный сигнал для формирования синцития без активации защитных реакций со стороны растения (Wang et al., 2005).
Кроме того, личинки на этапе паразитирования в корнях восприимчивого растения-хозяина характеризуются довольно высокой экспрессией генов SPRYSEC-1, VAP-1, Tpx и Gpx. Продукты генов SPRYSEC-1 и VAP-1 участвуют в подавлении иммунных реакций хозяина. Ген SPRYSEC-1 кодирует белок, который взаимодействует с СС-областью рецепторов растений (R-белков), ответственных за распознавание эффекторных молекул паразита, выделяемых в растительную ткань в процессе инвазии. Такое связывание приводит к ингибированию активности рецептора, и растение, соответственно, не способно распознавать внедрение личинок и активировать реакцию сверхчувствительности (Copper, Eleftherianos, 2016). В сходном направлении действует ген VAP-1 (venom allergen-like gene), который кодирует белок, блокирующий сигналинг от рецепторов (R-белков) в геном, тем самым препятствуя запуску иммунных реакций растений (Copper, Eleftherianos, 2016). В защите личинок от иммунных реакций хозяина принимают участие гены Tpx и Gpx. Они кодируют тиоредоксинпероксидазу и глутатионпероксидазу соответственно. Данные ферменты участвуют в защите личинок от окислительного повреждения путем разрушения перекисей, возникающих в процессе развития защитных реакций в растениях (Robertson et al., 2000). В совокупности повышенная активность генов SPRYSEC-1, VAP-1, Tpx и Gpx способствует подавлению иммунной системы растения-хозяина, защите личинок и обеспечению наиболее оптимальных условий для развития нематоды в корнях.
В случае личинок, паразитирующих в корнях ДРОП-обработанных растений, показана сходная с контролем тенденция к повышению экспрессии генов по сравнению с таковой на стадии вылупившихся личинок. Однако были выявлены различия в накоплении транскриптов некоторых генов. Так, в варианте ДРОП отмечен пониженный уровень экспрессии гена Cle по сравнению с контролем, что может свидетельствовать о сниженных возможностях формирования синцития и/или формирования неполноценного синцития. Интересные результаты показаны для генов SPRYSEC-1, VAP-1, Pel-1 и Eng-1.4. Как описывалось ранее, гены SPRYSEC-1 и VAP-1 принимают участие в подавлении иммунных реакций хозяина, а гены Pel-1 и Eng-1.4 ответственны за разрушение клеточных стенок и процессы миграции личинок в организме растений. Для успешного паразитирования нематоды необходим полный комплекс работающих генов, обеспечивающих реализацию определенных функций. Паразитирование личинок в корнях ДРОП-обработанных растений сопровождается нарушением баланса в экспрессии генов, что проявляется в сниженной транскрипции VAP-1 и Pel-1. В совокупности полученные данные свидетельствуют о подавлении возможности личинок достигать проводящую систему в целях формирования синцития и о подверженности действию защитных реакций со стороны растения.
В то же время установлены сходные характеры активности генов, кодирующих тиоредоксин- и глутатионпероксидазы, у личинок нематоды при паразитировании в корнях как контрольных, так и ДРОП-обработанных растений, что может свидетельствовать об активности процессов защиты от окислительного стресса, возникающего в ходе паразитирования в корнях растений.
Полученные результаты определения экспрессии генов у личинок при паразитировании в корнях контрольных и ДРОП-обработанных растений могут быть связаны с разными активностями иммунной системы хозяина. Ранее была установлена замедленная во времени активация защиты у контрольных (восприимчивых) растений при заражении, повышающая шансы для успешного проникновения личинок в корни и создающая благоприятные условия для их паразитирования, а соответственно полноценной реализации транскрипции генов (Лаврова и др., 2017).
В то же время показано, что ДРОП-обработка картофеля приводит к значительным изменениям в иммунном статусе растений: активации генов устойчивости H1 и Gro1-4, повышению экспрессии защитных генов PR1, PR2, PR3, PR6 (Лаврова и др., 2015, 2017). Такие изменения позволяют ДРОП-обработанным растениям своевременно и быстро активировать адекватную систему защиты при последующем заражении (в частности, реакцию сверхчувствительности), ограничивая доступ личинок нематоды к питанию. Это могло негативно отразиться на экспрессии генов у личинок, а значит и на развитии G. rostochiensis в целом. Подтверждением этого служат данные о снижении жизнеспособности и уменьшении коэффициента размножения нематоды при развитии в корнях ДРОП-обработанных растений (Lavrova, Matveeva, 2015).
ЗАКЛЮЧЕНИЕ
Изучение экспрессии генов на ранних этапах жизненного цикла G. rostochiensis вносит вклад в понимание молекулярных механизмов становления отношений паразит–хозяин. Проведенное исследование показало, что личинки G. rostochiensis на стадии цисты – пассивного периода жизненного цикла – характеризуются низкой активностью генов. Переход к активной жизнедеятельности сопровождается активацией транскриптома, выражающейся в повышении экспрессии определенных генов, ответственных за реализацию определенного этапа. В случае когда в роли хозяина выступают восприимчивые растения, у личинок на этапе вылупления основную роль играют гены, связанные с поиском корней (Ams-1) и проникновением в них (Pel-1, Eng-1.4). В период паразитирования в корнях для личинок приоритетна транскрипция генов, принимающих участие в формировании синцития (Cle, Pel-1, Eng-1.4) и в максимальном ограничении от возможных иммунных реакций хозяина (SPRYSEC-1, VAP-1, Tpx, Gpx). Такая поэтапная активация генов способствует успешному прохождению жизненного цикла нематоды.
В случае когда роль хозяина для нематоды играют ДРОП-обработанные растения, отмечается нарушение баланса в поэтапной активации генов. В период вылупления личинки, с одной стороны, характеризуются активацией генов, с другой – низкой и однотипной экспрессий, т.е. отсутствует факт преобладания каких-либо генов с выраженным накоплением транскриптов. При дальнейшем паразитировании в корнях ДРОП-обработанных растений у личинок также наблюдается снижение активности генов, особенно тех, которые связаны с формированием синцития (Cle, Pel-1, Eng-1.4) и защиты (VAP-1). Отсутствие поэтапной активации генов и снижение транскрипции генов в целом могут приводить к нарушению эволюционно сложившейся синхронизации жизненного цикла паразита с определенным видом растения, что обеспечивает ограничение распространения нематоды в тканях растения и подавление ее развития.
Финансовое обеспечение исследований осуществлялось из средств федерального бюджета на выполнение государственного задания КарНЦ РАН (№ 0221-2017-0042) и при поддержке РФФИ (грант 16-34-00650).
Список литературы
Зиновьева С.В. Взаимоотношения растений и паразитических нематод – иммунобиологические аспекты // Труды Центра паразитологии ИПЭЭ РАН. М.: Наука, 2012. Т. 47. С. 77–90.
Лаврова В.В., Матвеева Е.М., Зиновьева С.В. Экспрессия R-генов при генетической и индуцированной устойчивости картофеля к цистообразующей нематоде Globodera rostochiensis (Wollenweber, 1923) Behrens, 1975 // Докл. РАН. 2015. Т. 464. № 2. С. 231–233.
Лаврова В.В., Матвеева Е.М., Зиновьева С.В. Экспрессия генов защитных белков картофеля при инвазии цистообразующей нематодой Globodera rostochiensis (Wollenweber 1923) Behrens, 1975 и модуляция их активности при кратковременном воздействии низких температур // Изв. РАН. Сер. биол. 2017. № 2. С. 97–106.
Лаврова В.В., Матвеева Е.М., Сысоева М.И. Эффект предпосадочной низкотемпературной обработки клубней картофеля в условиях заражения картофельной цистообразующей нематодой // С.-х. биология. 2014. № 1. С. 98–102.
Лаврова В.В., Сысоева М.И., Матвеева Е.М. Жирнокислотный состав липидов листьев картофеля в условиях периодической и длительной гипотермии // Тр. КарНЦ РАН. 2012. № 2. С. 91–96.
Лаврова В.В., Сысоева М.И., Шерудило Е.Г., Топчиева Л.В., Матвеева Е.М. Экспрессия гена ci7 в листьях картофеля при действии кратковременных ежесуточных снижений температуры // Тр. КарНЦ РАН. 2011. № 3. С. 73–77.
Марковская Е.Ф., Шерудило Е.Г., Рипатти П.О., Сысоева М.И. Роль липидов в устойчивости семядольных листьев огурца к постоянному и кратковременному периодическому действию низкой закаливающей температуры // Тр. КарНЦ РАН. Сер. эксперим. биология. 2009. № 3. С. 67–74.
Мяги Э.А. Влияние биотических и абиотических факторов на вылупление личинок картофельной нематоды. Тарту: АН ЭССР, 1974. 157с.
Сысоева М.И., Лаврова В.В., Матвеева Е.М. Влияние кратковременных ежесуточных снижений температуры на содержание фотосинтетических пигментов в листьях зараженного нематодой картофеля // Тр. КарНЦ РАН. 2013. № 3. С. 194–199.
Сысоева М.И., Лаврова В.В., Матвеева Е.М., Шерудило Е.Г., Топчиева Л.В. Кросс-адаптация растений картофеля к действию низких температур и заражению картофельной цистообразующей нематодой // Физиология растений. 2011. Т. 58. № 6. С. 853–858.
Beneventi M.A., Bonfim da Silva O., Jr., Lisei de Sá M.E., Firmino A.A.P., Santos de Amorim R.M., Albuquerque É.V.S., Mattar da Silva M.C., Padilha da Silva J., de Araújo Campos M., Lopes M.J.C., Togawa R.C., Pappas G.J., Jr., Grossi-de-Sa M.F. Transcription profile of soybean-root-knot nematode interaction reveals a key role of phythormones in the resistance reaction // BMC Genomics. 2013. V. 14. P. 1–17. (http://www.biomedcentral.com/1471-2164/14/322)
Bird D.M. Mechanisms of the Meloidogyne-host interaction // Nematology: from Molecule to Ecosystem. Dundee, UK: Europ. Soc. Nematologists, 1992. P. 51–59.
Bird D.M., Clifton S.W., Kepler T., Kieber J.J., Thorne J., Opperman C.H. Genomic dissection of a nematode-plant interaction: a tool to study plant biology // Plant Physiol. 2002. V. 129. P. 394–395.
Bleve-Zacheo T., Melillo M.T., Zacheo G. Ultrastructural response of potato roots resistant to cyst nematode Globodera rostochiensis pathotype Ro1 // Rev. Nématol. 1990. V. 13. № 1. P. 29–36.
Byrne J.T., Maher N.J., Jones P.W. Comparative responses of Globodera rostochiensis and G. pallida to hatching chemicals // J. Nematol. 2001. V. 33. № 4. P. 195–202.
Byrne J., Twomey U., Maher N., Jones P.W. Detection of hatching inhibitors and hatching factor stimulants for golden potato cyst nematode, Globodera rostochiensis, in potato root leachate // Ann. Appl. Biol. 1998. V. 132. № 3. P. 463–472.
Chen Q., Rehman S., Smant G., Jones J.T. Functional analysis of pathogenicity proteins of the potato cyst nematode Globodera rostochiensis using RNAi // Mol. Plant Microbe Interact. 2005. V. 18. № 7. P. 621–625.
Cooper D., Eleftherianos I. Parasitic nematode immunomodulatory strategies: recent advances and perspectives // Pathogenes. 2016. V. 5. № 58. P. 1–12.
Cotton J.A., Lilley C.J., Jones L.M., Kikuchi T., Reid A.J., Thorpe P., Tsai I.J., Beasley H., Blok V., Cock P.J.A., Eves-van den Akker S., Holroyd N., Hunt M., Mantelin S., Naghra H., Pain A., Palomares-Rius J.E., Zarowiecki M., Berriman M., Jones J.T., Urwin P.E. The genome and life-stage specific transcriptomes of Globodera pallida elucidate key aspects of plant parasitism by a cyst nematode // Genome Biol. 2014. V. 15. P. 1–17. (http://genomebiology.com/2014/15/3/R43)
Giebel J. Biochemical mechanisms of plant resistance to nematodes: a review // J. Nematol. 1974. V. 6. № 4. P. 175–184.
Jones J.T., Perry R.N., Johnston M.R.L. Changes in the ultrastructure of the amphids of the potato cyst nematode, Globodera rostochiensis, during development and infection // Fundam. Appl. Nematol. 1994. V. 17. № 4. P. 369–382.
Jones M.G.K. The development and function of plant cells modified by endoparasitic nematodes // Plant parasitic nematodes. V. III / Eds Zuckerman B.M., Rohde R.A. N.Y.: Academic, 1981. P. 255–279.
Kombrink E., Schmelzer E. The hypersensitive response and its role in local and systemic disease resistance // Europ. J. Plant Pathol. 2001. V. 107. P. 69–78.
Lavrova V.V., Matveeva E.M. Temperature as management strategy for plant-parasitic nematode Globodera rostochiensis Woll. // Russ. J. Nematol. 2015. V. 23. № 2. P. 160.
Lee J.H., Lee J.S., Ahn J.H. Ambient temperature signaling in plants: an emerging field in the regulation of flowering time // J. Plant Biol. 2008. V. 51. № 5. P. 321–326.
Lilley C.J., Atkinson H.J., Urwin P.E. Molecular aspects of cyst nematodes // Mol. Plant Pathol. 2005. V. 6. № 6. P. 577–588.
Palomares-Rius J.E., Hedley P.E., Cock P.J.A., Morris J.A., Jones J.T., Vovlas N., Blok V. Comparison of transcript profiles in different life stages of the nematode Globodera pallida under different host potato genotypes // Mol. Pathol. 2012. V. 13. № 9. P. 1120–1134.
PM 7/40 (3) Globodera rostochiensis and Globodera pallida // Bull. OEPP/EPPO Bull. 2017. V. 47. № 2. P. 174–197.
Robertson L., Robertson W.M., Sobczak M., Helder J., Tetaud E., Ariyanayagam M.R., Ferguson M.A., Fairlamb A., Jones J.T. Cloning, expression and functional characterisation of a peroxiredoxin from the potato cyst nematode Globodera rostochiensis // Mol. Biochem. Parasitol. 2000. V. 111. № 1. P. 41–49.
Robinson M.P., Atkinson H.J., Perry R.N. The association and partial of a fluorescent hypersensitive response of potato roots to the potato cyst nematodes Globodera rostochiensis and G. pallida // Rev. Nématol. 1988. V. 11. P. 99–107.
Sheridan J.P., Miller A.J., Perry R.N. Early responses of resistant and susceptible potato roots during invasion by the potato cyst nematode Globodera rostochiensis // J. Exp. Botany. 2004. V. 55. № 397. P. 751–760.
Smant G., Goverse A., Stokkermans J.W.P.G., de Boer J.M., Pomp H., Zilverentant J.F., Overmars H.A., Helder J., Schots A., Bakker J. Potato root diffusate-induced secretion of soluble, basic proteins originating from the subventral esophageal glands of potato cyst nematodes // Phytopathology. 1997. V. 87. P. 839–845.
Wang X., Mitchum M.G., Gao B., Li C., Diab H., Baum T.J., Hussey R.S., Davis E.L. A parasitism gene from a plant-parasitic nematode with function similar to CLAVATA3/ESR (CLE) of Arabidopsis thaliana // Mol. Plant Pathol. 2005. V. 6. № 2. P. 187–191.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


