Известия РАН. Серия биологическая, 2019, № 4, стр. 439-448
Планктонные биоценозы горного озера Шебеты (Забайкальский край)
Е. Ю. Афонина 1, *, Н. А. Ташлыкова 1, Г. Ц. Цыбекмитова 1
1 Институт природных ресурсов, экологии и криологии СО РАН
672014 Чита, ул. Недорезова, 16а, а/я 521, Россия
* E-mail: kataf@mail.ru
Поступила в редакцию 25.04.2017
После доработки 30.11.2018
Принята к публикации 15.12.2018
Аннотация
Представлены результаты летних исследований (2002 и 2016 гг.) фито- и зоопланктона горного оз. Шебеты (Забайкальский край). Отмечено, что по гидрохимическому составу озерные воды гидрокарбонатно-кальциевые с общей минерализацией 30 мг/л, а планктонный биоценоз литорали по сравнению с пелагическим характеризуется большим видовым разнообразием и количественным развитием. С помощью метода главных компонент установлено, что на глубоководных участках озера основной абиотический фактор, влияющий на структурную организацию планктонного сообщества, – химический состав вод (концентрация биогенных элементов, органического вещества и pH), на небольших глубинах – гидрохимические (pH, содержание биогенов и катионный состав) и гидрофизические параметры (глубина и температуры воды). Обнаружено, что сочетание абиотических и биотических факторов обусловливает различное качественное распределение гидробионтов в разных зонах озера. В прибрежной зоне отмечена большая интегрированность сообщества, в пелагиальной – его многокомпонентность.
Высокогорные озера, характеризующиеся небольшим водосбором, малым содержанием биогенных элементов и низкой минерализацией, – уникальный индикатор состояния окружающей природной среды, климатических изменений и антропогенного загрязнения (Моисеенко и др., 1997; Flanagan et al., 2003; Strecker et al., 2004; Косолапов и др., 2007). Ледниковые водоемы относятся к экосистемам с экстремальными условиями обитания (Catalan et al., 2006) и пригодны для существования ограниченного числа видов животных и растений. Важный структурный и пластичный компонент водных биоценозов – планктонное сообщество – фито- и зоопланктон, составляющие первичные и вторичные звенья в трофических цепях экосистемы и играющие особую роль в процессах перемещения и аккумуляции веществ и энергии в биогеоценозах (Остроумов, 2003; Neves et al., 2003). Развитие жизни и распределение обитающих организмов зависит от особенностей водоемов (местоположение, температурный режим, химический состав вод, глубина и т.д.). В разнородных по гидрологическим и физико-химическим параметрам биотопах развиваются разные по качественному и количественному составам сообщества планктонных водорослей и беспозвоночных.
В результате исследования распределения и динамики качественных и количественных показателей сообществ гидробионтов в водоемах, расположенных на особо охраняемых природных территориях и не испытывающих антропогенной нагрузки, получен важный сравнительный материал для оценки характера и уровня изменений биоценозов озер со схожими природными условиями, но подверженных антропогенному прессу. Однако в силу сурового климата и труднодоступности экосистемы горных озер изучены слабо. Это относится и к водоемам Забайкальского края.
Цель работы – выявление особенностей пространственной структуры планктонных гидробионтов в зависимости от различных абиотических факторов и биотических взаимоотношений внутри сообществ горного оз. Шебеты.
МАТЕРИАЛЫ И МЕТОДЫ
Оз. Шебеты (Шебетый, Шебетуй) расположено на абсолютной высоте 1567.4 м в границах буферной зоны Байкальской природной территории, в составе национального парка “Чикой” (Красночикойский р-н, Забайкальский край). Абсолютные высоты отрогов Чикоконского хребта, окружающих водоем, от 1653.5 (на севере) до 2252.8 м (на юге). Озеро проточное, на юго-западе в него впадает руч. Пороховой, на западе из него вытекает ручей без названия. Площадь водоема – 873 000 м2, максимальная глубина – 42.5 м, средняя глубина – 18 м, объем озера – 15 684 530 м3, площадь водосбора – 10.5 км2. По происхождению оз. Шебеты относится к водоемам ледниково-подпрудного типа. Оно образовалось 18–20 тыс. лет назад в результате перегораживания долины руч. Пороховой береговой мореной сартанского ледника, стекавшего по пади Мельничной с северного мегасклона Быстринского Гольца (Малая …, 2009).
Изучение планктонной флоры и фауны оз. Шебеты проводилось в июле 2002 и 2016 гг. Работы велись в пелагиали (станции 1 и 2) и литорали (станции 3 и 4). Высшая водная растительность в озере практически не развита, растения наблюдались только в районе впадения руч. Пороховой (рис. 1).
Рис. 1.
Карта-схема мест отбора проб в оз. Шебеты. 1 – геометрический центр, 2 – глубинный центр, 3 – юго-восточное побережье, 4 – юго-западное побережье.

Гидробиологические и гидрохимические пробы отбирались послойно (в литоральной зоне – в поверхностных и придонных горизонтах, в пелагиальной – на поверхности, глубинах прозрачности и двойной прозрачности, у дна) с помощью батометра Паталаса. Зоопланктон также облавливался тотально средней сетью Джеди (конус из капронового сита диаметром ячеи 0.064 мм). Пробы фиксировались 4%-ным формалином. Материал обрабатывался общепринятыми гидробиологическими методами (Методические …, 1982). Всего было собрано 78 планктонных и 57 гидрохимических проб. Биомасса фитопланктона определялась по объему отдельных клеток или колоний водорослей, при этом удельная масса принималась равной единице (Садчиков, 2003). Биомасса зоопланктеров вычислялась по уравнениям связи длины тела и сырой массы (Ruttner-Kolisko, 1977; Балушкина, Винберг, 1979). Видовое сходство оценивалось по коэффициенту Съеренсена (Песенко, 1982). Содержание биогенных элементов (N, P) и органического вещества (ОВ) определялось стандартными методами (Алекин и др., 1973). Макрокомпонентный состав воды анализировался в аккредитованной лаборатории АО “Лабораторно-исследовательский центр по изучению минерального сырья” (АО ЛИЦИМС, г. Чита).
Одновременно отбирались пробы и с помощью многопараметрического портативного анализатора качества вод GPS-AQVAMETER (Aquaread, Великобритания) измерялись абиотические показатели среды: минерализация (Total dissolved solids (TDS)), содержание кислорода и его насыщенность, мутность, цветность, рН, температура воды. Прозрачность воды определялась белым диском Секки.
Первичные данные были подвергнуты статистической и математической обработке с использованием пакета программ Microsoft Excel 2010 и надстройки для программы Microsoft Excel XLSTAT (Addinsoft, США). Для изучения взаимосвязей структурных характеристик планктона и абиотических факторов среды применяли метод главных компонент Canonical correlation analysis (CCorA). В качестве переменных модели были использованы 53 параметра: минерализация (TDS), pH, содержание растворенного кислорода (O2), насыщенность кислородом (SAT), температура воды (T), глубина отбора проб (H), прозрачность (TR), мутность (TUR), цветность (COL), ОВ, химическое потребление кислорода (ХПК), перманганатная окисляемость (ПОК), общий фосфор (Pобщ), анионы фосфатов (PO4), аммония (NH4), нитратов (NO3), нитритов (NO2), карбонатов (CO3), катионы калия (K), кальция (Ca), натрия (Na), число видов фитопланктона и зоопланктона, численность (N) и биомасса (B) всего фито- и зоопланктона, численность и биомасса основных таксономических групп водорослей (Cyanobacteria (Cya), Bacillariophyta (Bac), Chrysophyta (Chr), Chlorophyta (Chl), Dinophyta (Din)) и беспозвоночных (Rotifera (Rot), Cladocera (Clad), Copepoda (Cop)), численность массовых видов фито- и зоопланктона (четыре и шесть видов соответственно). Для снижения размерности признакового пространства проводили нормирование базы данных (Фёрстнер, Рёнц, 1983). Для парных данных рассчитывали коэффициент корреляции Пирсона. Среди полученных коэффициентов парной корреляции (r) проводили отсев связей с |r| < 0.5. Доверительную оценку коэффициента корреляции проводили по t-критерию Стьюдента при уровне значимости p ≤ 0.05. На основании корреляционной матрицы были построены чертежи-схемы взаимосвязи компонентов планктонного сообщества. При анализе использовали среднеарифметическое значение и ошибку средней арифметической (Mean ± SE).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Гидрохимические показатели вод оз. Шебеты между станциями, расположенными в литорали, и между станциями пелагиали практически не различались. Отмечались различия между литоральными и пелагиальными участками. В литоральной зоне по сравнению с зоной пелагиали показатели мутности, содержания P, O2 и насыщения кислородом были выше, а концентрации ОВ, K, Ca и Na были ниже. Водная толща на глубоководных участках озера была стратифицирована, наблюдалось расслоение по температуре, содержанию O2 и его насыщенностью. Поверхностные слои воды прогревались до 18–19°С, толщина эпилимниона составляла 4–5 м. Температура нижних слоев гиполимниона (ниже 10 м) опускалась до 4–4.6°С. Концентрации растворенного O2 в верхних и нижних горизонтах воды соответствовали 8.48–8.55 и 6.78–6.95 мг/л, а насыщенность – 85.3–87.1 и 53.4–55.1%. По преобладающим ионам солевого состава озерные воды отнесены к гидрокарбонатно-кальциевому типу с общей минерализацией 30 мг/л. Реакция водной среды слабощелочная. Различий в гидролого-гидрохимических показателях в разные годы исследований не отмечалось. Физико-химические показатели обследованных зон оз. Шебеты представлены в табл. 1.
Таблица 1.
Физико–химические параметры разных зон оз. Шебеты
| Параметр, ед. изм. | Литораль (min–max) | Пелагиаль (min–max) | ||
|---|---|---|---|---|
| поверхность | дно | поверхность | дно | |
| H*, м | 1.8–4.5 | 27.4–34.7 | ||
| TR, м | До дна | 4.8–5.2 | ||
| T, ºС | 18.1–19 | 14–16 | 18–19 | 4–4.6 |
| рН | 7.09–8.26 | 8–8.2 | 7.22–7.8 | 7.22–7.5 |
| COL, град | 17 | 17 | 17 | 17 |
| TUR, мг/л | 0.34–0.55 | 0.34–0.55 | 0.46–0.56 | 0.46–0.56 |
| O2, мг/л | 5.9–8.27 | 5.7–8.48 | 8.48–8.55 | 6.78–6.95 |
| SAT, % | 60.7–85.9 | 58.5–88.1 | 85.3–87.1 | 53.4–55.1 |
| ${\text{NO}}_{3}^{ - }$, мг/л | 0.18–0.32 | 0.01 | 0.016–0.24 | 0.24 |
| ${\text{NO}}_{2}^{ - }$, мг/л | 0.01 | 0.007 | 0.01–0.012 | 0.01 |
| ${\text{NH}}_{4}^{ - }$, мг/л | 0.24–0.37 | – | 0.3 | 0.3 |
| ${\text{PO}}_{4}^{{3 - }}$, мг/л | 0.005–0.006 | 0.006–0.015 | 0.001–0.008 | 0.018 |
| Pобщ, мг/л | 0.011–0.012 | 0.012–0.013 | 0.013–0.015 | 0.026 |
| ПОК, мгО/л | 2.48–3.36 | 2.47–4.23 | 2.64–3.36 | 1.86 |
| ХПК, мгО/л | 13.52–18.72 | 14.4–23.92 | 18.2–20.16 | 20.8 |
| ОВ, мгО/л | 10.2–14 | 9.1–17.9 | 5.8–13.7 | 15.6 |
| Na+, мг/л | 0.7–0.75 | – | 1.09 | 1.09 |
| K+, мг/л | 0.44–0.45 | – | 0.51 | 0.51 |
| Ca2+, мг/л | 2–5 | – | 5 | 5 |
| ${\text{HCO}}_{3}^{ - }$, мг/л | 18.3–21.35 | – | 18.3 | 18.3 |
| TDS, мг/л | 30 | 30 | 30 | 30 |
Примечание. “–” – отсутствие данных; для табл. 1 и 2; * – глубина отбора проб.
В составе фитопланктона были обнаружены 35 таксонов рангом ниже рода, относящихся к 7 отделам, 10 классам, 15 порядкам, 20 семействам, 25 родам. Более 40% общего таксономического списка было сформировано диатомовыми водорослями, 23% – зелеными водорослями. Примерно равное разнообразие присуще харовым и золотистым (по 14 и 11% соответственно), остальные отделы (цианобактерии, криптофитовые и динофитовые) представлены намного беднее (6, 3 и 3% соответственно). Всего в литоральной зоне было отмечено 28 видов водорослей, в пелагиальной – 21. Значение средней численности фитопланктона в прибрежье составляло 64.77 ± 27.8 тыс. кл./л, биомассы – 317.7 ± 197.5 мг/м3, доминировали Coelosphaerium kuetzingianum Nägeli, Diatoma vulgaris Bory, Tabellaria flocculosa (Roth) Kützing, Peridinium sp. В глубоководной части озера количественные показатели в среднем равнялись 30.36 ± 7.9 тыс. кл./л и 47.21 ± 6.8 мг/м3, преобладали Cyclotella meneghiniana Kützing, D. vulgaris, Aulacoseira islandica (Otto Müller) Simonsen, Kephyrion doliolum Conrad, Wiella irregularis Wille) P.M. Tsarenko & D.M.John in D.M. John & P.M. Tsarenko, Crucigenia tetrapedia (Kirchner) Kuntze, Monoraphidium griffithii (Berkeley) Komárková-Legnerová, Peridinium sp. (Афонина, Ташлыкова, 2017).
В составе зоопланктона было отмечено 35 видов из 11 отрядов, 16 семейств, 30 родов, из них Rotifera – 9 видов, Cladocera – 19, Copepoda – 7. Качественный состав животных в разных зонах озера различался. На мелководных участках озера были встречены 28 видов, на глубоководных – 18. Общая численность зоопланктона в литорали озера в среднем равнялась 66.20 ± 20.64 тыс. экз./м3, общая биомасса – 379.29 ± 160.17 мг/м3. Основу численности создавали коловратки Conochilus unicornis Rousselet (20–85%), Kellicottia longispina (Kellicott) (26–31%), основу биомассы – ветвистоусые ракообразные Sida crystallina (Müller) (40–65%), Diaphanasoma brachyurum (Lievin) (28%), Bosmina longirostris (Müller) (21–25%) и коловратка Asplanchna priodonta Gosse (40–45%). В пелагиали средние значения численности и биомассы составляли 28.43 ± 5.69 тыс. экз./м3 и 274.95 ± 44.35 мг/м3 соответственно. Превалировали веслоногие ракообразные Arctodiaptomus neithammeri (Mann) (34–40% всей численности и 56–83% всей биомассы) и Cyclops abyssorum Sars (10–20% и 29–35%) (Афонина, Ташлыкова, 2017).
Для анализа структуры взаимосвязей признаков планктонных сообществ применяли метод корреляционных плеяд (при r ≥ 75, p < 0.05), построенных на основе корреляционных матриц. Результаты показали, что в двух зонах горного озера развивались разные по качественным компонентам и интегрированности планктонные сообщества. Так, в литорали озера планктоценоз слагался из пяти взаимосвязанных между собой групп: Chlorophyta, Bacillariophyta, Copepoda, Cladocera, Rotifera, где коловратки – основной структурообразующий элемент. В пелагиали сообщество состояло из шести компонентов (вышеперечисленные и Cryptophyta) (рис. 2).
Рис. 2.
Корреляционная плеяда взаимосвязей фито- и зоопланктона оз. Шебеты. а – литораль, б – пелагиаль; для рис. 2 и 3; r ≥ 75, p < 0.05.

В результате изучения корреляционных взаимосвязей между численностью различных видов фито- и зоопланктона были установлены статистически значимые коэффициенты Пирсона для четырех видов водорослей и шести беспозвоночных. Наибольшим числом связей с другими видами водорослей и беспозвоночных обладала коловратка C. unicornis. Большая часть взаимных связей была положительной и свойственной литоральным сообществам. Лишь два коэффициента указывали на сокращение относительного обилия одного таксона при увеличении второго (рис. 3).
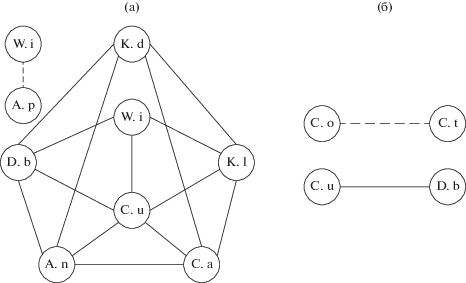
Рис. 3.
Чертеж-схема структуры планктонного сообщества оз. Шебеты. а – литораль, б – пелагиаль; сплошная линия – прямая корреляция, штриховая – обратная; для табл. 2 и рис. 3; W. i – Wiella irregularis, K. d – Kephyrion doliolum, C. t – Crucigenia tetrapedia, C. o – Cryptomonas ovata, K. q – Keratella quadrata, K. l – Kellicottia longispina, A. p – Asplanchna priodonta, C. u – Conochilus unicornis, D. b – Diaphanasoma brachyurum, A. n – Arctodiaptomus neithammeri, C. a – Cyclops abyssorum.
Для определения влияния факторов внешней среды на вариабельность показателей развития планктона был использован метод главных компонент (CCorA). Исходной для факторного анализа послужила матрица корреляционных отношений между структурными характеристиками планктонного сообщества и гидролого-гидрохимическими параметрами. В результате компонентного анализа для каждой из двух зон озера было выделено по три фактора с суммарным вкладом в изменчивость планктонных сообществ 99.99% и с равной долей дисперсии каждого из них (табл. 2).
Таблица 2.
Компонентный анализ планктонных сообществ для разных зон оз. Шебеты*
| Параметр | Факторы, литораль | Факторы, пелагиаль | ||||
|---|---|---|---|---|---|---|
| I (33.33%) | II (33.33%) | III (33.33%) | I (34.19%) | II (32.9%) | III (32.9%) | |
| H | 0.02 | –0.99 | –0.04 | –0.57 | –0.74 | 0.37 |
| T | –0.45 | 0.89 | 0.05 | 0.31 | 0.63 | –0.64 |
| COL | 0.46 | 0.86 | 0.05 | 0.04 | –0.83 | –0.56 |
| TUR | 0.35 | 0.83 | –0.22 | 0.04 | –0.83 | –0.56 |
| pH | –0.47 | 0.88 | –0.44 | –0.26 | 0.92 | 0.22 |
| O2 | –0.59 | 0.81 | 0.07 | 0.34 | 0.8 | –0.49 |
| ${\text{NO}}_{3}^{ - }$ | 0.32 | 0.81 | –0.49 | 0.04 | –0.83 | –0.56 |
| ${\text{NO}}_{2}^{ - }$ | 0.48 | 0.86 | –0.15 | 0.04 | –0.83 | –0.56 |
| ${\text{NH}}_{4}^{ - }$ | 0.36 | 0.83 | –0.42 | 0.04 | –0.83 | –0.56 |
| ${\text{PO}}_{4}^{{3 - }}$ | –0.97 | –0.26 | 0 | –0.67 | –0.51 | 0.19 |
| Pобщ | –0.92 | –0.44 | –0.21 | –0.68 | –0.73 | –0.04 |
| ПОК | 0.42 | 0.86 | –0.11 | 0 | –0.7 | –0.55 |
| ХПК | 0.5 | 0.86 | –0.3 | 0.25 | –0.59 | 0.77 |
| ОВ | 0.5 | 0.86 | –0.11 | 0.25 | –0.59 | 0.77 |
| Na+ | 0.5 | 0.86 | –0.1 | 0.04 | –0.83 | –0.56 |
| K+ | 0.49 | 0.86 | –0.14 | 0.04 | –0.83 | –0.56 |
| Ca2+ | 0.24 | 0.75 | –0.62 | 0.04 | –0.83 | –0.56 |
| ${\text{HCO}}_{3}^{ - }$ | 0.52 | 0.86 | –0.05 | 0.04 | –0.83 | –0.56 |
| TDS | 0.48 | 0.86 | –0.15 | 0.04 | –0.83 | –0.56 |
| NBac | –0.93 | –0.08 | 0.31 | 0.21 | -0.43 | 0.76 |
| BBac | –0.95 | –0.08 | 0.35 | –0.15 | –0.89 | –0.15 |
| NDin | 0.34 | 0.73 | 0.59 | 0.47 | 0.64 | –0.58 |
| BDin | 0.34 | 0.73 | 0.59 | 0.47 | 0.64 | –0.58 |
| NChl | –0.75 | –0.2 | 0.63 | 0.55 | 0.37 | –0.62 |
| BChl | –0.95 | –0.13 | 0.3 | 0.52 | 0.28 | –0.73 |
| NChr | 0.59 | –0.09 | 0.81 | 0.74 | 0.26 | 0.49 |
| BChr | 0.06 | –0.13 | 0.99 | 0.46 | –0.03 | 0.72 |
| NCya | 0.56 | 0.48 | 0.68 | – | – | – |
| BCya | 0.56 | 0.48 | 0.68 | – | – | – |
| NCry | – | – | – | 0.64 | 0.01 | –0.63 |
| BCry | – | – | – | 0.05 | 0.37 | 0.21 |
| NRot | –0.95 | –0.2 | 0.25 | –0.16 | 0.54 | –0.34 |
| BRot | –0.82 | –0.09 | –0.56 | 0.67 | 0.02 | –0.74 |
| NCop | –0.96 | –0.06 | 0.28 | –0.51 | –0.81 | 0.28 |
| BCop | –0.97 | –0.03 | 0.23 | –0.09 | –0.59 | 0.69 |
| NClad | –0.97 | –0.17 | 0.12 | –0.37 | 0.65 | –0.17 |
| BClad | –0.97 | –0.06 | 0.26 | –0.48 | 0.65 | –0.15 |
| NW. i | –0.9 | –0.39 | 0.21 | 0.71 | 0.26 | –0.62 |
| NC. t | 0.63 | –0.13 | –0.77 | 0.12 | 0.62 | –0.29 |
| NK. d | –0.94 | –0.09 | 0.34 | –0.72 | –0.69 | 0.01 |
| NK. l | –0.98 | –0.18 | 0.1 | –0.29 | 0.57 | 0.03 |
| NA. p | –0.48 | –0.01 | –0.88 | 0.63 | –0.14 | –0.74 |
| NC. u | –0.94 | –0.2 | 0.29 | –0.46 | 0.59 | –0.21 |
| ND. b | –0.89 | –0.33 | 0.31 | –0.56 | 0.64 | –0.26 |
| NA. n | –0.95 | –0.06 | 0.3 | –0.51 | –0.83 | 0.2 |
| NC. a | –0.98 | 0 | 0.21 | –0.36 | –0.48 | 0.6 |
Для литоральной зоны первая компонента в качестве параметров с максимальными отрицательными факторными нагрузками имеет количественные показатели Bacillariophyta, Chlorophyta, Rotifera, Cladocera и Copepoda. Факторные нагрузки второй и третьей компонент положительные и определяются соответственно показателями численности и биомассы Dinophyta и Chrysophyta. Из абиотических факторов среды по трем компонентам наибольшее влияние на функционирование планктона оказывают содержание P, и глубина. Отметим, что высокими факторными нагрузками обладают также показатели температура воды и pH. Анализ CCorA на уровне видов показал, что наиболее чувствительными к воздействию факторов среди водорослей были W. irregularis и K. doliolum, среди беспозвоночных – K. longispina, C. unicornis, C. abyssorum, A. neithammeri.
Для пелагиальной зоны наибольшими положительными факторными нагрузками на первую компоненту характеризуются признаки численности Chrysophyta, на вторую – показатели численности на биомассы Bacillariophyta и численности Copepoda (факторные нагрузки отрицательные), на третью – показатели численности Bacillariophyta (факторная нагрузка положительная) биомассы Chlorophyta и Rotifera (факторные нагрузки отрицательные), Chrysophyta (положительная). Основные абиотические факторы, оказывающие влияние на структурную организацию планктонного сообщества, – концентрация P и PO4 (по первой компоненте), pH (по второй) и содержание ОВ (по третьей). Наиболее чувствителен к воздействию факторов среды веслоногий рачок A. neithammeri.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
По гидрохимическому составу воды горного оз. Шебеты относятся к гидрокарбонатному классу кальциевой группы, по степени минерализации – к ультрапресным, по степени жесткости – к мягким, по рН – к нейтрально-слабощелочным. Химический состав озерных вод в разные годы исследования постоянен, что также отмечается и для таких крупных озер, как Ладожское (Румянцев, 2012) и Телецкое (Долматова, 2011).
Летний планктон оз. Шебеты характеризуется небогатым таксономическим составом водорослей и беспозвоночных, доминированием мелкоразмерных групп гидробионтов (зеленые, диатомовые и хризофитовые водоросли, коловратки и ювенильные стадии веслоногих ракообразных), обусловливающим низкие значения биомассы. Результаты исследований, проведенных в разные годы, не показали значимых различий в видовом разнообразии и количественном развитии гидробионтов (Афонина, Ташлыкова, 2017). Эти характеристики планктонных сообществ объединяют исследуемое озеро с другими подобными горными водоемами (Богданов и др., 2004; Forsström, 2006; Матвеев и др., 2008; Rahkola-Sorsa, 2008; Бондаренко, 2009; Глущенко и др., 2009; Итигилова, Шевелева, 2009; Ракыбаева, 2011; Krupa, Barinova, 2016).
Разнородные по гидрологическим и физико-химическим параметрам биотопы определяют и разные по таксономическому, биотопическому и трофическому разнообразию сообщества гидробионтов (Walseng et al., 2006). При заданном сочетании условий формируется определенный комплекс планктонных организмов. Упорядочение структуры сообществ гидробионтов происходит под воздействием внешних (абиотические факторы) и внутренних факторов (связи между организмами). Состояние сообществ планктонных организмов отражает реакцию видов на изменение условий среды, таких как перемешивание, прогреваемость воды, влияние водосбора, а также физических и химических показателей, что вызывает перестройку альго- и зооценозов (Трифонова, Макарцева, 2006; Крылов и др., 2010; Овсепян и др., 2010).
В оз. Шебеты литоральный планктоценоз (прежде всего на участке с растительностью) по сравнению с пелагическим более разнообразен и качественно обилен. Благоприятные гидродинамический и термический режимы небольших глубин способствуют наибольшему развитию в этих участках озера водорослей из отделов Charophyta, Bacillariophyta, Cyanobacteria и ракообразных из Cladocera. Значения общих численности и биомассы фито- и зоопланктона превышают таковые в глубоководной части озера в несколько раз. В прибрежной зоне по сравнению с планктоном пелагических участков возрастает значение подвижных жгутиковых форм водорослей и фитофильных, литоральных видов ракообразных. Доминантные комплексы планктонных сообществ литорали состоят из 14 видов, в пелагиали – из 18. На мелководных участках озера в составе зоопланктона превалируют детритофаги, на глубоководных – фильтраторы и хищники. Большинство отмеченных видов – типичные представители холодноводного комплекса (среди фитопланктона – это Chrysococcus rufescens Klebs, C. biporus Skuja, K. doliolum, Mallomonas caudata Iwanoff [Ivanov], Cryptomonas ovata Ehrenberg, среди зоопланктона – это C. unicornis, K. longispina, Daphnia crystata Sars, C. abyssorum, Atteyella nordenskjoldi (Lilljeborg) и др.). Коэффициент видового сходства между литоральным и пелагическим сообществами для фитопланктона составляет 0.61 ± 0.04, для зоопланктона – 0.57 ± 0.1, что свидетельствует о близости альгофлоры и планктофауны из различных зон оз. Шебеты. Подобное распределение планктонных организмов наблюдается и в других озерах с незначительной площадью мелководных участков и низким развитием водной растительности (Bondarenko et al., 2002; Зарубина и др., 2005; Матвеев и др., 2008; Крылов и др., 2010; Овсепян и др., 2010; Бурмистрова, Ермолаева, 2013; Денисов и др., 2015).
Различия в качественном распределении видов фито- и зоопланктона по зонам в оз. Шебеты определяются условиями, которые в литоральной части озера способствуют большей интегрированности сообщества, в пелагиальной – его многокомпонентности. По наличию большего числа связей между организмами литоральный планктоценоз можно отнести к устойчивому, поскольку “поочередное искусственное усечение” (Бухарин и др., 2012) структуры комплекса сообщества не приводит к его распаду. Структурообразующую роль в этом сообществе играют коловратки, в частности широко распространенный в холодноводных озерах C. unicornis. Структура пелагического сообщества неустойчивая, поскольку “искусственное усечение” приводит к рассыпанию базового комплекса на отдельные фрагменты. Малое число связей между гидробионтами в пелагиали, возможно, обусловлено особенностями вертикального распределения отдельных видов водорослей и беспозвоночных, связанного с предпочтением ими определенных условий среды обитания, с пищевой конкуренцией и с отношением хищник–жертва (George, Winfield, 2000; Кипрушина, 2009).
В горных водоемах изменения температуры и световые условия – самые важные факторы для развития фитопланктона (Moore, 1981), а недостаточно высокие концентрации биогенных элементов не способствуют интенсивному развитию водорослей (Бондаренко, 2009; Денисов, 2010). Такие условия предпочтительны для развития крипто-, хризо- и динофитовых флагеллят, способных утилизировать растворенную органику (Tolotti, 2001; Tolotti et al., 2003; Бондаренко, Щур, 2008) и потреблять легкоусвояемую низкомолекулярную органическую пищу при низких температурах (Maeda, Ichimura, 1973; Reynolds, 1984) и малой доступности биогенов (Arvola et al., 1991). Синезеленые водоросли встречаются только в прибрежной зоне оз. Шебеты (с большей приуроченностью к участку с растительностью), где при повышенной концентрации нитратов происходит увеличение разнообразия и плотности этой таксономической группы (Krupa, Barinova, 2016).
Массовое развитие ветвистоусых ракообразных в прибрежных участках озера связано с особенностями их экологии. Кладоцеры предпочитают более прогреваемые мелководные местообитания с хорошей перемешиваемостью водных масс, включая чистую литораль, заросли погруженных макрофитов, различные типы донной поверхности (DiFonzo, Campbell, 1988; Paterson, 1993; Gilloly, Dodson, 2000). Основной вклад в видовое разнообразие литоральных кладоцер вносят представители семейства Chydoridae, способные усваивать несъедобные для зоопланктона (Погожев, Герасимова, 2001; Кононова и др., 2014), и характеризующиеся низкими пищевыми качествами синезеленые водоросли (Сущик, 2008; Дубовская, 2009) через микробиальную петлю (Бульон, 2002).
Определяющий фактор в распределении Cyclopoida – температура воды, при снижении которой обилие рачков заметно возрастает. Количественные показатели Calanoida возрастают при увеличении глубины озера. Приуроченность веслоногих к наиболее глубоким и темным слоям озера (ниже 10 м) является приспособлением для снижения выедания их рыбами (Gliwicz, Rowan, 1984) и обусловлена особенностью их экологии (низкий температурный оптимум, способность запасать липиды) (Smyntek et al., 2008; Вецлер, 2009).
Мелкие зоопланктонные организмы (A. priodonta, C. unicornis, K. longispina), менее поедаемые рыбой, в большей степени концентрируются в верхних слоях озера, наиболее освещенных, аэрированных и богатых фитопланктоном, который состоит преимущественно из зеленых водорослей (W. irregularus, C. tetrapedia). Исследования же горных озер Алтая (Бурмистрова, Ермолаева, 2013) показали, что при понижении температуры воды число видов коловраток, наоборот, возрастает, а доля ракообразных уменьшается. В оз. Севан с увеличением глубины повышается и число видов зоопланктона (Крылов и др., 2010).
Таким образом, летний фито- и зоопланктон в разных зонах горного оз. Шебеты различаются по качественному составу, составу доминирующего комплекса и количественным показателям. Видовое разнообразие и показатели численности и биомассы литорального планктоценоза выше по сравнению с пелагическим. Структурные характеристики планктонных сообществ озера зависят от химического состава воды и гидрофизических параметров среды, для литорали – это концентрации P, pH, глубина, температура воды, для пелагиали – содержание P, ОВ, pH. Набор абиотических и биотических факторов обусловил наличие интегрированного (более устойчивого) сообщества водорослей и беспозвоночных, в котором структурообразующий элемент – коловратки. В пелагиали сообщество многокомпонентное с минимальным числом связей между гидробионтами (менее устойчивое).
Исследование выполнено в рамках проекта ФНИ IX.137.1.1. при финансовой поддержке администрации национального парка “Чикой” (Договор № 386-06/16).
Список литературы
Алекин О.А., Семенов А.Д., Скопинцев Б.А. Руководство по химическому анализу вод суши. Л.: Гидрометеоиздат, 1973. 269 с.
Афонина Е.Ю., Ташлыкова Н.А. Литоральные и пелагиальные планктонные сообщества высокогорного оз. Шебеты (Забайкальский край) // Наука и образование. 2017. № 2. С. 128–135.
Балушкина Е.Б., Винберг Г.Г. Зависимость между массой и длиной тела у планктонных животных // Общие основы изучения водных экосистем. Л.: Наука, 1979. С. 169–172.
Богданов В.Д., Богданова Е.Н., Гаврилов А.Л., Мельниченко И.П., Степанов Л.Н., Ярушина М.И. Биоресурсы водных экосистем Полярного Урала. Екатеринбург: УрО РАН, 2004. 168 с.
Бондаренко Н.А. Экология и таксономическое разнообразие планктонных водорослей в озерах горных областей Восточной Сибири: Автореф. дис. докт. биол. наук. Борок: ИББВ РАН, 2009. 46 с.
Бондаренко Н.А., Щур Л.А. Cryptophyta водоемов и водотоков Восточной Сибири (Россия) // Альгология. 2008. Т. 18. № 4. С. 408–422.
Бульон В.В. Структура и функция микробиальной “петли” в планктоне озерных экосистем // Биология внутр. вод. 2002. № 2. С. 5–14.
Бурмистрова О.С., Ермолаева Н.И. Зоопланктон высокогорных озер Алтая // Биология внутр. вод. 2013. № 3. С. 27–36.
Бухарин О.В., Немцева Н.В., Яценко-Степанова Т.Н. Ассоциативный симбиоз гидробионтов и его значение в определении экологического состояния водоемов // Поволжск. экол. журн. 2012. № 3. С. 356–360.
Вецлер Н.М. Структурные особенности и динамика зоопланктонного сообщества в пелагиали озера Дальнее (Камчатка): Автореф. дис. канд. биол. наук. Борок: ИБВВ РАН, 2009. 25 с.
Глущенко Л.А., Дубовская О.П., Иванова Е.А., Шулепина С.П., Зуева И.В., Агеева А.В. Гидробиологический очерк некоторых озер горного хребта Ергаки (Западный Саян) // Журн. СФУ. Биология. 2009. Т. 2. № 3. С. 355–378.
Денисов Д.Б. Экологические особенности водорослевых сообществ разнотипных субарктических водоемов // Вестн. КНЦ РАН. 2010. № 1. С. 48–56.
Денисов Д.Б., Валькова С.А., Терентьев П.М., Черепанов А.А. Экологические особенности малых ледниковых субарктических озер (Хибинский горный массив, Кольский полуостров) // Тр. КарНЦ РАН. 2015. № 2. С. 40–52.
Долматова Л.А. Особенности гидрохимического режима Телецкого озера в период осеннего охлаждения // Мир науки, культуры, образования. 2011. № 6–2 (31). С. 418–431.
Дубовская О.П. Не связанная с хищниками смертность планктонных ракообразных, ее возможные причины (обзор литературы) // Журн. общ. биологии. 2009. Т. 70. № 2. С. 168–192.
Зарубина Е.Ю., Яныгина Л.В., Бурмистрова О.С., Митрофанова Е.Ю., Ким Г.В., Котовщиков А.В., Крылова Е.Н., Ковешников М.И. Литоральные биоценозы как один из факторов устойчивости экосистемы Телецкого озера // Ползуновск. вестн. 2005. № 4. С. 201–207.
Итигилова М.Ц., Шевелева Н.Г. Видовой состав и количественное распределение зоопланктона оз. Ничатка (Северное Забайкалье) // Изв. ИГУ. Сер. Биология. Экология. 2009. Т. 2. № 2. С. 8–10.
Кипрушина К.Н. Сезонная динамика вертикального распределения зоопланктона открытой части Южного Байкала (район Больших Котов) // Изв. ИГУ. Сер. Биология. Экология. 2009. Т. 2. № 1. С. 39–44.
Кононова О.Н., Дубовская О.П., Фефилова Е.Б. Зоо- и некрозоопланктон Харбейских озер большеземельской тундры (по исследованиям 2009–2012 годов) // Журн. СФУ. Биология. 2014. Т. 7. № 3. С. 303–327.
Косолапов Д.Б., Крылов А.В., Косолапова Н.Г., Копылов А.И. Распределение планктонных микроорганизмов и беспозвоночных в горном озере в период осенней гомотермии // Биология внутр. вод. 2007. № 3. С. 21–31.
Крылов А.В., Акопян С.А., Никогосян А.А., Айрапетян А.О. Зоопланктон озера Севан и его притоков // Экология озера Севан в период повышения его уровня. Результаты исследований Российско-Армянской биологической экспедиции по гидроэкологическому обследованию озера Севан (Армения) (2005–2009 гг.). Махачкала: Наука ДНЦ, 2010. С. 168–200.
Малая энциклопедия Забайкалья: Природное наследие / Гл. ред. Гениатулин Р.Ф. Новосибирск: Наука, 2009. 698 с.
Матвеев А.Н., Самусенок В.П., Юрьев А.Л. Вокин А.И., Бондаренко Н.А., Слугина З.В., Рожкова Н.А., Помазкова Г.И., Мельник Н.Г. Гидробиологическая характеристика оз. Большой Намаракит (Северное Забайкалье) // Изв. ИГУ. Сер. Биология. Экология. 2008. Т. 1. № 1. С. 99–107.
Методические рекомендации по сбору и обработке материалов при гидробиологических исследованиях. Л.: ГосНИОРХ, 1982. 28 с.
Моисеенко Т.И., Даувальтер В.А., Каган Л.Я. Горные озера как маркеры загрязнения воздуха // Вод. ресурсы. 1997. Т. 24. № 5. С. 600–608.
Овсепян А.А., Гамбарян Л.Р., Оганесян Р.О., Гусев Е.С. Планктонные водоросли озера Севан // Экология озера Севан в период повышения его уровня. Результаты исследований Российско-Армянской биологической экспедиции по гидроэкологическому обследованию озера Севан (Армения) (2005–2009 гг.). Махачкала: Наука ДНЦ, 2010. С. 90–104.
Остроумов С.А. Гидробионты как фактор регуляции потока вещества и миграции элементов в водных экосистемах // Изв. СамарНЦ РАН. 2003. Т. 5. № 2. С. 249–255.
Песенко Ю.А. Принципы и методы количественного анализа в фаунистических исследованиях. М.: Наука, 1982. 288 с.
Погожев П.И., Герасимова Т.Н. Влияние зоопланктона на цветение микроводорослей при эвтрофировании водоемов // Вод. ресурсы. 2001. № 4. С. 461–469.
Ракыбаева А.А., Джантасова А.С., Баймуканов М.Т. К оценке современного состояния зоопланктона озера Маркаколь // Вестн. КазНУ. Сер. биол. 2011. № 4 (50). С. 98–102.
Румянцев В.А. Ладожское озеро: экологические проблемы, причины, пути решения // Регион. экология. 2012. № 1–2 (33). С 7–13.
Садчиков А.П. Методы изучения пресноводного фитопланктона. М.: Университет и школа, 2003. 157 с.
Сущик Н.Н. Роль незаменимых жирных кислот в трофометаболических взаимодействиях в пресноводных экосистемах (обзор) // Журн. общ. биологии. 2008. Т. 69. № 4. С. 299–316.
Трифонова И.С., Макарцева Е.С. Сезонная и многолетняя динамика фито- и зоопланктона и их взаимоотношения в мезотрофном озере // Биология внутр. вод. 2006. № 3. С. 18–25.
Фёрстнер Э., Рёнц Б. Методы корреляционного и регрессионного анализа. М.: Финансы и статистика, 1983. 303 с.
Arvola L., Ojala A., Barbosa F., Heaney S.I. Migration behaviour of three cryptophytes in relation to environmental gradients: an experimental approach // Brit. Phycol. J. 1991. V. 26. Iss. 4. P. 361–373.
Bondarenko N.A., Sheveleva N.G., Domysheva V.M. Structure of plankton communities in Ilchir, an alpine lake in eastern Siberia // Limnology. 2002. V. 3. Iss. 2. P. 127–133.
Catalan J., Camarero L., Felip M., Pla S., Ventura M., Buchaca T., Bartumeus F., de Mendoza G., Miró A., Casamayor E.O., Medina-Sánchez J.M., Bacardit M., Altuna M., Bartrons M., Díaz de Quijano D. High mountain lakes: extreme habitats and witnesses of environmental change // Limnetica. 2006. V. 25. Iss. 1–2. P. 551–584.
DiFonzo C.D., Campbell J.M. Spatial partitioning of microhabitats in littoral Cladoceran communities // J. Freshwater Ecol. 1988. V. 4. P. 303–313.
Flanagan K.M., McCauley E., Wrona F., Prowse T. Climate change: the potential for latitudinal effects on algal biomass in aquatic ecosystems // Can. J. Fish. Aquat. Sci. 2003. V. 60. Iss. 6. P. 635–639.
Forsström L. Phytoplankton ecology of subarctic lakes in Finnish Lapland: academic dissertation. Helsinki: Univ. Helsinki, 2006. 42 p.
George D.G., Winfield I.J. Factors influencing the spatial distribution of zooplankton and fish in Loch Ness, UK // Freshwater Biol. 2000. V. 43. Iss. 4. P. 557–570.
Gilloly J.F., Dodson S.L. Latitudinal patterns in the size distribution and seasonal dynamics of New World, freshwater cladocerans // Limnol. Oceanogr. 2000. V. 45. Iss. 1. P. 22–30.
Gliwicz Z.M., Rowan M.G. Survival of Cyclops abyssorum tatricus (Copepoda, Crustacea) in alpine lakes stocked with planktivorous fish // Limnol. Oceanogr. 1984. V. 29. Iss. 6. P. 1290–1299.
Krupa E.G., Barinova S.S. Environmental variables regulating the phytoplankton structure in high mountain lakes // Res. J. Pharm., Biol. Chemical Sci. 2016. V. 7. Iss. 4. P. 1251–1261.
Maeda O., Ichimura S. On the high density of a phytoplankton population found in a lake under ice // Int. Rev. Ges Hydrobiol. 1973. V. 58. № 5. P. 673–685.
Moore J.W. Influence of temperature, photoperiod and trophic conditions on the seasonal cycles of phytoplankton and zooplankton in two deep subarctic lakes of Northern Canada // Int. Rev. Ges Hydrobiol. 1981. V. 66. № 5. P. 745–770.
Neves I.F., Rocha D., Roche K.F., Pinto A.A. Zooplankton community structure of two marginal lake of river (Cuiaba) (Mato, Grosso, Brazil) with analysis of rotifer and Cladocera diversity // Braz. J. Biol. 2003. V. 63. Iss. 2. P. 329–343.
Paterson M. The distribution of microcrustacea in the littoral zone of a freshwater lake // Hydrobiologia. 1993. V. 263. Iss. 3. P. 173–183.
Rahkola-Sorsa M. The structure of zooplankton communities in large boreal lakes and assessment of zooplankton methodology. Joensuu: Univ. Joensuu, 2008. 117 p.
Reynolds C.S. The ecology of freshwater phytoplankton. Cambridge: Cambr.Univ. Press, 1984. 384 p.
Ruttner-Kolisko A. Suggestions for biomass calculation of plankton rotifers // Arch. Hydrobiol. Beih. Ergebn. Limnol. Struttgart. 1977. Bd 8. S. 71–76.
Smyntek P.M., Teece M.A., Schulz K.L., Storch A.J. Taxonomic differences in the essential fatty acid composition of groups of freshwater zooplankton relate to reproductive demands and generation time // Freshwater Biol. 2008. V. 53. Iss. 9. P. 1768–1782.
Strecker A.L., Cobb T.P., Vinebrooke R.D. Effects of experimental greenhouse warming on phytoplankton and zooplankton communities in fishless alpine ponds // Limnol. Oceanogr. 2004. V. 49. Iss. 4. P. 1182–1190.
Tolotti M. Phytoplankton and littoral epilithic diatoms in high mountain lakes of the Adamello-Brenta Regional Park (Trentino, Italy) and their relation to trophic status and acidification risk // J. Limnol. 2001. V. 60. Iss. 2. P. 171–188.
Tolotti M., Fies H., Cantonati, M., Hansen C.M.E., Thaler B. Flagellate algae (Chrysophyceae, Dinophyceae, Cryptophyceae) in 48 high mountain lakes of the Northern and Southern slope of the Eastern Alps: biodiversity, taxa distribution and their driving variables // Hydrobiologia. 2003. V. 502. Iss. 1–3. P. 331–348.
Walseng B., Hessen D.O., Halvorsen G., Schartau A.K. Major contribution from littoral crustaceans to zooplankton species richness in lakes // Limnol. Oceanogr. 2006. V. 51. Iss. 6. P. 2600–2606.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


