Известия РАН. Серия биологическая, 2019, № 4, стр. 358-367
Различия в характере движения ядер GV-ооцитов мыши с разной конфигурацией хроматина
Е. А. Лаврентьева 1, *, К. В. Шишова 1, О. В. Зацепина 1
1 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
117197 Москва, ул. Миклухо-Маклая, 16/10, Россия
* E-mail: Lavrenteva-H@yandex.ru
Поступила в редакцию 22.02.2018
После доработки 01.03.2018
Принята к публикации 30.04.2018
Аннотация
С помощью цейтраферной видеосъемки установлены закономерности движения ядер в GV-ооцитах SN- и NSN-типов, различающихся по конфигурации хроматина и начальному положению ядра. Показано, что для ядер GV-ооцитов характерны два типа движения: направленное движение с периферии в центральную область ооцита, колебательные перемещения в области центра или периферии ооцита. Отмечено, что ядра ооцитов NSN-типа с начальным положением на периферии практически не изменяют локализацию, а ооциты гибнут через 3.5–4 ч после начала съемки.
Предовуляторные (germinal vesicle (GV)) ооциты мыши – финальная стадия развития герминативных клеток внутри яичника (Talbot et al., 1999; Brunet, Maro, 2005; Ferreira et al., 2009). Конечное созревание GV-ооцитов сопровождается разрушением ядра (зародышевого пузырька, germinal vesicle breakdown (GVBD)), образованием веретена первого мейотического деления и его остановкой в развитии на стадии метафазы второго мейотического деления до оплодотворения (Sathananthan et al., 2006; Coticchio et al., 2015). Принято считать, что компетентность предовуляторных GV-ооцитов мыши к созреванию определяется по двум основным морфологическим критериям: характеру организации хроматина и положению ядра ооцита. GV-ооциты мыши различаются по общей конфигурации хроматина, позволяющей разделять их на два основных типа: NSN (non-surrounded; NSN-ооциты) и SN (surrounded, SN-ооциты) (Debey et al., 1993; Zuccotti et al., 2005; De La Fuente, 2006). Для ооцитов NSN-типа характерно наличие блоков центромерного гетерохроматина (хромоцентров), контактирующих с ядрышкоподобным тельцем (ЯПТ, nucleolus-like body (NLB) (Tan et al., 2009). Для ооцитов SN-типа специфичен непрерывный слой хроматина на поверхности ЯПТ (Parfenov et al., 1989; Nikolova et al., 2017).
Ооциты NSN- и SN-типов различаются по транскрипционной активности, паттерну экспрессирующихся генов и компетентности к созреванию (Bouniol-Baly et al., 1999; Liu, Aoki, 2002; Shishova et al., 2015). У мыши наиболее компетентными считаются SN-ооциты, поскольку только они позволяют получать зародыши, способные in vitro развиваться до бластоцисты (Inoue et al., 2008; Zuccotti et al., 2011). Как NSN-, так и SN-ооциты способны достигать метафазы второго мейотического деления, однако эмбрионы, полученные in vitro после оплодотворения NSN-ооцитов, останавливаются в развитии на cтадии двух бластомеров (Zuccotti et al., 1998, 2002). Согласно имеющимся данным центральное положение ядра GV-ооцита на стадии профазы первого мейотического деления свидетельствует о его компетентности в созревании, т.е. способности к переходу на стадию GVBD, завершению первого мейотического деления и вступлению во второе (Sathananthan et al., 2006; Brunet, Maro, 2007; Bellone et al., 2009; Brunet, Verlhac, 2010; Coticchio et al., 2015). Стадия GVBD и последующее образование веретена деления метафазы первого мейотического деления происходят в области центра ооцита (Verlhac et al., 2000; Metchat et al., 2015). Миграция ядра GV-ооцита изучалась с точки зрения механизма его перемещения в центральную область ооцита (Alexandre et al., 1989; Almonacid et al., 2015), однако до сих пор остается неизвестной полная картина динамики движения ядер GV-ооцитов разных типов. Известно только, что миграция веретена к периферии ооцита, где оно локализуется на стадии метафазы II, как и перемещение ядра GV-ооцита с периферии в центр, происходит благодаря актиновому цитоскелету (Li et al., 2008; Almonacid et al., 2015, 2017).
По данным Беллоне c соавт. (Bellone et al., 2009), у мыши ~90% ядер в ооцитах NSN-типа и 65% ядер в ооцитах SN-типа располагаются в центральной области. Несмотря на то что GV-ооциты с периферическим положением ядра регулярно встречаются при выделении из яичников (Shishova et al., 2016), динамика движения их ядер до сих пор не изучена.
Цель работы – показать, что динамика движения ядер GV-ооцитов зависит как от конфигурации хроматина, так и от начального положения ядра ооцита.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперименты выполняли на самках мышей линии C57Bl/6 в возрасте 5–9 нед., приобретенных в питомнике лабораторных животных “Пущино” (Московская обл.). Все животные в момент получения из питомника были свободны от патогенной флоры, содержались в соответствии с законодательством о правилах работы с лабораторными животными, получали стандартизированный корм и воду ad libitum. Для индукции роста ооцитов мышам инъецировали 7.5 МЕ (международных единиц) фолликулостимулирующего гормона гонадотропина сыворотки жеребой кобылы (ГСЖК) в 100 мкл растворителя (Sigma-Aldrich, США). Через 46–48 ч животных умерщвляли путем цервикальной дислокации. Яичники извлекали и помещали в среду М2 (M7167, Sigma-Aldrich) с добавлением 100 мкг/мл дибутирил-циклического аденозинмонофосфата (dbcAMP (D0627, Sigma-Aldrich)) для предотвращения спонтанной активации ооцитов. GV-ооциты выделяли из яичников с помощью препарировальных игл под контролем стереомикроскопа Stemi2000 (Carl Zeiss, Германия). Все манипуляции с выделенными ооцитами проводили в среде М2+dbcAMP с использованием механических микропипеток Stripper (Origio, США) с внутренним диаметром капилляра 135 мкм.
После выделения GV-ооциты разделяли на два типа: ооциты с центральным и периферическим положением ядра, для чего использовали инвертированный микроскоп AxioObserver (Carl Zeiss). Конфигурацию хроматина определяли после окраски витальным ДНК-связывающим красителем Hoechst 33342 (H1399, Molecular Probes, США). Выделенные ооциты помещали в раствор Hoechst 33342 (0.1 мкг/мл, в среде М2 с добавлением 100 мкг/мл dbcAMP) на 5 мин при 22°С. Затем ооциты отмывали 2 раза по 5 мин в среде М2 с добавлением 100 мкг/мл dbcAMP. GV-ооциты переносили в среду α-MEM (12561056, Life Technologies, США) с добавлением 5%-ной (по объему) инактивированной фетальной бычьей сыворотки (SH30071.03, Hyclone, США), 2 мМ L-глутамина (Ф032, ПанЭко, Россия), 5 мМ таурина (T0625, Sigma-Aldrich) и 36 мкг/мл пирувата натрия (P4562, Sigma-Aldrich).
Несколько ооцитов, отмытых от dbcAMP в среде M2, помещали в каплю α-MEM объемом 10 мкл, находящуюся в центре чашки Петри со стеклянным дном диаметром 35 мм, и покрывали минеральным маслом во избежание испарения среды. Чашку с каплей помещали в камеру-инкубатор PMS1 (Carl Zeiss) с нагревательным столиком PS1 (Carl Zeiss) и фотографировали на инвертированном микроскопе AxioObserver Z1 (Carl Zeiss) CCD-камерой Hamamatsu (C10600-10B, 12 бит) (Hamamatsu Photonics K. K., Япония), используя объектив EC Plan-Neofluar DIC × 40/0.6 (числовая апертура). Съемку осуществляли в течение 1–5 ч с частотой 1 кадр в каждые 10 мин при 37°С, в увлажненной атмосфере с 5%-ной концентрацией CO2. В каждой временной точке проводилась съемка изображений по z-оси (3–7 кадров с интервалом 3–5 мкм) для более точного определения границ ядра GV-ооцита. Использование зеленого фильтра позволило минимизировать действие такого фактора, как проходящий свет от галогеновой лампы. По результатам съемки анализировали ооциты, вступившие в стадию GVBD.
Для определения положения ядра ооцита был использован метод, разработанный Леви с соавт. (Levi et al., 2013). Определение положения ядра относительно центра ооцита основано на вычислениях коэффициента ρ, который отражает расстояние между центрами ооцита (Cо) и ядра (Cя) и рассчитывается по формуле ρ = d(Cя – Со)/d(Rо – Rя), где d(Ся – Со) – расстояние между центрами ядра и ооцита (мкм), а d(Rя – Rо) – разность средних радиусов (R) ооцита и ядра (мкм). Определяли средние радиусы, а также центры ядер и ооцитов с использованием программных обеспечений ImageJ1.47 (NIH, США; http://imagej.nih.gov/ij/download.html) и AxioVision (Carl Zeiss; https:// www.zeiss.com/microscopy/int/products/microscope- software/axiovision.html). Коэффициент ρ – параметр, указывающий на позицию ядра внутри ооцита: при 0 < ρ ≤ 0.5 ядро ооцита занимает центральное положение, а при 0.5 < ρ ≤ 1 – периферическое. На основании этого было выбрано пороговое значение ρ = 0.5, по отношению к которому оценивали положение ядра ооцита (Levi et al., 2013). Статистическую обработку результатов проводили с помощью Microsoft Office Excel 2007.
Для определения положения ядра использовали живые GV-ооциты сразу после выделения или после фиксации в течение 30 мин 3%-ным раствором параформальдегида (ПФА) на фосфатно-солевом буфере (ФСБ) и окрашивания 1 мкг/мл DAPI (4',6-diamidino-2-phenylindole, dihydrochloride) в течение 10 мин. После окрашивания DAPI ооциты отмывали в ФСБ (2 × 10 мин), заключали в DAPI/Antifade (MetaSystems, США) и фотографировали в режиме флуоресценции и дифференциального интерференционного контраста по Номарскому (differential interference contrast (DIC)) с использованием конфокального лазерного сканирующего микроскопа LSM510 DuoScanMETA (Carl Zeiss) и коррекционного объектива LD Plan-Neofluar ×63 (числовая апертура 0.75)/DIC. Для расчета расстояния, пройденного ядром, а также средней скорости его движения для каждого GV-ооцита с помощью программы ImageJ1.47 определяли координаты центра ядра (x, y) на всех кадрах прижизненной видеосъемки до перехода ооцита на стадию GVBD. Было измерено по пять GV-ооцитов NSN- и SN-типов для каждого начального положения ядра. Для ооцитов NSN- и SN-типов с периферическим или центральным положением ядра рассчитывали суммарный путь, пройденный ядром в течение 60 мин, и среднюю скорость движения с учетом изменения его положения на каждом кадре. Для GV-ооцитов SN-типа с начальным положением ядра на периферии вычисляли его перемещение в область центра, сравнивая начальные координаты с координатами центра ядра после его перехода в центральную область ооцита (0 < ρ ≤ 0.5). Для того чтобы учитывать возможное изменение положения самого GV-ооцита в процессе съемки, для каждого кадра определяли координаты центра ооцита без блестящей оболочки.
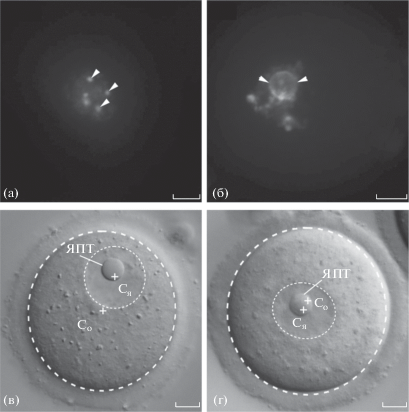
Конфигурацию хроматина в ядрах GV-ооцитов оценивали после окрашивания витальным ДНК-связывающим красителем Hoechst 33342 в концентрации 0.1 мкг/мл в течение 5 мин в среде М2 с добавлением 100 мкг/мл dbcAMP при 22°С. Затем ооциты отмывали в течение 5 мин в среде M2 с добавлением 100 мкг/мл dbcAMP и переносили в капли с этой же средой объемом 10 мкл, покрытые минеральным маслом (Ovoil, Vitrolife, Швеция), и просматривали под инвертированным флуоресцентным микроскопом Axiovert 200 с использованием объектива EC Plan-Neofluar ×40/0.75 (числовая апертура). Ооцит относили к NSN-типу, если в ядре выявлялись хромоцентры и отсутствовало кольцо конденсированного хроматина вокруг ЯПТ. Если в ядре ооцита хорошо выявлялось замкнутое кольцо гетерохроматина вокруг ЯПТ, ооцит относили к SN-типу (рис. 1а, 1б).
Рис. 1.
Классификация GV-ооцитов мыши. а, б – по конфигурации хроматина; в, г – по периферическому и центральному положениям ядра (зародышевого пузырька) на основе значений коэффициента 0.5 < ρ ≤ 1 и 0 < ρ ≤ 0.5 соответственно. Штриховые круги – контуры ооцита и ядра; крестиками отмечены центры ооцита и ядра (Со и Ся соответственно); головки стрелок – хромоцентры NSN (а) и кольцо гетерохроматина SN (б); ЯПТ – ядрышкоподобное тельце (в, г). Масштаб: 10 мкм.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Положение ядер в GV-ооцитах мыши. В общей сложности было изучено положение ядер в 307 GV-ооцитах мыши. На основании общей конфигурации хроматина (рис. 1а, 1б) ооциты были разделены на два типа: NSN-тип (126 ооцитов, или 41% общего числа), SN-тип (181 ооцитов, или 59%). К NSN-типу относили ооциты, в которых присутствовали хромоцентры, контактирующие с ЯПТ (рис. 1а), к SN-типу – ооциты, на поверхности ЯПТ которых присутствовал непрерывный слой конденсированного хроматина (рис. 1б). Расчетным путем были получены значения ρ для каждого ооцита (рис. 1в, 1г). Для этого определяли положение центра ядра (Ся) и центра ооцита (Со), а также маркировали контуры ядра и ооцита, что необходимо для расчетов среднего радиуса и коэффициента ρ (рис. 1в, 1г).
Суммирование результатов оценки положения ядер фиксированных ооцитов с разной конфигурацией хроматина показало, что доминирует центральное расположение ядра (57.3% ооцитов). Ооциты с периферическим положением ядра встречаются реже (42.7%). В табл. 1 приведены результаты определения положения ядер в ооцитах NSN- и SN-типов при ρ = 0.5. Видно, что в ооцитах NSN- и SN-типов ядра, занимающие центральное положение, встречаются чаще. Оценка соотношения числа GV-ооцитов каждого типа с периферическим и центральным положениями ядра показала, что чаще встречаются ооциты SN-типа с центральным положением ядра, а реже – ооциты NSN-типа с периферическим положением ядра (табл. 2).
Таблица 1.
Доля GV-ооцитов NSN- и SN-типов с центральным и периферическим положениями ядер при ρ = 0.5
| Положение ядра | ρ | NSN, % | SN, % |
|---|---|---|---|
| Центральное | 0 < ρ ≤ 0.5 | 54 (68) | 59.7 (108) |
| Периферическое | 0.5 < ρ ≤1 | 46 (58) | 40.3 (73) |
| Всего | 100 (126) | 100 (181) | |
Примечание. В скобках приведено число ооцитов; для табл. 1 и 2.
Таблица 2.
Частота встречаемости GV-ооцитов NSN- и SN-типов с различными положениями ядра
| Тип ооцита/положение ядра | Число ооцитов, % |
|---|---|
| NSN/периферическое | 18.9 (58) |
| NSN/центральное | 22.1 (68) |
| SN/периферическое | 23.8 (73) |
| SN/центральное | 35.2 (108) |
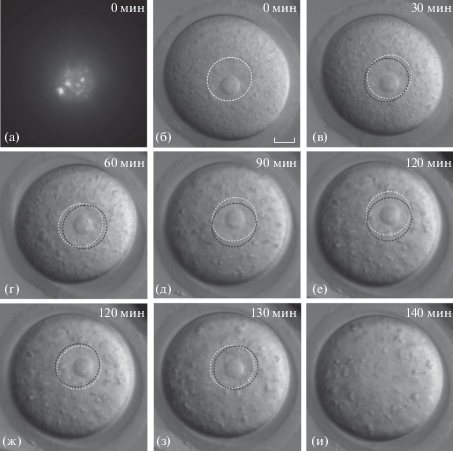
Прижизненные наблюдения; GV-ооциты NSN-типа. Было изучено 35 GV-ооцитов NSN-типа с периферическим расположением ядра (рис. 2) и 30 ооцитов с центральным положением ядра (рис. 3). Динамика движения и изменение структуры ядер ооцитов NSN-типа в каждой из этих групп было одинаковым. Пример динамики движения ядра ооцита NSN-типа с ядром на периферии показан на рис. 2а, 2б. По выбранному нами критерию оценки положения ядра ρ = 0.5 (Levi et al., 2013), на нулевой минуте съемки ядро занимает периферическое положение (ρ = 0.91; рис. 2б, белый штриховой контур). На последующих фотографиях (рис. 2в–2и) показан тот же ооцит вплоть до исчезновения видимой границы ядра (рис. 2и). Видно, что в течение первых 30 мин съемки (рис. 2б–2г) ядро совершает небольшие перемещения в районе периферии ооцита. С 100-й по 200-ю минуту ядро ооцита, находясь на периферии, не изменяет своего положения (рис. 2д–2ж). На 220-й минуте наблюдения значительно увеличиваются в размеры ооцита, без перехода на стадию GVBD, а ядро теряет четкие очертания (рис. 2з). К 300-й минуте размер GV-ооцита уменьшается и принимает свои первоначальные значения, при этом границы ядра и ЯПТ становятся практически неразличимыми. Эти результаты свидетельствуют о прекращении движения ядра и нарушении его нормальной структуры. Временное увеличение размера ооцита в процессе видеосъемки (рис. 2з) и остановка в развитии – признаки гибели ооцитов NSN-типа с ядром на периферии.
Рис. 2.
Покадровая визуализация GV-ооцита NSN-типа с периферическим положением ядра в течение 300 мин; для рис. 2–5. Здесь и на рис. 3–5 а – окраска Hoechst 33342; б–и – дифференциальный интерференционный контраст по Номарскому (DIC); белым контуром отмечено текущее положение ядра ооцита, черным – положение ядра на предыдущем кадре. Масштаб: 10 мкм.
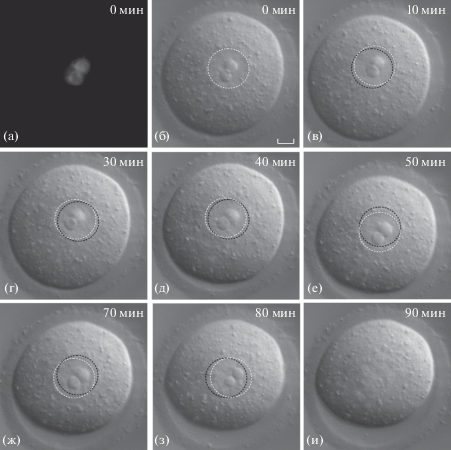
На рис. 3 представлен пример движения ядра GV-ооцита NSN-типа с начальным положением в центре ооцита (ρ = 0.29). Видно, что ядро ооцита совершает небольшие перемещения в области центра вплоть до стадии GVBD (рис. 3б–3и). Наиболее заметное смещение ядра относительно предыдущего положения наблюдалось через 90 мин (ρ = 0.33) после начала съемки (рис. 3e). Поскольку ρ на протяжении всего периода съемки варьирует незначительно (от 0.29 до 0.38 в период 0–130 мин), можно сделать вывод, что ядра GV-ооцитов такого типа сохраняют центральное положение вплоть до стадии GVBD.
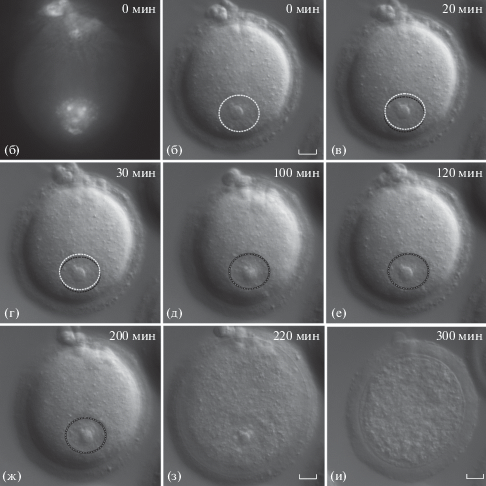
GV-ооциты SN-типа. Было изучено по 30 ооцитов SN-типа с периферическим и центральным расположениями ядер. На рис. 4 представлены результаты наблюдения движения ядра GV-ооцита SN-типа с начальным расположением на периферии. Отчетливо видно, что ядро ооцита постепенно перемещается с периферии к центру, достигая центрального положения через 120 мин (ρ = 0.17; рис. 4е). После этого ядро ооцита вплоть до стадии GVBD (рис. 4и, 180 мин после начала съемки) совершает только колебательные движения.
В соответствии с этим выбранный нами показатель положения ядра изменяется от 0.86 (0 мин, рис. 4б) до 0.17 (120 мин, рис. 4е) и далее практически не изменяется до стадии GVBD (0.23, рис. 4з). Таким образом, в отличие от ооцитов NSN-типа с исходно периферическим положением ядра периферически расположенные ядра ооцитов SN‑типа перемещаются в центр и сохраняют такое положение до стадии GVBD. На рис. 5 показано движение ядра GV-ооцита SN-типа с начальным положением в центре (ρ = 0.28). Как и в GV-ооците (рис. 3б–3и), ядро совершает небольшие перемещения в области центра вплоть до стадии GVBD (рис. 5б–5и). Значения ρ, оценивающие положение ядра GV-ооцита, подтверждают это наблюдение. Ядро находится в центре ооцита на протяжении всей видеосъемки, до вступления в стадию GVBD (рис. 5и), ρ = 0.28 (0 мин; рис. 5б) – 0.18 (80 мин; рис. 5з).
Данные о пройденном расстоянии и скорости движения центров ядер ооцитов NSN- и SN-типов, расположенных на периферии или в центральной области, приведены в табл. 3. Скорость движения ядра ооцита SN-типа с периферии в центр в 19 раз превышает скорость движения ядра на периферии GV-ооцита NSN-типа (табл. 3). Для ооцитов NSN- и SN-типов с центральным ядром характерна его высокая подвижность, которая совпадает в пределах погрешностей: средняя скорость движения центра составляет 0.24 ± 0.03 и 0.25 ± 0.01 мкм/мин для ооцитов NSN- и SN-типов соответственно (табл. 3).
Таблица 3.
Параметры (средние значения) динамики движения центра ядра GV-ооцитов NSN- и SN-типов в течение 60 мин с учетом ошибки определения среднего
| Тип ооцита/ начальное положение ядра |
Пройденный путь, мкм | Скорость, мкм/мин |
|---|---|---|
| SN/центральное | 14.76 ± 0.46 | 0.25 ± 0.01 |
| NSN/центральное | 14.65 ± 1.6 | 0.24 ± 0.03 |
| SN/периферическое | 12.69 ± 1.39 | 0.21 ± 0.02 |
| NSN/периферическое | 3.02 ± 0.12 | 0.011 ± 0.001 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Центральное положение ядра предовуляторного GV-ооцита мыши и конфигурация хроматина, характерная для SN-типа, – два основных критерия компетентности в созревании (Brunet, Maro, 2007; Bellone et al., 2009; Almonacid et al., 2017). Ооциты с центральным положением ядра преобладают по количеству и считаются наиболее предрасположенными к завершению мейотического созревания (Brunet, Maro, 2007; табл. 1). Однако GV-ооциты, в которых ядро при выделении расположено на периферии, способны достигать стадии GVBD (Levi et al., 2013). В ряде работ движение ядра изучалось в целях определения механизмов его перемещения в центральную область GV-ооцита, тогда как полная траектория его перемещений до стадии распада оставалась без внимания (Almonacid et al., 2015, 2017).
С помощью метода цейтраферной видеосъемки мы впервые определили характер движения ядер с периферическим и центральным положениями в GV-ооцитах с разной конфигурацией хроматина и показали, что для ядер GV-ооцитов характерны два типа движения: направленное движение зародышевого пузырька с периферии в центральную область ооцита (рис. 6а), колебательные перемещения на небольшие расстояния в области центра ооцита (рис. 6б) или периферии (рис. 6в). Было установлено, что характер движения ядра GV-ооцита зависит от положения ядра в начальный момент съемки. Так, в случае центрального положения ядра (рис. 3, 5, 6б) видно, что для ооцитов NSN- и SN-типов характерны перемещения ядра на небольшие расстояния в районе центра ооцита вплоть до стадии GVBD. Напротив, характер движения ядер GV-ооцитов, в начальный момент съемки расположенных на периферии, зависит от конфигурации хроматина (рис. 2, 4, 6а, в). В ооцитах SN-типа ядра перемещаются с периферии в центральную область (рис. 4, 6а), где совершают колебательные движения относительно центра ооцита, аналогично GV-ооцитам с исходно центрально расположенным ядром в начале съемки (рис. 3, 5, 6б). Характер движения ядер ооцитов NSN-типа с периферическим положением ядра (самая малочисленная группа среди использованных нами параметров (табл. 2)) отличается от всех ранее рассмотренных вариантов (рис. 2, 6в). Ядро ооцита такого типа совершает лишь незначительные перемещения на периферии, изменяет свою позицию в течение первого часа съемки, полностью останавливаясь к 100-й минуте эксперимента (рис. 2, 6в), что предшествует гибели ооцита. Таким образом, наименее подвижны как по скорости передвижения, так и по пройденному пути ядра ооцитов NSN-типа с периферическим положением ядра. С точки зрения направленного движения ядра в центр GV‑ооциты NSN-типа с периферическим положением наименее подвижны.
Рис. 6.
SN-, NSN/SN- и SN-типы движения ядер GV-ооцитов мыши (а–в соответственно). Внутри белого контура – центральная область GV-ооцита; белый и черный кресты – центры ядра и GV-ооцита соответственно. Стрелки – траектория движения центра ядра GV-ооцита.
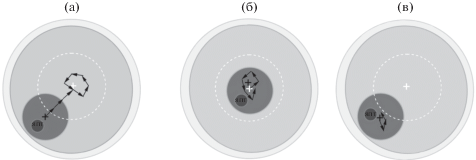
Эти результаты хорошо согласуются с данными по инкубации GV-ооцитов с цитохалазином D, во время которой скорость перемещения ядра стала <0.02 мкм/мин, тогда как в отсутствие ингибитора скорость перемещения ядра с периферии в центр составляла ~0.08 мкм/мин (Almonacid et al., 2015). Следовательно, можно сделать вывод, что в ооцитах NSN-типа с периферическим ядром может быть нарушена работа элементов цитоскелета, в частности актиновых филаментов.
Элементы цитоскелета не только отвечают за позиционирование ядра GV-ооцита (Almonacid et al., 2015), но и участвуют в миграции веретена и метафазных хромосом из области центра к периферии ооцита (Verlhac et al., 2000; Li et al., 2008). Средние скорости перемещения метафазной пластинки и веретена к периферии ооцита составляют 0.13 и 0.12 мкм/мин соответственно (Verlhac et al., 2000; Schuh, Ellenberg, 2007; Li et al., 2008). По нашим данным, скорость перемещения ядра с периферии в центральную область ооцита SN-типа составила 0.08 ± 0.01 мкм/мин, что не превышает скорости перемещения метафазной пластинки. Более высокая скорость движения метафазной пластинки может быть связана с участием в движении активного миозина Vb (Schuh, Ellenberg, 2007). Скорость движения ядра также зависит от вязкости цитоплазмы и силы трения, которая создается при его передвижении (Almonacid et al., 2015). Из-за меньших размеров метафазная пластинка при движении, вероятно, создает меньшую силу трения по сравнению с ядром GV-ооцита.
На основании полученных результатов можно сделать вывод, что один из критериев жизнеспособности GV-ооцита мыши – подвижность его ядра, которая должна сохраняться вплоть до его распада. Длительная иммобилизация ядра – признак гибели GV-ооцита. Высокой подвижностью обладают ядра GV-ооцитов NSN-типа с центрально-расположенным ядром и SN-типа с произвольным расположением ядра, а ядра GV-ооцитов NSN-типа с ядром на периферии практически не изменяют своей локализации. Перемещение ядра в центральную область обязательно для нормального развития GV-ооцита. Если в выделенном GV-ооците не происходит перемещения ядра с периферии в центральную область в течение 1–3 ч с момента наблюдения, как показано для ооцитов SN-типа (рис. 4), вероятно, такой ооцит нежизнеспособен. Ооциты NSN-типа с периферическим положением ядра – самая малочисленная и нежизнеспособная популяция GV-ооцитов мыши.
Работа выполнена при финансовой поддержке РФФИ (грант 16-04-01199).
Список литературы
Alexandre H., Van Cauwenberge A., Mulnard J. Involvement of microtubules and microfilaments in the control of the nuclear movement during maturation of mouse oocyte // Dev. Biol. 1989. V. 136. № 2. P. 311–320.
Almonacid M., Terret M.E., Verlhac M.H. Control of nucleus positioning in mouse oocytes // Semin. Cell Dev. Biol. 2018. V. 82. P. 34–40.
Almonacid M., Ahmed W.W., Bussonnier M., Mailly P., Betz T., Voituriez R., Gov N.S., Verlhac M.H. Active diffusion positions the nucleus in mouse oocytes // Nat. Cell Biol. 2015. V. 17. № 4. P. 470–479.
Bellone M., Zuccotti M., Redi C.A., Garagna S. The position of the germinal vesicle and the chromatin organization together provide a marker of the developmental competence of mouse antral oocytes // Reproduction. 2009. V. 138. № 4. P. 639–643.
Bouniol-Baly C., Hamraoui L., Guibert J., Beaujean N., Szöllösi M.S., Debey P. Differential transcriptional activity associated with chromatin configuration in fully grown mouse germinal vesicle oocytes // Biol. Reprod. 1999. V. 60. № 3. P. 580–587.
Brunet S., Maro B. Cytoskeleton and cell cycle control during meiotic maturation of the mouse oocyte: integrating time and space // Reproduction. 2005. V. 130. № 6. P. 801–811.
Brunet S., Maro B. Germinal vesicle position and meiotic maturation in mouse oocyte // Reproduction. 2007. V. 133. № 6. P. 1069–1072.
Brunet S., Verlhac M.H. Positioning to get out of meiosis: the asymmetry of division // Hum. Reprod. Update. 2010. V. 17. № 1. P. 68–75.
Coticchio G., Dal Canto M., Renzini M.M., Guglielmo M.C., Brambillasca F., Turchi D., Novara P.V., Fadini R. Oocyte maturation: gamete-somatic cells interactions, meiotic resumption, cytoskeletal dynamics and cytoplasmic reorganization // Hum. Reprod. Update. 2015. V. 21. № 4. P. 427–454.
Debey P., Szollosi M. S., Szollosi D., Vautier D., Girousse A., Besombes D. Competent mouse oocytes isolated from antral follicles exhibit different chromatin organization and follow different maturation dynamics // Mol. Reprod. Dev. 1993. V. 36. № 1. P. 59–74.
De La Fuente R. Chromatin modifications in the germinal vesicle (GV) of mammalian oocytes // Dev. Biol. 2006. V. 292. № 1. P. 1–12.
Ferreira E.M., Vireque A.A., Adona P.R., Meirelles F.V., Ferriani R.A., Navarro P.A.A.S. Cytoplasmic maturation of bovine oocytes: structural and biochemical modifications and acquisition of developmental competence // Theriogenology. 2009. V. 71. № 5. P. 836–848.
Inoue A., Nakajima R., Nagata M., Aoki F. Contribution of the oocyte nucleus and cytoplasm to the determination of meiotic and developmental competence in mice // Hum. Reprod. 2008. V. 23. № 6. P. 1377–1384.
Levi M., Ghetler Y., Shulman A., Shalgi R. Morphological and molecular markers are correlated with maturation-competence of human oocytes // Hum. Reprod. 2013. V. 28. № 9. P. 2482–2489.
Li H., Guo F., Rubinstein B., Li R. Actin-driven chromosomal motility leads to symmetry breaking in mammalian meiotic oocytes // Nat. Cell Biol. 2008. V. 10. P. 1301–1308.
Liu H., Aoki F. Transcriptional activity associated with meiotic competence in fully-grown mouse GV oocytes // Zygote. 2002. V. 10. № 4. P. 327–332.
Metchat A., Eguren M., Hossain J.M., Politi A.Z., Huet S., Ellenberg J. An actin-dependent spindle position checkpoint ensures the asymmetric division in mouse oocytes // Nat. Comm. 2015. V. 6. P. 7784.
Nikolova V., Markova M., Zhivkova R., Chakarova I., Hadzhinesheva V., Delimitreva S. Kariosphere, the Enigmatic “Surrounded Nucleolus” of Maturing Oocytes // Acta Morphol. Anthropol. 2017. V. 24. P. 1–2.
Parfenov V., Potchukalina G., Dudina L., Kostyuchek D., Gruzova M. Human antral follicles: oocyte nucleus and the karyosphere formation (electron microscopic and autoradiographic data) // Gamete Res. 1989. V. 22. № 2. P. 219–231.
Sathananthan A.H., Selvaraj K., Girijashankar M.L., Ganesh V., Selvaraj P., Trounson A.O. From oogonia to mature oocytes: inactivation of the maternal centrosome in humans // Microsc. Res. Tech. 2006. V. 69. № 6. P. 396–407.
Shishova K.V., Lavrentyeva E.A., Dobrucki J.W., Zatsepina O.V. Nucleolus-like bodies of fully-grown mouse oocytes contain key nucleolar proteins but are impoverished for rRNA // Dev. Biol. 2015. V. 397. № 2. P. 267–281.
Shishova K.V., Lavrentyeva E.A., Khamidullina A.I., Zatsepina O.V. Position of the nucleus in mouse germinal vesicle–stage oocytes with different chromatin configurations // Russ. J. Dev. Biol. 2016. V. 47. № 6. P. 313–319.
Schuh M., Ellenberg J. Self-organization of MTOCs replaces centrosome function during acentrosomal spindle assembly in live mouse oocytes // Cell. 2007. V. 130. P. 484–498
Talbot P., Geiske C., Knoll M. Oocyte pickup by the mammalian oviduct // Mol. Biol. Cell. 1999. V. 10. № 1. P. 5–8.
Tan J.H., Wang H.L., Sun X.S., Liu Y., Sui H.S., Zhang J. Chromatin configurations in the germinal vesicle of mammalian oocytes // Mol. Hum. Reprod. 2009. V. 15. № 1. P. 1–9.
Verlhac M.H., Lefebvre C., Guillaud P., Rassinier P., Maro B. Asymmetric division in mouse oocytes: with or without Mos // Curr. Biol. 2000. V. 10. № 20. P. 1303–1306.
Zuccotti M., Garagna S., Merico V., Monti M., Redi C.A. Chromatin organisation and nuclear architecture in growing mouse oocytes // Mol. Cell Endocrinol. 2005. V. 234. № 1–2. P. 11–17.
Zuccotti M., Merico V., Cecconi S., Redi C.A., Garagna S. What does it take to make a developmentally competent mammalian egg? // Hum. Reprod. Update. 2011. V. 17. № 4. P. 525–540.
Zuccotti M., Rossi P.G., Martinez A., Garagna S., Forabosco A., Redi C.A. Meiotic and developmental competence of mouse antral oocytes // Biol. Reprod. 1998. V. 58. № 3. P. 700–704.
Zuccotti M., Ponce R.H., Boiani M., Guizzardi S., Govoni P., Scandroglio R., Garagna S., Redi C.A. The analysis of chromatin organisation allows selection of mouse antral oocytes competent for development to blastocyst // Zygote. 2002. V. 10. № 1. P. 73–78.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая