Известия РАН. Серия биологическая, 2019, № 5, стр. 551-560
Феномен редукции органов в эволюции легочных моллюсков
А. А. Шилейко *
Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
* E-mail: asch0829@gmail.com
Поступила в редакцию 04.03.2019
После доработки 15.04.2019
Принята к публикации 15.04.2019
Аннотация
Установлено, что среди всех органов и систем легочных моллюсков лишь раковина и элементы репродуктивного тракта – видимые субъекты редукционных изменений. Отмечено, что редукция раковины в различных ветвях подкласса Pulmonata (в основном внутри надотряда Stylommatophora) происходила многократно (не менее 20 раз). Редукция придаточных органов репродуктивного тракта осуществлялась либо путем одномоментных мутаций, либо постепенно в цепи поколений. Названа вероятная причина появления придаточных органов репродуктивного тракта – необходимость создания изолирующих механизмов для предотвращения интрогрессии. Предполагается, что в ходе эволюции морфологические изолирующие механизмы заменяются менее энергозатратными этологическими, биохимическими и физиологическими механизмами, что стимулирует редукцию аксессорных органов репродуктивного тракта.
Редукция органа – уменьшение его размера, связанное обычно с ослаблением его функции. Один из главных вопросов: редукция каких органов может происходить? Рассмотрим основные компоненты организма легочного моллюска.
Раковина. Известно множество примеров редукции экзоскелета на всех стадиях – от нормальной многооборотной раковины до конхиолиновой пластинки, инкрустированной известковыми гранулами и полностью скрытой под мантией. Нередко можно проследить основные этапы редукции раковины в цепи родственных рецентных таксонов (Лихарев, Виктор, 1980; Schileyko, 2016).
Цефалоподиум и слагающие его элементы. Случаи редукции цефалоподиума отсутствуют, но у некоторых улиток маленького размера (Vertiginoidea) нижние щупальца отсутствуют. Это явление может считаться редукцией; оно несомненно вторично и связано с миниатюризацией.
Нервная система. Случаев редукции не наблюдается.
Пищеварительная система. Случаи редукции системы отсутствуют, но у единственного вида рода Careoradula (сем. Streptaxidae), живущего на Сейшельских о-вах, полностью отсутствуют радула и одонтофор (Gerlach, van Bruggen, 1998). У хищных моллюсков кишечник укорочен (формально можно говорить о редукции), что связано со спецификой пищевых объектов. Кроме того, у хищных пульмонат (Oleacinidae, Streptaxidae, Trigonochlamydidae, Daudebardiidae) более или менее редуцирована челюсть, что определяется механизмом поимки и заглатывания жертвы (Schileyko, 1966; Лихарев, Виктор, 1980).
Экскреторная система. Известные трансформации почки и мочеточников (Pilsbry, 1900; Baker, 1955; Шилейко, 1976) под понятие “редукция” не подпадают.
Респираторная система. Случаи редукции неизвестны, но у слизней легкое занимает сравнительно меньший объем, чем у таксономически близких улиток. Видимо, это связано с частичным погружением висцерального мешка в ткани цефалоподиума, некоторым уменьшением объема мешка и возрастанием роли кожного дыхания по мере утраты раковины (Лихарев, Виктор, 1980).
Циркуляторная система. Случаи редукции не установлены, но у большинства мелких улиток (Vertigo, Truncatellina, Punctum) васкуляризация крыши легкого очень слабо развита.
Осевая мускулатура. Случаев редукции не наблюдается, но по мере утраты раковины колумеллярный мускул укорачивается – прямое следствие редукции раковины.
Репродуктивный тракт. Случаи редукции этого аппарата в целом неизвестны, но имеются многочисленные примеры редукции, вплоть до полного исчезновения, различных дополнительных органов и их элементов (флагеллум, стилофоры и их дериваты, слизистые железы, саркобелум и его модификации, пениальный или эпифаллиальный цэкум и т.п.). Кроме того, известны примеры частичной редукции копулятивного аппарата (гемифаллия) у Succineidae (Patterson, 1968) и Zonitoides nitidus (Müller, 1774) (Gastrodontidae) (Jordaens et al., 1998), a также афаллии, т.е. полного исчезновения пениса и, соответственно, пениального ретрактора, например, у Spermodea lamellata (Jeffreys, 1830) и у видов рода Vallonia (Valloniidae) или в популяциях Chondrina clienta (Westerlund, 1883) (Chondrinidae), где наряду с нормальными особями встречаются афалличные – в разных соотношениях (Baur et al., 1993).
Здесь рассматриваются только легочные моллюски, но редукция раковин – феномен, наблюдающийся не только в этой группе. Тенденция к утрате раковины наблюдается и среди заднежаберных (морские слизни Nudibranchia). Современные головоногие (кальмары, каракатицы, вампироморфы, осьминоги) также утратили наружную раковину; единственное исключение в современной фауне – род Nautilus (от трех до шести видов), сохранивший хорошо развитую раковину (“раковина” Argonauta не в счет, поскольку она не гомологична раковине прочих моллюсков и формируется только у самок).
Таким образом, часто и постоянно наблюдающаяся редукция (вплоть до полного исчезновения) у легочных моллюсков касается двух структур: раковины и придаточных органов репродуктивного тракта. Именно эти структуры отличаются у наземных пульмонат наибольшим разнообразием. Поэтому не должен вызывать удивления тот факт, что принимаемая в настоящее время система этих животных основана преимущественно на особенностях строения полового аппарата и (в меньшей степени) раковины.
РЕДУКЦИЯ РАКОВИНЫ
Проблемы, связанные с редукцией раковины, и эволюционные последствия этого процесса были подробно рассмотрены ранее (Шилейко, 2003, 2012; Schileyko, 2014, 2016), поэтому остановимся вкратце лишь на основных положениях.
Раковина представляет собой относительно эффективную защиту наземного моллюска от обезвоживания и нападений хищников, но, будучи пассивным средством защиты, часто становится тормозом биологической эволюции, поскольку на любые внешние воздействия улитка способна ответить единственной стереотипной реакцией – втягиваться в раковину.
Слизень, лишенный внешней раковины, должен активно выбирать способ реагирования на внешнее воздействие – остаться на месте, сменить местоположение, уползти в укрытие либо избрать иную линию поведения. Другими словами, слизни, характеризующиеся более гибким поведением, должны быть “умнее” улиток. В пользу этого предположения свидетельствует тот факт, что плотность синапсов в процеребруме слизня Limax maximus намного выше, чем в мозге улитки Helix pomatia (Zs.-Nagy, Sakharov, 1970). Поэтому естественно, что сейчас мы наблюдаем широко распространенную тенденцию к утрате раковины во многих таксонах наземных пульмонат: к настоящему времени установлено >20 случаев независимого становления морфотипа слизней и полуслизней (Шилейко, 2003, с. 149).
Табл. 1 дает представление о том, насколько феномен редукции раковины распространен среди стебельчатоглазых моллюсков (надотряд Stylommatophora).
Таблица 1.
Соотношение числа “раковинных” и “слизневых” таксонов в надотряде Stylommatophora
| Группа | Общее число таксонов родового ранга |
Число таксонов с редуцированной раковиной (слизни и полуслизни) |
|---|---|---|
| Подотряд Pupilloidei | ||
| инфраотряд Pupilloinei | 294 | 0 |
| инфраотряд Sagdoinei | 21 | 1 |
| Подотряд Achatinoidei | 636 | 6 |
| Подотряд Oleacinoidei | 202 | 4 |
| Подотряд Limacoidei | ||
| инфраотряд Еndodontoinei | 238 | 5 |
| инфраотряд Limacoinei | 857 | 129 |
| Подотряд Succineoidei | 26 | 5 |
У водных легочных моллюсков (надотряд Basommatophora) полного исчезновения раковины не бывает, и редукция раковины у них происходит до стадии колпачка, спиральная завитость которого практически не прослеживается (Ancylidae, Acroloxidae). Некоторые признаки начального этапа утраты раковины наблюдаются также у Myxas glutinosa (Müller, 1774) из сем. Lymnaeidae (раковина очень тонкостенная, последний оборот сильно вздут) и некоторых Physidae (помимо тонкостенной раковины и увеличенного последнего оборота, значительная часть раковины у многих членов этого семейства покрыта выростами мантии).
РЕДУКЦИЯ ЭЛЕМЕНТОВ РЕПРОДУКТИВНОГО ТРАКТА
Для дальнейшего анализа необходимо обсудить вопрос: какое состояние репродуктивного тракта первично для Pulmonata в целом, и для Stylommatophora в частности, – простота строения (дополнительные органы отсутствуют) или сложность (половой аппарат несет дополнительные органы)?
Есть основания предполагать, что плезиоморфное состояние для подкласса легочных моллюсков – простота. Такое предположение основано на том, что гениталии сидячеглазых (Basommatophora), как правило, лишены дополнительных органов, а стебельчатоглазые (Stylommatophora) произошли от базомматофорных предков, уже перешедших к наземному образу жизни.
Среди стебельчатоглазых существует целый ряд таксонов ранга семейства, репродуктивный тракт представителей которых всегда и, видимо, исходно имеет внешне простое строение: Partulidae, Endodontoidea, Achatinidae, Clavatoridae, Bulimulidae, Streptaxidae, Polygyridae, Acavidae, Urocoptidae, Clausiliidae, Zonitidae, Camaenidae, Pleurodontidae, Arionidae, Succineidae. Следовательно, эти таксоны выпадают из нашего рассмотрения.
Вместе с тем есть немало семейств, для которых исходно сложное строение репродуктивного тракта весьма характерно: Achatinellidae, Amastridae, Strobilopsidae, Spelaeodiscidae, Valloniidae, Pupillidae, Orculidae, Enidae + Pachnodidae, Sagdidae, Bradybaenidae, Xanthonychidae, Helminthoglyptidae, Epiphragmophoridae, Humboldtianidae, Elonidae, Sphincterochilidae, Cochlicellidae, Helicarionidae, Dyakiidae, Staffordiidae, Milacidae, Helicodontidae, Hygromiidae, Helicidae (Schileyko, 2006). Морфологические усложнения выражаются в появлении различных, иногда очень сложных, придаточных органов, располагающихся на дистальных участках репродуктивного тракта.
Случаи редукции дополнительных органов полового аппарата в перечисленных и некоторых других группах многочисленны и разнообразны. Так, среди ортуретральных таксонов (имеющих длинную почку и незамкнутые мочеточники), которые в целом характеризуются наличием своеобразного пениального аппендикса, состоящего из пяти отделов, имеется подсемейство Odontocycladinae (Orculidae). Оно представлено в Альпах двумя родственными монотипическими родами; у вида рода Walklea [W. rossmaessleri (Rossmaessler, 1838)] имеются нормально развитые аппендикс и цэкум, тогда как у вида рода Odontocyclas [O. kokeilii (Rossmaessler, 1837)] аппендикс рудиментарный, а цэкум отсутствует. В подсемействе Orculinae мы видим серию родов Orculella–Schileykula–Orcula: виды рода Orculella имеют модифицированный, но вполне развитый аппендикс, у видов рода Schileykula аппендикс рудиментарный, у видов рода Orcula он отсутствует. Попутно отметим, что у видов южно-африканских родов Anisoloma, Fauxulella и Fauxulus, традиционно относимых к Orculidae, аппендикс также отсутствует. Надо отметить, что африканские “Orculidae”, вполне вероятно, представляют собой отдельное семейство Fauxulidae (Harl et al., 2017), и редукция аппендикса у европейских и африканских групп происходила независимо (Schileyko, 2012).
В пределах обширного тропического семейства Achatinellidae, включающего в себя 45 таксонов родового ранга, можно проследить все стадии редукции пениального аппендикса (Cooke, Kondo, 1960; Schileyko, 1998).
Родственные семейства Pupillidae и Vertiginidae различаются среди прочих признаков тем, что у первых пениальный аппендикс нормально развит, а у вторых этот орган отсутствует. Правда, родство между этими семействами может оказаться не столь уж близким (Pokryszko, 1994).
Для семейства Enidae наличие пениального аппендикса традиционного облика весьма характерно, но у представителей нескольких родов и подродов аппендикс полностью отсутствует (Mordania s. str., Cyrenaeus, Chondrula, Meijeriella и др.). В том же семействе среди трех близкородственных родов Multidentulinae виды рода Multidentula имеют как дивертикул протока семяприемника, так и пениальный аппендикс, виды Improvisa имеют аппендикс, но лишены дивертикула, виды Senaridenta имеют дивертикул, но аппендикс у них отсутствует (Шилейко, 1984). По существу три указанных рода диагностируются в основном именно комбинациями наличия/отсутствия названных органов.
В том же семействе Enidae кавказский вид Adzharia renschi Hesse, 1933 известен по двум экземплярам, у одного из которых дивертикул протока семяприемника имеется, тогда как у другого дивертикул отсутствует. Пениального аппендикса у обоих экземпляров нет (Hesse, 1933). Существенно, что ни у одного вида Enidae не зафиксирован в рудиментарном состоянии: либо он нормально развит, либо полностью отсутствует.
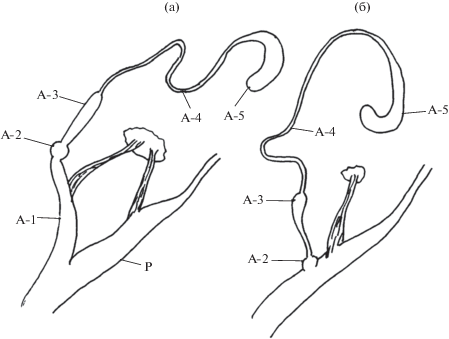
В некоторых популяциях двух других представителей Enidae (крымского Brephulopsis bidens (Krynicki, 1833) и азиатского Geminula isseliana callilabris (Boettger, 1889)) установлен очень редкий случай – частичная редукция пениального аппендикса за счет “выпадения” его базального отдела (А-1) (рис. 1). Примеры такой частичной редукции пока ограничиваются только двумя названными видами (Лившиц, Шилейко, 1978; Шилейко, 1984).
Рис. 1.
Частичная редукция пениального аппендикса у Brephulopsis bidens (Enidae). (a) – особь с нормально развитым пениальным аппендиксом, (б) – особь, у которой базальный отдел аппендикса (А-1) отсутствует. А-1–А-5 – отделы пениального аппендикса, Р – пенис.
В семействе Bradybaenidae члены Aegistinae имеют флагеллум, тогда как у Bradybaeninae флагеллум отсутствует. В рудиментарном состоянии флагеллум у видов Bradybaenidae (как и у Enidae) не известен – этот орган либо нормально развит, либо совсем отсутствует.
Семейство Helminthoglyptidae (южная часть Северной Америки и Карибский регион) исходно характеризуется наличием стилофора и пары слизистых желез своеобразного строения. Однако имеется пара конхологических двойников – Cahillus greggi (Miller, 1972) и Eremariontoides argus (Edson, 1912), раковины которых практически неразличимы, но у первого вида строение репродуктивного тракта типично для семейства, тогда как у второго стилофор и слизистые железы отсутствуют (Miller, 1981; Schileyko, 2004). Отметим, что по остальным анатомическим признакам эти виды также практически не различаются; их ареалы очень узкие и разделены небольшим горным хребтом.
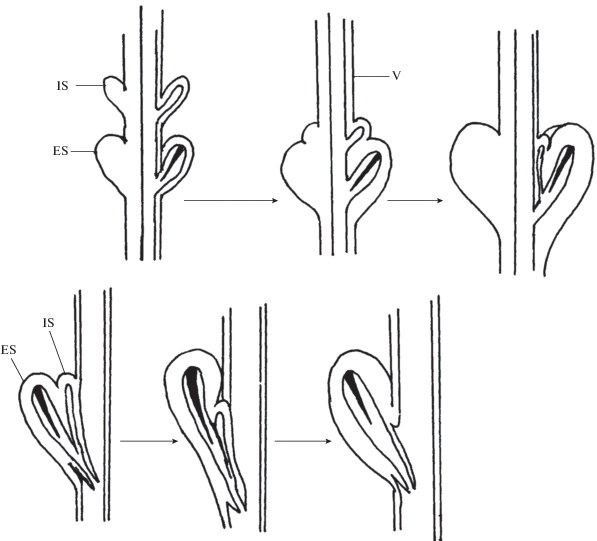
Среди Hygromiidae представители Trochulinae имеют четыре симметрично расположенных стилофора (верхняя пара рудиментарная, без стрел), тогда как у членов Hygromiinae имеются два стилофора, занимающих унилатеральное положение на вагине (верхний рудиментарный и стрелы не содержит) (рис. 2).
Рис. 2.
Стадии редукции верхних стилофоров у Trochulinae (верхний ряд) и Hygromiinae (нижний ряд). Стрелы зачернены. ES – наружный (нижний) стилофор, IS – внутренний (верхний) стилофор, V – вагина.
В составе семейства Helicidae почти все представители рода Helix имеют стилофор и ветвящиеся слизистые железы. Однако у H. (Naegelea) salomonica Nägele, 1899 – единственного представителя подрода – как стилофор, так и слизистые железы полностью отсутствуют. Во всем обширном семействе, насчитывающем >70 таксонов родового ранга и ~400 видов и подвидов (включая Ariantinae), это единственный вид, у которого отсутствуют придаточные органы.
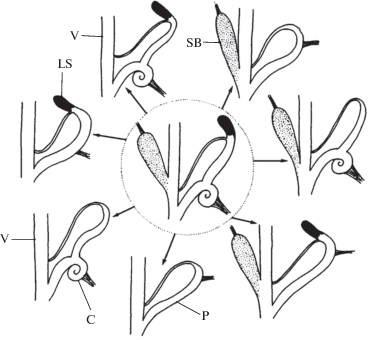
Обширное (преимущественно тропическое) надсемейство Helicarionoidea (Helicarionidae, Ariophantidae, Euconulidae) исходно характеризуется очень сложным строением полового аппарата, включающего в себя в полном наборе саркобелум, прямой или спиральнозавитый цэкум и известковый мешок (lime sac). Однако известно множество таксонов родового ранга, у представителей которых дополнительные органы отсутствуют во всех возможных комбинациях, включая полное исчезновение всех придатков (рис. 3).
Рис. 3.
Исходное строение репродуктивного тракта Helicarionoidea (в центре) и варианты редукции придаточных органов в разных родах (Шилейко, 1991). С – цэкум, LS – известковый мешок, Р – пенис, SB – саркобелум, V – вагина.
Число примеров редукции придатков можно многократно увеличить, но и приведенных фактов достаточно, чтобы убедиться в том, что редукция дополнительных органов репродуктивного тракта у значительной части легочных моллюсков – обычное и широко распространенное явление.
СПОСОБЫ РЕДУКЦИИ
Редукция может осуществляться двумя способами: эволюционно, в цепи поколений, или “мгновенно”, за счет единичных мутаций. Очевидно, что редукция раковины может происходить только эволюционно и мутагенный способ утраты раковины исключается. Мутации по конхологическим признакам ограничиваются, как правило, направлением завивания раковины (по часовой стрелке или против часовой стрелки), и, кроме направления спирали завитка, любые трансформации раковины происходят, за редчайшими исключениями, только эволюционно.
Отдельного упоминания заслуживает явление деколляции раковины, т.е. утраты нескольких верхних оборотов по достижении улиткой определенного возраста. Эта особенность наблюдается только у моллюсков с высокой и узкой раковиной (Subulinidae, Urocoptidae, Clausiliidae) и связана, вероятно, с тем, что управлять укороченной раковиной легче, чем высокой. Формально это явление можно расценить как частичную редукцию, но надо подчеркнуть, что деколляция обеспечивается сложными поведенческими, биохимическими и физиологическими механизмами. Так, прямые наблюдения за поведением особей Rumina decollata (Linnaeus, 1758) (Subulinidae) показали, что улитка активно освобождается от верхних оборотов, постукивая раковиной о камень. Перед началом деколляции внутренние органы, занимавшие верхние обороты (это в основном гепатопанкреас), опускаются ниже линии отлома, и на этом месте формируется сплошная известковая перегородка, изолирующая висцеральный мешок от внешней среды (Hochpöckler, Kothbauer, 1975; Kat, 1981).
Редукция придаточных органов репродуктивного тракта происходит обоими путями. Постепенная редукция – более ортодоксальный способ, есть возможность проследить все стадии этого процесса на современном материале. Этот способ установлен, например, для таких коррелятивно связанных органов, как флагеллум и дивертикул протока семяприемника (во флагеллуме формируется хвостовая нить сперматофора, который затем передается в дивертикул партнера). Постепенная редукция характерна также для верхней пары стилофоров у Hygromiidae, где можно проследить все стадии редукции среди видов одного рода или близких родов. Упомянутое семейство Achatinellidae тоже может послужить примером постепенной редукции пениального аппендикса. Слизистые железы эндемика австрийских Альп Cylindrus obtusus (Draparnaud, 1805) (Helicidae) также демонстрируют все стадии редукции (Schileyko et al., 1997).
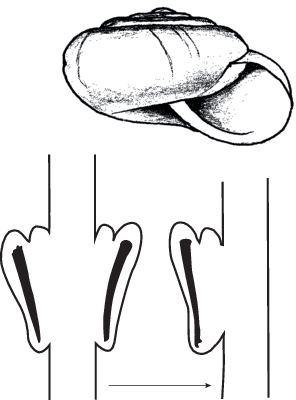
Яркий пример “мгновенной” и полной редукции органов показывает пара центрально-азиатских видов – Nanaja cumulata Schileyko, 1978 и Archaica heptapotamica (Lindholm, 1927) (Hygromiidae). Эти виды обитают совместно (в пределах одной осыпи) в соотношении примерно 50/50 и различаются единственным признаком: у первого вида имеются две пары стилофоров, а у второго – одна, причем стилофоры занимают на вагине унилатеральное положение (рис. 4). Резонно предположить, что здесь происходит мутагенная редукция одной пары стилофоров.
Рис. 4.
Внешний вид раковины и дистальной части вагины Nanaja cumulata (слева) и Archaica heptapotamica (справа). Стрелы зачернены. Раковины практически неразличимы.
Еще один случай, который можно расценить как “моментальную” редукцию путем мутагенеза также в сем. Hygromiidae, – кавказский вид Circassina circassica (Mousson, 1863). Этот вид состоит из четырех групп популяций (подвидов?), различающихся по комбинации утраченных придаточных органов: имеются как пара стилофоров, так и слизистые железы (С. circassica); стилофоры имеются, слизистые железы отсутствуют (С. akramowskii Schileyko, 1972); стилофоры отсутствуют, слизистые железы имеются (C. stephaniae Hudec et Lezhawa, 1970); отсутствуют как стилофоры, так и слизистые железы (C. simpla Schileyko, 1972). Надо подчеркнуть, что никто и никогда не видел этих органов в рудиментарном состоянии – они либо нормально развиты, либо полностью отсутствуют.
Единственное исключение из этой общей закономерности составляет центрально-азиатский (Ферганский хребет) род Leucarchaica c единственным видом L. rudimentifera Schileyko et Pazylov, 1990, у которого на одной стороне вагины имеется пара хорошо развитых, а на другой стороне – пара рудиментарных стилофоров (Шилейко, Пазылов, 1990).
Отдельного упоминания заслуживает очень редкий и своеобразный случай частичной редукции дополнительных органов (рис. 1). До сих пор этот способ известен лишь у двух видов Enidae – крымского B. bidens и азиатского G. isseliana callilabris. В популяциях этих видов среди особей с нормально развитым пениальным аппендиксом встречаются экземпляры, у которых “выпадает” базальный отдел аппендикса (А-1) и отдел А-2 впадает непосредственно в пенис (Шилейко, 1984).
Упомянутый пример Helix–Naegelea демонстрирует еще один случай одномоментного исчезновения всех аксессорных органов (стилофора и слизистых желез).
Все рассмотренные примеры показывают, что редукция дополнительных органов репродуктивного тракта представляет собой обычное и широко распространенное явление в эволюции пульмонат.
ВОЗМОЖНЫЕ ПРИЧИНЫ РЕДУКЦИИ
Предположено, что есть по меньшей мере две взаимосвязанные причины редукции дополнительных органов репродуктивного тракта:
необходимость экономии энергии. Для успешного функционирования аксессорных органов (стилофоры, слизистые железы и т.д.), состоящих в основном из железистой и мускульной тканей, нужны определенные затраты энергии. При исчезновении этих органов энергозатраты сокращаются. Кроме того, все элементы организма функционируют беспрерывно, тогда как половой аппарат со всеми его аксессуарами – эпизодически, в сезон размножения, но существует все время, расходует энергию постоянно;
возникновение более прогрессивных этологических, биохимических (феромоны) и/или физиологических изолирующих механизмов взамен морфологических. Поскольку редукция касается в основном компонентов репродуктивного тракта, логично предположить, что появление и дальнейшее усложнение различных придатков как-то связано с копуляцией в широком смысле слова, в частности с формированием и усложнением изолирующих механизмов, призванных предотвратить (или хотя бы минимизировать) риск интрогрессии. Есть основания думать, что наиболее архаичный путь к созданию таких механизмов – морфологические усложнения. Но появление дополнительных морфологических структур неизбежно влечет за собой, как отмечено, дополнительные затраты энергии.
Напомним, что выход из этого эволюционного тупика – замена морфологических изолирующих механизмов иными, требующими меньших затрат энергии.
РЕДУКЦИЯ И УВЕЛИЧЕНИЕ ЧИСЛА ЭЛЕМЕНТОВ
Теоретической базой дальнейшего анализа послужил принцип олигомеризации гомологичных органов (Догель, 1954). Сущность этого принципа заключается во множественной закладке новообразующихся структур; в ходе дальнейшей эволюции наблюдается олигомеризация, т.е. число элементов редуцируется.
Среди легочных моллюсков один из самых ярких примеров множественной закладки с последующей олигомеризацией – американский род Humboldtiana (Humboldtianidae). Большинство видов этого рода имеют четыре стилофора, каждый из которых содержит две стрелы, т.е. у гипотетического предка было, видимо, восемь стилофоров. Однако в составе этого рода имеется подрод Oreades, единственный вид которого – Humboldtiana (Oreades) porterae Thompson et Brewer, 2000 – полностью лишен как стилофоров, так и слизистых желез (Thompson, Brewer, 2000).
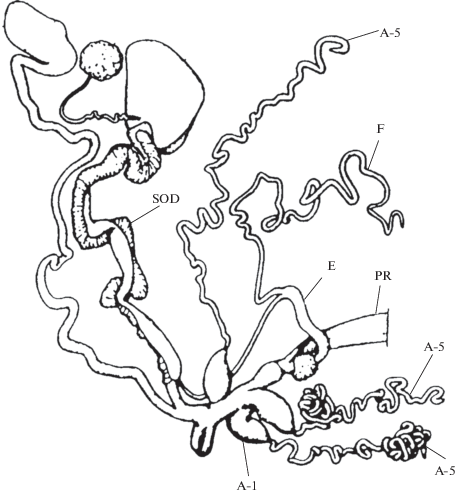
Обзор не будет полным, если не упомянуть о единственном известном среди легочных моллюсков случае обратного явления – увеличения числа гомологичных органов. Это Platysuccinea portoricensis (Shuttleworth, 1854), живущий в Пуэрто-Рико и на Малых Антильских островах. Названный вид выделен в монотипический род Platysuccinea и подсемейство Platysuccineinae (сем. Sagdidae) и имеет уникальную особенность – у него имеются три пениальных аппендикса идентичного строения (Baker, 1940) (рис. 5).
Рис. 5.
Пример умножения числа гомологичных органов: репродуктивный тракт Platysuccinea portoricensis. Имеются три одинаковых пениальных аппендикса (Baker, 1940). А-1 – базальный отдел пениального аппендикса, А-5 – концевой отдел пениального аппендикса, Е – эпифаллус, F – флагеллум, PR – ретрактор пениса, SOD – спермовидукт.
Поскольку половой аппарат у анцестральных пульмонат исходно имел, как отмечалось ранее, простое строение и такое строение сохраняется у ряда современных групп, то возникает вопрос о причинах усложнения, т.е. о причинах появления дополнительных (придаточных) органов. Ответ, вероятно, заключается в необходимости сформировать изолирующие механизмы, препятствующие интрогрессии. У представителей таксонов с исходно простым репродуктивным трактом образование таких механизмов могло происходить вследствие особенностей поведения при копуляции (брачные игры) или, например, из-за разницы в сроках размножения.
Другой способ сформировать изолирующий механизм можно условно назвать морфологическим, возникшим за счет образования различных придатков, создающих механические препятствия копуляции между родственными видами. По мере совершенствования физиологических, биохимических и этологических процессов необходимость в морфологических усложнениях постепенно отпадает, что и могло послужить причиной их редукции.
ИТОГОВЫЕ ЗАМЕЧАНИЯ
Приведенные примеры показывают, что упрощение репродуктивного тракта вследствие редукции дополнительных органов широко распространено во многих эволюционных ветвях легочных моллюсков. Редукция может осуществляться как постепенно, так и одномоментно, в результате мутаций.
Для обобщения изложенных фактов предлагается гипотеза, согласно которой появление дополнительных органов первоначально было связано с потребностью создать изолирующие механизмы между близкими видами, особенно во время бурного видообразования, начавшегося предположительно в конце мела–начале третичного периода. Наступление этого события могло быть связано с появлением и широким распространением покрытосеменных растений, предоставившим наземным моллюскам разнообразные и обильные пищевые ресурсы (Schileyko, 2014).
Однако морфологические усложнения требуют дополнительных энергетических затрат, а в последующем по мере формирования иных, более совершенных изолирующих механизмов (этологических, физиологических, биохимических) нужда в дополнительных морфологических структурах отпадает, и они подвергаются редукции.
Анализ приведенных примеров позволяет заключить, что под термином “редукция” скрываются два явления. Первое явление уместно назвать “тактической” редукцией. К этой категории можно отнести случаи, когда редукция связана с какими-то частными перестройками, например с редукцией кровеносной сети в крыше легкого и с отсутствием нижних щупалец у улиток малого размера (Vertiginoidea), что связано скорее всего с миниатюризацией. В эту же категорию можно включить отсутствие радулы и одонтофора у Careoradula (Streptaxidae), редукцию челюсти у хищных моллюсков, деколляцию у моллюсков с высокой раковиной, относительное уменьшение объема легкого у слизней и т.п.
Второе явление можно охарактеризовать как “стратегическую” редукцию, которая выражается в наличии некой общей тенденции в развитии группы. К этой категории резонно отнести, например, редукцию раковины, которая прослеживается во многих семействах подкласса легочных моллюсков и не связана с адаптацией к конкретным условиям или с частными морфологическими перестройками. Общая тенденция к утрате дополнительных органов репродуктивного тракта во многих семействах также должна расцениваться как появление “стратегической” редукции.
Автор благодарен анонимному рецензенту и Арк. А. Шилейко за ряд ценных замечаний.
Список литературы
Догель В.А. Олигомеризация гомологичных органов как один из главных путей эволюции животных. Л.: Изд-во ЛГУ, 1954. 368 с.
Лившиц Г.М., Шилейко А.А. Жизненный цикл моллюска Brephulopsis bidens // Экология. 1978. Bып. 5. С. 77–83.
Лихарев И.М., Виктор А.Й. Слизни фауны СССР и сопредельных стран (Gastropoda Terrestria Nuda) // Фауна СССР. Моллюски. Нов. сер. № 122. Т. 3. Bып. 5. Л.: Наука, 1980. 437 с.
Шилейко А.А. К биологии почвенных хищных слизней. Проблемы почвенной зоологии. М.: Наука, 1966. С. 155–156.
Шилейко А.А. Пути эволюции экскреторного аппарата Pulmonata и его филогенетическое значение // Зоол. журн. 1976. Т. 55. № 2. С. 215–225.
Шилейко А.А. Наземные моллюски подотряда Pupillina фауны СССР (Gastropoda, Pulmonata, Geophila) // Фауна СССР. Моллюски. Нов. сер. № 130. Т. 3. Bып. 3. Л.: Наука, 1984. 399 с.
Шилейко А.А. Вопросы филогении высших Pulmonata // Ruthenica. 1991. Т. 1. № 1–2. С. 3–16.
Шилейко А.А. Направления и способы эволюции наземных легочных моллюсков (Pulmonata, Stylommatophora) // Зоол. журн. 2003. Т. 82. № 2. С. 144–162.
Шилейко А.А. Разнообразие наземных моллюсков, их история и адаптации к жизни на суше // Биол. науки Казахстана. 2012. № 4. С. 44–65.
Шилейко А.А., Пазылов А.П. Направления эволюции Hygromiidae и описание нового рода из Средней Азии (Gastropoda, Pulmonata) // Изв. АH СССР. Cер. биол. 1990. № 6. С. 871–880.
Baker H.B. Some Antillean Sagdidae or Polygyridae // Nautilus. 1940. V. 54. № 2. P. 54–62.
Baker H.B. Heterurethrous and aulacopod // Nautilus. 1955. V. 68. № 4. P. 109–112.
Baur B., Chen X., Baur A. Genital dimorphism in natural populations of the land snail Chondrina clienta and the influence of the environment on its expression // J. Zool. London. 1993. V. 231. P. 275–284.
Cooke C.M., Kondo Y. Revision of Tornatellinidae and Achatinellidae // Bernice P. Bishop Museum Bull. 1960. V. 221. P. 1–303.
Gerlach J., van Bruggen A.C. A first record of a terrestrial mollusk without a radula // J. Mollusc. Stud. 1998. V. 64. P. 249–250.
Harl J., Haring E., Asami T., Sittenthaler T., Sattmann H., Páll-Gergely B. Molecular systematics of the land snail family Orculidae reveal polyphyly and deep splits within the clade Orthurethra (Gastropoda: Pulmonata) // Zool. J. Linn. Soc. 2017. V. XX. P. 1–17.
Hesse P. Zur Anatomie und Systematik der Familie Enidae // Arch. Naturg. Neue Folge. 1933. Bd 2. № 2. S. 145–224.
Hochpöckler F., Kothbauer H. Der Mechanismus der Dekollation bei Rumina decollata (L.) (Gastropoda: Stylommatophora) // Arch. Molluskenk. 1975. Bd 106. S. 119–121.
Jordaens K., Backeljau T., Ondina P., Reise H., Verhagen R. Allozyme homozygosity and phalli polymorphism in the land snail Zonitoides nitidus (Gastropoda, Pulmonata) // J. Zool. London. 1998. V. 246. P. 95–104.
Kat P.W. Shell shape changes in the Gastropoda: shell decollation in Rumina decollata // Veliger. 1981. V. 24. № 2. P. 115–119.
Miller W.B. A new genus and a new species of helminthoglyptid land snails from the Mojave Desert of California // Proc. Biol. Soc. Washington. 1981. V. 94. № 2. P. 437–444.
Patterson C.M. The reproductive anatomy and chromosome number of Quickia spurca (Gould) (Stylommatophora: Heterurethra: Succineidae) // Malac. Rev. 1968. V. 1. P. 1–13.
Pilsbry H.A. On the zoological position of Partula and Achatinella // Proc. Nat. Sci. Philadelphia. 1900. P. 561–567.
Pokryszko B.M. On the mono(?)phyly and classification of the Orthurethra/Pupilloidea (Gastropoda: Pulmonata: Stylommatophora) // Genus. 1994. V. 5. № 4. P. 371–390.
Schileyko A.A. Treatise on Recent Terrestrial Pulmonate Molluscs. Pt 1 // Ruthenica. 1998. Suppl. 2. P. 1–127.
Schileyko A.A. Treatise on Recent Terrestrial Pulmonate Molluscs. Pt 12 // Ruthenica. 2004. Suppl. 2. P. 1627–1763.
Schileyko A.A. Treatise on Recent Terrestrial Pulmonate Molluscs. Pt 13 // Ruthenica. 2006. Suppl. 2. P. 1765–1906.
Schileyko A.A. On the anatomy of Orculidae with special reference to the spermatophores (Gastropoda Pulmonata, Stylommatophora) // Ruthenica. 2012. V. 22. № 2. P. 141–158.
Schileyko A.A. On the early evolution of pulmonate mollusks. Arianta IV. Report on the workshop Alpine land snails // Naturhist. Mus. Wien. 2014. P. 13–16.
Schileyko A.A. Functional interrelations between conchological and anatomical characters in Stylommatophora (Mollusca, Gastropoda) // Аспекты биоразнообразия. Сб. трудов Зоол. музея МГУ. Т. 54. Вып. 1. Ч. 1. М.: KMK, 2016. С. 269–297.
Schileyko A.A., Baminger H., Sattmann H. On the variability of the distal genital tract of Cylindrus obtusus (Draparnaud, 1805) (Gastropoda: Helicidae) // Ann. Naturhist. Mus. Wien. 1997. V. 99B. P. 535–538.
Thompson F.G., Brewer G.P. Landsnails of the genus Humboldtiana from northern Mexico (Gastropoda, Pulmonata, Helicoidea, Humboldtianidae) // Bull. Florida Mus. Nat. Hist. 2000. V. 43. № 2. P. 49–77.
Zs.-Nagy I., Sakharov D.A. The fine structure of the procerebrum of pulmonate mollusks, Helix and Limax // Tiss. Cell. 1970. V. 2. № 3. P. 399–411.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


