Известия РАН. Серия биологическая, 2019, № 5, стр. 505-513
Сравнительное исследование влияния внутри- и межвидовых взаимодействий в группировках дождевых червей
А. В. Уваров 1, *, К. Илиева-Макулец 2, К. Карабан 2, Н. С. Яковенко 3, Я. Ухманьский 2
1 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
2 Cardinal Stefan Wyszyński University in Warsaw
01-815 Warsaw, Dewajtis 5, Poland
3 Зоологический институт им. И.И. Шмальгаузена НАНУ
01601 Киев-30, ул. Б. Хмельницкого, 15, Украина
* E-mail: av.uvarov@hotmail.com
Поступила в редакцию 04.03.2019
После доработки 15.04.2019
Принята к публикации 15.04.2019
Аннотация
Среди факторов, модифицирующих структуру ассоциаций и активность дождевых червей, влияние и относительная значимость внутри- и межвидовых взаимодействий изучены недостаточно. В полевых экспериментах проведено сравнение этих взаимодействий у люмбрицид – трофических конкурентов: почвенных детритофагов (Allolobophora chlorotica и Aporrectodea caliginosa) и потребителей листовой подстилки (Lumbricus rubellus и L. terrestris). Для каждого из четырех видов относительная значимость внутри- и межвидовых взаимодействий оценена путем сравнения состояния особей при низкой плотности данного вида (контроль) и при повышенной общей плотности люмбрицид в одно- и двухвидовых популяциях. Показано, что рост плотности населения (за счет особей как данного, так и конкурентного вида) обычно негативно влиял на состояние люмбрицид, затрагивая важнейшие показатели материнской генерации (рост, смертность, плодовитость особей), а также дочерней генерации (число и размеры произведенных коконов). Для трех из рассмотренных видов (кроме норного L. terrestris) обнаружены тренды, свидетельствующие о большей силе внутривидовых, чем межвидовых взаимодействий. Реакции видов определялись разными факторами: для подстилочного L. rubellus – трофической конкуренцией, а для почвенных Al. chlorotica и A. caliginosa (при избытке пищевых ресурсов) – предположительно конкуренцией за пространство.
Значение дождевых червей как ключевой группы организмов, активность которых во многом определяет структуру почвенного профиля, характер трансформации органического вещества и круговорота биогенов, функционирование детритных пищевых сетей и наземных экосистем в целом, хорошо известно (Edwards, Bohlen, 1996; Briones, 2014; Filser et al., 2016). В экосистемах умеренного пояса разнообразие и численность ассоциаций дождевых червей весьма изменчивы: от 1 до 10–15 видов, от единичных особей до тысяч экз./м2 (Petersen, Luxton, 1982; Dymond et al., 1997; Uvarov, 2009). Эти колебания зависят от состояния среды: климата, характера местообитания, растительности, типа почвы и качества подстилки и пр. Предполагается, что популяционные и межвидовые взаимодействия также существенно модифицируют структуру ассоциаций дождевых червей и функционирование отдельных видов в ассоциациях (Uvarov, 2009); однако этот вопрос изучен недостаточно.
Характер межвидовых взаимоотношений у дождевых червей определяется принадлежностью видов к той или иной функциональной группе (эпигейные, эндогейные, норные: по Bouché, 1977; Lee, 1985), типом жизненной стратегии (Satchell, 1980), а также специфическими качествами их биологии и поведения. Большой объем ресурсов и разнообразие способов разделения ниш в почве позволяют предположить, что синергические связи играют существенную роль в построении почвенных сообществ (Anderson, 1975; Стриганова, 2006; Wardle, 2006). Однако среди широкого спектра межвидовых реакций (от синергических до антагонистических), описанных для дождевых червей, преобладают взаимодействия негативного характера (Uvarov, 2009), что дает основания считать конкурентные отношения важным фактором структурирования ассоциаций люмбрицид (Curry, 1998; Decaëns et al., 2008; Xia et al., 2011). Прямые экспериментальные свидетельства межвидовой конкуренции были недавно представлены Чаном с соавт. (Chang et al., 2016). Большинство исследований внутривидовых отношений у люмбрицид вне зависимости от принадлежности видов к функциональной группе поддерживают наличие конкуренции за ресурсы и зависимой от плотности регуляции видовых популяций: так, с ростом плотности замедляются рост, созревание и скорость размножения, но повышается смертность (Uvarov, 2009, 2017).
Теоретически степень негативного влияния внутривидовых взаимодействий по сравнению с межвидовыми предполагается более существенной (Lowe, Butt, 2002); однако экспериментальные данные противоречивы. Например, у Octolasion lacteum замедление скорости размножения и роста при увеличении плотности популяции было более существенным, чем в присутствии Aporrectodea longa и Lumbricus terrestris. Напротив, у A. longa присутствие O. lacteum и особенно L. terrestris сильнее угнетало рост и размножение, чем рост собственной плотности (Butt, 1998). В других экспериментах с A. longa внутривидовые отношения оказывали большее влияние на изменения биомассы, чем соседство с Aporrectodea caliginosa; для последнего вида наблюдалась обратная тенденция в присутствии A. longa и L. terrestris (Dalby et al., 1998; Baker et al., 2002; Eriksen-Hamel, Whalen, 2007). Для пары Lumbricus rubellus и O. lacteum оценки скорости роста и выживания особей не позволили сделать определенных выводов о соотношении внутри- и межвидовых эффектов (Xia et al., 2011). Существует предположение, что относительная сила влияния внутри- и межвидовых отношений у дождевых червей имеет видовую специфику (Uvarov, 2009), но неясно, в какой мере эта специфика определяется принадлежностью видов к функциональным группам. Обобщение имеющихся данных затруднено также разнообразием условий опытов и обычно повышенной (по сравнению с естественной) плотностью люмбрицид в экспериментальных микрокосмах.
В данной работе оценивается относительная значимость внутривидовых взаимодействий (при росте плотности вида в естественных границах) и межвидовых взаимодействий (в двухвидовых ассоциациях) у дождевых червей. Опыты проведены в условиях, приближенных к естественным: люмбрицид содержали в почвенных системах большого объема, экспонировавшихся в лесной почве в течение большей части вегетационного сезона. Виды, сравниваемые в парных экспериментах, потребляют сходные ресурсы (листовая подстилка у L. terrestris и L. rubellus, почвенный детрит у A. caliginosa и Allolobophora chlorotica), т.е. являются активными трофическими конкурентами. Несмотря на последнее обстоятельство, мы предполагали, что отрицательные эффекты внутривидовых взаимодействий будут все же сильнее межвидовых. Предполагалось также, что у видов из одной функциональной группы, т.е. теоретически с более острыми конкурентными противоречиями (эндогейные A. caliginosa и Al. chlorotica), различия между внутри- и межвидовыми эффектами меньше, чем у видов, принадлежащих к разным функциональным группам (норный L. terrestris и эпигейный L. rubellus).
МАТЕРИАЛЫ И МЕТОДЫ
Подстилка и почва были собраны в буково-дубовом лесу (Мазурский ландшафтный парк, северо-восточная часть Польши) в начале июня 2006 г. В подлеске были липа, лещина, клен, травяной покров почти отсутствовал. Перезимовавшая подстилка толщиной 2–4 см была слабо стратифицирована (горизонты L и F/H) и состояла в основном из листьев дуба, бука и липы, заметно тронутых активностью почвенной биоты. Слабоструктурированная песчаная почва (haplic arenosol, классификация FAO/UNESCO) была отобрана из горизонта А (до глубины 15 см, рН 5.5). Содержание углерода в подстилке и почве составляло 37.3 и 2.7%, азота – 1.6 и 0.17% соответственно.
Эксперименты были проведены в буково-дубовом лесу на территории научной станции “Миколайки” Польской Академии Наук. Микрокосмы представляли собой пластмассовые цилиндры с внутренним диаметром 20 и высотой 60 см, с герметичной крышкой; в крышке было отверстие диаметром 2 см для газообмена. Отверстие и дно микрокосмов были заклеены газовой тканью для исключения бегства животных. В микрокосмах (наполовину вкопанных в землю) моделировали почвенные системы: 9.5 л почвы были перекрыты 100 г F/H-подстилки; граница почва/подстилка внутри и снаружи микрокосма совпадала. Количество подстилки в микрокосмах соответствовало ~2.1 кг сухой массы/м2, т.е. находилось у верхнего предела запасов подстилки, характерных для европейских широколиственных лесов (Базилевич, 1993). Почва была предварительно просеяна (4 мм) для гомогенизации и удаления корней и крупной фауны; подстилка (после выборки червей и хищной мезофауны) была перемешана. Для компенсации потерь микробиоты при подготовке подстилки, в микрокосмы было внесено по 50 мл водной суспензии, приготовленной из нативной подстилки. После трехнедельной стабилизации почвенных систем в полевых условиях, в микрокосмы поселяли дождевых червей, что означало начало эксперимента (10.07.2006 г.); его продолжительность составила 130 сут. Дождевых червей собирали в июне–начале июля в лесах Писка и Кампинос и до начала опытов содержали в контейнерах с почвой и подстилкой при 4°C.
Режим температуры в микрокосмах контролировали на уровне границы подстилка/почва с помощью термологгеров. Среднемесячные температуры в течение эксперимента составили 17.9 (июль), 16, 14.2, 10.5 и 5.2°C (ноябрь). Влажность исходно составляла 70% полной влагоемкости систем; в ходе опытов микрокосмы регулярно поливали, поддерживая благоприятный режим увлажнения. Количество добавленной воды соответствовало количеству осадков дождливых лета/осени 2006 г.
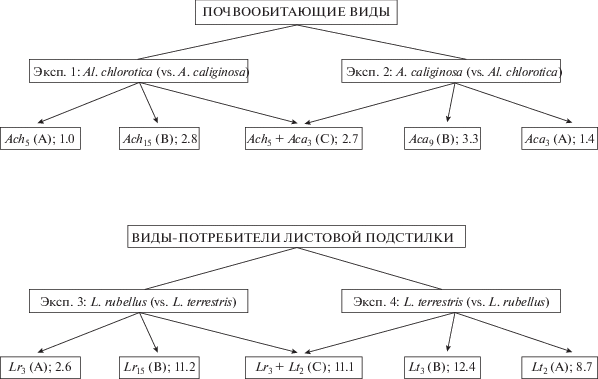
Схема исследований (рис. 1) включала четыре эксперимента с двумя парами видов дождевых червей – трофических конкурентов: почвенных детритофагов Al. chlorotica (Savigny) и A. caliginosa (Savigny) и потребителей листовой подстилки L. rubellus Hoffmeister и L. terrestris L. Все эти виды обычны для европейских лесов и часто встречаются совместно в ассоциациях люмбрицид. Эксперимент по каждому виду был представлен тремя вариантами: A – минимальная численность исследуемого вида в микрокосмах (контроль), B – моновидовые группировки повышенной плотности, C – двухвидовые группировки с численностью исследуемого вида, такой же, как в варианте A, и общей биомасcой, близкой к таковой в варианте B. Такая структура варианта C допускала сравнение измеряемых показателей исследуемого вида с контролем и исключала влияние изменчивости общей биомассы люмбрицид при сравнении вариантов B и C. Относительную силу внутри- и межвидовых взаимодействий у каждого вида оценивали при сравнении контроля A с вариантами B и C. Плотность люмбрицид в микрокосмах по сравнению с природными экосистемами варьировала от умеренной до высокой и составляла в вариантах A и B соответственно 5 и 15 экз. (150 и 450 экз./м2) для Al. chlorotica, 3 и 9 экз. (90 и 270 экз./м2) для A. caliginosa, 3 и 15 экз. (90 и 450 экз./м2) для L. rubellus, 2 и 3 экз. (60 и 90 экз./м2) для L. terrestris. В начале экспериментов виды Lumbricus были представлены половозрелыми, A. caliginosa – крупными ювенильными особями, а группировки Al. chlorotica содержали 40% половозрелых и 60% ювенильных особей. Живая масса особей (без содержимого кишечника) перед началом и после окончания экспериментов была определена после содержания червей на влажной фильтровальной бумаге в течение суток. При ликвидации экспериментов учитывали число погибших особей, долю половозрелых червей (для Al. chlorotica и A. caliginosa), продукцию потомства (сумма коконов и молодых червей) и индивидуальную массу коконов. Учет коконов и мелких ювенильных червей проводили путем тщательной разборки половины собранной подстилки и ~1 кг смешанной пробы почвы (отобранной с разной глубины почвенного слоя микрокосмов). Плодовитость червей выражали в расчете на особь или (для Al. chlorotica и A. caliginosa в связи с наличием неполовозрелых червей в исходной группе) на группу из пяти или трех особей соответственно. Удельная плодовитость (масса коконов/1 г массы червей в начале эксперимента) была мерой затрат энергии на воспроизводство. Помимо учетов люмбрицид оценивали и иные показатели состояния почвенной системы и населяющей ее биоты: общее дыхание сообщества и потери органического вещества в микрокосмах, биомассу и дыхание микроорганизмов, численность нанофауны (нематоды и коловратки-бделлоиды) и микрофауны (энхитреиды, ногохвостки, орибатиды, клещи-мезостигматиды). В данной работе мы не приводим детальный анализ этой информации, а используем ее как вспомогательную для объяснений результатов экспериментов по взаимодействию червей.
Рис. 1.
Варианты (A, B, C) четырех полевых экспериментов. Виды люмбрицид: Ach – Allolobophora chlorotica, Aca – Aporrectodea caliginosa, Lr – Lumbricus rubellus, Lt – L. terrestris. Подстрочный индекс в обозначениях видов – число особей данного вида, числа – средняя биомасса (г) люмбрицид в микрокосме.
Для статистической обработки экспериментов применяли однофакторный дисперсионный анализ (ANOVA) с последующим Тьюки-тестом. Данные в случае необходимости log-трансформировали, а смертность, изменение массы особей, долю половозрелых особей в процентах arcsin-трансформировали. Для сравнения доли половозрелых особей был применен непараметрический тест Краскела–Уоллиса. Повторность всех вариантов четырехкратная. Вычисления проведены в программе Statistica-6.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Почвообитающие виды. Эксперимент 1: Al. chlorotica vs. A. caliginosa. В контроле (вариант Ach5) все ювенильные особи к концу эксперимента достигли половозрелости, а смертность червей отсутствовала в отличие от двух других вариантов, где наблюдались единичные случаи гибели червей и не все особи достигли половозрелости (табл. 1). По сравнению с контролем как при росте плотности в моновидовых группировках Al. chlorotica, так и в присутствии A. caliginosa наблюдалось резкое снижение средней массы, общей и удельной плодовитости особей, а также уменьшение средней массы коконов (табл. 1). В плотных моновидовых группировках (Ach15) по сравнению с двухвидовыми (Ach5 + Aca3) были отмечены замедление достижения половозрелости ювенильными особями и тенденция к снижению общей и удельной плодовитости; однако средняя масса коконов была ниже в присутствии A. caliginosa.
Таблица 1.
Внутри- и межвидовые взаимодействия у люмбрицид: реакция на рост численности моновидовых группировок и на присутствие вида-конкурента
| Параметр | Эксп. 1: Al. chlorotica vs. A. caliginosa |
Эксп. 2: A. caliginosa vs. Al. chlorotica |
Эксп. 3: L. rubellus vs. L. terrestris |
Эксп. 4: L. terrestris vs. L. rubellus | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ach5 | Ach15 | Ach5 + Aca3 | Aca3 | Aca9 | Aca3 + Ach5 | Lr3 | Lr15 | Lr3 + Lt2 | Lt2 | Lt3 | Lt2 + Lr3 | |
| Смертность, % | 0 | 5 | 5 | 0 | 0 | 0 | 41.7 | 65 | 75 | 0 | 8.3 | 12.5 |
| Изменение средней массы особи, % | 49.1a | 17.2b | 14.3b | 58.2 | 44.9 | 1.3 | 15.2a | –50.7b | –23.9b | 6.4 | 2.5 | 5.9 |
| F2, 9 = 6.76, P = 0.016 | NS | F2, 7 = 81.6, P = 0.001 | NS | |||||||||
| Доля половозрелых особей, % | 100a | 68.5b | 95.0a | 100a | 77.8b | 100a | – | – | – | – | – | – |
| H2, 12 = 9.41, P = 0.009 | H2, 12 = 10.5, P = 0.005 | |||||||||||
| Число коконов, экз. | 43.3a | 14.7b | 23.6ab | 45.3a | 5.6b | 12.9ab | 27.5 | 9.5 | 17 | 13.2 | 20.2 | 8.7 |
| F2, 9 = 4.85, P = 0.037 | F2, 9 = 6.35, P = 0.019 | NS | NS | |||||||||
| Масса 1 кокона, мг | 13.1a | 12.7b | 11.8c | 25.4a | 23.1b | 22.1b | 13.2a | 12b | 11.8b | 64a | 59.1b | 55.6c |
| F2, 171 = 27.7, P = 0.001 | F2, 76 = 17.2, P = 0.001 | F2, 268 = 30.8, P = 0.001 | F2, 101 = 15, P = 0.001 | |||||||||
| Масса коконов /Wi, мг/г | 538.1a | 211.7b | 249.9ab | 774.4a | 121.9b | 210.9ab | 409.2 | 151.8 | 223.1 | 193.5 | 290.8 | 125.5 |
| F2, 9 = 4.36, P = 0.048 | F2, 9 = 4.84, P = 0.037 | NS | NS | |||||||||
Примечание. Число коконов для Al. chlorotica и A.caliginosa рассчитано на группу из пяти и трех особей соответственно, для прочих видов – на одну особь. Wi – масса особей данного вида в микрокосме в начале эксперимента. Для сравнения вариантов применены однофакторная ANOVA (F) или непараметрический тест Краскела–Уоллиса (H), нижние индексы у F и H – степени свободы. Достоверность различий (Р < 0.05) отмечена верхними индексами (разные буквы обозначают достоверные различия в пределах каждого эксперимента); NS – различия недостоверны; “–” – показатели отсутствуют. Обозначения вариантов представлены на рис. 1.
Почвообитающие виды. Эксперимент 2: A. caliginosa vs. Al. chlorotica. Во всех вариантах (табл. 1) отсутствовала смертность, а средняя масса особей увеличилась (в контроле – Aca3 – прирост был заметно, но статистически незначимо выше). Общая и удельная плодовитость была снижена в вариантах Aca9 и Aca3+ Ach5 по сравнению с контролем (достоверно в варианте Aca9). Масса коконов в обоих вариантах была достоверно ниже, чем в контроле. В варианте Aca9 степень достижения половозрелости к концу эксперимента составила лишь ¾ (против 100% в других вариантах), а плодовитость была в 2 раза ниже, чем в варианте (Aca3+Ach5) (табл. 1).
Потребители листовой подстилки. Эксперимент 3: L. rubellus vs. L. terrestris. Смертность особей L. rubellus была высокой во всех вариантах (табл. 1), но в контроле (Lr3) – заметно ниже; различие между контролем и двумя другими вариантами, взятыми вместе (Lr15 и Lr3+ Lt2), было близким к достоверному (F1, 10 = 3.44, P = 0.09). Средняя масса выживших особей к концу опыта в контроле увеличилась на 15%, но резко снизилась в других вариантах. Общая и удельная плодовитость червей в вариантах Lr15 и Lr3+ Lt2, взятых вместе, была ниже (при P < 0.1) по сравнению с контролем. Также (достоверно) снизилась средняя масса коконов (табл. 1). При сравнении вариантов Lr15 и Lr3+ Lt2 следует отметить явную тенденцию к ухудшению состояния червей L. rubellus в Lr15: увеличение (примерно вдвое) потерь массы особями и уменьшение (в 1.5–2 раза) их общей и удельной плодовитости.
Потребители листовой подстилки. Эксперимент 4: L. terrestris vs. L. rubellus. В контроле (Lt2) смертность L. terrestris отсутствовала, а в обоих других вариантах погибло по одной особи. Средняя масса особи за время эксперимента практически не изменилась. Значения общей и удельной продукции коконов оказались в 1.5–2 раза выше в варианте с тремя особями (Lt3), чем в обоих вариантах с двумя особями L. terrestris в микрокосме (табл. 1); различия по этим показателям между вариантом Lt3 и вариантами Lt2 и Lt2+Lr3, взятыми вместе, оказались достоверными (при P < 0.05). Средняя масса коконов достоверно снижалась в ряду вариантов Lt2–Lt3–Lt2+ Lr3 (табл. 1).
Позитивная реакция плодовитости L. terrestris на рост плотности особей этого вида очень интересна и нуждается в специальном эспериментальном подтверждении. В качестве предварительного объяснения этого результата укажем на возможность выбора более оптимального партнера для размножения в группах из трех особей в отличие от микрокосмов с двумя особями. Наличие и экологическое значение выбора партнера у L. terrestris, вида со сложной социальной организацией популяций, показали Михельс с соавт. (Michiels et al., 2001).
Сравнение влияния внутри- и межвидовых взаимодействий. Результаты экспериментов обнаружили у исследованных видов разнообразные негативные реакции на рост плотности группировки вне зависимости от того, обусловлен ли этот рост особями своего вида или вида-конкурента. Эти реакции отражали как изменения в состоянии самих червей (относительное снижение массы особей и рост смертности, замедление достижения половозрелости, снижение репродуктивного потенциала), так и последствия для дочерней генерации (уменьшение массы коконов). Те или иные негативные реакции на рост плотности наблюдались у всех видов независимо от типа питания (потребление почвенного детрита или листовой подстилки).
При рассмотрении особей материнской генерации у трех видов прослеживается ухудшение состояния червей в плотных моновидовых группировках по сравнению с двухвидовыми: замедление созревания (Al. chlorotica и A. caliginosa) и более резкая потеря массы тела (L. rubellus). У всех трех видов была отмечена также тенденция к снижению общей и удельной плодовитости в моновидовых по сравнению с двухвидовыми группировками; значения этих показателей в моновидовых группировках почвенных видов были достоверно ниже, чем в контроле. Следовательно, для этих видов положение о большей силе негативных внутривидовых, чем межвидовых взаимодействий (Lowe, Butt, 2002), проверяемое первой гипотезой данной работы, по-видимому, поддерживается.
Напротив, для L. terrestris данные о состоянии особей не позволили сделать четких выводов об относительной значимости внутри- и межвидовых взаимодействий. Повышение общей и удельной плодовитости в более плотных моновидовых группировках может свидетельствовать о позитивном значении возможности выбора партнера, отсутствующей в других вариантах. Поэтому для L. terrestris относительную значимость внутри- и межвидовых взаимодействий следует оценить в экспериментах с учетом специфического поведения особей и территориальной организации популяций, а также, возможно, и продолжительности жизненного цикла этого вида.
С другой стороны, реакции дочерней генерации оказались сходными у всех четырех видов: в плотных моновидовых группировках отмечены более крупные коконы, чем в двухвидовых группировках. Следовательно, в последнем случае стартовые условия (запас ресурсов) для роста особей дочерней генерации либо для зимовки коконов всех видов были менее благоприятны. Такой результат предполагает целесообразность рассмотрения проблемы внутри- и межвидовых взаимодействий в ряду последовательных генераций.
Сравнение относительной силы влияния внутри- и межвидовых взаимодействий у люмбрицид из разных экологических групп дало противоречивые результаты. Так, масса коконов у представителей всех экологических групп составляла 91–97% и 87–90% контрольных значений в плотных моно- и двухвидовых группировках соответственно. Общая и удельная продукция коконов у норного L. terrestris росла, тогда как у подстилочного L. rubellus и обоих почвенных видов она уменьшалась в плотных моновидовых по сравнению с двухвидовыми группировками. На данном этапе можно лишь констатировать, что влияния функциональной группы на соотношение внутри- и межвидовых эффектов у люмбрицид не обнаружено; таким образом, наша вторая гипотеза не подтвердилась.
Некоторые объяснения полученных результатов дают характеристики функциональных показателей почвенной системы и компонентов почвенного сообщества. Так, общее дыхание сообщества, потери органического вещества в почве и подстилке, биомасса и коэффициент удельного дыхания микроорганизмов были сходны в вариантах с почвенными люмбрицидами (Ach15, Ach5+ Aca3 и Aca9); между этими вариантами не обнаружено также значимых различий плотности важнейших групп животного населения – нанофауны, энхитреид и микроартропод. Следовательно, влияние червей на почвенные системы в этих вариантах с различной структурой населения, но близкими значениями биомассы люмбрицид было предположительно сходным. Согласно расчетам (Uvarov, 2016, 2017) потребление пищи почвенными люмбрицидами не превышало 4 г С за все время экспериментов; общие расходы углерода на дыхание микроорганизмов можно оценить приблизительно 10 г. В совокупности потери углерода за счет активности микроорганизмов и почвенных люмбрицид составили лишь небольшую часть исходных запасов органического вещества в почве микрокосма (~77 г только в верхних 10 см). Таким образом, отмеченные выше негативные реакции червей на рост плотности не связаны, по-видимому, с истощением кормовых ресурсов, а объясняются конкуренцией скорее за жизненное пространство, чем за доступную пищу. Следовательно, различия внутри- и межвидовых эффектов в близких по биомассе группировках Al. chlorotica (Ach15 и Ach5 + Aca3) и A. caliginosa (Aca9 и Ach5+ Aca3) при избытке пищевых ресурсов, вероятно, не были связаны с трофической конкуренцией.
Напротив, сравнение вариантов с потребителями подстилки (Lr15, Lr3+ Lt2 и Lt3) обнаружило ряд значимых различий в значениях функциональных показателей почвенной системы и численности животного населения. В частности, различия затронули биомассу микроорганизмов, интенсивность деструкции органического вещества, население трофических конкурентов люмбрицид – энхитреид и ногохвосток. Это свидетельствует о неоднозначных перестройках почвенных систем в группировках с близкой биомассой червей, но при разных комбинациях видов L. rubellus и L. terrestris.
Согласно расчетам потребление листовой подстилки червями L. rubellus достигало 6–7 г С (Uvarov, 2017), что в совокупности с микробным дыханием обеспечивало потери около половины органического вещества подстилки; одновременно снижалось качество кормового материала (росла доля грубых остатков) и условий среды в подстилке. Следовательно, реакции L. rubellus на рост плотности группировки могли быть обусловлены в значительной мере усилением дефицита пищевых ресурсов. Сравнение группировок Lr15 и Lr3+ Lt2 показало в варианте Lr15 сочетание худшего состояния и более низкой репродуктивной способности червей (табл. 1), а в населении микрофауны – замещение энхитреид, важных пищевых конкурентов подстилочных червей (Uvarov, Karaban, 2015), ногохвостками. Это позволяет предположить, что трофическая конкуренция имела в варианте Lr15 более существенное значение, чем в варианте Lr3+ Lt2.
Максимальные пищевые потребности люмбрицид в вариантах с L. terrestris были еще выше – до 9 г С (Uvarov, 2017), а листовая подстилка с поверхности почвы микрокосмов к концу опыта почти исчезла (она была частично сконцентрирована в норах L. terrestris). Однако острого дефицита пищевых ресурсов для червей L. terrestris не наблюдалось. Хотя в вариантах Lt3 и Lt2+ Lr3 погибло по одной особи, ухудшения состояния живых L. terrestris не было отмечено. Вероятным объяснением этого можно считать стимуляцию активности микроорганизмов при компостировании подстилки в норах L. terrestris (Tiunov, Scheu, 1999; Tiunov et al., 2001; Aira et al., 2009), благодаря чему ускоряются круговорот микробной биомассы и интенсивность деструкции органического вещества подстилки и почвы, что приводит к появлению дополнительных ресурсов питания червей. В нашем эксперименте об активизации микробной биомассы в микрокосмах с L. terrestris свидетельствовали повышенные значения метаболического коэффициента микробного дыхания (qO2) и общего дыхания микрокосмов.
ЗАКЛЮЧЕНИЕ
В градиентах естественной плотности дождевых червей рост плотности населения (за счет особей как своего вида, так и вида-конкурента) влиял на состояние особей и видовых популяций. Реакции люмбрицид затрагивали важнейшие показатели текущей генерации (рост, созревание и плодовитость особей, смертность), а также и дочерней генерации (число и размеры произведенных коконов). Независимо от принадлежности видов к функциональной группе, преобладали негативные тренды реакций на рост плотности, что свидетельствует о выраженной внутри- и межвидовой конкуренции у исследованных люмбрицид. Для трех видов обнаружены свидетельства большей силы внутривидовых, чем межвидовых негативных взаимодействий. Реакции видов определялись, вероятно, разными факторами: для подстилочного L. rubellus существенное значение имела трофическая конкуренция, тогда как для почвенных видов Al. chlorotica и A. caliginosa при избытке пищевых ресурсов более важной, по-видимому, была конкуренция за пространство. Определенных выводов об относительной значимости внутри- и межвидовых взаимодействий у норного вида L. terrestris сделать не удалось; такая оценка требует учета территориальной организации популяций и специфического поведения особей этого вида.
Результаты исследования показывают, что внутри- и межвидовая конкуренция может играть важную роль в регуляции структуры и динамики ассоциаций дождевых червей, являющихся одним из ключевых звеньев функционирования почвенной системы. По-видимому, справедливо положение о том, что относительная сила влияния внутри- и межвидовых отношений у дождевых червей имеет видовую специфику; однако этот вопрос нуждается в дальнейшей проработке.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Республики Польша (гранты 2P04F03030 и 4023/B/ P01/2010/38) и РФФИ (грант 06-04-49685).
Список литературы
Базилевич Н.И. Биологическая продуктивность экосистем Северной Евразии. М.: Наука, 1993. 293 с.
Cтриганова Б.Р. Системный анализ биоценотических связей в почвенных сообществах // I чтения памяти академика М.С. Гилярова: Йошкар-Ола, 1 октября 2002 г. М.: КМК, 2006. С. 16–38.
Aira M., McNamara N.P., Piearce T.G., Domínguez J. Microbial communities of Lumbricus terrestris L. middens: structure, activity, and changes through time in relation to earthworm presence // J. Soils Sediments. 2009. V. 9. P. 54–61.
Anderson J.M. The enigma of soil animal species diversity // Progress in Soil Zoology / Ed. Vanek J. Prague: Czechoslovak Acad. Sci., 1975. P. 51–58.
Baker G., Carter P., Barrett V., Hirth J., Mele P., Gourley C. Does the deep-burrowing earthworm, Aporrectodea longa, compete with resident earthworm communities when introduced to pastures in south-eastern Australia? // Eur. J. Soil Biol. 2002. V. 38. P. 39–42.
Bouché M.B. Strategies lombriciennes // Ecol. Bull. (Stockholm). 1977. V. 25. P. 122–132.
Briones M.J.I. Soil fauna and soil functions: a jigsaw puzzle // Front. Environ. Sci. 2014. V. 2. P. 1–22.
Butt K.R. Interactions between selected earthworm species: a preliminary, laboratory-based study // Appl. Soil Ecol. 1998. V. 9. P. 75–79.
Chang C.-H., Szlavecz K., Filley T., Buyer J.S., Bernard M.J., Pitz S.L. Belowground competition among invading detritivores // Ecology. 2016. V. 97(1). P. 160–170.
Curry J.P. Factors affecting earthworm abundance in soil // Earthworm Ecology / Ed. Edwards C.A. Boca Raton: St. Lucie Press, 1998. P. 37–64.
Dalby P.R., Baker G.H., Smith S.E. Competition and cocoon consumption by the earthworm Aporrectodea longa // Appl. Soil Ecol. 1998. V. 10. P. 127–136.
Decaëns T., Margerie P., Aubert M., Hedde M., Bureau M. Assembly rules within earthworm communities in North-Western France – A regional analysis // Appl. Soil Ecol. 2008. V. 39. P. 321–335.
Dymond P., Scheu S., Parkinson D. Density and distribution of Dendrobaena octaedra (Lumbricidae) in aspen and pine forests in the Canadian Rocky Mountains (Alberta) // Soil Biol. Biochem. 1997. V. 29. P. 265–273.
Edwards C.A., Bohlen P.J. Biology and ecology of earthworms. London: Chapman and Hall, 1996. 426 p.
Eriksen-Hamel N.S., Whalen J.K. Competitive interactions affect the growth of Aporrectodea caliginosa and Lumbricus terrestris (Oligochaeta: Lumbricidae) in single-and mixed species laboratory cultures // Eur. J. Soil Biol. 2007. V. 43. P. 142–150.
Filser J., Faber J.H., Tiunov A.V., Brussaard L., Frouz J., De Deyn G., Uvarov A.V., Berg M.P., Lavelle P., Loreau M., Wall D.H., Querner P., Eijsackers H., Jiménez J.J. Soil fauna: key to new carbon models // Soil. 2016. V. 2. P. 565–582.
Lee K.E. Earthworms, their ecology and relationships with soils and land use. Sydney: Acad. Press, 1985. 411 p.
Lowe C.N., Butt K.R. Growth of hatchling earthworms in the presence of adults: interactions in laboratory culture // Biol. Fertil. Soils. 2002. V. 35. P. 204–209.
Michiels N.K., Hohner A., Vorndran I.C. Precopulatory mate assessment in relation to body size in the earthworm Lumbricus terrestris: avoidance or dangerous liaisons? // Behav. Ecol. 2001. V. 12. P. 612–618.
Petersen H., Luxton M. A comparative analysis of soil fauna populations and their role in decomposition processes // Oikos. 1982. V. 39. P. 287–388.
Satchell J.E. r worms and K worms: a basis for classifying lumbricid earthworm strategies // Soil biology as related to land use practices. Proc. 7th Intern. Soil Zool. Colloq., Syracuse, 1979 / Ed. Dindal D.L. Washington: Environmental Protection Agency, 1980. P. 848–864.
Tiunov A.V., Scheu S. Microbial respiration, biomass, biovolume and nutrient status in Lumbricus terrestris L. burrow walls // Soil Biol. Biochem. 1999. V. 31. P. 2039–2048.
Tiunov A.V., Bonkowski M., Alphei J., Scheu S. Microflora, Protozoa and Nematoda in Lumbricus terrestris burrow walls: a laboratory experiment // Pedobiologia. 2001. V. 45. P. 46–60.
Uvarov A.V. Inter- and intraspecific interactions in lumbricid earthworms: Their role for earthworm performance and ecosystem functioning // Pedobiologia. 2009. V. 53. P. 1–27.
Uvarov A.V. Density-mediated earthworm effects on soil respiration // Polish J. Ecol. 2016. V. 64. P. 534–546.
Uvarov A.V. Density-dependent responses in some common lumbricid species // Pedobiologia. 2017. V. 61. P. 1–8.
Uvarov A.V., Karaban K. Do alterations in mesofauna community affect earthworms? // Oecologia. 2015. V. 179. P. 877–887.
Wardle D.A. The influence of biotic interactions on soil biodiversity // Ecol. Lett. 2006. V. 9. P. 870–886.
Xia L., Szlavecz K., Swan C.M., Burgess J.L. Inter- and intra-specific interactions of Lumbricus rubellus (Hoffmeister, 1843) and Octolasion lacteum (Örley, 1881) (Lumbricidae) and the implication for C cycling // Soil Biol. Biochem. 2011. V. 43. P. 1584–1590.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


