Известия РАН. Серия биологическая, 2019, № 5, стр. 485-494
Трофическое фракционирование изотопов углерода и азота (13C/12C и 15N/14N) грибоядными личинками двукрылых
А. Г. Зуев 1, *, О. Л. Розанова 1, С. М. Цуриков 1, 2, П. Л. Панченко 2, М. А. Ершова 2, Д. Д. Смолярова 2, М. Г. Кривошеина 1, А. В. Александрова 2, С. Б. Ивницкий 2, Ю. В. Малеева 2, А. В. Тиунов 1
1 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
2 Московский государственный университет им. М.В. Ломоносова, биологический ф-т
119991 Москва, Ленинские горы, 1, стр. 12, Россия
* E-mail: agzuev.sevin@gmail.com
Поступила в редакцию 04.03.2019
После доработки 15.04.2019
Принята к публикации 15.04.2019
Аннотация
Отмечено, что применение изотопного анализа для реконструкции структуры пищевых сетей требует определения величины трофического фракционирования изотопов углерода и азота (Δ13C и Δ15N). Установлено, что грибы и связанные с ними мицетофаги играют ключевую роль в почвенных сообществах, но полевых данных о степени фракционирования изотопов в системе грибы–мицетофаги очень мало. Исследован изотопный состав собранных в естественных условиях плодовых тел сапротрофных и микоризных грибов, паразитических ржавчинных грибов и специализированных мицетофагов – личинок двукрылых (Diptera). В системе с участием личинок галлиц Mycodiplosis sp., питавшихся ржавчинными грибами, обнаружено минимальное обогащение консументов 13С и 15N (на 0 и 0.9‰ соответственно). Показано, что у личинок двукрылых, населяющих плодовые тела сапротрофных и микоризных макромицетов, Δ13C и Δ15N составили в среднем 0.9 и 3.4‰, что соответствует таковым в пастбищных пищевых цепях. Накопление 15N было более выражено у личинок, питавшихся сапротрофными грибами, но четкой зависимости между величиной трофического фракционирования изотопов и таксономической принадлежностью животных или грибов не зафиксировано. Предположено, что вариация степени трофического фракционирования изотопов не должна препятствовать выявлению “микоризного” и “сапротрофного” энергетического каналов в почвенных пищевых сетях.
Измерение соотношения стабильных изотопов углерода (13C/12C) и азота (15N/14N) широко используется в качестве инструмента исследования трофической структуры почвенных сообществ (Scheu, Falca, 2000; Тиунов, 2007). Применение изотопного анализа для реконструкции структуры пищевых сетей базируется на двух основных принципах: изотопный состав консументов отражает интегрированный во времени изотопный состав их диеты и консументы несколько обогащены тяжелыми изотопами азота (15N) и в меньшей степени углерода (13С) по сравнению со своей пищей. Последний феномен называется “трофическим фракционированием” (обычно обозначается Δ) и составляет в среднем для пастбищных пищевых цепей 2–4‰ по азоту (Δ15N) и 0.5–1.0‰ по углероду (Δ13C) (Post, 2002; Martínez del Rio et al., 2009). На базовых уровнях детритных пищевых цепей накопление тяжелого изотопа углерода может быть выше, а тяжелого изотопа азота – ниже, чем в пастбищных пищевых цепях (Pollierer et al., 2009; Potapov et al., 2013, 2019).
От правильного определения величины трофического фракционирования изотопов азота и углерода зависят успех реконструкции конкретных трофических связей, а также точность оценки ключевых количественных параметров всей пищевой сети, таких как средняя длина пищевых цепей и число трофических уровней. При реконструкции структуры детритных (почвенных) пищевых сетей, как правило, признают существование “бактериального” и “грибного” энергетических потоков (Wardle, 2002; Гончаров, Тиунов, 2013). Не подлежит сомнению, что микофаги (коллемболы, панцирные клещи, нематоды, многие насекомые) составляют одну из важнейших функциональных групп почвенных организмов.
Для расшифровки структуры пищевых сетей в лесных почвах важна оценка интенсивности трофических связей почвенных мицетофагов с сапротрофными и микоризными грибами. В первом случае речь идет о детритных пищевых цепях sensu stricto, поскольку сапротрофные грибы осваивают энергию мертвого органического вещества. В случае питания микоризными грибами энергия (углерод) поступает преимущественно от живых корней растений. Значимость этого потока энергии остается предметом дискуссий (Pollierer et al., 2007; Goncharov et al., 2016; Potapov, Tiunov, 2016).
Идентификация трофических связей почвенных животных с микоризными и сапротрофными грибами облегчается устойчивой разностью изотопного состава их плодовых тел и, вероятно, вегетативного мицелия (Gebauer, Taylor, 1999; Mayor et al., 2009). Однако мы не располагаем надежными данными о характере трофического фракционирования изотопов азота и углерода при питании микоризными и сапротрофными грибами. Степень трофического фракционирования в системе гриб–мицетофаг оценивалась в ряде лабораторных экспериментов, прежде всего на примере коллембол, и показала значительную вариабельность в конкретных парах пища–потребитель (Haubert et al., 2005; Staaden et al., 2010; Semenina, Tiunov, 2011). Однако лабораторные модели, как правило, используют культуры сапротрофных микромицетов на искусственных субстратах и могут не вполне отражать естественную ситуацию.
Как ни странно, для оценки трофического фракционирования изотопов у микофагов практически не привлекались данные об изотопном составе специализированных мицетофагов – личинок двукрылых насекомых, населяющих плодовые тела макромицетов. Нам известна только одна работа (Remen, 2010), в которой была измерена разница изотопного состава личинок Anthomyiidae и Mycetophilidae и их грибных субстратов. Другой возможной моделью для оценки степени трофического фракционирования у специализированных мицетофагов могут быть личинки Cecidomyiidae, потребляющие ржавчинные грибы.
Цель работы – оценка степени фракционирования изотопов углерода и азота в трофической цепи грибы–мицетофаги в естественных условиях.
МАТЕРИАЛЫ И МЕТОДЫ
Отбор заселенных микофагами плодовых тел сапротрофных и микоризных грибов, а также образцов растительного опада проводили в течение вегетационного сезона (с мая по октябрь 2016 г.) на биогеоценологической станции Малинки ИПЭЭ РАН (55.4595° с.ш., 37.1794° в.д.). Территория, прилегающая к биостанции, покрыта переспелыми хвойными 150–160-летними лесами (ельники-кисличники, ельники мертвопокровные, сосняки сложные).
Ржавчинные грибы и питающиеся ими личинки Mycodiplosis sp. были собраны в июне и июле 2016 г. на территории Звенигородской биологической станции биологического факультета МГУ (55.6996° с.ш., 36.7227° в.д.). Образцы ржавчинных грибов Puccinia bromina, Coleosporium tussilaginis, Puccinia caricina и сборного вида Melampsora salicina были отобраны вместе с зелеными листьями растений, на которых они развивались (Pulmonaria officinalis, Tussilago farfara, Urtica dioica, Salix spp.).
Всего было собрано 92 плодовых тела микоризных грибов, 57 плодовых тел сапротрофных грибов, а также 20 проб ржавчинных паразитических грибов. Микоризные грибы были представлены 11 видами из 7 родов, сапротрофные – 10 видами из 8 родов, ржавчинные – 4 видами из 3 родов (табл. 1).
Таблица 1.
Изотопный состав (δ13C, SD; δ15N, SD) микоризных, сапротрофных и паразитических грибов (гименофоры или спорангии)
| Виды грибов | n | δ13C | SD | δ15N | SD |
|---|---|---|---|---|---|
| Микоризные | |||||
| Amanita muscaria (L.) Lam. | 13 | –26.3 | 0.2 | 9.1 | 1.4 |
| A. pantherina (DC.) Krombh. | 10 | –25 | 0.4 | 6.6 | 2.4 |
| Cortinarius triumphans Fr. | 3 | –26.1 | 0.1 | 6.9 | 1.1 |
| Gomphidius glutinosus (Schaeff.) Fr. | 4 | –28 | 0.8 | 5.8 | 2.4 |
| Lactarius flexuosus Pers. | 16 | –27.4 | 0.2 | 7.4 | 1.2 |
| L. pergamenus (Sw.) Fr. | 10 | –25.9 | 0.2 | 7.1 | 0.5 |
| Leccinum scabrum (Bull.) Gray | 11 | –28.3 | 0.5 | 8.3 | 1.6 |
| Russula decolorans (Fr.) Fr. | 10 | –24.5 | 0.7 | 6.3 | 2.6 |
| R. vesca Fr. | 1 | –25.9 | – | 4.2 | – |
| R. virescens (Schaeff.) Fr. | 11 | –24.8 | 0.7 | 4.7 | 1.8 |
| Tricholoma album (Schaeff.) Quél. | 2 | –25.1 | – | 5.6 | – |
| Сапротрофные | |||||
| Agaricus arvensis Schaeff. | 12 | –22.5 | 0.2 | 4.4 | 1.3 |
| Hypholoma fasciculare (Huds.:Fr.) P. Kumm. | 3 | –24.5 | 0.8 | 1.3 | 1.8 |
| H. lateritium (Schaeff.) P. Kumm. | 2 | –24.7 | 0.2 | 1.8 | 0.5 |
| Lycoperdon perlatum Pers. | 4 | –24 | 0.5 | –0.2 | 0.5 |
| Macrolepiota procera (Scop.) Singer | 3 | –25.1 | 0.2 | 4.2 | 0.5 |
| Megacollybia platyphylla (Pers.) Kotl. & Pouzar | 7 | –24.4 | 1.3 | –0.2 | 2 |
| Mycena pura (Pers.) P. Kumm. | 7 | –23.9 | 1 | 2.1 | 0.7 |
| Mycena sp. | 3 | –24.3 | 0.6 | 1.5 | 0.3 |
| Pluteus cervinus (Schäffer:Fr) P. Kumm. | 11 | –24.7 | 1 | 1.9 | 1.3 |
| Strobilurus esculentus (Wulfen) Singer | 5 | –24.8 | 0.2 | 2.3 | 0.2 |
| Паразитические | |||||
| Puccinia bromine Erikss. | 3 | –29.3 | 0.8 | 1 | 0.7 |
| P. caricina DC. | 6 | –29.4 | 2.3 | 0.8 | 0.9 |
| Coleosporium tussilaginis (Pers.) Lév. | 4 | –28.3 | 0.2 | 0.9 | 0.2 |
| Melampsora salicina (Moug. & Nestl. ex DC.) Desm. | 7 | –30.2 | 0.5 | 0.1 | 0.4 |
Примечание. n – число измерений; для табл. 1–3.
При обработке плодовых тел сапротрофных и микоризных грибов пробы тканей брали отдельно в ножках (стерильная плектенхима средней части) и в гименофоре (в середине радиуса шляпки). Однако мы не формировали попарных выборок грибных тканей, материал собирали только в случае наличия личинок-мицетофагов. Если не указано иное, для макромицетов в тексте приведен изотопный состав гименофора. У ржавчинных грибов проба состояла из соскобов спор с мицелием со спороношений. Части плодовых тел, предназначенные для изотопного анализа, были высушены в сушильном шкафу при 50°С в течение 3 сут. Личинки мицетофагов были зафиксированы 70%-ным этанолом и после идентификации были высушены в сушильном шкафу при 50°С.
Высушенные образцы плодовых тел грибов и опада измельчали в шаровой мельнице Retsch MM200 (Retsch GMBH, Германия). Личинок, по возможности, анализировали индивидуально. Ориентировочная масса проб для изотопного анализа составляла 30–500 мкг грибного материала, 50–550 мкг животных и 1500 мкг растительного материала.
Измерение изотопного состава углерода и азота (соотношение 13С/12С и 15N/14N) проводили с использованием элементного анализатора Flash 1112 и изотопного масс-спектрометра Thermo Delta V Plus (Thermo Fisher Scientifiс, СШA) в Центре коллективного пользования при ИПЭЭ РАН. Изотопный состав азота и углерода выражали в тысячных долях (δ, ‰) отклонения от международного стандарта (N2 атмосферы и VPDB). Аналитическая точность определения изотопного состава была <0.15‰ для δ15N и δ13C. Совместно с определением изотопного состава во всех пробах определяли общее содержание углерода и азота (%N, %C).
Для получения сравнимых данных из разных точек сбора материала данные по изотопному составу грибов, собранных на Звенигородской биостанции, были скорректированы:
Средние значения δ13С и δ15N свежего листового опада в окрестностях биостанции Малинки составили в среднем –30.1 ± 0.3‰ и –0.5 ± 0.3‰ соответственно (n = 20).
Трофическое фракционирование (δ) определяли как разницу изотопного состава животных и субстрата, из которого они были извлечены:
Результаты анализировали с помощью регрессионного (корреляция Пирсона) и дисперсионного анализа (ANOVA). Проверка на нормальность распределения и гомогенность вариации не выявила необходимости предварительной трансформации данных. Сравнение средних величин было выполнено с помощью множественного критерия Тьюки (Tukey HSD), попарное сравнение – с помощью t-критерия Стьюдента (t-test). Расчеты были выполнены в пакете STATISTICA 8. Изотопный состав отдельных групп грибов и мицетофагов на графиках сравнивали с использованием стандартных эллипсов, ограничивающих область 95%-ного доверительного интервала (Jackson et al., 2011). Вычисления площади и перекрытий эллипсов были выполнены в пакете SIBER среды R (R Core Team, 2014). В тексте представлены средние величины ± стандартное отклонение (SD).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Изотопный состав гименофоров отдельных видов макромицетов довольно сильно варьировал (табл. 1), однако закономерно различался у грибов, принадлежащих к разным функциональным группам (рис. 1). Средние значения δ13C составили –25.8 ± 1.4‰ у микоризных, –24.3 ± 0.7‰ у сапротрофных и –29.4 ± 1.5‰ у ржавчинных грибов. Сапротрофные грибы были в среднем сильнее обогащены 13C относительно опада по сравнению с другими грибами (HSD; P < 0.001). Ржавчинные грибы практически не отличались по изотопному составу от растений, на которых они паразитировали.
Рис. 1.
Изотопный состав (значения δ13C и δ15N) микоризных (1), сапротрофных (2) и паразитических (3) грибов. 4 – средний изотопный состав растительных тканей. Каждая точка отражает результаты анализа одной пробы; для высших грибов – гименофоров, для ржавчинных – спороношений. Эллипсы ограничивают область 95%-ного доверительного интервала.
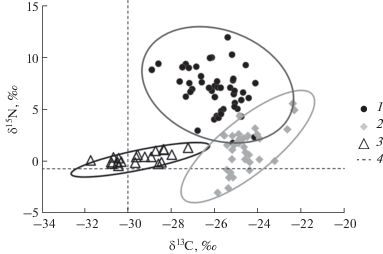
Средние значения δ15N составили 7.4 ± 2.3‰ у микоризных, 2.1 ± 1.5‰ у сапротрофных и 0.6 ± ± 0.7‰ у ржавчинных грибов. Микоризные грибы были значительно сильнее обогащены 15N относительно опада по сравнению с прочими грибами (HSD; P < 0.05). Перекрытие областей вероятных значений составило 22.3% для микоризных и сапротрофных и только 0.2% для ржавчинных и сапротрофных грибов (рис. 1).
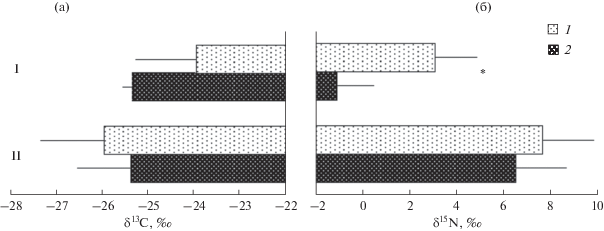
В выборке сапротрофных грибов ткани гименофора были обогащены 13С и 15N относительно тканей ножки; для δ15N различия были статистически значимы. У микоризных грибов значения δ13С и δ15N в шляпках и ножках не различались (рис. 2).
Рис. 2.
Изотопный состав (δ13C (а) и δ15N (б), среднее ± SD) гименофора (1) и ножки (2) у сапротрофных (I) и микоризных (II) и грибов. * – статистически значимые различия (HSD test, P < 0.05).
Изотопный состав личинок-мицетофагов коррелировал с изотопным составом грибных субстратов (R = 0.79 для δ13С и 0.82 для δ15N) и статистически значимо различался у личинок, питавшихся грибами разных функциональных групп (δ13С: F = = 179.4, δ15N: F = 97.6, Р < 0.001 (табл. 2)).
Таблица 2.
Изотопный состав плодовых тел грибов трех функциональных групп и питающихся ими мицетофагов
| Грибы, мицетофаги | δ13C, ‰ | δ15N, ‰ | n | ||
|---|---|---|---|---|---|
| среднее | SD | среднее | SD | ||
| Грибы | |||||
| микоризные | –25.8 | 1.4 | 7.4 | 2.3 | 92 |
| сапротрофные | –24.3 | 0.7 | 2.1 | 1.5 | 57 |
| паразитические | –29.4 | 1.5 | 0.6 | 0.7 | 20 |
| Мицетофаги на грибах | |||||
| микоризных | –24.9 | 1.1 | 9.7 | 2.7 | 92 |
| сапротрофных | –24 | 1.3 | 7 | 3.5 | 57 |
| паразитических | –29.4 | 1.3 | 1.5 | 1.3 | 20 |
Значения Δ13С и Δ15N также различались у мицетофагов, потреблявших грибы разных функциональных групп (F = 9.8 и 41.1 соответственно, P < 0.001). Трофическое фракционирование было незначительным у личинок галлиц, питавшихся ржавчинными грибами, Δ13С = 0 ± 1.2‰ и Δ15N = = 0.9 ± 1.0‰. У разных видов двукрылых, питавшихся сапротрофными и микоризными грибами, трофическое фракционирование варьировало в довольно широких пределах: от –1.4 до 2.5‰ для δ13С и от 0.7 до 8.5‰ для Δ15N (рис. 3).
Рис. 3.
Трофическое фракционирование (Δ13С и Δ15N) микофагов на микоризных (1), сапротрофных (2) и паразитических (3) грибах. Каждая точка отражает результаты анализа одной пары проб (грибных тканей и мицетофага). Эллипсы ограничивают область 95%-ного доверительного интервала.
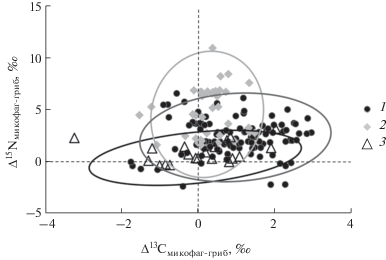
Трофическое фракционирование изотопов азота было в среднем сильнее, а фракционирование изотопов углерода слабее при питании личинок сапротрофными грибами, чем при питании микоризными грибами, однако разница была статистически значима только у некоторых таксонов (Pegomya sp., Mycetophila sp., Megaselia sp., Metalimnobia quadrimaculata (табл. 3)). В среднем по всему массиву данных Δ13С и Δ15N, у личинок двукрылых в макромицетах составили 0.9 ± 0.2‰ и 3.4 ± 0.4‰ соответственно (каждый вид на микоризных или сапротрофных грибах принят за одну повторность, n = 23).
Таблица 3.
Величины трофического фракционирования (Δ13C и Δ15N, ‰) отдельных таксономических групп мицетофагов, собранных в сапротрофных и микоризных грибах; средние и стандартное отклонение (SD)
| Личинки Diptera | n | Δ13С, ‰ | Δ15N, ‰ | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Микоризные | Сапротрофные | Микоризные | Сапротрофные | Микоризные | Сапротрофные | |||||
| Anthomyiidae | ||||||||||
| Anthomyia pluvialis L. | – | 4 | – | – | 0.2 | (0.3) | – | – | 6.7 | (0.2) – |
| Anthomyia sp. | 2 | – | 2.5 | (0.0) | – | – | 3.7 | (0.1) | – | |
| Pegomya sp. | 10 | 6 | 1.6 | (1.8) | 0.5 | (0.2) | 1.4 | (2.3) | 7.2 | (0.9)* |
| Drosophilidae | ||||||||||
| Drosophilidae gen. sp. | – | 2 | – | – | –1.4 | (0.2) | – | – | 4.9 | (0.6) |
| Scaptomyza sp. | 42 | 8 | 0.3 | (1.0) | 0.1 | (0.6) | 2.4 | (1.8) | 3.0 | (1.8) |
| Heleomyzidae | ||||||||||
| Heleomyzidae gen. sp. | 2 | – | 2.1 | (0.2) | – | – | 2.9 | (0.1) | – | – |
| Limoniidae | ||||||||||
| Metalimnobia quadrimaculata L. | 8 | 3 | 1.4 | (0.5) | 0.6 | (0.7) | 3.7 | (1.6) | 8.5 | (2.2)* |
| Mycetophilidae | ||||||||||
| Mycetophilidae gen. sp. | 1 | 1 | 0.3 | – | 1.3 | – | 1.9 | – | 3.3 | – |
| Mycetophila fungorum De Geer | 14 | 4 | 1.2 | (0.7) | 0.1 | (0.1)* | 2.1 | (1.0) | 2.1 | (0.5) |
| Mycetophila sp. | 10 | 2 | 1.2 | (0.6) | 1.4 | (0.1) | 0.7 | (1.1) | 2.8 | (0.1)* |
| Rymosia sp. | 4 | – | 1.0 | (1.1) | – | – | 1.8 | (1.5) | – | – |
| Trichonta sp. | 4 | 2 | 2.0 | (1.0) | 0.7 | (0.2) | 3.7 | (1.1) | 2.7 | (1.3) |
| Phoridae | ||||||||||
| Megaselia scalaris Loew | 2 | – | 0.4 | (0.1) | – | – | 1.3 | (0.2) | – | – |
| Megaselia sp. | 7 | 7 | 0.4 | (0.6) | 0.2 | (0.2) | 2.8 | (1.5) | 5.6 | (1.0)* |
| Sciaridae | ||||||||||
| Sciara sp. | 5 | – | 2.2 | (0.7) | – | – | 3.0 | (0.8) | – | – |
| Среднее | 13 | 10 | 1.3 | (0.8) | 0.4 | (0.8) | 2.4 | (1.0) | 4.7 | (2.2) |
| Медиана | 1.2 | 0.4 | 2.4 | 4.1 | ||||||
Изотопная подпись микофагов и степень трофического фракционирования не зависели от локализации (шляпка или ножка), несмотря на статистически значимые (в случае сапротрофных грибов) различия изотопного состава разных частей плодовых тел. Мы не обнаружили статистически значимых корреляций между отношением С/N в тканях грибов или микофагов и величинами δ15N грибов или личинок, а также Δ15N. Величины δ13Cгрибы и δ13Cмицетофаги отрицательно коррелировали с отношением С/N как в плодовых телах грибов, так и в тканях мицетофагов (R = –0.610 и –0.727 соответственно, P < 0.05). Величина δ13С слабо, но статистически значимо уменьшалась при увеличении значения С/N в тканях мицетофагов (R = –0.434, P < 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Вариабельность степени трофического фракционирования изотопов азота и иных элементов остается “узким местом изотопной экологии”. В силу невозможности экспериментальной оценки величины Δ15N в каждой паре пища–консумент при реконструкции трофических связей обычно используется усредненная величина (3.4‰ на один трофический уровень), хотя нет сомнений, что на самом деле она колеблется в широких пределах. В частности, в детритных пищевых сетях наблюдается очень небольшое обогащение первичных сапрофагов 15N по сравнению с растительным опадом, но неожиданно большое накопление 13С (так называемый детритный сдвиг) (Korobushkin et al., 2014; Kudrin et al., 2015; Potapov et al., 2019).
Пищей почвенных сапрофагов служат преимущественно сапротрофные микроорганизмы (Стриганова, 1980). Лабораторные опыты показывают, что особенности изотопного состава сапрофагов определяет прежде всего характер фракционирования изотопов в системе растительные остатки–микроорганизмы (Potapov et al., 2013), но это положение требует подтверждения в полевых экспериментах. Получение информации об изотопном составе обитающих в почве микроорганизмов представляет значительные методические трудности (Tiunov et al., 2015). Однако плодовые тела макромицетов и связанные с ними личинки двукрылых могут быть удобной моделью для оценки степени трофического фракционирования в системе грибы–мицетофаги. Это особенно важно в связи с выраженной разницей изотопного состава сапротрофных и микоризных грибов. Хорошо известно, что плодовые тела микоризных грибов в среднем обогащены 15N и обеднены 13С по сравнению с плодовыми телами сапротрофных макромицетов (Henn, Chapela, 2001; Mayor et al., 2009). Наши данные подтверждают этот феномен, хотя разница величин δ13С плодовых тел сапротрофных и микоризных грибов была в среднем небольшой (рис. 1). Устойчивая и существенная разница величин δ15N сапротрофных и микоризных грибов (в нашей выборке ~5‰, табл. 2) предполагает, что валовой изотопный анализ позволяет относительно четко разделять “микоризные” и “сапротрофные” потоки вещества и энергии в почвенных пищевых сетях.
Вопреки ожиданиям, анализ изотопного состава почвенных мицетофагов не дает указаний на активное питание микоризными грибами (Kudrin et al., 2015; Potapov, Tiunov, 2016). Эти данные отчасти противоречат результатам экспериментальных работ (Pollierer et al., 2007) и требуют верификации. Отсутствие “микоризного сигнала” можно объяснить как неполным соответствием изотопного состава плодовых тел и вегетативного мицелия (Wallander et al., 2004), так и особенностями трофического фракционирования при питании грибами разных функциональных групп.
Оценка изотопного состава плодовых тел макромицетов затруднена их химической и изотопной гетерогенностью. Как правило, гименофоры (или шляпки) грибов обогащены 15N и 13С по сравнению со стерильными тканями (или ножками). Это связано, по-видимому, с аккумуляцией в генеративных тканях грибов соединений белковой природы, которые обогащены 13С и 15N по сравнению с запасающими (липиды) и структурными (хитин) соединениями (Hobbie et al., 2012). Мы не ставили целью систематически исследовать вариации изотопного состава отдельных частей плодовых тел; в нашей выборке наблюдалось выраженное обогащение 13С и 15N гименофоров у сапротрофных, но не у микоризных грибов (рис. 2).
Изотопный состав тканей насекомых также неоднороден. Обнаруженное уменьшение значений δ13С тканей личинок при увеличении отношения С/N, т.е. содержания в тканях жиров, вполне соответствует известному феномену обеднения липидов 13С (Цуриков и др., 2015). Этим же можно объяснить уменьшение δ13С при увеличении отношения C/N в тканях личинок. Кроме того, мы использовали усредненные пробы, полученные после гомогенизации целого тела личинок. Наличие в пробе содержимого кишечника могло внести ошибку в определение изотопного состава животных. Подобная ошибка, по-видимому, неизбежна при работе с мелкими почвенными сапрофагами (коллемболами, клещами, нематодами), и мы не стремились избежать ее в нашей модельной системе. Отношение C/N по массе было существенно шире в тканях грибов (в среднем 11.2 ± 0.4), чем в тканях мицетофагов (5.1 ± 0.1). Таким образом, увеличение отношения C/N в пробах личинок могло отражать увеличенный вклад в изотопную подпись содержимого кишечника.
Величины трофического фракционирования изотопов азота существенно варьировали в отдельных парах пища–потребитель. В большинстве случаев значение δ15N было выше при питании личинок сапротрофными грибами, чем при питании микоризными грибами (табл. 3), однако эта тенденция наблюдалась не всегда. Нам также не удалось обнаружить четкой зависимости между величиной трофического фракционирования изотопов и таксономической принадлежностью животных или грибов. Интересно отметить, что в нашей выборке величина δ15N была в среднем выше у представителей Anthomyiidae, чем у Mycetophilidae, хотя в другом эксперименте была обнаружена обратная зависимость (Remen, 2010).
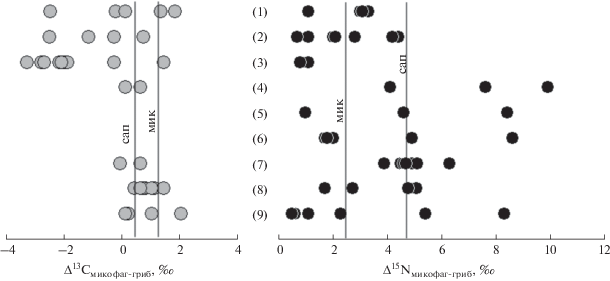
Весьма значительный разброс значений δ15N и δ13С в пределах одной таксономической группы микофагов был отмечен и в других опубликованных работах, в том числе в лабораторных экспериментах (рис. 4). Наши оценки δ15N и δ13С оказываются примерно в середине диапазона значений, полученных ранее. Более того, среднее трофическое фракционирование изотопов азота (3.4‰) и углерода (0.9‰) в системе шляпочные грибы–личинки двукрылых близко к значениям, полученным в результате усреднения данных многих экспериментальных работ с разными видами консументов, преимущественно в пастбищных пищевых цепях (Post, 2002; Vanderklift, Ponsard, 2003; Тиунов, 2007).
Рис. 4.
Величины трофического фракционирования изотопов углерода и азота (∆13С и ∆15N) в парах гриб–микофаг (опубликованные ранее дaнные). Полевые сборы, личинки двукрылых: Anthomyiidae (1) и Mycetophilidae (2) на микоризных макромицетах, личинки Mycetophilidae (3) на cапротрофных макромицетах. Коллемболы на сапротрофных микромицетах: Xenylla grisea (4), Vertagopus pseuodocinereus (5), Sinella tenebricosa (6), Protaphorura fimata (7), Heteromurus nitidus (8), Folsomia candida (9). Вертикальные линии показывают среднее трофическое фракционирование мицетофагами на сапротрофных (сап) и микоризных (мик) грибах в наших экспериментах (табл. 3). Использованы ранее опубликованные данные (Scheu, Folger, 2004; Haubert et al., 2005; Ruess et al., 2005; Larsen et al., 2009; Remen, 2010; Staaden et al., 2010; Semenina, Tiunov, 2011; Potapov et al., 2013).
Из общей закономерности выпадают личинки галлиц Mycodiplosis sp., питавшиеся паразитическими грибами. В этой системе отмечена минимальная степень обогащения консументов тяжелыми изотопами. Грибы почти не отличались по изотопному составу от зеленых листьев, которыми они питались (рис. 1), а личинки галлиц были всего лишь на 0.9‰ обогащены 15N по сравнению с грибами (рис. 3). Причины этого явления до конца неясны, но в целом оно соответствует ситуации, которая наблюдается в пищевых цепях с участием паразитов. Паразиты часто бывают обеднены 15N по сравнению с хозяевами, что нехарактерно для “нормальных” пищевых отношений (Pinnegar et al., 2001; Navarro et al., 2014). Однако эта особенность проявляется далеко не во всех случаях, и стоящие за ней механизмы пока не расшифрованы (Lafferty et al., 2008).
Таким образом, наиболее важный результат нашей работы – оценка степени трофического фракционирования изотопов азота и углерода в системе грибы–мицетофаги в естественных условиях. Полученные оценки δ15N и δ13С вполне соответствуют величинам, наблюдаемым в пастбищных пищевых цепях. Фракционирование изотопов азота было несколько сильнее у мицетофагов, питающихся сапротрофными грибами, но разница с мицетофагами из микоризных грибов была невелика и в среднем не достигала уровня статистической значимости. Следовательно, вариации степени трофического фракционирования изотопов не должны препятствовать эффективному выявлению “микоризного” и “сапротрофного” энергетических каналов в почвенных пищевых сетях. Наши результаты основаны на исследовании плодовых тел грибов; следующим шагом на пути эффективного использования изотопного анализа в реконструкции трофических связей почвенных грибов и связанных с ними мицетофагов должно стать подробное исследование изотопного состава вегетативного мицелия грибов разных функциональных групп.
Авторы выражают благодарность за помощь в сборе материала Е.А. Астаховой, В.О. Бакуменко, М.И. Варсанофьевой, А.А. Горшковой, Т.В. Логиновой, М.А. Перфильевой, А.Д. Семенову и Д.А. Федорову.
Работа выполнена при финансовой поддержке РФФИ (грант 17-04-01856).
Список литературы
Гончаров А.А., Тиунов А.В. Трофические цепи в почве // Журн. общ. биологии. 2013. № 6. С. 450–462.
Cтриганова Б.Р. Питание почвенных сапрофагов. М.: Наука, 1980. 244 с.
Тиунов А.В. Стабильные изотопы углерода и азота в почвенно-экологических исследованиях // Изв. РАН. Сер. биол. 2007. № 4. С. 475–489.
Цуриков С.М., Гончаров А.А., Тиунов А.В. Изотопный состав (13C/12C и 15N/14N) разных тканей жесткокрылых насекомых (Insecta, Coleoptera) и его изменения в онтогенезе // Зоол. журн. 2015. № 94. С. 336–344.
Gebauer G., Taylor A.F. 15N natural abundance in fruit bodies of different functional groups of fungi in relation to substrate utilization // New Phytol. 1999. V. 142. P. 93–101.
Goncharov A.A., Tsurikov S.M., Potapov A.M., Tiunov A.V. Short-term incorporation of freshly fixed plant carbon into the soil animal food web: field study in a spruce forest // Ecol. Res. 2016. V. 31. P. 923–933.
Haubert D., Langel R., Scheu S., Ruess L. Effects of food quality, starvation and life stage on stable isotope fractionation in Collembola // Pedobiologia. 2005. V. 49. P. 229–237.
Henn M.R., Chapela I.H. Ecophysiology of 13C and 15N isotopic fractionation in forest fungi and the roots of the saprotrophic-mycorrhizal divide // Oecologia. 2001. V. 128. P. 480–487.
Hobbie E.A., Sánchez F.S., Rygiewicz P.T. Controls of isotopic patterns in saprotrophic and ectomycorrhizal fungi // Soil Biol. Biochem. 2012. V. 48. P. 60–68.
Jackson A.L., Inger R., Parnell A.C., Bearhop S. Comparing isotopic niche widths among and within communities: SIBER – Stable Isotope Bayesian Ellipses in R // J. Anim. Ecol. 2011. V. 80. P. 595–602.
Korobushkin D.I., Gongalsky K.B., Tiunov A.V. Isotopic niche (δ13C and δ15N values) of soil macrofauna in temperate forests // Rapid Commun. Mass Spectrom. 2014. V. 28. P. 1303–1311.
Kudrin A.A., Tsurikov S.M., Tiunov A.V. Trophic position of microbivorous and predatory soil nematodes in a boreal forest as indicated by stable isotope analysis // Soil Biol. Biochem. 2015. V. 86. P. 193–200.
Lafferty K.D., Allesina S., Arim M., Briggs C.J., De Leo G., Dobson A.P., Dunne J.A., Johnson P.T.J., Kuris A.M., Marcogliese D.J., Martinez N.D., Memmott J., Marquet P.A., McLaughlin J.P., Mordecai E.A., Pascual M., Poulin R., Thieltges D.W. Parasites in food webs: the ultimate missing links // Ecol. Lett. 2008. V. 11. P. 533–546.
Larsen T., Ventura M., Damgaard C., Hobbie E.A., Krogh P.H. Nutrient allocations and metabolism in two collembolans with contrasting reproduction and growth strategies // Funct. Ecol. 2009. V. 23. P. 745–755.
Martínez del Rio C., Wolf N., Carleton S.A., Gannes L.Z. Isotopic ecology ten years after a call for more laboratory experiments // Biol. Rev. 2009. V. 84. P. 91–111.
Mayor J.D., Schuur E.A., Henkel T.W. Elucidating the nutritional dynamics of fungi using stable isotopes // Ecol. Lett. 2009. V. 12. P. 171–183.
Navarro J., Albo-Puigserver M., Coll M., Saez R., Forero M.G., Kutcha R. Isotopic discrimination of stable isotopes of nitrogen (δ15N) and carbon (δ13C) in a host-specific holocephalan tapeworm // J. Helminthol. 2014. V. 88. P. 371–375.
Pinnegar J.K., Campbell N., Polunin N.V. Unusual stable isotope fractionation patterns observed for fish host-parasite trophic relationships // J. Fish Biol. 2001. V. 59. P. 494–503.
Pollierer M.M., Langel R., Scheu S., Maraun M. Compartmentalization of the soil animal food web as indicated by dual analysis of stable isotope ratios (15N/14N and 13C/12C) // Soil Biol. Biochem. 2009. V. 41. P. 1221–1226.
Pollierer M.M., Langel R., Körner C., Maraun M., Scheu S. The underestimated importance of belowground carbon input for forest soil animal food webs // Ecol. Lett. 2007. V. 10. P. 729–736.
Post D.M. Using stable isotopes to estimate trophic position: models, methods, and assumptions // Ecology. 2002. V. 83. P. 703–718.
Potapov A.M., Tiunov A.V. Stable isotope composition of mycophagous collembolans versus mycotrophic plants: do soil invertebrates feed on mycorrhizal fungi? // Soil Biol. Biochem. 2016. V. 93. P. 115–118.
Potapov A.M., Tiunov A.V., Scheu S. Uncovering trophic positions and food resources of soil animals using bulk natural stable isotope composition // Biol. Rev. 2019. V. 94. P. 37–59.
Potapov A.M., Semenina E.E., Kurakov A.V., Tiunov A.V. Large 13C/12C and small 15N/14N isotope fractionation in an experimental detrital foodweb (litter-fungi-collembolans) // Ecol. Res. 2013. V. 28. P. 1069–1079.
R Core Team. R: A language and environment for statistical computing. Vienna, Austria: R Foundation for Statistical Computing, 2014.
Remen C. Unravelling the feeding habits of fungivores: Doctoral thesis. Uppsala. Swed. Univ. Agricult. Sci., 2010. 80 p.
Ruess L., Tiunov A., Haubert D., Richnow H.H., Häggblom M.M., Scheu S. Carbon stable isotope fractionation and trophic transfer of fatty acids in fungal based soil food chains // Soil Biol. Biochem. 2005. V. 37. P. 945–953.
Scheu S., Falca M. The soil food web of two beech forests (Fagus sylvatica) of contrasting humus type: stable isotope analysis of a macro- and a mesofauna-dominated community // Oecologia. 2000. V. 123. P. 285–286.
Scheu S., Folger M. Single and mixed diets in Collembola: effects on reproduction and stable isotope fractionation // Funct. Ecol. 2004. V. 18. P. 94–102.
Semenina E.E., Tiunov A.V. Trophic fractionation (Δ15N) in Collembola depends on nutritional status: a laboratory experiment and mini-review // Pedobiologia. 2011. V. 54. P. 101–109.
Staaden S., Milcu A., Rohlfs M., Scheu S. Fungal toxins affect the fitness and stable isotope fractionation of Collembola // Soil Biol. Biochem. 2010. V. 42. P. 1766–1773.
Tiunov A.V., Semenina E.E., Aleksandrova A.V., Tsurikov S.M., Anichkin A.E., Novozhilov Y.K. Stable isotope composition (δ13C and δ15N values) of slime molds: placing bacterivorous soil protozoans in the food web context // Rapid Commun. Mass Spectrom. 2015. V. 29. P. 1465–1472.
Vanderklift M.A., Ponsard S. Sources of variation in consumer-diet δ15N enrichment: a meta-analysis // Oecologia. 2003. V. 136. P. 169–182.
Wallander H., Goransson H., Rosengren U. Production, standing biomass and natural abundance of 15N and 13C in ectomycorrhizal mycelia collected at different soil depths in two forest types // Oecologia. 2004. P. 139. V. 89–97.
Wardle D.A. Communities and ecosystems: linking the aboveground and belowground components. Princeton: Princeton Univ. Press, 2002. 392 p.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


