Известия РАН. Серия биологическая, 2019, № 6, стр. 648-657
Климатическое моделирование местообитания Kalopanax septemlobus и Phellodendron amurense var. sachalinense в островном секторе Дальнего Востока России
К. А. Корзников *
* Ботанический сад-институт ДВО РАН
690024 Владивосток, ул. Маковского, 142, Россия
* E-mail: korzkir@mail.ru
Поступила в редакцию 30.10.2017
После доработки 30.11.2017
Принята к публикации 30.11.2017
Аннотация
Изучено расширение площади местообитаний Kalopanax septemlobus и Phellodendron amurense var. sachalinense на территории о-ва Сахалина и Курильских островов вследствие глобального изменения климата. Пространственное моделирование выполнено с помощью метода максимальной энтропии, реализованного в программе MaxEnt v. 3.3.3, по набору климатических параметров из базы данных WorldClim v. 1.4. Отмечено, что такие модели предсказывают увеличение площади климатически пригодных местообитаний K. septemlobus и P. amurense var. sachalinense к 2050 г. на 9.55 и 14.65% общей площади региона при увеличении среднегодовой температуры в регионе на 3.9°C (сценарий RCP2.6) и соответственно на 45.86 и 66.24% согласно радикальному сценарию увеличения температуры на 5.2°C (RCP8.5).
Климат – важнейший фактор, влияющий на формирование и распространение наземных экосистем (Вальтер, 1968, 1982; Уиттекер, 1980). Смена климата приводит к изменению ареалов, а значит, неизбежно влечет за собой изменение видового состава экосистем, смещение границ экорегионов и биогеографических зон. В условиях потепления климата общий характер трансформации растительного покрова связан с исчезновением холодостойких видов в более низких широтах и смещением ареалов теплолюбивых видов в высокие широты. Аналогичные изменения происходят в высотных поясах горных районов (Chen et al., 2011).
В островном секторе Российского Дальнего Востока (РДВ) – на о-ве Сахалине и Курильских островах – находятся северо-восточные границы распространения многих видов растений, характерных для смешанных и широколиственных лесов умеренного климата (Толмачев, 1955; Баркалов, 2009; Крестов и др., 2009). Одни авторы считают растительность островного региона полностью принадлежащей к бореальной зоне (Толмачев, 1955; Hämet-Ahti et al., 1974), другие относят растительность южных Курил и крайнего юго-запада о-ва Сахалина к Восточно-Азиатской хвойно-широколиственной умеренной зоне (Колесников, 1961; Nakamura, Krestov, 2005; Box, Fujiwara, 2012). В качестве маркеров для рубежа между двумя растительными зонами можно принять пределы распространения двух видов деревьев – Kalopanax septemlobus (Thunb.) Koidz. (Araliaceae) и Phellodendron amurense var. sachalinense F. Schmidt (Rutaceae), участвующих в формировании широколиственных и хвойно-широколиственных лесов (Nakamura, Krestov, 2005).
Цель работы – моделирование размещения климатически пригодных местообитаний K. septemlobus и P. amurense var. sachalinense на Сахалине и Курильских островах в условиях современного климата и при различных сценариях его изменения.
МАТЕРИАЛЫ И МЕТОДЫ
Природные условия. О-в Сахалин и Курильские острова располагаются на восточной окраине Евразии. Рельеф преимущественно горный, в северной трети о-ва Сахалина располагается обширная равнина. Среднегодовая температура меняется от –2 до +5°C, годовое количество осадков – от 400 до 1800 мм. Согласно классификации климатов Кеппена (Peel et al., 2007) острова находятся в пределах двух областей: умеренно-холодного гумидного климата с теплым летом (Dfb) и умеренно-холодного климата с холодным летом (Dfc). С биоклиматических позиций о-в Сахалин и Курильские острова относятся к области муссонного бореального макробиоклимата морского типа (Nakamura et al., 2007). Зональные сообщества – темнохвойные леса класса Vaccinio–Piceetea Br.-Bl. in Br.-Bl. et al. 1939 с видами-доминантами Abies sachalinensis (F. Schmidt) Mast. и Picea jezoensis (Siebold & Zucc.) Carr. (Толмачев, 1955; Krestov, Nakamura, 2002).
Объекты исследования. K. septemlobus (калопанакс семилопастной, диморфант) – однодомное дерево высотой 10–25 м, которое встречается на территории Японии, Кореи, Китая, на РДВ – в Приморском крае и Сахалинской обл. Деревья произрастают поодиночке или небольшими группами, цветение происходит в августе, который, как правило, на юге РДВ наиболее теплый месяц (Пояркова, 1950; Полетико, 1960). Урожайные годы со зрелыми семенами редки и бывают лишь при теплой сухой и продолжительной осени. Распространение семян орнитохорное (Iida, Nakashizuka, 1998). Возможно размножение вегетативным путем (Полетико, 1960). Спорадическое размещение снижает поражаемость грибными инфекциями и не влияет на успешность опыления (Fujimori et al., 2006).
P. amurense var. sachalinense (бархат амурский сахалинский) – двудомное дерево высотой до 15 м, иногда рассматривается как самостоятельный вид P. sachalinense (F. Schmidt) Sarg. (Черепанов, 1995; Ma et al., 2006). Разновидность распространена в Японии, в России – на юге о-ва Сахалина и Курильского архипелага (Недолужко, 1989; Ma et al., 2006). Размножается семенами, дает корневые отпрыски и пневую поросль (Введенский, 1949; Родионенко, 1958). Цветение происходит в конце июня и начале июля, цветки опыляются насекомыми (Mizui, Kikuzawa, 1991), семена распространяются птицами (Нечаев, 1960; Нечаев, Нечаев, 2016).
В островном регионе оба вида встречаются в составе растительных сообществ ассоциации Piceo–Abietetum sachalinense Ohba ex Nakamura 1988 класса Vaccinio–Piceetea (Krestov, Nakamura 2002), в хвойно-широколиственных лесах – в сообществе с Quercus mongolica Fisch. ex Ledeb. и Acer mono var. mayrii (Schwer.) Sugim., в лесах речных долин – в сообществе c Fraxinus mandshurica Rupr., Ulmus japonica (Rehder) Sarg. и Ulmus laciniata (Trautv.) Mayr. В лесах умеренной зоны рассматриваемые виды произрастают в хвойно-широколиственных и широколиственных древостоях (Krestov et al., 2006; Okitsu, 2016).
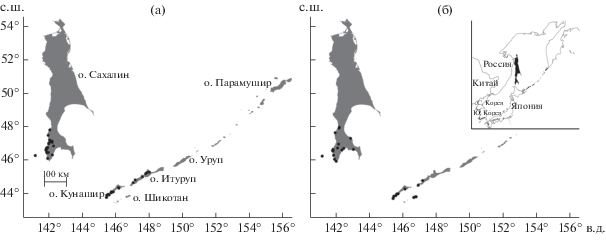
Данные для моделирования. Исходные данные для моделирования взяты из 38 локалитетов K. septemlobus и 29 локалитетов P. amurense var. sachalinense с островов Сахалина, Монерона, Кунашира, Итурупа и Шикотана (рис. 1). Локалитеты установлены по опубликованным ранее данным (Клюйков, Тихомиров, 1987; Недолужко, 1989; Каталог…, 1999; Красная…, 2005) и этикеткам гербарных образцов. Просмотрены коллекции Ботанического сада-института ДВО РАН (VBGI), ФНЦ Биоразнообразия наземной биоты Восточной Азии ДВО РАН (VL) и МГУ (MW). Гербарные образцы с неточной привязкой, собранные с культивируемых растений, а также повторяющиеся сборы из одного географического пункта не учитывались. Поскольку картографический материал из литературных источников не позволял сделать достаточно точных привязок, то размещение этих локалитетов для о-ва Сахалина было скорректировано согласно собственным данным, собранным с 2012 по 2016 г.
Рис. 1.
Локалитеты Kalopanax septemlobus (n = 38) и Phellodendron amurense var. sachalinense (n = 29).
Климатические данные с разрешением 30 с/пиксель (~0.565 км2, n = 154 129) были взяты из глобальной климатической модели WorldClim v. 1.4. (Hijmans et al., 2005). Для целей моделирования изначально выбрали восемь параметров: T – среднегодовая температура; WKI – тепловой индекс Кира, сумма среднемесячных температур выше 5°C (WKI = Σ[(tcр > 5°C) – 5]; m – средний температурный минимум самого холодного месяца; Ic – индекс континентальности, разность средних температур самого теплого и самого холодного месяцев; P – годовая сумма осадков; Pp – сумма осадков в месяцы со средней температурой ниже 0°C; Pw – сумма осадков за три месяца с наиболее низкой средней температурой; Io – омбротермический индекс, отношение суммы осадков в месяцы с положительными температурами к сумме этих среднемесячных температур. Экологический смысл перечисленных климатических параметров и индексов подтвержден в ряде предшествующих работ по моделированию распространения отдельных видов растений и растительных сообществ в Северо-Восточной Азии (Krestov et al., 2006, 2010; Nakamura et al., 2007; Sakaguchi et al., 2010, 2011, 2012; Kang et al., 2016). Включение в анализ большего числа показателей излишне из-за проблемы мультиколлинеарности, возникающей вследствие высокой корреляции их значений, чего следует избегать при моделировании (Austin, 2007).
Построенная на основе исходных климатических параметров модель была спроецирована на климатические условия 2050 г., соответствующие двум сценариям глобального изменения климата (Moss et al., 2010). Наиболее сдержанный сценарий RCP2.6 (representative concentration pathways) подразумевает сдвиг радиационного баланса Земли в сторону увеличения на 2.6 Вт/м2 к 2100 г. по сравнению с доиндустриальным периодом, что приведет к росту температуры на планете в среднем на 1°C. Второй сценарий подразумевает сдвиг радиационного баланса на 8.5 Вт/м2 (RCP8.5) и увеличение температуры в среднем на 3.7°C. Климатические данные по обоим сценариям созданы на основе глобальной климатической модели (CCSM4, Community Climate System Model) (Gent et al., 2011), интегрированной в WorldClim v. 1.4.
Параметры рельефа не были использованы в качестве предикторов по причине отсутствия у большинства гербарных образцов высокоточных привязок мест сбора к географическим координатам, что могло вызвать ошибки при построении моделей и интерпретации результатов.
Статистические методы. Для определения ведущих градиентов факторов и возможных различий между климатическими нишами видов было проведено многомерное неметрическое шкалирование (NMDS). В качестве исходной матрицы использовали значения по восьми климатическим параметрам из известных 67 мест произрастания рассматриваемых видов (K. septemlobus – 38, P. amurense var. sachalinense – 29). Данные не трансформировались, дистанция между объектами была оценена по расстоянию Евклида. Все процедуры выполнялись в программной среде R с подключенным пакетом Vegan (Oksanen et al., 2017).
Зависимости между рядами данных устанавливали с помощью критерия линейной корреляции Пирсона. Статистическая значимость объясненной дисперсии (r2) была определена с помощью теста пермутаций (n = 999), а значимость различий средних значений между рядами данных – с помощью t-теста Стьюдента.
Моделирование. Для построения модели климатически пригодных местообитаний использовался метод максимальной энтропии (maximum entropy), реализованный в программе MaxEnt v. 3.3.3. Алгоритм позволяет провести пространственное моделирование на основании точек присутствия вида и известных значений параметров среды в этих точках (Phillips et al., 2006).
Размер обучающей выборки для каждого вида был задан равным 75%, а 25% локалитетов использовались в качестве тестовой выборки. Формирование выборок проводилось на базе бутстреп-подхода. Число повторных репликаций модели было задано равным 20. Множитель регуляризации (regularization multiplier) был равен 2. Остальные настройки программы были оставлены по умолчанию. В качестве выходного формата значений модели был выбран кумулятивный. Для интерпретации использовали средние значения по всем репликациям.
Качество моделей оценено по значениям AUC (area under curve) – площади под ROC-кривой, представляющей собой зависимость доли положительно и ложноположительно классифицированных случаев (receiver operating characteristics) (Fawcett, 2006), а также уровню омиссии модели (omission rate), характеризующей ложноотрицательные случаи (ошибка второго рода). При значениях AUC 0.9–1 качество модели оценивается как отличное, 0.8–0.9 – хорошее, <0.6 – очень плохое (Phillips, Dudik, 2008). Значимость климатических параметров для моделирования была оценена по показателю “важность при пермутациях” (permutationce importance) (Phillips et al., 2006; Phillips, Dudik, 2008). Кроме того, для оценки относительного вклада каждого предиктора был использован метод “складного ножа” (jackknife test) (Phillips et al., 2006). Для оценки характера зависимости моделируемого уровня пригодности с двумя наиболее важными переменными были построены кривые отклика (response curves). Построение карт и подсчет площадей выполнялись в программе ArcMap v. 10.4.1.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Многомерный анализ климатических параметров показал отсутствие статистически значимых различий между центроидами локалитетов K. septemlobus и P. amurense var. sachalinense (рис. 2). Средние значения каждого климатического параметра в локалитетах двух видов различаются незначимо по результатам t-теста Стьюдента (при p = 0.05). Первая ось варьирования была наиболее тесно связана с континентальностью климата и годовым количеством осадков. Вторая ось варьирования была сильно скоррелирована с температурозависимыми показателями (табл. 1).
Рис. 2.
Результат многомерного неметрического шкалирования (NMDS), уровень стресса 0.02. Обозначения векторов: WKI – тепловой индекс Кира, T – среднегодовая температура, P – среднегодовая сумма осадков, Io – омбротермический индекс, Pw – сумма осадков за три месяца с самыми низкими средними температурами, Pp – сумма осадков за месяцы со средней температурой <0°C, m – средний минимум самого холодного месяца, Ic – индекс континентальности. 1 – Kalopanax septemlobus, 2 – Phellodendron amurense var. sachalinense. Черные обозначения 1 и 2 – о-в Сахалин, серые – Курильские острова.
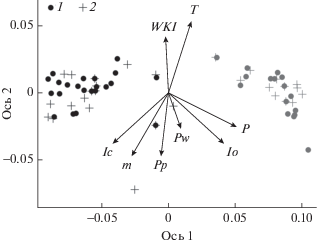
Таблица 1.
Корреляции климатических параметров с координатами NMDS
| Параметр | NMDS ось 1 | NMDS ось 2 | r2 |
|---|---|---|---|
| P | 0.99* | –0.12 | 0.99 |
| Ic | –0.97* | –0.2 | 0.97 |
| m | –0.91* | –0.36** | 0.95 |
| Io | 0.95* | –0.2 | 0.94 |
| T | 0.79* | 0.55* | 0.92 |
| Pp | –0.36** | –0.73* | 0.67 |
| WKI | –0.13 | 0.72* | 0.54 |
| Pw | 0.42* | –0.27** | 0.25 |
Примечание. P – годовая сумма осадков; Ic – индекс континентальности; m – средний температурный минимум самого холодного месяца; Io – омбротермический индекс; T – среднегодовая температура; Pp – сумма осадков в месяцы со средней температурой <0°C; WKI – тепловой индекс Кира; Pw – сумма осадков за три месяца с наиболее низкими средними температурами. * – p = 0.001, ** – p = 0.05; все значения объясненной дисперсии (r2) значимы по результатам теста пермутаций (n = 999, p = 0.001).
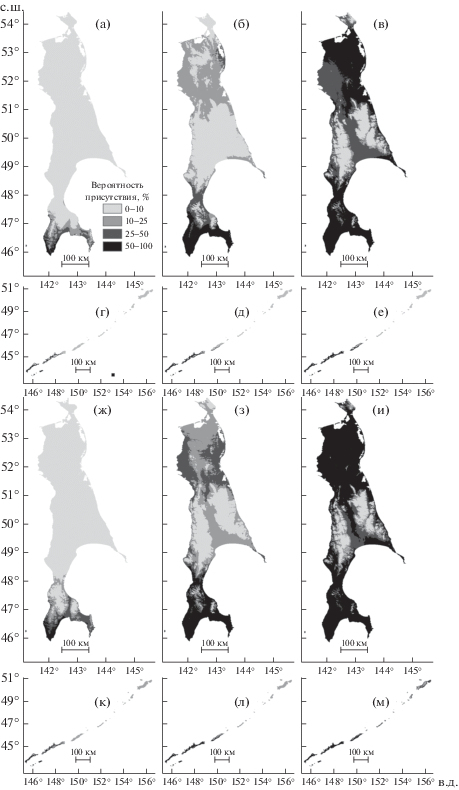
Созданные модели имеют высокое качество классификации, что свидетельствует о возможностях их интерпретации. Для K. septemlobus AUC = = 0.97 ± 0.01 (уровень омиссии 0.18 ± 0.01), для P. sachalinense AUC = 0.97 ± 0.01 (уровень омиссии 0.2 ± 0.03; приведены средние и стандартные отклонения, n = 20). Согласно прогностическим моделям общая площадь климатически пригодной территории для видов существенно возрастет (табл. 2, рис. 3).
Таблица 2.
Доля территории климатически пригодных местообитаний (%) в общей площади островов (~87.1 тыс. км2)
| Вид | Вероятность присутствия, % | Климатические условия | ||
|---|---|---|---|---|
| актуальные | 2050 г. (RCP2.6) | 2050 г. (RCP8.5) | ||
| Kalopanax septemlobus | 50–100 | 1.27 | 9.55 | 45.86 |
| >10 | 9.55 | 51.92 | 84.08 | |
| Phellodendronamurense var. sachalinense | 50–100 | 2.55 | 14.65 | 66.24 |
| >10 | 13.76 | 71.02 | 89.81 | |
Рис. 3.
Модели местообитаний Kalopanax septemlobus (а–е) и Phellodendron amurense var. sachalinense (ж–м) в условиях современной климатической обстановки (а, г, ж, к) и согласно прогнозируемым сценариям ее изменения к 2050 г. RCP2.6 (б, д, з, л) и RCP8.5 (в, е, и, м).
Наиболее значимыми факторами для моделирования климатических ниш оказались WKI и Pw. Суммарный вклад этих двух факторов составил 57.7% в случае K. septemlobus и 61.8% в случае P. amurense var. sachalinense (табл. 3). Согласно результатам “складного ножа” T – лучший предиктор, если использовать этот показатель в качестве единственного параметра моделирования, но отсутствие WKI сильнее влияет на общее качество модели, если при этом использованы все другие показатели.
Таблица 3.
Вклад предикторов в общую модель
| Вид | Фактор | Важность при пермутациях, % |
|---|---|---|
| Kalopanax septemlobus | Pw | 34.6 |
| WKI | 23 | |
| m | 15.2 | |
| Pp | 19 | |
| T | 8.2 | |
| Iс | 0 | |
| Phellodendron amurense var. sachalinense |
Pw | 19.6 |
| WKI | 42.2 | |
| m | 20.7 | |
| Pp | 5.2 | |
| T | 12.3 | |
| Iс | 0 |
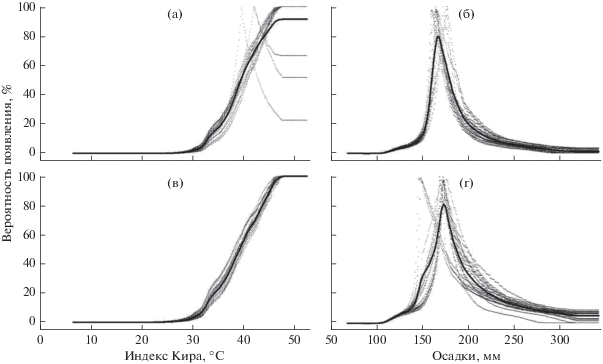
В случае когда WKI – единственный предиктор модели, максимальная вероятность появления изучаемых видов деревьев соответствует WKI > 45°C. Значения WKI < 30°C соответствуют почти нулевой вероятности присутствия видов. В случае выбора Pw в качестве единственного предиктора кривая отклика приобретает унимодальный вид с максимумом 160–170 мм (рис. 4).
Рис. 4.
Кривые отклика Kalopanax septemlobus (a, б) и Phellodendron amurense var. sachalinense (в, г) на параметры теплового индекса Кира (WKI) (а, в) и суммы осадков за три наиболее холодных месяца (Pw) (б, г). Прерывистые линии соответствуют отдельным репликациям (n = 20), сплошная линия построена методом экспоненциального сглаживания.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Современные ареалы и пространственные модели. Об идентичности климатических ниш изучаемых видов свидетельствует отсутствие статистически значимых различий между средними значениями климатических параметров локалитетов видов и их центроидами по результатам NMDS. Наличие обособленного “курильского” и “сахалинского” кластеров на ординационной диаграмме соответствует долготному климатическому градиенту суша–океан. В то же время факторы, вносящие наибольший вклад в модель, оказываются слабо скоррелированными с первой осью варьирования.
Согласно полученным моделям климатически пригодные местообитания K. septemlobus и P. amurense var. sachalinense отчасти соответствуют современным ареалам видов. Модели предсказывают оптимальные климатические условия на крайнем юго-западе о-ва Сахалина, близлежащем о-ве Монероне и южных Курильских островах. В пределах этой территории модели не предсказывают появление видов в осевых частях хребтов и на склонах вулканов, а также севернее 47.5° с.ш. на о-ве Сахалине и севернее 45.5° с.ш. на Курильских островах. Несмотря на то что климатические условия о-ва Шикотана оцениваются как подходящие для K. septemlobus, в настоящее время вид известен там только по старым гербарным сборам (Баркалов, 2009). Хотя модели предсказывают наличие рассматриваемых видов на крайнем юго-востоке о-ва Сахалина, актуальные ареалы видов не включают в себя эту территорию.
Прогностические модели. Климатически пригодные местообитания для рассматриваемых видов к 2050 г. появятся вдоль побережий, в низменностях центральной части среднего Сахалина и в равнинной северной трети острова. На Курильских островах появление местообитаний предсказывается для южного и восточного побережья о-ва Урупа, высотных поясах растительности на островах Кунашире и Итурупе.
Для отражения общей теплообеспеченности показатель T не столь информативен, как WKI. Например, среднегодовые температуры в Северо-Курильске (о-в Парамушир) и в Южно-Сахалинске почти равны (~2.8°C), однако различие значений WKI составляет 25°C (19 и 44°C соответственно). Согласно сценарию RCP2.6 к 2050 г. среднегодовая температура в островном регионе по сравнению с 1960–1990 гг. увеличится на 3.9°C (WKI – на 8.8°C, Pw – на 19 мм), а согласно RCP8.5 – на 5.2°C (WKI – на 14.8°C, Pw – на 31 мм). При этом широколиственные умеренные леса Дальнего Востока формируются при WKI > 45°C (Nakamura et al., 2007).
Pw – второй фактор, тесно связанный с распространением K. septemlobus и P. amurense var. sachalinense. Снежный покров защищает растения от вымерзания, что важно для сохранения подроста. В то же время мощная толща снега дольше тает, что снижает продолжительность вегетации. Кроме того, бо́льшая сумма зимних осадков характерна для горных районов с низкой теплообеспеченностью, поэтому такие участки не распознаются как подходящие для рассматриваемых видов деревьев, а кривая отклика имеет “классический” унимодальный вид с оптимумом в средней части градиента. В предшествующей работе по моделированию распространения K. septemlobus на островах Японского архипелага фактор зимних осадков оказался не столь значимым (Sakaguchi et al., 2010). Вероятно, экологическая роль зимних осадков, формирующих достаточно мощный снежный покров, возрастает по мере приближения к северной границе ареала вида.
Таким образом, существенное увеличение потенциально пригодных площадей в пределах островного сектора РДВ прогнозируется за счет увеличения теплообеспеченности территории и увеличения количества зимних осадков.
Изменения в сопредельных регионах. Согласно моделям глобального изменения климата к 2080 г. в Японии прогнозируется уменьшение площади местообитаний K. septemlobus почти на 70% существующей (Sakaguchi et al., 2010). Для Южной Кореи сокращение климатически пригодных местообитаний K. septemlobus оценивается 51–85% (Kang et al., 2016). Речь идет не о полном исчезновении вида на этих территориях, а о продолжающемся снижении численности и увеличении фрагментации популяций.
Палинологические реконструкции. Использование палинологических данных позволяет реконструировать распространение видов во времена климатических максимумов прошлого и соотнести их с результатами моделирования. В течение климатического максимума голоцена климат на о-ве Сахалине и Курильских островах был более теплым (среднегодовая температура была на 3‒5°C выше) и более влажным, чем современный. Этому периоду соответствуют увеличение содержания пыльцы широколиственных деревьев (роды Acer, Fraxinus, Juglans, Kalopanax, Phellodendron, Quercus, Ulmus) и размещение границ их ареалов к северу от современных (Mikishin et al., 2009; Igarashi, Zharov, 2011; Микишин, Гвоздева, 2013; Leipe, 2015; Igarashi, 2016). На Курильских островах голоценовый оптимум сопровождался увеличением присутствия широколиственных видов на островах Кунашире, Итурупе, Шикотане. Возможно, они даже могли произрастать на юге о-ва Урупа (Razjigaeva et al., 2004, 2013; Разжигаева и др., 2014).
Результаты палинологических исследований дают основания утверждать, что в условиях былых более теплых и влажных климатов островов K. septemlobus и P. amurense var. sachalinense имели более широкие ареалы и чаще встречались в составе растительных сообществ.
Различие реализованных и климатических ниш. Поскольку возможность существования вида в том или ином местообитании определяется не только климатическими, но и ландшафтными факторами, а также комплексом биотических взаимоотношений, климатическая ниша, как правило, шире, чем реализованная. В связи с этим, а также с историческим аспектом, актуальные ареалы не совпадают с климатически предсказанными. Например, рассматриваемые виды деревьев не смогут заселить заболоченные участки речных долин или небольшие острова с сильными морскими ветрами.
Любое моделирование основано на принципах экстраполяции и не всегда отражает реальные контуры ареалов (Worth et al., 2014). Так, построенные модели не предусматривают появления пригодных местообитаний в горных районах средней части о-ва Сахалина. С точки зрения моделирования регионального климата такой результат вполне обоснован и связан с высотным термическим градиентом. Однако локальные климаты горных районов сильно зависят от экспозиции и крутизны поверхностей, наличия температурных инверсий и ветробойных участков. Локальные комбинации климатических и эдафических условий способны поддерживать комплексы растительности более теплых эпох (Крестов и др., 2009; Omelko et al., 2012). Условия хорошо прогреваемых и защищенных от морских ветров южных склонов могут быть вполне подходящими для рассматриваемых видов теплоумеренной флоры.
Массовые ветровалы – триггеры перестройки экосистем. K. septemlobus и P. amurense var. sachalinense в естественных сообществах произрастают спорадически. Приживание сеянцев и успешное развитие этих деревьев происходят в окнах полога, местах естественных нарушений (Ishizuka, Sugawara, 1986; Iida, Nakashizuka, 1998; Yoshida, Kamitani, 1999). Наличие почвенного нарушения (участка с ослабленной конкуренцией) – более важное условие возобновления для P. amurense, чем наличие светового окна (Нечаев, 1960), при этом в производных древостоях на территории РДВ плотность размещения P. amurense может достигать 200 деревьев на 1 га (Цымек, 1969). Экология K. septemlobus сходна: на юге Приморского края вид активно участвует в формировании вторичных лесных сообществ на вырубках и гарях (Гладкова и др., 2015). Таким образом, отсутствие подходящих для возобновления площадей может сильно тормозить процесс расселения и увеличения численности рассматриваемых видов.
Проецируя этот важный аспект экологии K. septemlobus и P. amurense var. sachalinense на современную природную обстановку юга о-ва Сахалина и Курильских сотровов, можно предположить, что проводниками расселения и увеличения численности этих видов способны стать участки массовых ветровалов, возникших после прохождения тропических циклонов 2014 и 2015 гг. По данным предварительного анализа космических снимков общая площадь участков сплошных ветровалов в регионе составляет ~40 тыс. га.
Сильные ветры – естественные факторы возникновения нарушений в лесах, приводящие к формированию регенерационных ниш деревьев (Ulanova, 2000; Kramer et al., 2001; McCarthy, 2001; Смирнова, 2004). Наличие ветровальных нарушений изменяет пространственную и функциональную структуру экосистем, вызывает изменение численности и соотношения экологических групп животных, в том числе птиц – агентов распространения семян (Hirao et al., 2008). Хотя роль ветра как фактора динамики лесного покрова в островном регионе отмечалась давно (Цымек, Соловьев, 1948), на о-ве Сахалине и Курильских островах ранее не было зафиксировано столь массовых ветровальных явлений. Возможно, усиление ветровой нагрузки во время прохождения тропических циклонов еще одна сторона процесса изменения климата в регионе. В ряде работ показано, что число и сила тайфунов в Северо-Восточной Азии увеличиваются (Altman et al., 2013, 2016).
Таким образом, массовые ветровалы могут поспособствовать процессу увеличения численности видов деревьев теплоумеренной флоры, их распространению на новые площади и поддержать процесс перестройки экосистем в соответствии с меняющимися климатическими условиями. Однако данное предположение требует специальной проверки.
Список литературы
Баркалов В.Ю. Флора Курильских островов. Владивосток: Дальнаука, 2009. 468 с.
Вальтер Г. Растительность земного шара: эколого-физиологическая характеристика. Т. 1. Тропические и субтропические зоны. М.: Прогресс, 1968. 551 с.
Вальтер Г. Общая геоботаника. М.: Мир, 1982. 261 с.
Введенский А.И. Рутовые – Rutaceae // Флора СССР. Т. 14 / Ред. Шишкин Б.К., Бобров Е.Г. М.; Л.: Изд-во АН СССР, 1949. С. 198–241.
Гладкова Г.А., Сибирина Л.А., Бутовец Г.Н. Редкие растительные сообщества с калопанаксом семилопастным на острове Русский (южное Приморье) // Вестн. ДВО РАН. 2015. № 1. С. 34–44.
Дудов С.В. Моделирование распространения видов по данным рельефа и дистанционного зондирования на примере сосудистых растений нижнего горного пояса хр. Тукурингра (Зейский заповедник, Амурская область) // Журн. общ. биологии. 2016. Т.77. № 2. С. 122–134.
Каталог научного гербария сосудистых растений ИМГиГ ДВО РАН / Сост. Смирнов А.А. Южно-Сахалинск: Ин-т морской геологии и геофизики ДВО РАН, 1999. 207 с.
Клюйков Е.В., Тихомиров В.Н. Аралиевые – Araliaceae Juss. // Флора Советского Дальнего Востока. Т. 2 / Отв. ред. Харкевич С.С. Л.: Наука, 1987. С. 195–203.
Колесников Б.П. Растительность // Дальний Восток: Физико-географическая характеристика. М.: Наука, 1961. С. 183–298.
Красная книга Сахалинской области: Растения / Отв. ред. Еремин В.М. Южно-Сахалинск: Сахалин. кн. изд-во, 2005. 348 с.
Крестов П.В., Баркалов В.Ю., Омелько А.М., Якубов В.В., Накамура Ю., Сато К. Реликтовые комплексы растительности современных рефугиумов северо-восточной Азии // Комаровские чтения. 2009. Вып. 56. С. 5–63.
Микишин Ю.А., Гвоздева И.Г. Средний-поздний голоцен Северо-Сахалинской равнины // Russ. J. Earth Sci. 2013. № 2(14). С. 97–108.
Недолужко В.А. Рутовые – Rutaceae // Флора Советского Дальнего Востока. Т. 4 / Отв. ред. Харкевич С.С. Л.: Наука, 1989. С. 339–343.
Нечаев А.П. Факторы естественного возобновления бархата амурского // Ботан. журн. 1960. Т. 45. № 1. С. 77–84.
Нечаев В.А., Нечаев А.А. Птицы – потребители плодов и распространители семян бархата Phellodendron Rupr. на юге Дальнего Востока России // Сиб. лес. журн. 2016. № 1. С. 64–70.
Полетико О.М. Аралиевые – Araliaceae // Деревья и кустарники СССР. Т. 5 / Под ред. Соколова С.Я. М.; Л.: Изд-во АН СССР, 1960. С. 148–189.
Пояркова А.И. Аралиевые – Araliaceae // Флора СССР. Т. 16. / Ред. Шишкин Б.К. М.; Л.: Изд-во АН СССР, 1950. С. 2–36.
Разжигаева Н.Г., Ганзей Л.А., Гребенникова Т.А., Белянина Н.И., Мохова Л.М., Арсланов Х.А., Чернов С.Б. Эволюция ландшафтов Курильских островов в голоцене // Изв. РАН. Сер. геогр. 2014. № 3. С. 43–50.
Родионенко Г.И. Рутовые – Rutaceae // Деревья и кустарники СССР. Т. 4 / Под ред. Соколова С.Я. М.; Л.: Изд-во АН СССР, 1958. С. 230–256.
Смирнова О.В. Методологические подходы и методы оценки климаксового и сукцессионного состояния лесных экосистем (на примере восточноевропейских лесов) // Лесоведение. 2004. № 3. С. 15–27.
Толмачев А.И. Геоботаническое районирование острова Сахалина. М.; Л.: Изд-во АН СССР, 1955. 80 с.
Уиттекер Р. Сообщества и экосистемы. М.: Прогресс, 1980. 327 с.
Цымек А.А. Леса с бархатом амурским // Леса Дальнего Востока / Под ред. Агеенко А.С. М.: Лесн. пром-сть, 1969. С. 182–184.
Цымек А.А., Соловьев К.П. Лесное хозяйство Южного Сахалина // Лес. хоз-во. 1948. № 1. С. 81–84.
Черепанов С.К. Сосудистые растения России и сопредельных государств (в пределах бывшего СССР). СПб.: Мир и семья, 1995. 992 с.
Altman J., Doležal J., Cerný T., Song J.-S. Forest response to increasing typhoon activity on the Korean peninsula: Evidence from oak tree-rings // Glob. Chang. Biol. 2013. V. 19. P. 498–504.
Altman J., Fibich P., Leps J., Uemura S., Hara T., Doležal J. Linking spatiotemporal disturbance history with tree regeneration and diversity in an old-growth forest in northern Japan // Perspect. Plant Ecol. Evol. Syst. 2016. V. 21. P. 1–13.
Austin M. Species distribution models and ecological theory: A critical assessment and some possible new approaches // Ecol. Model. 2007. V. 200. P. 1–19.
Box E.O., Fujiwara K.A. Comparative look at bioclimatic zonation, vegetation types, tree taxa and species richness in Northeast Asia // Bot. Pacif. 2012. V. 1. P. 5–20.
Chen I.-C., Hill J.K., Ohlemüller R., Roy D.B., Thomas C.D. Rapid range shifts of species associated with high levels of climate warming // Science. 2011. V. 333. P. 1024–1026.
Fawcett T. An introduction to ROC analysis // Pattern Recogn. Lett. 2006. V. 27. 861–874.
Fujimori N., Samejima H., Kenta T., Ichie T., Shibata M., Iida S., Nakashizuka T. Reproductive success and distance to conspecific adults in the sparsely distributed tree Kalopanax pictus // J. Plant Res. 2006. V. 119. P. 195–203.
Gent P.R., Danabasogl U., Donner L.J., Holland M.M., Hunke E.C., Jayne S.R., Lawrence D.M., Neale R.B., Rasch P.J., Vertenstein M., Worley P.H., Yang Z.-L., Zhang M. The Community Climate System Model version 4 // J. Clim. 2011. V. 24. P. 4973–4991.
Hämet-Ahti L., Ahti T., Koponen T. A scheme of vegetation zones for Japan and adjacent regions // Ann. Bot. Fennici. 1974. V. 11. P. 59–88.
Hijmans R.J., Cameron S.E., Parra J.L., Jones P.G., Jarvis A. Very high resolution interpolated climate surfaces for global land areas // Int. J. Climatol. 2005. V. 25. P. 1965–1978.
Hirao T., Murakami M., Oguma H. Functional spatial scale of community composition change in response to windthrow disturbance in a deciduous temperate forest // Ecol. Res. 2008. V. 23. P. 249–258.
Igarashi Ya. Vegetation and climate during the LGM and the last deglaciation on Hokkaido and Sakhalin Islands in the northwest Pacific // Quat. Int. 2016. V. 425. P. 28–37.
Igarashi Ya., Zharov A.E. Climate and vegetation change during the late Pleistocene and early Holocene in Sakhalin and Hokkaido, northeast Asia // Quat. Int. 2011. V. 237. P. 24–31.
Iida S., Nakashizuka T. Spatial and temporal dispersal of Kalopanax pictus seeds in a temperate deciduous forest, central Japan // Plant Ecol. 1998. V. 135. P. 243–248.
Ishizuka M., Sugawara S. Composition and structure of natural mixed forests in Central Hokkaido (1) composition differences and species characteristics by elevation and from disturbances // J. Jap. For. Soc. 1986. V. 68. P. 79–86.
Janská V., Jiménez-Alfaro B., Chytrý M., Divíšek J., Anenkhonov O., Korolyuk A., Lashchinskyi N., Culek M. Palaeodistribution modelling of European vegetation types at the Last Glacial Maximum using modern analogues from Siberia: Prospects and limitations // Quat. Sci. Rev. 2017. V. 159. P. 103–115.
Kang W., Minor E.S., Lee D., Park C.-R. Predicting impacts of climate change on habitat connectivity of Kalopanax septemlobus in South Korea // Acta Oecol. 2016. V. 71. P. 31–38.
Kramer M.G., Hansen A.J., Taper M.L., Kissinger E.J. Abiotic controls on long-term windthrow disturbance and temperate rain forest dynamics in southeast Alaska // Ecology. 2001. V. 82. P. 2749–2768.
Krestov P., Omelko A.M., Nakamura Yu. Phytogeography of higher units of forests and krummholz in North Asia and formation of vegetation complex in the Holocene // Phytocoenologia. 2010. V. 40. P. 41–56.
Krestov P.V., Nakamura Yu. Phytosociological study of the Picea jezoensis forests of the Far East // Folia Geobot. 2002. V. 37. P. 441–473.
Krestov P.V., Song J.-S., Nakamura Y., Verkholat V.P. A phytosociological survey of the deciduous temperate forests of mainland Northeast Asia // Phytocoenologia. 2006. V. 36. P. 77–150.
Leipe C., Nakagawa T., Gotanda K., Müller S., Tarasov P. // Late Quaternary vegetation and climate dynamics at the northern limit of the East Asian summer monsoon and its regional and global-scale controls // Quat. Sci. Rev. 2015. V. 116. P. 57–71.
Ma J., Liu Q., Yu M., Han L. A revision of Phellodendron (Rutaceae) // Edinb. J. ot. 2006. V. 63. P. 131–151.
McCarthy J. Gap dynamics of forest trees: A review with particular attention to boreal forests // Environ. Rev. 2001. V. 9. P. 1–59.
Mikishin Yu.A., Gvozdeva I.G., Orlova L.A. Basic Holocene section of south west Sakhalin // Environment development of East Asia in Pleistocene-Holocene (boundaries, factors, stages of Human mastering). Proceedings of International Scientific Conference, Sept. 14–18, 2009. Vladivostok, Russia. Vladivostok: Dalnauka, 2009. P. 149–152.
Mizui N., Kikuzawa K. Proximate limitations to fruit and seed set in Phellodendron amurense var. sachalinense // Plant Spec. Biol. 1991. V. 6. P. 39–46.
Moss R.H., Edmonds J.A., Hibbard K.A., Manning M.R., Rose S.K., van Vuuren D.P., Carter T.R., Emori S., Kainuma M., Kram T. The next generation of scenarios for climate change research and assessment // Nature. 2010. V. 463. P. 747–756.
Nakamura Yu., Krestov P.V. Coniferous forests of the temperate zone of Asia // Coniferous forests. Ecosystems of the World, 6 / Ed. Andersson F.A. Amsterdam: Elsevier, 2005. P. 165–220.
Nakamura Yu., Krestov P.V., Omelko A.M. Bioclimate and vegetation complexes in Northeast Asia: a first approximation to integrated study // Phytocoenologia. 2007. V. 37. P. 443–470.
Okitsu S. Vegetation comparison between the Russian Far East and the Taisetsu Mountains, Central Hokkaido, northern Japan // Bot. Pacif. 2016. V. 5. P. 3–18.
Oksanen J., Blanchet F.G., Kindt R., Legendre P., Minchin P.R., O’Hara R.B., Simpson G.S., Solymos P., Stevens M.H.H., Wagner H.H. Vegan: community ecology package. R package version 2.4-3. 2017. 292 p. [Electronic resources] URL: https://cran.r- project.org/web/packages/vegan/vegan.pdf
Omelko A.M., Krestov P.V., Yakovleva A.N. A topography-based model of the vegetation cover of the Lanzhinskie Mountains // Bot. Pacif. 2012. V. 1. № 1. P. 109–119.
Peel M.C., Finlayson B.L., McMahon T.A. Updated world map of the Köppen-Geiger climate classification // Hydrol. Earth Syst. Sci. 2007. V. 11. P. 1633–1644.
Phillips S.J., Dudik M. Modeling of species distributions with MaxEnt: new extensions and a comprehensive evaluation // Ecography. 2008. V. 31. P. 161–175.
Phillips S.J., Anderson R.P., Schapire R.E. Maximum entropy modeling of species geographic distribution // Ecol. Modell. 2006. V. 190. P. 231–259.
Razjigaeva N.G., Grebennikova T.A., Ganzey L.A., Mokhova L.M., Bazarova V.B. The role of global and local factors in determining the middle to late Holocene environmental history of the South Kurile and Komandar islands, northwestern Pacific // Palaeogeogr. Palaeoclimatol. Palaeoecol. 2004. V. 209. P. 313–333.
Razjigaeva N.G., Ganzey L.A., Grebennikova T.A., Belyanina N.I., Mokhova L.M., Arslanov K.A., Chernov S.B. Holocene climatic changes and vegetation development in the Kuril Islands // Quat. Int. 2013. V. 290–291. P. 126–138.
Sakaguchi S., Sakurai S., Yamasaki M., Isagi Y. How did the exposed seafloor function in postglacial northward range expansion of Kalopanax septemlobus? Evidence from ecological niche modeling // Ecol. Res. 2010. V. 25. P. 1183–1195.
Sakaguchi S., Takeuchi Y., Yamasaki M., Sakurai S., Isagi Y. Lineage admixture during postglacial range expansion is responsible for the increased gene diversity of Kalopanax septemlobus in a recently colonised territory // Heredity. 2011. V. 107. P. 338–348.
Sakaguchi S., Qiu Y.-X., Liu Y.-H., Qi X.-S., Kim S.-H., Han J., Takeuchi Y., Worth J.R.P., Yamasaki M., Sakurai S., Isagi Y. Climate oscillation during the Quaternary associated with landscape heterogeneity promoted allopatric lineage divergence of a temperate tree Kalopanax septemlobus (Araliaceae) in East Asia // Mol. Ecol. 2012. V. 21. P. 3823–3838.
Ulanova N.G. The effects of windthrow on forests at different spatial scales: a review // For. Ecol. Manage. 2000. V. 135. P. 155–167.
Worth J.R.P., Williamson G.J., Sakaguchi S., Nevill P.G., Jordan G.J. Environmental niche modelling fails to predict Last Glacial Maximum refugia: niche shifts, microrefugia or incorrect palaeoclimate estimates? // Glob. Ecol. Biogeogr. 2014. V. 23. P. 1186–1197.
Yoshida T., Kamitani T. Growth of a shade-intolerant tree species, Phellodendron amurense, as a component of a mixed-species coppice forest of central Japan // For. Ecol. Manage. 1999. V. 113. P. 57–65.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


