Известия РАН. Серия биологическая, 2019, № 6, стр. 590-597
Генетическая предрасположенность к болезни хронического изнурения (Chronic Wasting Disease) северных оленей Rangifer tarandus европейского Севера России
М. В. Холодова 1, *, А. И. Баранова 1, И. А. Мизин 2, Д. В. Панченко 3, Т. М. Романенко 4, А. Н. Королев 5
1 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
2 Национальный парк “Русская Арктика”
163000 Архангельск, просп. Советских космонавтов, 57, Россия
3 Институт биологии КарНЦ РАН
185910 Петрозаводск, ул. Пушкинская, 11, Россия
4 Нарьян-Марский филиал Федерального исследовательского центра комплексного изучения Арктики им. Н.П. Лаверова РАН
166000 Нарьян-Мар, ул. Рыбников, 1, Россия
5 Институт биологии Коми НЦ УрО РАН
167982 Сыктывкар, ул. Коммунистическая, 28, Россия
* E-mail: mvkholod@mail.ru
Поступила в редакцию 13.03.2019
После доработки 21.06.2019
Принята к публикации 21.06.2019
Аннотация
Для оценки потенциальной генетической предрасположенности к заражению смертельно опасным прионным заболеванием хронического изнурения (CWD) для трех региональных группировок дикого и двух домашнего северного оленя Rangifer tarandus европейского Севера России получены нуклеотидные последовательности гена прионного белка PRNP. Обнаружено семь однонуклеотидных полиморфизмов, соответствующих заменам в шести кодонах прионного белка PrP – 2(V/M), 129(G/S), 138(S/N), 169(V/M), 176(N/D) и 225(S/Y), описано шесть аллелей белка PrP. Генотипы с аспарагином (N) в кодоне 138 (138NN и 138SN), ассоциированные с повышенной устойчивостью к заражению CWD, в группировках диких северных оленей Новой Земли, Кольского п-ова и лесных районов Архангельской обл. и Республики Коми обнаружены у 8.7, 14.3 и 18.2% особей. Установлено, что частота встречаемости этих генотипов у домашних оленей Республики Коми и о. Колгуев была выше – 37.5 и 42.1% соответственно. Отмечено, что в связи с преобладанием генотипов PrP с серином в кодоне 138 (138SS), ассоциированных с повышенной восприимчивостью к заражению CWD, а также с появлением этого заболевания среди северных оленей, лосей и благородных оленей в Скандинавии существует реальная угроза распространения CWD среди северных оленей европейской части России.
Болезнь хронического изнурения оленей (Chronic Wasting Disease (CWD)) – смертельно опасное прионное заболевание, поражающее различные виды диких копытных сем. Cervidae (Williams, 2005; Sigurdson, 2008). CWD относится к группе трансмиссивных губчатых энцефалопатий (transmissible spongiform encephalopathy (TSE)), включающих в себя также целый ряд заболеваний человека и животных, вызываемых прионами, в том числе болезнь Крейтцфельдта–Якоба, фатальную семейную бессонницу, “куру” папуасов Новой Гвинеи, губчатую энцефалопатию крупного рогатого скота (“коровье бешенство” (BSE)), скрейпи овец и коз. Инфекционный агент – прион (белок с аномальной третичной структурой), который попадая в организм, вызывает конфармационное превращение гомологичного ему нормального клеточного белка в себе подобный (прион) и запускает цепную реакцию. В ходе этой реакции образуется множество белковых молекул с аномальной структурой (Prusiner, 1998).
До последнего времени CWD отмечалась только у оленьих Северной Америки. С начала ХХI в. CWD, обнаруженная в двух штатах США, стала интенсивно распространяться среди диких и разводимых на фермах оленьих США. По данным Национального Центра Здоровья Дикой Природы (National Wildlife Health Center USGS, www.usgs.gov, Bryan Richards) в 2019 г. CWD была зарегистрирована среди диких и разводимых при полувольном содержании представителей оленьих в 26 штатах США и 3 провинциях Канады. Случаи заболевания CWD в Северной Америке были отмечены у различных подвидов белохвостого оленя Odocoileus virginianus, чернохвостого оленя O. hemionus, лося Alces alces, вапити Cervus canadensis (Miller, Wild, 2004; Williams, 2005; Baeten et al., 2007; Basu et al., 2012). До последнего времени у евразийского северного оленя Rangifer tarandus и у карибу, включающего в себя североамериканские подвиды северного оленя, CWD не отмечалась. Тем не менее экспериментально, путем введения в организм инокулятов от больных вапити и белохвостых оленей, была установлена возможность заражения этого вида CWD (Mitchell et al., 2012). Выводы, сделанные на основе результатов экспериментов, к сожалению, подтвердились.
В 2016 г. CWD впервые была зарегистрирована в Европе. Так, в Норвегии случаи гибели от CWD были диагностированы у лосей A. alces, диких северных оленей R. t. tarandus (Benestad et al., 2016), благородного оленя Cervus elaphus (Vikøren et al., 2019). В 2018 г. был отмечен случай гибели лося от CWD в Финляндии, в районе Кухмо, на границе с Россией (http://cwd-info.org). В последние годы в разных странах проводятся интенсивные исследования в области эпидемиологии CWD. Особое внимание уделяется проблеме генетической предрасположенности оленьих к данному заболеванию. Для ряда видов получены данные, свидетельствующие о связи между полиморфизмом гена PRNP, кодирующего прионный протеин (PrP), и устойчивостью животных к CWD (O’Rourke et al., 1999; Jewell et al., 2005). У северных оленей особое внимание уделяется мутациям в 138-й позиции аминокислотной последовательности белка PrP. Установлено, что присутствие аспарагина (N) в кодоне 138 сопряжено с более высокой устойчивостью оленей к заражению CWD (Mitchell et al., 2012). Авторы объясняют это характерным строением пространственной конфигурации прионного белка, обусловливающим защиту от поражения этим инфекционным агентом. В основном данные о генотипах PRNP получены для R. tarandus Северной Америки и Скандинавии (Happ et al., 2007; Mitchell et al., 2012; Wik et al., 2012; Benestad et al., 2016; Cheng et al., 2017). Сведения о разнообразии гена прионного белка среди копытных России, и в частности северного оленя, отсутствуют. Учитывая, что возбудители CWD, прионы, попадая в окружающую среду с частями тела погибших животных, экскретами (слюной, мочой, экскрементами) зараженных животных, способны длительное время сохраняться на растительности, в почве, на природных солонцах (Miller et al., 2004; Sigurdson, 2008; Plummer et al., 2018), а также возможность межвидового переноса возбудителя (Williams, 2005; Sigurdson, 2008; Robinson et al., 2012) и непосредственную близость очагов заболевания CWD к границам нашей страны, возникла необходимость всестороннего изучения эпидемиологической ситуации с CWD в России.
Цель работы – описать распространение аллелей прионного белка PRP, ассоциированных с различной устойчивостью к прионному заболеванию хронического изнурения, у северных оленей R. tarandus европейского Севера России.
МАТЕРИАЛЫ И МЕТОДЫ
Образцы для исследования (кусочки заспиртованных мышц, сухих шкур, костей и экскременты) были собраны в разных группировках северного оленя, обитающего на европейской части России. Выборка диких оленей включала в себя образцы (n) c Кольского п-ова – из Мурманской обл. и пограничных районов Республики Карелия (n = 14), а также из Республики Коми и Архангельской обл. (n = 11) и с арх. Новая Земля (n = 23). Домашняя форма R. tarandus была представлена образцами с о. Колгуев (n = 19) и из Республики Коми (n = 16), относящимися к ненецкой породе северного оленя.
ДНК выделяли с помощью наборов DiatomPrep100 (Изоген, Россия), QIAamp Fast DNA Stool Mini Kit (QIAGEN, Германия) по прописи производителей. Амплификацию гена прионного белка PRNP проводили с использованием набора MasterMix с добавлением полимеразы SmarTaq (Диалат, Россия) и с праймерами Ce19 ATTTTGCAGATAAGTCATC (прямой) и Ce778 AGAAGATAATGAAAACAGGAAG (обратный) (O’Rourke et al., 1999). Амплификацию проводили в следующем режиме: I – 94°C (4 мин); II – (40 циклов) 94°C (30 с), 51°C (30 с), 72°C (30 с); III – 72°C (10 мин) (Happ et al., 2007). Определение нуклеотидных последовательностей (секвенирование) проводили на генном анализаторе AB 3500 (Applied Biosystems, США), применяя набор реагентов BigDye Terminator kit v.3.1 (Applied Biosystems) и праймеры, использованные в ПЦР. Исследования были проведены в кабинете методов молекулярной диагностики ИПЭЭ РАН, входящем в состав Центра коллективного пользования “Инструментальные методы в экологии” ИПЭЭ РАН. Выравнивание нуклеотидных последовательностей было проведено вручную с использованием программы BioEdit (Hall, 1999). Филогенетические отношения между аллелями определялись путем построения медианной сети в программе Network 4.6 (http://www.fluxus-engineering.com). Генетические дистанции по Нею (Nei, 1972) рассчитывали, рассматривая каждый изменчивый кодон в белке PrP в качестве отдельного локуса в программе GenAlEx 6 (Peakall, Smouse, 2006). На основании полученных дистанций в той же программе проводили анализ главных координат.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Получены 83 нуклеотидные последовательности открытой рамки считывания гена прионного белка PRNP длиной 771 п.н., кодирующие 256 аминокислот. В общем выравнивании гена PRNP обнаружено семь нуклеотидных замен – однонуклеотидных полиморфизмов (Single nucleotide polymorphism (SNP)). Семь описанных аллелей гена PRNP (A15, Kol15, 9A_1, 39Mur, 40Mur, Kol6, 37RKD) зарегистрированы в международной базе GenBank (ncbi) под номерами MK097270, MN052815−MN052820. Шесть SNP гена PRNP соответствовали заменам аминокислот в шести кодонах белка PrP. SNP в позиции 117 гена PRNP (C/T) был синонимичным и не приводил к замене аминокислоты (S/S). По всем шести несинонимичным заменам гена PRNP и соответственно шести кодонам прионного белка наблюдалась гетерозиготность (табл. 1). Всего было описано шесть аллелей белка PrP. Частоты распределения замен, их гомо- и гетерозиготности в кодонах белка PrP в исследованных группировках северных оленей существенно различались (рис. 1, табл. 2). Поскольку замена в кодоне 2 (V/M) располагается в предполагаемой сигнальной части сиквенса и не оказывает влияния на конформацию зрелого белка, обычно рассматриваются изменчивые кодоны 129G/S, 138S/N, 169V/M, 176N/D и 225S/Y (Happ et al., 2007).
Таблица 1.
Замены в гене прионного белка PRNP и в кодонах прионного белка PrP у северного оленя севера европейской части России
| № позиции замены в гене PRNP | Нуклеотид | № кодона в белке PrP | Аминокислота |
|---|---|---|---|
| 4 | g | 2 | V |
| a | M | ||
| 385 | g | 129 | G |
| a | S | ||
| 413 | g | 138 | S |
| a | N | ||
| 505 | g | 169 | V |
| a | M | ||
| 526 | g | 176 | N |
| a | D | ||
| 674 | c | 225 | S |
| a | Y |
Примечание. Строчными буквами обозначены азотистые основания (g – гуанин, a – аденин, c – цитозин), прописными – аминокислоты (V – валин, M – метионин, S – серин, G – глицин, N – аспарагин, D – аспарагиновая кислота, Y – тирозин; для табл. 1 и 2).
Рис. 1.
Частоты гомо- и гетерозигот в изменчивых кодонах белка PrP у северных оленей различных группировок европейской части России. а–д – кодоны 129, 138, 169, 176, 225 соответственно.
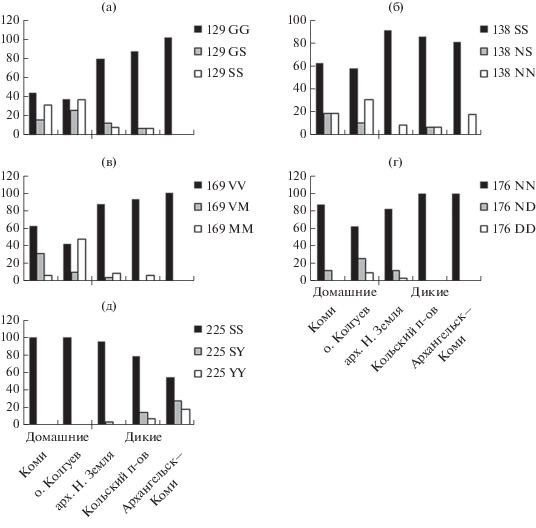
Таблица 2.
Частоты встречаемости замен аминокислот в кодонах прионного белка PrP у северных оленей европейского Севера России
| Белок PrP | Региональные группировки | |||||
|---|---|---|---|---|---|---|
| № кодона | аминокислота | домашние | дикие | |||
| Коми | о. Колгуев | арх. Новая Земля | Кольский п-ов | Архангельск–Коми | ||
| 2 | V | 0.625 | 0.474 | 0.739 | 0.929 | 1 |
| M | 0.375 | 0.526 | 0.261 | 0.071 | 0 | |
| 129 | G | 0.531 | 0.526 | 0.848 | 0.893 | 1 |
| S | 0.469 | 0.474 | 0.152 | 0.107 | 0 | |
| 138 | S | 0.719 | 0.632 | 0.913 | 0.893 | 0.818 |
| N | 0.281 | 0.368 | 0.087 | 0.107 | 0.182 | |
| 169 | V | 0.781 | 0.447 | 0.870 | 0.929 | 1 |
| M | 0.219 | 0.553 | 0.130 | 0.071 | 0 | |
| 176 | N | 0.938 | 0.763 | 0.891 | 1 | 1 |
| D | 0.063 | 0.237 | 0.109 | 0 | 0 | |
| 225 | S | 1 | 1 | 0.978 | 0.857 | 0.864 |
| Y | 0 | 0 | 0.022 | 0.143 | 0.136 | |
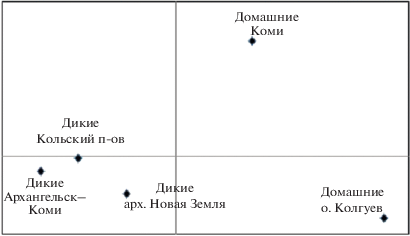
Наиболее значимый с точки зрения устойчивости/предрасположенности к заражению прионным заболеванием хронического изнурения у северных оленей кодон 138S/N. В целом в выборке образцов северных оленей, обитающих в европейской части России, в данной позиции белка преобладали аллели с серином (138S), что ассоциируется с повышенной предрасположенностью к CWD. Тем не менее во всех исследованных группировках также были отмечены и аллели с аспарагином (138N) в гомо- или гетерозиготном состоянии (рис. 1). Доля аллелей с генотипом 138N среди домашних оленей оказалась в 3–4 раза выше, чем среди исследованных группировок дикого северного оленя (табл. 2). Особенно высокой частотой встречаемости аллелей с аспарагином в кодоне 138 отличались домашние олени с о. Колгуев. Отличия между домашними и дикими северными оленями обнаружены также по кодонам 129S/G (более высокая частота встречаемости 129S у домашних), 169V/M (более высокая частота 169M у домашних), 176N/D (более высокая частота 176D у домашних) и 225S/Y (аллель 225Y отмечен только у диких оленей) (табл. 2). Анализ главных координат, проведенный на основании генетических дистанций по Нею, показал существенные различия между группировками дикого и домашнего северного оленя (рис. 2). Следует отметить, что генетические дистанции между домашними оленями о. Колгуев и Республики Коми, относящимися к ненецкой породе, были больше, чем между всеми тремя группировками диких оленей из разных регионов европейского Севера России.
Рис. 2.
Результаты анализа главных координат на основании генетических дистанций между исследованными группировками северного оленя по аллелям прионного белка PrP.
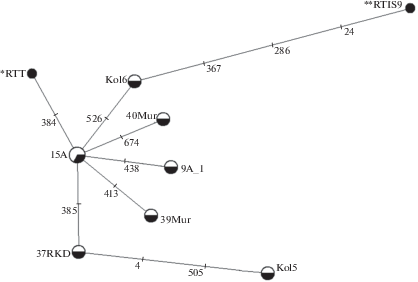
Сравнение алеллей гена PRNP, описанных для северных оленей европейского Севера России, с гомологичными сиквенсами у представителей R. tarandus из других частей видового ареала в международной компьютерной базе GenBank показали следующее. Часть аллелей были идентичны аллелям, описанным для карибу Гранта R. t. granti с Аляски (Happ et al., 2007): 15А (MK097270) – аллелю VGSV1 (DQ154293) и AY769956 (Jewel et al., 1999), 9A_1 – аллелю VGSV2 (DQ154296), Mur39 – аллелю VGNV (DQ154292), Kol5 – аллелю MSSM (DQ154295), RKD37 – аллелю VSSV (DQ154294). Еще два аллеля (Kol6 и Mur4) были идентичны генотипам, описанным для северных оленей Норвегии и Шпицбергена (Wik et al., 2012): Kol6 – аллелю 176D (JQ290075), Mur40 – аллелю 225Y (JQ290076). Характерно, что часть аллелей гена PRNP, обнаруженных у северных оленей европейской части России, была описана только для Европы, часть – для Северной Америки. Филогенетические отношения между нуклеотидными последовательностями аллелей гена PRNP, описанными в нашей работе и полученными другими авторами, приводятся на медианной сети (рис. 3). Отметим, что в GenBank включены последовательности гена PRNP северных оленей (EU032303 и AY639093), на медианной сети отмеченные звездочками, не выявленные в исследованной нами выборке (рис. 3). В общей выборке доминировал аллель VGSN, в гомозиготном состоянии он отмечен у 37.4% всех исследованных особей. Гомозиготные генотипы VGNV были обнаружены у 9.6% оленей, MSSM – у 8.4%. Остальные генотипы в гомо- и гетерозиготном состоянии встречались у 1–3 особей.
Рис. 3.
Медианная сеть аллелей гена PRNP Rangifer tarandus. Кружки обозначают аллели, черной заливкой отмечены аллели из GenBank, без заливки – аллели, описанные для северных оленей европейской части России. Аллели из GenBank, отсутствующие в нашей выборке, отмечены звездочками: * – RTT (AY639093), ** – RTIS9 (EU032303). Числа на ветвях – позиции мутаций.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Дикие северные олени, населяющие европейский Север России, в настоящее время находятся в критическом состоянии. Численность большинства региональных и локальных группировок постоянно снижается, наблюдается уменьшение площади обитания. К неблагоприятным факторам, способствующим этим процессам, относятся как естественные природно-климатические (многоснежные зимы, образование наста и др.) и биотические (воздействие хищников, инфекционные заболевания), так и антропогенные. Воздействие последних, включающее в себя техногенную трансформацию среды, истощение и сокращение площади пастбищ, превышение уровня изъятия в периоды разрешенного промысла, тяжелый пресс нелегальной охоты, факторы беспокойства, все возрастает (Ермолаев и др., 2003; Ефимов, 2010; Данилов, Панченко, 2012; Мамонтов, Хохлов, 2016; Панченко и др., 2018). Ряд популяций дикого северного оленя европейской части России включен в списки региональных Красных книг, а новоземельский северный олень, относящийся к подвиду R. t. pearsoni, Lydekker, 1903, – в Красную книгу Российской Федерации (Красная…, 2001).
В последние годы возникла новая потенциальная угроза существованию северных оленей на европейском Севере России – распространение смертельно опасного заболевания CWD. В соседних с Россией Норвегии и Финляндии случаи гибели от CWD северных оленей и других видов оленьих отмечаются с 2016 г. (Benestad et al., 2016; Vikøren et al., 2019). CWD, поражающая различные виды сем. Cervidae, считается одним из наиболее быстро и эффективно передаваемых прионных заболеваний (Robinson et al., 2012). Особенно высок риск быстрого распространения CWD для копытных, ведущих стадный образ жизни, в первую очередь северного оленя. Возникновение очага CWD в европейской части Севера России может привести к исчезновению уникальных популяций диких северных оленей и утрате стад домашнего оленя.
Изучение потенциальной генетической восприимчивости/устойчивости животных к CWD имеет существенное значение для прогнозирования возможной эпидемической ситуации в данном регионе. Проведенные нами исследования распространения среди северных оленей R. tarandus европейской части России аллелей прионного белка PrP, ассоциированных с различной устойчивостью к CWD, показали их высокое разнообразие. Из девяти имеющихся на настоящий момент в базе GenBank аллелей гена PRNP R. tarandus семь были выявлены среди оленей европейского Севера России, при этом встречались аллели, описанные как для карибу Северной Америки, так и для северного оленя Скандинавии.
Основное внимание уделялось распространению и частоте встречаемости аллелей прионного белка с аспарагином (N) в кодоне 138, для которого экспериментально была показана связь с повышенной устойчивостью R. tarandus к CWD (Mitchell et al., 2012). Во всех исследованных группировках дикого северного оленя частота встречаемости генотипов 138NN и 138SN была невысока (7.14–18.18 и 0–7.14% соответственно). Более высокие показатели были обнаружены у домашних оленей: частота встречаемости генотипа 138NN составила 18.75% среди оленей Республики Коми и 31.58% среди оленей о. Колгуев, генотипа 138SN – 18.75 и 10.53% соответственно (рис. 1). В целом среди домашних оленей Республики Коми и о. Колгуев частоты встречаемости всех генотипов с 138N, ассоциированных с повышенной устойчивостью к заражению CWD, составили 37.5 и 42.1% соответственно. Среди диких северных оленей генотипы с аспарагином в кодоне 138 встречались гораздо реже: среди новоземельских оленей у 8.7% особей, на Кольском п-ове у 14.3%, в Архангельской обл. и Республике Коми у 18.2%. Характерно, что среди обследованных популяций карибу Северной Америки доля генотипов 138N оказалась выше, чем у диких северных оленей европейской части России. Так, в трех популяциях карибу Гранта R. t. granti на Аляске частота встречаемости генотипов 138SN составила 47%, 138NN – 10% (Happ et al., 2007). По данным, полученным для девяти популяций лесного карибу R. t. caribou из Альберты (Канада), в восьми из них частота встречаемости генотипа 138NN составляла 0–10%, генотипа 138SN – 6.7–30%. Только в одной популяции (в районе Чинчага) был обнаружен необычно высокий уровень встречаемости аспарагина в кодоне 138 – генотип 138NN описан у 36.7% особей, 138SN у 43.3% (Cheng et al., 2017). Интересно, что эта малочисленная популяция генетически неоднородна, по результатам микросателлитного анализа она включает в себя смесь генотипов трех подвидов карибу (R. t. granti, R. t. groenlandicus и R. t. caribou) (Cheng et al., 2017).
Таким образом, для всех исследованных группировок дикого северного оленя европейского Севера России отмечено существенное преобладание генотипов PrP с серином в кодоне 138 (138SS), ассоциированных с повышенной восприимчивостью к заражению CWD. У домашних оленей, особенно у оленей с о. Колгуев, доминирование генотипов с 138SS выражено несколько слабее. Отметим, что у северных оленей, павших от CWD в Норвегии, по белку PrP был описан генотип VGSV (Benestad et al., 2016). Ранее экспериментальным путем для этого генотипа была установлена ассоциация с повышенной предрасположенностью к заражению CWD (Mitchell et al., 2012). Этот аллель был наиболее широко распространен у оленей из европейской части Севера России. Помимо кодона 138(S/N) в литературе также обсуждается потенциальная роль в формировании устойчивости к CWD и других кодонов белка PrP, а также возможное участие других генов (Happ et al., 2007; Sigurdson, 2008; Basu et al., 2012; Robinson et al., 2012). Однако эти предположения требуют дальнейших экспериментальных и статистических исследований.
Результаты нашего исследования, основанного на относительно небольших выборках, показали, что для северных оленей, обитающих на территории европейского Севера России, существует реальная угроза распространения смертельно опасного заболевания хронического изнурения оленей. В связи с этим необходимы разработка и выполнение специальных мер по предотвращению распространения CWD в России: запрет на ввоз любых видов оленьих и их дериватов из неблагополучных по CWD стран и регионов, проведение широкомасштабных исследований эпидемиологической обстановки по этому заболеванию, в том числе анализа на зараженность прионами павших диких и домашних оленей, генотипирование северных оленей и других видов сем. Cervidae по гену прионного белка. Последнее особенно важно для племенных хозяйств домашнего северного оленя. Подобные программы разрабатываются и выполняются на государственном уровне в США, Норвегии и других странах (http:// cwd-info.org/faq/, www.usgs.gov и др.).
Авторы выражают искреннюю признательность С.Л. Кальнову, подавшему идею проведения данного исследования, В.В. Елсакову, А.В. Давыдову, К.Ф. Тирронену и другим коллегам, помогавшим в сборе образцов, И.Г. Мещерскому и П.А. Сорокину за помощь в лабораторных исследованиях.
Работа выполнена при финансовой поддержке Программы фундаментальных научных исследований Президиума РАН “Биоразнообразие природных систем. Биологические ресурсы России: оценка состояния и фундаментальные основы мониторинга” (тема 52) и РФФИ (грант 14-04-01135).
Список литературы
Ермолаев В.Т., Макарова О.А., Новиков Б.В., Тихонов А.А. Северный олень Кольского полуострова в конце XX–начале XXI века // Северный олень в России 1982–2002 гг. М.: Брифстиль, 2003. С. 81–91.
Ефимов В.А. Северный олень Европейского Севера России: состояние популяций и проблемы сохранения // Вестн. охотоведения. 2010. Т. 7. № 2. С. 178–182.
Красная книга Российской Федерации (животные). М.: АСТ, 2001. 862 с.
Мамонтов В.Н., Хохлов Р.В. Состояние популяции дикого северного оленя (Rangifer tarandus L.) в национальном парке “Водлозерский” // Научные исследования в заповедниках и национальных парках России: Тез. Всероc. науч.-практ. конф. (Петрозаводск, 29 августа–4 сентября 2016 г.). Петрозаводск: КарНЦ РАН, 2016. С. 149–150.
Панченко Д.В., Данилов П.И., Тирронен К.Ф. Состояние и использование популяций представителей семейства Оленьи (Cervidae) в Республике Карелия // Тр. КарНЦ РАН. 2018. Т. 4. № 4. С. 105–114.
Baeten L.A., Powers B.E., Jewell J.E., Spraker T.R., Miller M.W. A Natural Case of Chronic Wasting Disease in a Free-ranging Moose (Alces alces shirasi) // J. Wild. Dis. 2007. V. 43. № 2. P. 309–314.
Basu U., Almeida L.M., Dudas S., Graham C.E., Czub S., Moore S.S., Guan L.L. Gene expression alterations in rocky mountain elk infected with chronic wasting disease // Prion. 2012. V. 6. № 3. P. 282–301.
Benestad S.L., Mitchell G., Simmons M., Ytrehus B., Vikøren T. First case of chronic wasting disease in Europe in a Norwegian free-ranging reindeer // Vet. Res. 2016. V. 47. № 88. P. 1–7.
Hall T.A. BioEdit: a user friendly biological sequence alignment editor and analysis program for Windows 95/98/NT // Nucl. Acids Symp. Ser. 1999. № 41. P. 95–98.
Happ G.M., Huson H.J., Beckmen K.B., Kennedy L.J. Prion protein genes in caribou from Alaska // J. Wild. Dis. 2007. V. 43. № 2. P. 224–228.
Hoover C.E., Davenport K.A., Henderson D.M., Denkers N.D., Mathiason C.K., Soto C., Zabel M.D., Hoover E.A. Pathways of prion spread during early chronic wasting disease in deer // J. Virol. 2017. V. 91. № 10. 91:e00077-17. https://doi.org/10.1128/JVI.00077-17
Jewell J.E., Conner M.M., Wolfe L.L., Miller M.W., Williams E.S. Low frequency of PrP genotype 225SF among freeranging mule deer (Odocoileus hemionus) with chronic wasting disease // J. General Virol. 2005. V. 86. P. 2127–2134.
Miller M.W., Wild M.A. Epidemiology of chronic wasting disease in captive white-tailed and mule deer // J. Wild. Dis. 2004. V. 40. P. 320–327.
Miller M.W., Williams E.S., Hobbs N.T., Wolfe L.L. Environmental sources of prion transmission in mule deer // Emerging Infect. Dis. 2004. V. 10. P. 1003–1006.
Mitchell G.B., Sigurdson C.J., O’Rourke K.I., Algire J., Harrington N.P., Walther I., Spraker T.R., Balachandran A. Experimental Oral Transmission of Chronic Wasting Disease to Reindeer (Rangifer tarandus tarandus) // PLoS One. 2012. V. 7. № 6. e39055. https://doi.org/10.1371/journal.pone.0039055
Nei M. Genetic distance between populations // Am. Naturalist. 1972. V. 106. P. 283–392.
O’Rourke K.I., Besser T.E., Miller M.W., Cline T.F., Spraker T.R., Jenny A.L., Wild M.A., Zebarth G.L., Williams E.S. PrP genotypes of captive and free-ranging Rocky Mountain elk (Cervus elaphus nelsoni) with chronic wasting disease // J. Gen. Virol. 1999. V. 80. P. 2765–2769.
Peakall R., Smouse P.E. GENALEX 6: genetic analysis in Excel. Population genetic software for teaching and research // Mol. Ecol. Notes. 2006. V. 6. P. 288–295.
Plummer I.H., Johnson C.J., Chesney A.R., Pedersen J.A., Samuel M.D. Mineral licks as environmental reservoirs of chronic wasting disease prions // PLoS One. 2018. V. 13. № 5. 0196745. https://doi.org/10.1371/journal.pone.0196745
Prusiner S.B. Prions // Proc. Natl Acad. Sci. USA. 1998. V. 95. P. 13363–13383.
Pulford B., Spraker T.R., Wyckoff A.C., Meyerett C., Bender H., Ferguson A., Wyatt B., Lockwood K., Powers J., Telling G.C., Wild M.A., Zabel M.D. Detection of PrP CWD in feces from naturally exposed Rocky Mountain elk (Cervus elaphus nelsoni) using protein misfolding cyclic amplification // J. Wild. Dis. 2012. V. 48. № 2. P. 425–434.
Robinson S.J., Samuel M.D., Katherine I., O’Rourke K.I., Johnson C.J. The role of genetics in chronic wasting disease of North American Cervids // Prion. 2012. V. 6. № 2. P. 1–10.
Sigurdson C.J. A prion disease of cervids: Chronic Wasting Disease // Vet. Res. 2008. V. 39. № 41. P. 1–12.
Vikøren T., V age J., Madslien K.I., Røed K.H., Rolandsen C.M., Tran L., Hopp P., Veiberg V., Heum M., Moldal T., das Neves C.G., Handeland K., Ytrehus B., Kolbjørnsen Ø., Wisløff H., Terland R., Saure B., Dessen K.M., Svendsen S.G., Nordvik B.S., Benestad S.L. First Detection of Chronic Wasting Disease in a Wild Red Deer (Cervus elaphus) in Europe // J. Wild. Dis. 2019. V. 55. № 4. P. 000–000.
Wik L., Mikko S., Klingeborn M., Stéen M., Simonsson M., Linné T. Polymorphisms and variants in the prion protein sequence of European moose (Alces alces), reindeer (Rangifer tarandus), roe deer (Capreolus capreolus) and fallow deer (Dama dama) in Scandinavia // Prion. 2012. V. 6. № 3. P. 256–260.
Williams E.S. Chronic wasting disease // Vet. Pathol. 2005. V. 42. P. 530–549.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


