Известия РАН. Серия биологическая, 2019, № 6, стр. 565-571
Мелафен снижает негативное действие солевого стресса на растения календулы и ускоряет процесс их восстановления
Л. А. Стеценко 1, Вл. В. Кузнецов 1, *
1 Институт физиологии растений им. К.А. Тимирязева РАН
127276 Москва, Ботаническая ул., 35, Россия
* E-mail: vlkuzn@mail.ru
Поступила в редакцию 17.04.2017
После доработки 21.10.2018
Принята к публикации 14.01.2019
Аннотация
Впервые показано, что 10–9 М мелафен (МФ) повышает солеустойчивость растений календулы лекарственной Calendula officinalis L. при солевом стрессе и ускоряет процесс восстановления растений после удаления избытка соли из среды выращивания. Отмечено, что при солевом стрессе и на этапе восстановления МФ снижал ингибирующее действие соли на аккумуляцию биомассы и ассимилирующую поверхность, стабилизировал водный статус, понижал концентрации малонового диальдегида и стрессиндуцированного пролина, не влияя при этом на содержание основных фотосинтетических пигментов.
В течение последних десятилетий в мире наблюдается стабильная тенденция к возрастанию потребности в лекарственных растениях в интересах здравоохранения. В Европе используется >2000 видов лекарственных растений, в Индии >7500, в Китае >10 000. Только на Европейском континенте собирают 20−30 тыс. т/год дикорастущих лекарственных растений, что наносит колоссальный ущерб природным ресурсам. Один из путей решения данной проблемы – плантационное выращивание лекарственных растений, среди которых в России наиболее востребованы такие виды, как ромашка, шалфей и календула (Латышева, Усова, 2016).
Интенсивное загрязнение окружающей среды остро ставит вопрос о необходимости вовлечения в активный хозяйственный оборот неиспользуемых земель. Наибольший интерес с этой точки зрения представляют засоленные территории, на долю которых приходится почти четверть всей суши земного шара (Строгонов, 1973). Однако выращивание лекарственных растений на засоленных землях предполагает прежде всего изучение механизмов их устойчивости и последующую разработку современных технологий, обеспечивающих высокую продуктивность растений и качество получаемого сырья. Для решения этой задачи целесообразно использовать экологически чистые регуляторы роста, повышающие устойчивость растений к избыточному засолению.
К числу подобного рода соединений относится препарат мелафен (МФ) (меламиновая соль бис-(оксиметил)-фосфиновой кислоты) – синтетический регулятор роста растений (Фаттахов и др., 2000). В настоящее время накоплен значительный экспериментальный материал использования МФ для регуляции роста, развития и продуктивности растений (Загоскина и др., 2007; Фаттахов и др., 2014; Жигачева и др., 2016). Для практического применения крайне важно, что МФ эффективен в низких концентрациях (10–8−10–7%, что соответствует 10–10−10–9 М) (Фаттахов и др., 2014). Это уменьшает риск химического загрязнения окружающей среды, а также повышает экономическую эффективность его использования. Препарат МФ безвреден, не токсичен, не обладает мутагенными свойствами и не накапливается в растениях, почве и воде (Ладыженская и др., 2007; Жигачева и др., 2016).
МФ оказывает многостороннее воздействие на метаболизм растительной клетки, интенсифицируя дыхание и энергетические процессы, стимулируя фосфорилирование белков фотосинтетической ассимиляции углекислоты (Жигачева и др., 2007а, б). Кроме того, установлено, что МФ повышает активность РНК-полимеразы I, но не влияет на транскрипцию пластидных генов ячменя (Кузнецов и др., 2010). Вместе с тем механизмы защитного действия МФ при стрессе, в том числе при засолении, практически не исследованы. Вопрос о том, вовлекается ли МФ в процесс восстановления растений после стрессорного воздействия, также остается без ответа.
Цель работы − исследование возможных защитных механизмов МФ при солевом стрессе и на этапе восстановления растений при удалении избытка соли из среды выращивания.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом данного исследования была выбрана календула лекарственная Calendula officinalis L., ценное лекарственное растение из семейства сложноцветных Asteraceae. Семена календулы проращивали в чашках Петри на влажной фильтровальной бумаге, после чего их высевали в перлит. В фазе двух настоящих листьев проростки переносили из перлита на модифицированную питательную среду Хогланда−Снайдерс (10 мМ KNO3, 7.4 мМ KH2PO4, 4.1 мМ MgSO4 ⋅ 7H2O, 4.2 мМ Ca(NO3)2 ⋅ 4H2O, 1.77 мкМ MnSO4 ⋅ 5H2O, 8.87 мкМ H3BO3, 1 мкМ ZnSO4 ⋅ 7H2O, 0.32 мкМ CuSO4 ⋅ 5H2O, 0.026 мкМ (NH4)6Mo7O2 ⋅ 4H2O, 28.7 мкМ FeSO4 ⋅ 7H2O; pH 6.5 ± 0.2). Растения выращивали в камере фитотрона при 12-часовом фотопериоде, освещенности 100 ± 20 мкмоль/(м2 ⋅ с), температуре воздуха 22 ± 3°C и относительной влажности воздуха 65 ± 5%. Питательную среду в сосудах меняли каждые 5−6 сут. В возрасте 4 нед растения были разделены на три группы. Растения первой группы выращивали на стандартной питательной среде (контроль). В питательную среду растений второй группы одноразово вносили NaCl до конечной концентрации 150 мМ, а растения третьей группы выращивали в присутствии различных концентраций МФ (10−7−10−11 М) и 150 мМ NaCl. Через 7 сут экспозиции на указанных средах часть растений всех трех групп использовали для проведения биохимических анализов, а оставшиеся растения из контрольной и второй групп продолжали выращивать в течение следующих 7 сут на стандартной питательной среде без соли, но в присутствии или в отсутствие МФ. Это позволило изучать влияние МФ на восстановление растений. По окончании эксперимента в контрольных и опытных растениях были определены морфофизиологические параметры. Часть растительного материала фиксировали в жидком азоте и хранили при −70°С до проведения биохимических анализов. Биомассу растений определяли общепринятым гравиметрическим методом с точностью до 0.1 мг (весы марки OHAUS Scout STX, США).
Интенсивность перекисного окисления липидов (ПОЛ) оценивали по основному продукту реакции – малоновому диальдегиду (МДА), содержание которого рассчитывали в микромолях на грамм сырой массы листьев. Для этого использовали метод, основанный на образовании окрашенного комплекса МДА с тиобарбитуровой кислотой (ТБК) при нагревании (Heath, Packer, 1968). Оптическую плотность растворов измеряли на спектрофотометре Genesys 10 uv (Thermoelectron corporation, США) при длине волны 532 нм и неспецифическом помутнении раствора при 600 нм (контроль – раствор ТБК в трихлоруксусной кислоте).
Содержание свободного пролина определяли с помощью кислого нингидринового реактива методом Бэйтса с соавт. (Bates et al., 1973). Интенсивность окраски определяли спектрофотометрически при длине волны 520 нм. Содержание пролина рассчитывали с помощью калибровочной кривой, для построения которой использовали пролин (Serva, Германия).
Содержание фотосинтетических пигментов определяли методом Лихтенталера (Lichtenthaler, 1987). Для этого проводили экстракцию хлорофиллов а и b и каротиноидов холодным 80%-ным ацетоном в 3-4 кратной повторности до полного обесцвечивания образцов. Оптическую плотность экстрактов определяли при длинах волн 470, 648 и 663 нм.
Данные обрабатывали методами параметрической статистики в среде Microsoft Excel 2007. В каждом варианте опыта было по 7−10 растений. На диаграммах представлены средние значения со стандартными ошибками среднего. Количественные данные были обработаны с помощью однофакторного дисперсионного анализа.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты опытов по влиянию широкого диапазона концентраций NaCl (50−250 мМ) на рост растений показали, что календула характеризуется достаточно высокой солеустойчивостью (рис. 1а). Так, выращивание растений в течение 7 сут на питательной среде в присутствии 100 мМ NaCl ингибировало накопление биомассы целого растения лишь на 16%, тогда как рост корневой системы был подавлен на 35% (рис. 1а). Повышение концентрации NaCl до 150 мМ сопровождалось торможением роста растений и корневой системы в среднем на 42 и 70% соответственно по сравнению с контрольными растениями (рис. 1а). При повышении концентрации соли в среде (175−250 мМ NaCl) наблюдалось снижение тургора в листьях и подавление аккумуляции биомассы. В дальнейших экспериментах мы использовали концентрацию 150 мМ NaCl, которая значительно тормозила рост растений, но не приводила к их гибели.
Рис. 1.
Влияние различных концентраций NaCl (а) и мелафена при солевом стрессе (150 мМ NaCl) (б) на рост растений календулы. 1 − сырая масса растения, 2 − сырая масса корневой системы. Длительность экспозиции растений 7 сут. Достоверно различающиеся между собой значения (при р < 0.05) обозначены разными латинскими буквами; для рис. 1−3.
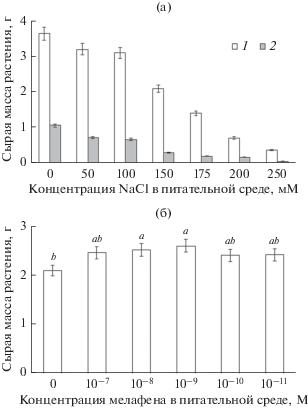
Добавление в среду МФ (10−7−10−11 М) при оптимальных условиях выращивания растений практически не влияло на их рост (данные не приведены), тогда как введение в среду МФ (10−8−10−9 М) в присутствии 150 мМ NaCl на 13−16% снижало ингибирующее действие соли на накопление биомассы растений (рис. 1б). МФ в более низких концентрациях (10−10−10−11М) практически не влиял на рост растений в условиях стресса (рис. 1б). В последующих экспериментах нами был использован препарат МФ в концентрации 10−9 М.
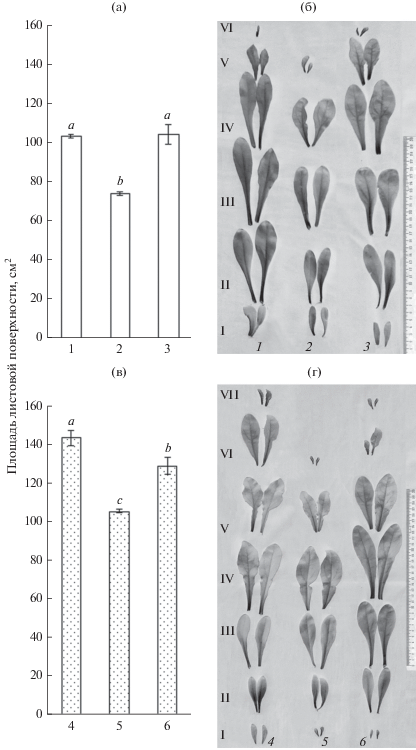
Физиологическое состояние растений при солевом стрессе и на этапе восстановления оценивали по ряду параметров (табл. 1). МФ в условиях солевого стресса не только снижал ингибирующее действие 150 мМ NaCl на аккумуляцию биомассы растений, но и несколько стабилизировал водный статус листьев (рис. 1, табл. 1). Засоление вызывало снижение площади листовой поверхности растений календулы на 25−28% по сравнению с контролем. При совместном действии МФ и NaCl наблюдали стимулирование роста верхушечной меристемы, о чем свидетельствуют нормальное развитие листьев V яруса и закладка листьев VI яруса, которые отсутствовали у растений при солевом стрессе в отсутствие МФ (рис. 2а, б).
Таблица 1.
Влияние мелафена на показатели физиологического ответа растений календулы при солевом стрессе и на этапе восстановления
| Варианты опыта | Сырая биомасса, г/растение | Содержание в листьях | ||
|---|---|---|---|---|
| воды, % | малонового диальдегида, мкмоль/ г сырой массы | свободного пролина, мкмоль/г сырой массы | ||
| Период солевого стресса | ||||
| Контроль | 4.91 ± 0.24a | 95.78 ± 0.67a | 0.19 ± 0.01c | 0.052 ± 0.01c |
| +150 мМ NaCl | 3.14 ± 0.15b | 93.14 ± 0.86b | 1.35 ± 0.07a | 0.593 ± 0.03a |
| +150 мМ NaCl +10−9 М мелафена |
4.10 ± 0.20c | 94.83 ± 0.59b | 0.83 ± 0.04b | 0.244 ± 0.01b |
| Период восстановления | ||||
| Контроль | 7.20 ± 0.36a | 96.81 ± 0.75a | 0.24 ± 0.01c | 0.053 ± 0.01a |
| –NaCl | 6.15 ± 0.31b | 95.16 ± 0.61b | 0.62 ± 0.02a | 0.073 ± 0.01a |
| +150 мМ NaCl +10−9 М мелафена |
6.96 ± 0.35a | 96.75 ± 0.56a | 0.38 ± 0.02b | 0.055 ± 0.01a |
Примечание. Растения подвергали действию NaCl (150 мМ NaCl) в течение 7 сут, затем часть из них переносили на питательную среду без NaCl в присутствии или в отсутствие мелафена (10−9 М) и наблюдали за восстановлением растений в течение 7 сут. Значения (±m) − стандартные отклонения от среднего значения признака. Достоверно различающиеся между собой значения (при р < 0.05) обозначены разными латинскими буквами.
Рис. 2.
Влияние мелафена на развитие листовой поверхности растений календулы. а, б − при солевом стрессе; в, г − на этапе восстановления растений после солевого стресса; а, в – площадь листовой поверхности, см2; б, г − фотографии листьев, расположенных в порядке их ярусного (I−VII) размещения на стеблях контрольных и опытных растений. 1−3 − растения выращивали 7 сут на стандартной среде (контроль), при солевом стрессе (150 мМ NaCl) и в присутствии 10−9 М мелафена соответственно, 4 − растения выращивали 14 сут на стандартной среде (контроль), 5 − растения выращивали 7 сут при солевом стрессе (150 мМ NaCl), затем 7 сут на стандартной среде (без NaCl), 6 − растения выращивали 7 сут при солевом стрессе (150 мМ NaCl) затем 7 сут на стандартной среде (без NaCl) в присутствии 10−9 М мелафена.
К негативным проявлениям избыточного засоления при клеточном метаболизме растений относятся генерация активных форм кислорода и активация ПОЛ. Содержание МДА после 7 сут экспозиции растений в присутствии 150 мМ NaCl увеличилось в среднем в 7 раз по сравнению с контролем (табл. 1). Введение в питательную среду 10−9 М МФ при засолении снижало концентрацию МДА в среднем в 1.6 раза, что свидетельствует об антиоксидантном эффекте МФ. При этом наблюдалось 10–11-кратное увеличение содержания пролина в условиях солевого стресса. МФ в 2 раза понижал индуцированную NaCl аккумуляцию пролина (табл. 1), что также является дополнительным аргументом в пользу способности МФ уменьшать интенсивность окислительного стресса при засолении. Отметим, что аккумуляция пролина – один из универсальных механизмов защиты растений от действия повреждающих факторов различной природы (Кузнецов, Шевякова, 1999).
Способность МФ понижать активность ПОЛ в растениях была отмечена ранее (Жигачева и др., 2007а, б; Бинюков и др., 2012), в частности было установлено, что в условиях умеренного охлаждения и недостаточного увлажнения проростков гороха предварительная обработка семян раствором МФ приводила к значительному снижению интенсивности ПОЛ (Бинюков и др., 2012; Жигачева и др., 2016). Данный эффект наряду с изменением морфологических характеристик митохондрий гороха авторы объясняют антиоксидантной активностью препарата МФ (Жигачева и др., 2007а, б; Бинюков и др., 2012; Жигачева и др., 2016).
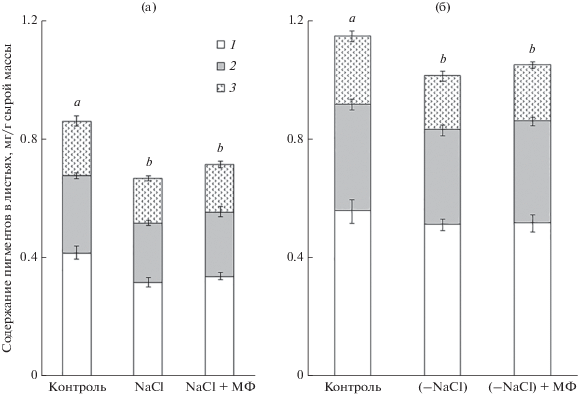
Функциональная активность фотосинтетического аппарата растений зависит от содержания в листьях основных фотосинтетических пигментов. Согласно полученным нами данным, содержание хлорофиллов и каротиноидов в листьях контрольных растений календулы заметно возрастало за 14 сут эксперимента (рис. 3а, б). В условиях солевого стресса (150 мМ NaCl, 7 сут) суммарное содержание пигментов составляло в среднем 74% контрольных значений (рис. 3а). Введение в среду выращивания 10−9 М МФ при засолении (рис. 3а) не оказывало достоверного воздействия на содержание фотосинтетических пигментов (рис. 3а, б).
Рис. 3.
Влияние мелафена (10−9 М) на содержание фотосинтетических пигментов в листьях календулы. а − при солевом стрессе (150 мМ NaCl, 7 сут), б − на этапе восстановления. В последнем случае растения выращивали 7 сут при солевом стрессе, затем 7 сут на стандартной среде (без NaCl) в присутствии или в отсутствие 10−9 М мелафена. 1 − хлорофилл а; 2 − хлорофилл b; 3 − каротиноиды.
Для ответа на вопрос о том, влияет ли МФ на процесс восстановления календулы после солевого стресса, растения выращивали 7 сут при действии 150 мМ NaCl, а затем переносили на стандартную (без NaCl) среду в присутствии МФ (10−9 М) или без него. За 7 сут выращивания растений на бессолевой среде (после экспозиции в присутствии NaCl) их масса увеличилась примерно в 2 раза по сравнению с массой растений, выращиваемых в присутствии NaCl (табл. 1). На этапе восстановления в присутствии 10−9 М МФ наблюдали повышение тургора, содержания воды в листьях и увеличение площади листовой поверхности по сравнению с аналогичными показателями у растений, не получавших препарат МФ в период восстановления (табл. 1). После снятия стрессорного воздействия в растениях в присутствии МФ был отмечен верхушечный рост побега, о чем свидетельствует развитие листьев VI яруса и закладка листьев VII яруса (рис. 2в, г). Результаты по активизации роста и улучшению физиологических процессов при действии МФ были получены на Chlorella vulgaris Beijer и некоторых других видах растений (Загоскина и др., 2007; Фаттахов и др., 2014).
При солевом стрессе, как и после удаления избытка соли из среды выращивания, МФ снижал интенсивность ПОЛ в листьях растений. Об этом свидетельствует существенное уменьшение (на 40%) содержания МДА у растений, восстановление которых происходило в присутствии МФ по сравнению с растениями, на которые МФ не действовал (табл. 1).
Суммарное содержание пигментов в листьях календулы на этапе восстановления повышалось и составило в среднем 83% содержания контрольных растений (рис. 3б). При введении в среду выращивания 10−9 М МФ как при солевом стрессе (рис. 3а), так и на этапе восстановления (рис. 3б) достоверных отличий в содержании фотосинтетических пигментов в листьях обнаружено не было (рис. 3а, б). Ранее было установлено, что МФ не оказывал влияния на содержание фотосинтетических пигментов в растениях ячменя и не вовлекался в регуляцию транскрипции пластидного генома (Кузнецов и др., 2010).
Таким образом, при солевом стрессе (150 мМ NaCl) МФ (10−9 М) повышал устойчивость растений календулы к засолению, о чем свидетельствуют улучшение ростовых характеристик, стабилизация водного статуса, снижение содержания МДА и пролина. При снятии солевого стресса МФ облегчал процесс восстановления растений, что проявлялось на уровне аккумуляции биомассы, увеличения общей площади листовой поверхности, снижения интенсивности окислительного стресса. Можно полагать, что в основе повышения солеустойчивости растений и ускорения процесса их восстановления лежит антиоксидантный эффект МФ, который реализуется в его способности снижать интенсивность ПОЛ. Полученные результаты могут найти применение при разработке технологии выращивания лекарственных растений на засоленных, не используемых в настоящее время территориях.
Список литературы
Бинюков В.И., Миль Е.М., Жигачева И.В., Албантова А.А., Генерозова И.П., Шугаев А.Г., Фаттахов С.Г., Коновалов А.И. Недостаточное увлажнение и мелафен изменяют морфологию митохондрий проростков гороха // Докл. РАН. 2012. Т. 446. С. 222–225.
Жигачева И.В., Бурлакова Е.Б., Голощапов А.Н. Функциональное состояние митохондрий определяет устойчивость проростков гороха к недостаточному увлажнению // Актуальные вопросы биол. физики и химии. 2016. № 1−2. С. 168−172.
Жигачева И.В., Фаткуллина Л.Д., Русина И.Ф., Шугаев А.Г., Генерозова И.П., Фаттахов С.Г., Коновалов А.И. Антистрессовые свойства препарата мелафен // Докл. РАН. 2007а. Т. 414. С. 263−265.
Жигачева И.В., Фаткуллина Л.Д., Шугаев А.Г., Генерозова И.П., Фаттахов С.Г., Резник В.С., Коновалов А.И. Функциональное состояние мембран митохондрий корнеплода сахарной свеклы при действии препарата мелафен // Физиология растений. 2007б. Т. 54. С. 672−677.
Загоскина Н.В., Пинаев А.С., Алявина А.К., Ямбуренко М.В., Гладышко Т.О., Кузнецов В.В., Коновалов А.И. Активация мелафеном роста и накопления фенольных соединений в каллусной культуре чайного растения не связана с его возможной цитокининовой активностью // Докл. РАН. 2007. Т. 413. С. 841−844.
Кузнецов В.В., Кравцов А.К., Селиванкина С.Ю., Зубо Я.О., Зубкова Н.К., Кулаева О.Н., Фаттахов С.Г., Коновалов А.И. Мелафен повышает активность РНК-полимеразы I, но не влияет на транскрипцию пластидных генов в растениях ячменя // Докл. РАН. 2010. Т. 431. С. 551−555.
Кузнецов Вл.В., Шевякова Н.И. Пролин при стрессе: биологическая роль, метаболизм, регуляция // Физиология растений. 1999. Т. 46. С. 321–336.
Ладыженская А.П., Платонов Т.А., Евсюнина А.С., Фаттахов С.Г., Кораблева Н.П., Резник В.С. Влияние меламиновой соли бис-(оксиметил)-фосфиновой кислоты (мелафен) на ростовые процессы и функционирование цитоплазматической мембраны клеток клубней картофеля // Прикл. биохимия и микробиология. 2007. Т. 43. С. 246−251.
Латышева Н.В., Усова К.А. Повышение урожайности календулы лекарственной при применении удобрений и препарата “ЭПИН-ЭКСТРА” // Новая наука: опыт, традиции, инновации. 2016. № 591. Ч. 2. С. 14−16.
Строгонов Б.П. Метаболизм растений в условиях засоления. М.: Наука, 1973. 51 с.
Фаттахов С.Г., Кузнецов В.В., Загоскина Н.В. Мелафен: механизм действия и области применения. Казань: ?, 2014. 408 с.
Фаттахов С.Г., Лосева Н.Л., Резник B.C. Меламиновая соль бис-(оксиметил)-фосфиновой кислоты (мелафен) в качестве регулятора роста и развития растений и способ ее получения // Патент РФ № 2158735 от 10.11.2000.
Bates L.S., Waldren R.P., Teare I.D. Rapid determination of free proline for water-stress studies // Plant Soil. 1973. V. 39. P. 205–207.
Heath R.L., Packer L. Photoperoxidation in isolated chloroplasts. Kinetics and stoichiometry of fatty acid peroxidation // Arch. Biochem. Biophys. 1968. V. 125. P. 189−198.
Lichtenthaler H.K. Chlorophylls and carotenoids, pigments of photosynthetic biomembranes // Meth. Enzymol. 1987. V. 148. P. 350–382.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


