Известия РАН. Серия биологическая, 2020, № 1, стр. 22-29
Таксономическая и размерно-морфологическая структура бактериопланктона двух водохранилищ Монголии
Е. В. Кузнецова a, *, Д. Б. Косолапов a, b, Н. Г. Косолапова a
a Институт биологии внутренних вод им. И.Д. Папанина РАН,
пос. Борок, 109, Некоузский р-н, Ярославская обл., 152742 Россия
b Череповецкий государственный университет
просп. Луначарского, 5, г. Череповец, Вологодская обл., 162600 Россия
* E-mail: elivic.rum@gmail.com
Поступила в редакцию 31.07.2018
После доработки 20.02.2019
Принята к публикации 03.06.2019
Аннотация
В двух крупных разнотипных водохранилищах Монголии и водотоках, на которых они образованы, исследована таксономическая и размерно-морфологическая структура бактериопланктона. Изучены взаимоотношения последнего с его основными потребителями – гетеротрофными жгутиконосцами. Показано, что эти простейшие избирательно выедают крупных и активных бактерий из класса Gammaproteobacteria и филы Bacteroidetes, оставляя в сообществе в качестве доминантов мелких бактерий из класса Alphaproteobacteria и среднеразмерных бактерий из филы Actinobacteria. Отмечено, что размерно-морфологическая структура бактериопланктона, формируемая консументами, сопровождается сменой в пространстве таксонов-субдоминантов, по-видимому, выполняющих в экосистемах водоемов сходные функции.
Бактериопланктон большинства пресноводных экосистем сходен по составу доминирующих таксонов высокого ранга (Newton et al., 2011; Lliros et al., 2014). Его размерно-морфологические структуры в разных водоемах также похожи (Ferguson, Rublee, 1976; Копылов, Косолапов, 2008). Состав и структура бактериального сообщества формируются в результате взаимодействия контролирующих механизмов “снизу” и “сверху”. При этом виды-победители в конкурентной борьбе за ресурсы избирательно выедаются простейшими и метазоопланктоном или лизируются специфичными к ним вирусами (Копылов, Косолапов, 2008; Winter et al., 2010; Batani et al., 2016).
В эпилимнионе пресных водоемов в бактериопланктоне обычно доминируют филы Proteobacteria, Actinobacteria, Cytophaga–Flavobacterium– Bacteroidetes (CFB), Cyanobacteria и Verrucomicrobia. Наиболее многочислен класс Betaproteobacteria, составляющий обычно 60–70% общей численности пресноводного бактериопланктона (Newton et al., 2011), причем представители этого таксона могут быть разного размера одиночными палочками, вибрионами, спириллами, кокками, нитями, находиться в составе микроколоний или быть прикрепленными к различным субстратам.
Размер бактериальных клеток – важный показатель, отражающий взаимоотношения по типу хищник–жертва между бактериями и их основными потребителями – простейшими. Бактерии имеют защитные механизмы, препятствующие их потреблению консументами (Jürgens, 2007). Под воздействием консументов в бактериальном сообществе начинают преобладать мелкие устойчивые к выеданию формы, что позволяет стабилизировать биомассу сообщества на определенном уровне. Бактерии обладают высокой фенотипической пластичностью и адаптируются к трофическому прессу со стороны простейших путем формирования резистентных морфотипов, таких как крупные агрегаты (микроколонии) и нити (Sommaruga, Psenner, 1995). Вызванные консументами морфологические изменения бактериопланктона сопровождаются изменением его таксономического состава, что выражается сменой доминирующих в сообществе групп (Simek et al., 1999; Jürgens, Mats, 2002). В бактериальном сообществе обычно начинают доминировать мелкие (Actinobacteria) или крупные нитевидные формы, а также бактериальные “агрегаты” (Salcher, 2014).
Цель работы – исследовать таксономическую и размерно-морфологическую структуру бактериопланктона водохранилищ и водотоков, расположенных в аридной зоне (Котловина Больших Озер, Западная Монголия).
МАТЕРИАЛЫ И МЕТОДЫ
Тайширское (46°43′ с.ш., 96°41′ в.д., 1701 м над у.м.) и Дургунское (48°20′ с.ш., 92°48′ в.д., 1156 м над у.м.) водохранилища крупнейшие в МНР. Тайширское вдхр. образовано в 2007 г. на р. Завхан – самой крупной реке Западной Монголии, Дургунское – в 2008 г. на прот. Чонохарайх, вытекающей из эвтрофного оз. Хар-Ус. Протяженность Тайширского вдхр. ~ 35, Дургунского ~4 км. Эти водоемы расположены в западной части Монголии, в Котловине Больших Озер, которая относится к Центрально-Азиатскому бессточному бассейну. Климат в этой местности резко-континентальный, преимущественный ландшафт – сухие степи, полупустыни и пустыни. Исследования проводили 21–26.08.2015 г. в пелагиали (станции Д2 и Т2 соответственно) и литорали (ст. Д3 и Т3) приплотинных областей Дургунского (Д) и Тайширского (Т) водохранилищ, а также на незарегулированных участках прот. Чонохарайх и р. Завхан, примерно в 1 км выше (ст. Д1 и Т1) и ниже водохранилищ (ст. Д4 и Т4) (табл. 1).
Таблица 1.
Глубина (H), температура (T), концентрация растворенного кислорода (O2), рН и электропроводность воды при 25°С (EC) в водохранилищах и водотоках Монголии 21–26.08.2015 г.
| Ст. | Описание | Н, м | Т, °С | О2, мг/л | рН | ЕС, мкСм/см |
|---|---|---|---|---|---|---|
| Д1 | прот. Чонохарайх, 1 км выше водохранилища | 1 | 19.1 | 7.21 | 7.54 | 251 |
| Д2 | Дургунское вдхр., приплотинный участок, пелагиаль | 12 | 21.6 | 8.07 | 7.38 | 254 |
| Д3 | Дургунское вдхр., приплотинный участок, литораль | 3 | 22.6 | 7.52 | 7.22 | 253 |
| Д4 | прот. Чонохарайх, 1 км ниже водохранилища | 0.8 | 19.7 | 7.31 | 7.7 | 252 |
| Т1 | р. Завхан, 1 км выше водохранилища | 0.5 | 15.2 | 8.22 | 7.83 | 272 |
| Т2 | Тайширское вдхр., приплотинный участок, пелагиаль | 30 | 17.5 | 9.26 | 9 | 253 |
| Т3 | Тайширское вдхр., приплотинный участок, литораль | 2 | 18.1 | 9.22 | 9.01 | 255 |
| Т4 | р. Завхан, 1 км ниже водохранилища | 0.5 | 18 | 7.88 | 7.95 | 258 |
Для учета микроорганизмов на каждой станции отбирали по 60 мл воды из поверхностного слоя, помещали в стерильные флаконы, фиксировали формалином до конечной концентрации 2%, хранили в темноте при 4°С и обрабатывали в течение месяца в лаборатории. Численность и размеры клеток бактерий и гетеротрофных нанофлагеллят определяли методом эпифлуоресцентной микроскопии с использованием флуорохромов DAPI (Porter, Feig, 1980) и Primullin (Caron, 1983) соответственно. Микроорганизмы, осажденные на фильтрах, просматривали под эпифлуоресцентным микроскопом Olympus BX51 (Olympus, Япония), снабженным цифровой камерой и системой компьютерного анализа изображений Cell-F (Olympus, Япония). На каждом фильтре просчитывали не менее 400 и измеряли не менее 100 бактерий.
Параллельно пробы природной воды (~200 мл на ст. Д1, Д2, Д3 и Д4, ~750 мл на ст. Т1 и 1 л на ст. Т2, Т3 и Т4) концентрировали на стерильные нитроцеллюлозные фильтры с диаметром пор 0.22 мкм SterivexTM-GS (Millipore, США). Предварительно водные пробы подвергали префильтрации через фильтры с диаметром пор 1.5 мкм. После фильтрования пробы замораживали и хранили до анализа при –20°С. Выделение суммарной ДНК проводили в лаборатории коммерческим набором ДНК-сорб-В (Амплипрайм, РФ).
Фрагмент гена 16S рРНК, содержащий вариабельные районы, амплифицировали на бактериальных праймерах с олигонуклеотидными бар-кодами, уникальными для каждого отдельного образца. Метагеномное секвенирование ампликонов 16S pДНК проводили на реактивах GS Junior+ и пиросеквенаторе 454 GS Junior System (Roche, США).
Таксономический состав бактериальных сообществ определяли с использованием онлайн-сервиса RDP Pipeline (https://pyro.cme.msu.edu) (Cole et al., 2014). Химерные последовательности и последовательности короче 300 нуклеотидов исключались из анализа. Длина анализируемых последовательностей варьировала от 500 до 550 пар нуклеотидов (п.н). Выделение филотипов – операционных таксономических единиц (OTЕ) – проводили при кластерном расстоянии 0.03. Для определения таксономического состава и сравнения сообществ применяли пакет программ Pyrosequencing pipeline.
Для установления взаимосвязей между бактериопланктоном, гетеротрофными нанофлагеллятами и физико-химическими параметрами воды использовали непараметрический ранговый коэффициент корреляции Спирмена.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Наибольшие глубины были зарегистрированы в приплотинных участках Тайширского (30 м) и Дургунского (12 м) водохранилищ, наименьшие – в прибрежных мелководьях водохранилищ и на незарегулированных участках водотоков (табл. 1). Температура воды в системе прот. Чонохарайх–Дургунское водохранилище была выше (19.1–22.6°С), чем в системе р. Завхан–Тайширское вдхр. (15.2–18.1°С). Наибольшие ее значения отмечались в литорали водохранилищ, наименьшие – на участках водотоков выше водохранилищ. Электропроводность воды составляла 251–258 мкСм/см и возрастала до 272 мкСм/см в р. Завхан выше Тайширского вдхр. Значения рН воды находились в слабощелочном диапазоне и существенно не различались на обследованных участках водных объектов. В период проведения наблюдений кислородный режим водоемов и водотоков был благоприятен для развития гидробионтов: концентрация кислорода превышала 70% его растворимости.
Общая численность бактериопланктона в системе р. Завхан–Тайширское вдхр. составляла (2.51–5.11) × 106 кл./мл. В прот. Чонохарайх и Дургунском вдхр. она была выше – (8.64–11.23) × × 106 кл./мл. Наименьшие значения этого параметра были зарегистрированы в литорали приплотинных участков водохранилищ (табл. 2). Средние объемы бактериальных клеток в этих двух водных системах оказались примерно одинаковыми и изменялись от 0.074 до 0.167 мкм3.
Таблица 2.
Численность, объем клеток и биомасса бактериопланктона (БП) и гетеротрофных нанофлагеллят (ГНФ) на различных участках водохранилищ и водотоков
| Параметр | Станции | |||||||
|---|---|---|---|---|---|---|---|---|
| Д1 | Д2 | Д3 | Д4 | Т1 | Т2 | Т3 | Т4 | |
| Численность БП, 106 кл./мл | 11.23 | 10.76 | 8.64 | 9.9 | 3.14 | 5.11 | 2.51 | 3.34 |
| Средний объем клеток БП, мкм3 | 0.096 | 0.074 | 0.119 | 0.091 | 0.093 | 0.167 | 0.082 | 0.112 |
| Биомасса БП, мг/м3 | 1078 | 796 | 1028 | 901 | 292 | 853 | 206 | 374 |
| Численность ГНФ, кл./мл | 3076 | 3716 | 4870 | 2643 | 705 | 641 | 705 | 748 |
| Биомасса ГНФ, мг/м3 | 480 | 423 | 321 | 161 | 47 | 72 | 33 | 34 |
Биомасса бактериопланктона в р. Завхан и Тайширском вдхр. составляла 206–853, в прот. Чонохарайх и Дургунском вдхр. – 796–1078 мг/м3. Хотя в среднем бактериальная биомасса была выше в прот. Чонохарайх и Дургунском вдхр., в пелагиали приплотинного плеса Тайширского вдхр. значение этого параметра было сопоставимо с таковым в приплотинном плесе Дургунского вдхр. В Тайширском вдхр. наибольшие значения биомассы наблюдались там, где были наибольшими объемы клеток бактерий, а в Дургунском – там, где была наибольшей их численность.
На незарегулированных участках р. Завхан в бактериопланктоне доминировали палочковидные бактерии: мелкие (<2 мкм длиной) и крупные (≥2 мкм длиной) палочки в совокупности составляли >50% численности бактерий (рис. 1). В прот. Чонохарайх доминировали кокки, которые на всех ее участках занимали более половины сообщества. Кокки преобладали также в обоих водохранилищах. В Тайширском вдхр. была высокой доля (20–22%) самых мелких (диаметром 0.2–0.35 мкм) кокков. В пелагиали Дургунского вдхр. доминировали среднеразмерные кокки (диаметром 0.35–0.45 мкм) и коккобациллы (36%), а также мелкие кокки (35%). В литорали Дургунского вдхр. содоминантами были палочки и среднеразмерные кокки (41 и 43% соответственно), а доля мелких кокков составляла лишь 14%. Крупные кокки были минорной группой на всех участках исследованных водных экосистем.
Рис. 1.
Доля в бактериопланктоне наиболее представленных размерно-морфологических групп в водохранилищах и водотоках Западной Монголии. 1 – мелкие палочки длиной 0.5–2 мкм, 2 – среднеразмерные кокки и коккобациллы диаметром 0.35–0.45 мкм, 3 – мелкие кокки диаметром 0.2–0.35 мкм, 4 – крупные кокки диаметром 0.5–0.8 мкм, 5 – крупные палочки длиной >2 мкм.

В бактериопланктоне системы прот. Чонохарайх–Дургунское вдхр. доминирующим было семейство ACK-M1 (фила Actinobacteria). В системе р. Завхан–Тайширское вдхр. на разных участках доминировали разные таксоны: в р. Завхан выше водохранилища (ст. Т1) – род Flavobacterium (фила Bacteroidetes), в Тайширском вдхр. (ст. Т2 и Т3) – сем. Pelagibacteraceae (класс Alfaproteobacteria), в р. Завхан ниже плотины (ст. Т4) – сем. ACK-M1 (рис. 2).
Рис. 2.
Доля доминирующих таксонов высокого ранга в бактериопланктоне. 1 – Alphaproteobacteria, 2 – Betaproteobacteria, 3 – Gammaproteobacteria, 4 – Actinobacteria, 5 – Bacteroidetes, 6 – Verrucomicrobia, 7 – Cyanobacteria.
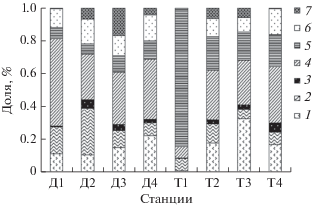
В водохранилищах Монголии была установлена следующая закономерность: чем ниже уровень доминирования какого-либо таксона, тем больше в сообществе субдоминантов, доля которых в бактериопланктоне составляет ≥5% (n = 8, r = –0.87, p ≤ 0.05, где n – число значений, r – ранговый коэффициент корреляции, p – уровень значимости). При этом наименьший уровень доминирования отмечался в пелагиали обоих водохранилищ (табл. 3).
Таблица 3.
Доля (%) доминирующих и субдоминирующих (>5%) таксонов в бактериопланктоне
| № таксона | Таксон | Станции | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Д1 | Д2 | Д3 | Д4 | Т1 | Т2 | Т3 | Т4 | ||
| Фантомы | |||||||||
| 1 | ACK-M1 | 42.9* | 14.7* | 22.3* | 27* | 5.3 | 12.6 | 10.1 | 20.9* |
| 2 | LD-19 | 5.4 | 5.7 | 6.2 | |||||
| 3 | C111 | 10 | 10 | 5.3 | |||||
| 4 | R441B | 7.2 | |||||||
| Кокки | |||||||||
| 5 | Pelagibacteraceae | 9.3 | 5.2 | 11 | 18.8 | 13.8* | 25* | 13.7 | |
| 6 | Staphylococcus | 8.9 | |||||||
| 7 | Cerasicoccaceae | 6.1 | 5.2 | ||||||
| Палочки | |||||||||
| 8 | Comamonadaceae | 10.2 | 6.9 | ||||||
| 9 | Tepidomonas | 8 | |||||||
| 10 | Thermus | 7.2 | |||||||
| 11 | Flavobacterium | 54.3* | |||||||
| 12 | Cytophagaceae | 19.3 | |||||||
| 13 | Cyclobacteriaceae | 6.1 | 8.2 | ||||||
| 14 | Fluviicola | 5 | |||||||
В состав субдоминантов пелагиали Дургунского вдхр. (ст. Д2) входили род Staphylococcus (фила Firmicutes), род Tepidomonas (класс Betaproteobacteria), род Thermus (фила [Thermi]), сем. Comamonadaceae (класс Betaproteobacteria), сем. LD19 (фила Verrucomicrobia), сем. Pelagibacteraceae (класс Alfaproteobacteria).
Субдоминантами пелагиали Тайширского вдхр. (ст. Т2) были другие таксоны: сем. ACK-M1 (фила Actinobacteria), сем. С111 (фила Actinobacteria), сем. Cyclobacteriaceae (фила Bacteroidetes), сем. Cerasicoccaceae (фила Verrucomicrobia), род Fluviicola (фила Bacteroidetes).
Меньше всего доминирующих таксонов было зарегистрировано на участках водотоков выше водохранилищ. Субдоминантами на ст. Д1 были только семейства Pelagibacteraceae и Comamonadaceae, а на ст. Т1 – семейства Cytophagaceae и ACK-M1.
Исследованные водоемы различались уровнем количественного развития основных потребителей бактерий – гетеротрофных нанофлагеллят (табл. 2). В системе прот. Чонохарайх–Дургунское вдхр. численность этих простейших варьировала от 2643 до 4870 кл./мл, а биомасса – от 161 до 480 мг/м3. Интересно, что на участке с минимальными численностью и биомассой гетеротрофных нанофлагеллят наблюдалась максимальная численность крупных палочковидных бактерий (ст. Д4). В р. Завхан и Тайширском вдхр. жгутиконосцев было на порядок меньше: их численность изменялась от 641 до 748 кл./мл, биомасса – от 33 до 72 мг/м3.
В период проведения исследований были зарегистрированы 22 вида и формы гетеротрофных жгутиконосцев из 8 крупных таксонов и группы неопределенного систематического положения. Наибольшее число видов было идентифицировано в прот. Чонохарайх (11 видов), при этом их видовое богатство выше Дургунского вдхр. было значительнее, чем на участке, расположенном ниже водохранилища. Меньше всего видов нанофлагеллят (3) было зарегистрировано в Тайширском вдхр.
Доминирующими по числу видов таксономическими группами гетеротрофных жгутиконосцев были Stramenopiles (шесть видов) и Choanomonada (пять видов). Остальные группы состояли из 1–3 видов. Наибольшим таксономическим разнообразием отличалось сообщество жгутиконосцев в прот. Чонохарайх (семь таксонов), наименьшим – в Тайширском вдхр. (два таксона).
Большинство обнаруженных видов гетеротрофных жгутиконосцев относились к бактериодетритофагам-фильтраторам и организмам с активным поиском пищи. Также были идентифицировано два всеядных и два хищных вида. В сообществе по числу видов на большинстве исследованных участков доминировали бактериодетритофаги-фильтраторы. Исключение составляла прот. Чонохарайх, где преобладали жгутиконосцы с активным поиском пищи.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Благодаря небольшим размерам бактерии имеют очень высокие скорости роста и оборота биомассы. Объем большинства клеток планктонных гетеротрофных бактерий не превышает 0.03 мкм3 (Batani et al., 2016). Такие объемы имеют кокки диаметром 0.2–0.35 мкм. Ряд авторов относит к фракции мелких бактерий кокки и коккобациллы с линейными размерами до 0.5 мкм и объемом не более 0.1 мкм3 (Lebaron et al., 2001; Chros et al., 2009). В нашем исследовании бактерии с линейными размерами 0.35–0.45 мкм рассматриваются как среднеразмерные, поскольку у них существенно снижается отношение площади поверхности к объему клеток, а следовательно, снижаются и скорости метаболических процессов по сравнению с мелкими (диаметром 0.2–0.35 мкм) кокками (Румянцева и др., 2016). Поэтому при потреблении ресурсов мелкие кокки имеют конкурентное преимущество перед среднеразмерными кокками и коккобациллами.
Крупные кокки диаметром 0.45–0.8 мкм и объемом 0.1–0.5 мкм3 еще менее приспособлены к конкурентной борьбе за органические субстраты и биогенные элементы. Мы относим таких кокков к крупным бактериям, а палочек длиной до 2 мкм – к мелким. Последние, меняя форму и увеличивая отношение площади поверхности к объему, могут повышать свою конкурентоспособность.
Крупные палочки (длиной ≥2 мкм) – наиболее активный компонент бактериопланктона (Gasol et al., 1995; Копылов, Косолапов, 2008). Они быстро растут и делятся, и в регуляции их количества возрастает значение контроля “сверху” со стороны гетеротрофных нанофлагеллят и других фаготрофных простейших. Тем самым, простейшие оказывают значительное влияние на формирование размеров каждого бактериального филотипа, избирательно выедая крупные клетки и стимулируя развитие мелких форм. Такие защитные механизмы против выедания простейшими, как образование крупных нитей и колоний, менее успешны (Batani et al., 2016). Эти группы бактерий в большинстве водоемов малочисленны и обычно не превышают 1% общей численности бактериопланктона, частично из-за использования в пищу метазоопланктоном.
Таксономические группы бактериопланктона неоднородны по составу, бактериальные клетки могут изменять свою морфологию в зависимости от жизненных стадий и условий окружающей среды. По-видимому, именно поэтому в водохранилищах и водотоках Монголии не было выявлено взаимосвязей между размерно-морфологическими группами и узкими доминирующими таксонами бактерий. Однако данные по доминирующим таксонам бактериопланктона высокого ранга соотносятся с данными по его размерно-морфологической структуре: сем. ACK-M1 представлено в основном кокками и коккобациллами, сем. Pelagibacteraceae – мелкими кокками, а род Flavobacterium – палочками разного размера.
Две исследуемые нами системы водохранилище–река похожи тем, что в числе доминантов и субдоминантов с представленностью в бактериопланктоне ≥5% всегда были группы филы Actinobacteria. Их постоянное присутствие в сообществах можно объяснить адаптацией к выеданию консументами, а именно малыми размерами их клеток (Pernthaler et al., 2001; Hahn et al., 2003; Newton et al., 2011). В трех водохранилищах Бельгии представители Actinobacteria занимали ~20% сообщества вне зависимости от сезона и трофического статуса водоемов. Было отмечено их преимущественное развитие в эпилимнионе по сравнению с мета- или гиполимнионом этих водохранилищ (Lliros et al., 2014).
Космополитами считаются и представители филы Verrucomicrobia (Newton et al., 2011), которые в нашем исследовании были в числе субдоминантов на всех участках, кроме участка р. Завхан выше водохранилища (ст. Т1). Данная фила использует широкий спектр метаболических стратегий (Lindström et al., 2004), что позволяет ее представителям входить в ядро микробного сообщества эпилимниона водоемов разного трофического статуса (Lliros et al., 2014). Эти стратегии позволяют представителям филы Verrucomicrobia успешно конкурировать за субстраты с группами других фил, но не с представителями Bacteroidetes, которые, по-видимому, их вытесняют.
Главное различие между двумя исследованными водными системами Монголии – многочисленное присутствие в составе бактериопланктона Тайширского вдхр. групп филы Bacteroidetes. Эти группы обычно развиваются в водоемах с высоким содержанием автохтонных органических веществ (Kirchman, 2002). В мезо- и политрофном водохранилищах Бельгии регистрировали высокое содержание таксонов филы Bacteroidetes, тогда как в олиготрофном водохранилище вклад этой филы в формирование структуры бактериопланктона был небольшим (Lliros et al., 2014). В этих водоемах представители Bacteroidetes часто были прикреплены к частицам детрита (Batani et al., 2016).
Однако таксоны из филы Bacteroidetes могут достигать высокой численности и в олиготрофных условиях. Так, в олиготрофном оз. Мичиган регистрировалась высокая численность рода Flavobacterium. Следует отметить, что этот род в водоемах представлен множеством олиготипов (последовательностей гена 16S рРНК с отличиями в 1–2 нуклеотида). Из 16 олиготипов этого рода один (наиболее многочисленный) был приспособлен к обитанию в оз. Мичиган, но не в его эвтрофных притоках (Newton, McLellan, 2015).
Трофический статус Дургунского вдхр. выше, чем Тайширского, что отражается в более высоком уровне количественного развития бактерий и гетеротрофных нанофлагеллят. Об этом свидетельствует также сравнительно невысокое развитие (в числе субдоминантов) сем. Pelagibacteraceae в Дургунском вдхр. по сравнению с таковым в Тайширском, где этот таксон доминирующий. Представители порядка Pelagibacterales относятся к наиболее многочисленным микроорганизмам на Земле и широко распространены в олиготрофных морских и пресных водах (Smith et al., 2015). Представители класса Alphaproteobacteria характерны для олиготрофных экосистем с высокой концентрацией гуминовых веществ (Hutalle-Schmelzer et al., 2010; Lliros, 2014).
Бактерии класса Betaproteobacteria, напротив, быстро растут в условиях высокого содержания органических веществ и соединений биогенных элементов и являются копиотрофами (Newton et al., 2011). Они значились в числе субдоминантов в пелагиали Дургунского вдхр., что также указывает на его более высокий трофический статус. В пелагиали Дургунского вдхр. субдоминантами были и бактерии родов Staphylococcus и Thermus, а в прот. Чонохарайх выше и ниже водохранилища они не встречались.
Важную роль в формировании структуры бактериопланктона играют гетеротрофные нанофлагелляты – главные потребители бактерий во многих водных экосистемах (Sanders et al., 1992; Копылов, Косолапов, 2008). В исследовании жгутиконосцев и бактерий в качестве модели взаимоотношений хищник–жертва в лабораторных условиях наблюдались вариации численности пяти наиболее крупных бактериальных таксонов, их размерная селекция, а также размерно-морфологические адаптации против выедания (Batani et al., 2016). Было показано, что в отсутствие протистов популяции бактерий из классов Alphaproteobacteria и Gammaproteobacteria увеличивают численность, а представители филы Actinobacteria остаются практически неизменными. По-видимому, большинство бактерий из класса Alphaproteobacteria – мелкие кокки диаметром 0.2–0.35 мкм, а Gammaproteobacteria – крупные и наиболее активные в сообществе палочки длиной >2 мкм. Они выигрывают конкуренцию за субстраты у среднеразмерных кокков диаметром 0.35–0.45 мкм, относящихся к филе Actinobacteria.
В водных экосистемах Монголии между численностью бактериопланктона и биомассой гетеротрофных жгутиконосцев установлена сильная положительная связь (r = 0.95, р < 0.05). Выявлены также тесные зависимости гетеротрофных нанофлагеллят с доминирующими крупными таксонами и мелкими размерно-морфологическими группами бактерий (табл. 4), что свидетельствует о важной роли этих простейших в формировании структуры бактериопланктона. Жгутиконосцы селективно выедают крупных и активных представителей класса Gammaproteobacteria, а совместно с метазоопланктоном – и филы Bacteroidetes, оставляя доминирующими в сообществах мелкие бактерии из класса Alphaproteobacteria и среднеразмерные кокки и коккобациллы из филы Actinobacteria, с которыми они коррелируют положительно. На участках водоемов и водотоков с невысоким количественным развитием гетеротрофных нанофлагеллят структура бактериопланктона формируется в результате конкуренции за субстраты, которую выигрывают крупные палочковидные морфотипы.
Таблица 4.
Значимые при р < 0.05 корреляции между крупными таксонами бактериопланктона (БП), его размерно-морфологическими группами и гетеротрофными нанофлагеллятами (ГНФ) (n = 8)
| Группы БП | ГНФ | |
|---|---|---|
| численность | биомасса | |
| Alphaproteobacteria | – | 0.72 |
| Betaproteobacteria | 0.74 | 0.98 |
| Actinobacteria | – | 0.83 |
| Verrucomicrobia | – | 0.76 |
| Общая численность БП | – | 0.95 |
| Палочки <2 мкм длиной | – | 0.93 |
| Кокки диаметром 0.35–0.45 мкм | 0.83 | 0.9 |
| Кокки диаметром 0.2–0.35 мкм | – | 0.86 |
ЗАКЛЮЧЕНИЕ
В пелагиали исследованных водохранилищ и водотоков Монголии преобладали мелкие (0.2–0.35 мкм) и среднеразмерные кокки и коккобациллы (0.35–0.45 мкм). Совместно на эти группы приходились 61 и 53% численности бактериопланктона в Дургунском и в Тайширском водохранилищах соответственно. В бактериальных сообществах этих водохранилищ доминировали представители сем. АСК-М1 (Actinobacteria) и сем. Pelagibacteraceae (Alfaproteobacteria), совместно достигавшие соответственно ~20 и ~25% общей численности. Согласно результатам микроскопических и молекулярно-биологических исследований более половины бактериального сообщества прот. Чонохарайх, вытекающей из эвтрофного озера, также составляли кокки, по-видимому, из этих же семейств. В р. Завхан выше Тайширского вдхр. доминировали мелкие палочки (длиной <2 мкм), вероятно, из рода Flavobacterium (Bacteroidetes). В системе прот. Чонохарайх–Дургунское вдхр. было зарегистрировано на порядок больше гетеротрофных нанофлагеллят, чем в системе р. Завхан–Тайширское вдхр. Эти простейшие, по-видимому, избирательно выедали крупных палочковидных бактерий, оставляя в качестве доминантов мелких и среднеразмерных кокков и коккобацилл в прот. Чонохарайх и Дургунском вдхр. В р. Завхан доминировали палочки, имеющие конкурентное преимущество перед другими размерно-морфологическими группами в использовании ресурсов.
Работа выполнена в рамках государственного задания (№ темы АААА-А18-118012690098-5). Экспедиционные исследования проведены при финансовой поддержке Совместной Российско-Монгольской комплексной биологической экспедиции РАН и АНМ.
Авторы выражают благодарность Н.Л. Бельковой (Научный центр проблем здоровья семьи и репродукции человека (г. Иркутск)) за помощь в получении библиотек ампликонов и их секвенировании, а также в обработке и обсуждении результатов.
Список литературы
Копылов А.И., Косолапов Д.Б. Бактериопланктон водохранилищ Верхней и Средней Волги. М.: СГУ, 2008. 377 с.
Румянцева Е.В., Косолапова Н.Г., Косолапов Д.Б. Взаимоотношения бактериопланктона, гетеротрофных нанофлагеллят и вириопланктона в литорали крупного равнинного водохранилища: влияние колониальных птиц // Микробиология. 2016. Т. 85. № 5. С. 588–597.
Batani G., Perez G., Martinez de la Escalera G., Piccini C., Fazi S. Competition and protist predation are important regulators of riverine bacterial community composition and size distribution // J. Freshwater Ecol. 2016. V. 31. № 4. P. 609–623.
Caron D.A. Technique for enumeration of heterotrophic and phototrophic nanoplankton, using epifluorescence microscopy and comparison with other procedures // Appl. Environ. Microbiol. 1983. V. 46. № 2. P. 491–498.
Chrós R.J., Adamczewski T., Kalinowska K., Skowronska A. Abundance and structure of microbial loop components (bacteria and protists) in lakes of different trophic status // J. Microbiol. Biotechnol. 2009. V. 19. № 9. P. 858–868.
Cole J.R., Wang Q., Fish J.A., Chai B., Mc Garrell D.M., Sun Y., Brown C.T., Porras-Alfaro A., Kuske C.R., Tiedje J.M. Ribosomal Database Project: data and tools for high throughput rRNA analysis // Nucl. Acids Res. 2014. V. 42 (Database iss.): D633–D642.
Ferguson R.L., Rublee P. Contribution of bacteria to standing crop of coastal plankton // Limnol. Oceanogr. 1976. V. 21. P. 141–145.
Gasol J.M., del Giorgio P.A., Massana R., Duarte C.M. Active versus inactive bacteria: size-dependence in a coastal marine plankton community // Mar. Ecol. Prog. Ser. 1995. V. 128. P. 91–97.
Hahn M.W., Lünsdorf H., Wu Q., Schauer M., Höfle M.G., Boenigk J., Stadler P. Isolation of novel ultramicrobacteria classified as actinobacteria from five freshwater habitats in Europe and Asia // Appl. Environ. Microbiol. 2003. V. 69. P. 1442–1451.
Hutalle-Schmelzer K.M.L., Zwirnmann E., Kruger A., Grossart H.-P. Enrichment and cultivation of pelagic bacteria from a humic lake using phenol and humic matter additions // FEMS Microb. Ecol. 2010. V. 72. P. 58–73.
Jürgens K. Predation on bacteria and bacterial resistance mechanisms: comparative aspects among different predator groups in aquatic systems. Berlin; Heidelberg: Springer-Verlag, 2007. V. 4. P. 57–92.
Jürgens K., Mats C. Predation as a shaping force for the phenotypic and genotypic composition of planktonic bacteria // Antonie van Leeuwenhoek. 2002. V. 81. P. 413–434.
Kirchman D.L. The ecology of Cytophaga-Flavobacteria in aquatic environments // FEMS Microb. Ecol. 2002. V. 39. P. 91–100.
Lebaron P., Servais P., Agogue H., Courties C., Joux F. Does the high nucleic acid content of individual bacterial cells allow us to discriminate between active cells and inactive cells in aquatic systems? // Appl. Environ. Microbiol. 2001. V. 67. P. 1775–1782.
Lindström E.S., Vrede K., Leskinen E. Response of a member of the Verrucomicrobia, among the dominating bacteria in a hypolimnion, to increased phosphorus availability // J. Plankton. Res. 2004. V. 26. P. 241–246.
Lliros M., Inceoğlu Ö., García-Armisen T., Anzil A., Leporcq B., Pigneur L.M., Viroux L., Darchambeau F., Descy J.-P., Servais P. Bacterial community composition in three freshwater reservoirs of different alkalinity and trophic status // PloS One. 2014. V. 9. № 12. e116145.
Newton R.J., McLellan S.L. A unique assemblage of cosmopolitan freshwater bacteria and higher community diversity differentiate an urbanized estuary from oligotrophic Lake Michigan // Front. Microbiol. 2015. V. 6. P. 1028. https://doi.org/10.3389/fmicb.2015.01028
Newton R.J., Jones S.E., Eiler A., Mcmahon K.D., Bertilsson S. A guide to the natural history of freshwater lake bacteria // Microbiol. Mol. Biol. Rev. 2011. V. 75. P. 14–49.
Pernthaler J., Posch T., Simek K., Vrba J., Pernthaler A., Glöckner F.O., Nübel U., Psenner R., Amann R. Predator-specific enrichment of actinobacteria from a cosmopolitan freshwater clade in mixed continuous culture // Appl. Environ. Microbiol. 2001. V. 67. P. 2145–2155.
Porter K.G., Feig Y.S. The use of DAPI for identifying and counting of aquatic microflora // Limnol. Oceanogr. 1980. V. 25. № 5. P. 943–948.
Salcher M.M. Same same but different: ecological niche partitioning of planktonic freshwater prokaryotes // J. Limnol. 2014. V. 73. № 1. P. 74–87.
Sanders R.W., Caron D.A., Berninger U.G. Relationships between bacteria and heterotrophic nano-plankton in marine and fresh waters: An inter-ecosystem comparison // Mar. Ecol. Prog. Ser. 1992. V. 86. P. 1–14.
Simek K., Kojecka P., Nedoma J., Hartman P., Vrba J., Dolan J.R. Shifts in bacterial community composition associated with different microzooplankton size fractions in a eutrophic reservoir // Limnol. Oceanogr. 1999. V. 44. № 7. P. 1634–1644.
Smith M.B., Rocha A.M., Smillie C.S., Olesen S.W., Paradis C., Wu L., Campbell J.H., Fortney J.L., Mehlhorn T.L., Lowe K.A., Earles J.E., Phillips J., Techtmann S.M., Joyner D.C., Elias D.A., Bailey K.L., Hurt R.A., Preheim S.P., Sanders M.C., Yang J.Y., Mueller M.A., Brooks S., Watson D.B., Zhang P., He Z., Dubinsky E.A., Adams P.D., Arkin A.P., Fields M.W., Zhou J., Alm E.J., Hazen T.C. Natural bacterial communities serve as quantitative geochemical biosensors // MBio. 2015. V. 6. № 3. https://doi.org/10.1128/mBio.00326-15
Sommaruga R., Psenner R. Permanent presence of grazing-resistant bacteria in a hypertrophic lake // Appl. Environ. Microbiol. 1995. V. 61. P. 3457–3459.
Winter C., Bouvier T., Weinbauer M.G., Thingstad T.F. Trade-offs between competition and defense specialists among unicellular organisms: The “killing the winner” hypothesis revisited // Microbiol. Mol. Biol. Rev. 2010. V. 74. № 1. P. 42–57.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


