Известия РАН. Серия биологическая, 2020, № 1, стр. 30-34
Микробная азотфиксация в кишечнике личинок типулид Tipula maxima
Н. В. Костина a, b, *, А. Н. Чернышева a, М. В. Вечерский b, Т. А. Кузнецова b
a Московский государственный университет им. М.В. Ломоносова, ф-т почвоведения,
Ленинские горы, 1, стр. 12, Москва, 119991 Россия
b Институт проблем экологии и эволюции им. А.Н. Северцова РАН,
Ленинский просп., 33, Москва, 119071 Россия
* E-mail: nvkostina@mail.ru
Поступила в редакцию 12.01.2018
После доработки 23.04.2018
Принята к публикации 23.04.2018
Аннотация
Исследованы активность азотфиксирующих микроорганизмов в кишечнике личинок комаров-долгоножек (Tipulidae) и их влияние на процессы микробной азотфиксации в почве. Двумя независимыми методами зафиксированы высокие показатели нитрогеназной активности в пищеварительном тракте личинок, обусловленные деятельностью в основном транзитных микроорганизмов. Отмечено, что азотфиксаторы, активно развивающиеся в кишечнике личинок, стимулируют резкое возрастание нитрогеназной активности в почве – уже через 3 мес. инкубации активность возрастает в 8 раз, что может способствовать накоплению азота в местах обитания личинок.
Комары-долгоножки (Diptera, Tipulidae) широко распространены во всех биогеографических регионах. У многих долгоножек развитие личиночной фазы может продолжаться до 10–11 мес., что составляет большую часть их жизненного цикла. Личинки долгоножек – фито- и сапрофаги – активно перерабатывают листовой опад. Их численность в некоторых биотопах может достигать 120 экз./м2 (Стриганова, 1976). Вследствие высокой численности личинок трофическая деятельность типулид, а также микробное сообщество экскретов личинок могут оказывать значительное влияние на микробиом почв и трансформацию основных биофильных элементов – азота и углерода. Пищеварительная трансформация органического вещества почвенной мезо- и макрофауной достаточно подробно исследована, однако влияние ее на трансформацию азота в почве, прежде всего на диазотрофное звено азотного цикла, рассмотрено недостаточно. Известно, что сапротрофы могут испытывать недостаток азота, поскольку их пища содержит в 5–10 раз меньше этого элемента, чем пища зоофагов. При этом биохимические потребности у представителей разных трофических групп не различаются. Мы предполагаем, что одним из путей восполнения дефицита диетарного азота личинок типулид может служить микробная азотфиксация в пищеварительном тракте. Микробная нитрогеназная активность уже была обнаружена в кишечнике некоторых насекомых, корма которых бедны азотом: термитов (Breznak, 2000), личинок жуков-короедов (Bridges, 1981), личинок жуков-рогачей (Kuranouchi et al., 2006), проволочников (Самойлова и др., 2015) и др. Кроме того, некоторые насекомые, например термиты и проволочники, оказывают позитивное влияние на численность и активность азотфиксаторов в почве благодаря увеличению количества и активности микроорганизмов в пищеварительном тракте с последующей их экскрецией (Breznak, 2000; Самойлова и др., 2015).
Цель работы – оценка активности азотфиксирующих микроорганизмов кишечника личинок типулид и их влияния на нитрогеназную активность населяемых почв.
МАТЕРИАЛЫ И МЕТОДЫ
Объектами исследования служили личинки комара-долгоножки Tipula (Acutipula) maxima Poda, 1761 и образцы урбо-дерново-глеевой почвы, отобранные в затопленных понижениях рельефа на территории природного заказника “Воробьевы горы” (Москва, Россия). В опыте были использованы 47 личинок старших возрастов (III и IV). Личинок содержали в пяти сосудах объемом 1 л со свежей почвой с учетом естественной плотности расселения (8–10 шт. на 1 сосуд) при 4°С. Влажность почвы поддерживали на уровне 80% полной влагоемкости.
Активность азотфиксации измеряли ацетиленовым и изотопным методами. Для определения актуальной нитрогеназной активности почвы ацетиленовым методом (Методы…, 1991) использовали хроматограф “Кристалл-2000” (Россия) с пламенно-ионизационным детектором (длина колонки – 1 м, диаметр – 3 мм, наполнитель – Porapak N 80/100, температуры колонки, детектора, испарителя – 60, 160 и 100°С соответственно, расходы газа-носителя (N2), воздуха и водорода – 50, 280 и 28 мл/мин соответственно). Определение проводили в 5-кратной повторности. Активность азотфиксации выражали в мкг С2Н4/(г ч).
Для определения актуальной нитрогеназной активности в кишечнике типулид предварительно взвешенных личинок поштучно помещали в пенициллиновые флаконы, которые закрывали резиновой пробкой. Во флакон вводили 1 мл ацетилена и инкубировали 1 ч при 20°С. Дальнейший анализ описан выше. Определение эндогенного этиленогенеза (контроль) проводили по той же методике без добавления ацетилена.
Для дифференцированного определения нитрогеназной активности пристеночного сообщества кишечника личинок за 1 сут до измерения высаживали в чашки Петри со стерильным 1%-ным агаром. После освобождения кишечника от содержимого проводили измерение актуальной нитрогеназной активности в девятикратной повторности, как указано выше.
Для определения актуальной нитрогеназной активности изотопным методом восемь предварительно взвешенных личинок помещали в пенициллиновые флаконы. Половину навесок (контрольные образцы) стерилизовали добавлением 1 мл толуола. Все флаконы герметично закрывали резиновыми пробками, вводили 0.4 мл газообразного изотопа азота 15N (98%) (Sigma Aldrich, США) и инкубировали в течение 1 сут при комнатной температуре. Аналогичная процедура была проведена с навесками влажной почвы (2 г). Затем фиксировали образцы этанолом, высушивали, проветривали, растирали в ступке и измеряли изотопный состав на масс-спектрометре Thermo-Finnigan Delta V Plus (Thermo Electron (Bremen) GmbH, Германия). Изотопный состав азота выражали в тысячных долях отклонения от международного стандарта (δ, ‰).
Численность аэробных и факультативно-анаэробных бактерий в содержимом отделов кишечника личинок типулид и в почве определяли методом посева на твердые питательные среды: глюкозопептонно-дрожжевую (ГПД) и Федорова‒Калининской из 3–4 разведений. Инкубировали посевы при 28°С в течение 5 сут (Методы…, 1991). Определение биомассы почвенных микроорганизмов проводили методом субстратиндуцированного дыхания (West, Sparling, 1986).
Статистическую обработку результатов проводили с использованием программы Statistica 8.0 (StatSoft Inc, США). Нормальность распределения оценивали с помощью критерия Шапиро‒Уилка. Для оценки различий произвольно распределенных значений использовали тесты Краскела‒Уоллиса и Манна‒Уитни. Количественные результаты представлены в виде медианы и квартилей. Для оценки различий нормально распределенных значений использовали t-критерий. Количественные результаты представлены в виде среднего и стандартного отклонения.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Живые личинки типулид благодаря кишечным симбионтам способны к активной азотфиксации (рис. 1). Средняя нитрогеназная активность составляла ~0.105 мкг С2Н4/(г ч), что превышает значения, обнаруженные в кишечнике дождевых червей и проволочников разных эколого-трофических групп (Костина и др., 2011; Самойлова и др., 2015). Полученные нами результаты сопоставимы с оценками интенсивности нитрогеназной активности в кишечнике термитов (0.143 мкг С2Н4/(г ч)) (Голиченков и др., 2006), в которых до 23% азота обеспечивается за счет симбиотической азотфиксации (Fujita, Abe, 2006). Известно, что значимая бактериальная азотфиксация в пищеварительном тракте обнаруживается только у растительноядных животных: термитов (Breznak, 2000), короедов (Bridges, 1981), позвоночных-фитофагов (Вечерский и др., 2014; Кузнецова и др., 2014) и др. Вероятно, для типулид, потребляющих отмершие растительные остатки, микробная азотфиксация также имеет физиологическое значение.
Рис. 1.
Нитрогеназная активность личинок Tipula maxima. В качестве контроля приведен уровень эндогенного этиленогенеза. 1 – среднее, 2 – среднее ± стандартное отклонение, 3 – среднее ± 1.96 × стандартное отклонение. ЖКТ – желудочно-кишечный тракт.
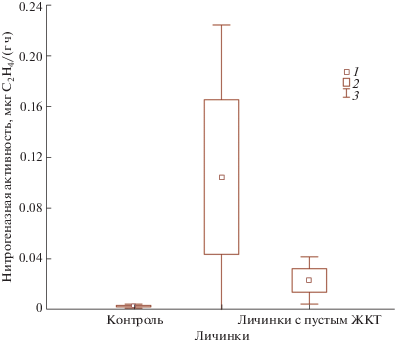
Ацетиленовый метод может давать ложноположительную реакцию при наличии эндогенного этиленогенеза. Однако у живых типулид этиленогенез хотя и обнаруживался, но оставался на достаточно низком уровне (рис. 1, контроль). Возникает вопрос о прочности экологических взаимоотношений типулид и бактерий-азотфиксаторов. Диазотрофы могут быть либо мутуалистическими симбионтами, прочно ассоциированными со стенками кишечника, либо транзитными формами, увеличивающими активность в благоприятных условиях пищеварительного тракта (Breznak, 2000; Голиченков и др., 2006; Самойлова и др., 2015). Чтобы получить ответ на вопрос о преимущественной локализации бактерий-азотфиксаторов, было проведено сравнение нитрогеназной активности у личинок из естественной среды и личинок с пустым кишечником (после содержания их в течение 1 сут на 1%-ном голодном агаре). Длительность эксперимента позволяет добиться выведения транзитных форм бактерий, сохраняя жизнедеятельность пристеночного сообщества. Оказалось, что после опорожнения кишечника, нитрогеназная активность, измеренная у живых личинок, снижается более чем в 4 раза (t-критерий, p < 0.05) (рис. 1). Полученные результаты позволяют сделать вывод, что азотфиксаторы у личинок T. maxima представлены преимущественно транзитной микрофлорой.
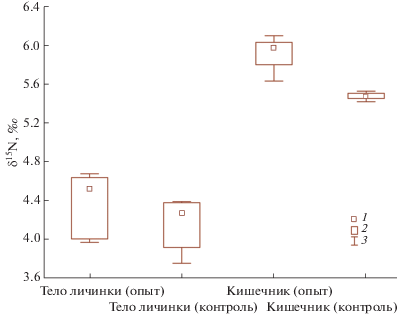
Активность азотфиксации у личинок T. maxima была также исследована изотопным методом. С его помощью можно отследить закрепление атмосферного азота в бактериальной биомассе кишечника и в белке самих типулид. После суточной инкубации в атмосфере, содержащей 3.5% 15N, произошло достоверное обогащение тяжелым изотопом содержимого кишечника на 0.5‰ (критерий Манна‒Уитни, p = 0.00628) (рис. 2). Это свидетельствует о том, что атмосферный азот достаточно активно связывается прокариотами в содержимом кишечника типулид. В теле живых личинок увеличение содержания тяжелого изотопа азота после суточной инкубации не зафиксировано, что не противоречит литературным данным. Известно, что включение изотопной метки в тело термитов происходит не ранее чем на 7-е сут (Fujita, Abe, 2006). В образцах контрольной почвы, инкубируемых в атмосфере, содержащей 3.5% 15N, достоверного обогащения тяжелым изотопом не обнаружено.
Рис. 2.
Изотопный состав азота после инкубации в атмосфере 15N стерильных личинок T. maxima (личинки – контроль), стерильного изолированного кишечника типулид (кишечник – контроль) и нативных типулид и их кишечника (личинки и кишечник соответственно). 1 – медиана, 2 – верхний и нижний квартили, 3 – минимум и максимум.
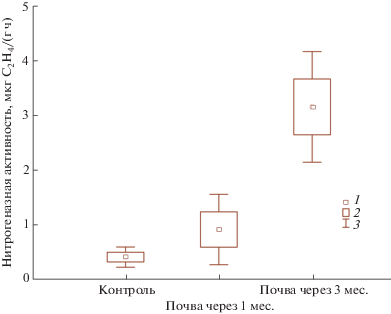
Чтобы оценить влияние типулид на азотфиксацию в почвах, было проведено сравнение нитрогеназной активности в нативной почве и почве после 1 и 3 мес. пребывания в ней типулид (при естественной плотности популяции 8–10 шт./кг почвы). Через 1 мес. нитрогеназная активность возросла вдвое, а через 3 мес. – в 8 раз по сравнению с контролем (t-критерий, p < 0.05) (рис. 3).
Рис. 3.
Нитрогеназная активность контрольной почвы (контроль) и модельных почв, в которых обитали личинки T. maxima при естественной плотности популяции. 1 – среднее, 2 – среднее ± стандартное отклонение, 3 – среднее ± ± 1.96 × стандартное отклонение.
Присутствие типулид почти в 2 раза увеличивало биомассу почвенных микроорганизмов, определяемую методом субстратиндуцированного дыхания: в контрольной почве она составляла 360.64 мкг С/г почвы, а после месячного обитания в ней личинок T. maxima достоверно увеличилась до 646.69 мкг С/г почвы (критерий Манна–Уитни, p < 0.05).
Общая численность культивируемых аэробных микроорганизмов пищеварительного тракта типулид, способных к росту на глюкозопептонно-дрожжевой среде, была достаточно высокой (1.3 × 107 КОЕ/г для суммарного содержимого кишечника и 2.8 × 107 КОЕ/г для бродильной камеры – специализированного микробного ферментера типулид). Численность микроаэрофилов в бродильной камере личинок была на порядок выше (3.3 × 108 КОЕ/г).
После инкубации личинок в почве увеличилась и численность азотфиксаторов, способных к росту на среде Федорова–Калининской с 5 × 106 КОЕ/г в контрольной почве до 1.2 × 107 КОЕ/г в модельной (критерий Манна–Уитни, p < 0.05). Следует отметить высокую численность азотфиксаторов в почве, сопоставимую с их численностью в кишечнике личинок типулид (0.9 × 107 КОЕ/г), хотя обычно это значение для почвы не превышает 106 КОЕ/г.
Таким образом, присутствие типулид достоверно увеличивает численность и активность почвенных бактерий, обеспечивающих протекание ключевого процесса азотного цикла в почве. В этом отношении типулиды, как, возможно, и другие фито- и детритофаги, являются естественными резервуарами для размножения бактерий-азотфиксаторов. Однако помимо прямого воздействия насекомые могут стимулировать азотфиксацию косвенным образом, агрегируя почвенные отдельности и осуществляя минерализацию опада в подстилке и верхней части гумусового горизонта.
Таким образом, в кишечнике личинок T. maxima зарегистрирована фиксация атмосферного азота, как газохроматографическим, так и изотопным методами. Эта нитрогеназная активность обусловлена деятельностью преимущественно транзитных кишечных микроорганизмов-диазотрофов. Покидая пищеварительный тракт, они обогащают почвенный пул азотфиксаторов, что приводит к резкому возрастанию нитрогеназной активности в почве, заселенной личинками типулид – уже через 3 мес. инкубации активность возрастает в 8 раз, что может способствовать накоплению азота в местах обитания личинок. Работа демонстрирует важность беспозвоночных, в том числе личинок насекомых, в обеспечении почвы азотом и поддержании ее азотного баланса.
Авторы признательны А.В. Тиунову за помощь при проведении изотопного анализа в Центре коллективного пользования ИПЭЭ РАН “Инструментальные методы в экологии”.
Работа выполнена при финансовой поддержке РФФИ (грант 16-04-01864а).
Список литературы
Вечерский М.В., Кузнецова Т.А., Костина Н.В., Горленко М.В., Голиченков M.B., Умаров М.М., Наумова Е.И. Роль микроорганизмов желудочно-кишечного тракта в питании тетеревиных // Изв. РАН. Сер. биол. 2014. № 3. С. 281–285.
Голиченков М.В., Костина Н.В., Кузнецова Т.А., Умаров М.М. Диазотрофы пищеварительного тракта термитов Neotermes castaneus // Изв. РАН. Сер. биол. 2006. № 5. С. 624–629.
Костина Н.В., Богданова Т.В., Умаров М.М. Биологическая активность копролитов дождевых червей // Вестн. МГУ. Сер. 17: Почвоведение. 2011. № 1. С. 20–26.
Кузнецова Т.А., Вечерский М.В., Голиченков М.В., Костина Н.В., Умаров М.М., Наумова Е.И. Активность азотфиксирующих микроорганизмов в желудочно-кишечном тракте зайца-русака // Докл. РАН. 2014. Т. 456. № 4. С. 499–501.
Методы почвенной микробиологии и биохимии / Под ред. Звягинцева Д.Г. М.: Изд-во МГУ, 1991. С. 47–58.
Самойлова Е.С., Костина Н.В., Стриганова Б.Р. Несимбиотическая азотфиксация в кишечнике личинок жуков-щелкунов (Coleoptera, Elateridae) // Докл. РАН. 2015. Т. 461. № 2. С. 242–245.
Стриганова Б.Р. Специфика пищеварительной активности почвенных беспозвоночных как показатель характера разложения растительных остатков // Биологическая диагностика почв. М.: Наука, 1976. С. 268–269.
Breznak J.A. Ecology of prokaryotic microbes in the guts of wood- and litter-feeding termites // Termites: evolution, sociality, symbiosis, ecology / Eds Abe T., Bignell D.E., Higashi M. Dordrecht: Springer, 2000. P. 209–231.
Bridges J.R. Nitrogen-fixing bacteria associated with bark beetles // Microb. Ecol. 1981. V. 7. P. 131–137.
Fujita A., Abe T. Atmospheric nitrogen assimilation by a wood-feeding termite, Reticulitermes speratus (Isoptera: Rhinotermitidae) // Sociobiology. 2006. № 1. P. 175–188.
Kuranouchi T., Nakamura T., Shimamura S., Kojima H., Goka K., Okabe K., Mochizuki A. Nitrogen fixation in the stag beetle, Dorcus (Macrodorcus) rectus (Motschulsky) (Col., Lucanidae) // J. Appl. Entomol. 2006. V. 130(9–10). P. 471–472.
West A.W., Sparling G.P. Modifications to the substrate-induced respiration method to permit measurement of microbial biomass in soils of differing water contents // J. Microbiol. Meth. 1986. V. 5. P. 177–189.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


