Известия РАН. Серия биологическая, 2020, № 1, стр. 44-50
Влияние хронической частичной дефолиации лиственницы чехликовой молью на физиологические параметры ствола
Г. Г. Полякова a, *, Н. В. Пашенова a, В. А. Сенашова a
a Институт леса им. В.Н. Сукачева Сибирского отделения Российской академии наук, Федеральный исследовательский центр “Красноярский научный центр СО РАН”
660036 Красноярск, Академгородок, 50/28, Россия
* E-mail: ggpolyakova@mail.ru
Поступила в редакцию 22.02.2018
После доработки 03.03.2018
Принята к публикации 23.04.2018
Аннотация
В очаге лиственничной чехликовой моли Coleophora sibiricella Falkovitsh в чистом лиственничнике исследован защитный ответ флоэмы ствола лиственницы сибирской Larix sibirica Ledeb. на поранение или инокуляцию ствола грибным индуктором. В качестве грибного инокулята использовали мицелий офиостомового гриба Ceratocystis laricicola Redfern & Minter, его экстракт и белковую фракцию, полученную из экстракта. Содержание лигнина, крахмала, конденсированных дубильных веществ (проантоцианидинов) во флоэме определено в начале опыта (0 сут), через 7 и 14 сут. С помощью анализа ANOVA показано, что параметры ответа флоэмы не зависели от формы грибного инокулята (р ≥ 0.918), но зависели от других факторов (р ≤ 0.005) – повреждения кроны молью, времени от начала опыта, наличия инокулята в ране.
Лиственничные чехлоноски или лиственничные чехликовые моли (Lepidoptera, Coleophoridae), вызывающие частичное хроническое повреждение хвои, широко распространены по всему ареалу лиственницы в Евразии (Плешанов, 1982; Ермолаев, Ермолаева, 2003; Vîlcan et al., 2013). Лиственничная чехлоноска сибирская Coleophora sibiricella Falkovitsh – один из представителей данного семейства, являющийся вредителем лиственницы сибирской Larix sibirica Ledeb.
Повреждение хвои молью не приводит к гибели деревьев (гусеницы выедают внутренние ткани верхней части хвоинок), но вызывает значительное снижение прироста стволовой древесины и продуктивности лиственничников. При этом характерно образование хронических очагов размножения, в которых одни и те же деревья подвергаются многократному повреждению насекомыми. Несмотря на разрастание базальной части хвои и повышение интенсивности фотосинтеза, образование первичных продуктов фотосинтеза снижено, нарушен синтез лигнина (Benz, 1974; Плешанов, 1982; Ермолаев, Ермолаева, 2003). Характерная особенность лиственницы, повреждаемой молью, – отсутствие снижения устойчивости к насекомым-ксилофагам (Плешанов, 1982), жизненный цикл которых в основном проходит в тканях ствола (Исаев, Гирс, 1975). Причины такой высокой резистентности к стволовым вредителям до сих пор остаются невыясненными.
Повреждение лиственницы чехликовой молью оценивается в основном с точки зрения влияния этого биотического фактора на параметры хвои. При этом физиологические характеристики тканей ствола вообще остаются за пределами области исследования, хотя снижение ассимиляционной активности дефолиированной кроны не может не сказаться на его функционировании.
В практике применяется метод искусственной инокуляции ствола офиостомовыми грибами для изучения изменений в системе растение-хозяин–патоген-вредитель (Paine et al., 1997; Goodsman et al., 2013; Hammerbacher et al., 2013). Регистрация в зоне ответа флоэмы таких неспецифических параметров, как динамика протекторных соединений и неструктурных углеводов, позволяет судить о механизмах устойчивости к неблагоприятным факторам.
Давно известно, что офиостомовые грибы, развивающиеся в проводящих тканях, заносятся в растительные ткани насекомыми-ксилофагами (Paine et al., 1997; VonSchrenk, 1903, цит. по Gibbs, 1999). Развитие этих грибов в проводящих тканях вызывает окрашивание древесины (у хвойных известное как синева древесины). Для хвойных показано, что устойчивость к офиостомовым грибам прямо связана с резистентностью к стволовым вредителям, которые эти грибы переносят (Wright et al., 1979; Ветрова и др., 1995). В связи с этим понимание физиологических механизмов устойчивости тканей ствола к офиостомовым грибам, вероятно, поможет получить ответ на вопрос о причинах высокой устойчивости дефолиированной молью лиственницы к воздействию стволовых вредителей.
В норме хвойные растения, как правило, устойчивы к офиостомовым грибам. Искусственная инокуляция ствола этими специализированными патогенами либо препаратами, выделенными из мицелия, вызывает локальную сверхчувствительную реакцию флоэмы, сопровождающуюся быстрой некротизацией тканей, накоплением в них протекторных веществ и формированием изолирующей перидермы, разделяющей некроз и живые ткани (Полякова и др., 2011; Goodsman et al., 2013; Hammerbacher et al., 2013). Опыты на деревьях согласуются с экспериментами in vitro. В каллусах лиственницы сибирской L. sibirica, обработанных экстрактами из мицелия офиостомового гриба Ceratocystis laricicola Redfern & Minter, зарегистрировано накопление лигнина, участвующего, как известно, в защитной трансформации клеточных стенок, и конденсированных дубильных веществ (проантоцианидинов (ПА)), также обладающих протекторными свойствами (Шеин и др., 2001; Vidhyasekaran, 2008).
Цель работы – проверка предположения об изменении физиологических параметров ствола лиственницы сибирской при хроническом частичном повреждении хвои насекомым C. sibiricella.
МАТЕРИАЛЫ И МЕТОДЫ
Для достижения цели исследования сравнивали динамику лигнина, ПА и крахмала в зоне сверхчувствительной реакции флоэмы ствола лиственницы сибирской на поранение и действие гриба C. laricicola либо мицелиальных экстрактов у деревьев без признаков повреждения хвои и дефолиированных молью.
Характеристика древостоя. Объект исследования – лиственница сибирская L. sibirica 100–120 лет диаметром 24 см, произрастающая в чистом лиственничнике разнотравном (54°41′11′′ с.ш., 89°25′37′′ в.д., 523 м над у. м.), в спелом среднеполнотном насаждении II класса бонитета (Южно-Хакасский округ подтаежных сосново-лиственничных и горно-таежных лиственнично-темнохвойных лесов Алтае-Саянской горной лесорастительной области (Смагин и др., 1980)). Древостой расположен в хроническом очаге лиственничной чехликовой моли (чехлоноски) C. sibiricella.
Подготовка микробиологического материала для инокуляции. Чистую культуру офиостомового гриба C. laricicola выделяли из образцов флоэмы и заболони, высеченных из стволов лиственницы сибирской, содержащих различные части ходов большого лиственничного короеда Ips cembrae Heer. Культуры грибов поддерживали при 4°С на агаризованной питательной среде – пивном сусле (2° по Баллингу). Мицелий гриба для инокулирования деревьев выращивали на агаризованном пивном сусле (2° по Баллингу) при 24°С в течение 5 сут.
Мицелиальную массу для экстрагирования наращивали на жидком пивном сусле методом “поверхностного” культивирования при 24°С. В качестве инокулюма для жидкой среды использовали мицелий 7-суточных колоний гриба на агаризованном сусле. После 10 сут культивирования на жидкой среде биомассу гриба собирали фильтрованием.
Мицелиальную массу после предварительного замораживания использовали для приготовления грибного экстракта (Метлицкий и др., 1976). Мицелий гомогенизировали с помощью жидкого азота, затем ультразвука (15 кГц) с добавлением кварцевого песка. После исчерпывающей экстракции 70%-ным этанолом с использованием водяной бани супернатант упаривали досуха. Растворенный в воде остаток (5 мл) подвергали диализу против 4 л воды в течение 2 сут с 4-кратной сменой воды при 4–6°С.
Инокуляция ствола и отбор образцов флоэмы. В начале опыта в середине июля (0 сут) в очаге лиственничной чехликовой моли инокулировали семь деревьев лиственницы без признаков повреждения и семь деревьев, частично дефолиированных этим насекомым. В начале эксперимента на каждом дереве на высоте 1.3 м высекали восемь отверстий в лубе до заболони диаметром 7 мм и прямоугольный образец луба размером 2 × 4 см. Высечки располагались на стволе горизонтально на расстоянии ~5 см одна от другой. Прямоугольный образец после удаления мертвой коры фиксировали в 96%-ном этиловом спирте для биохимического анализа в варианте “неповрежденная флоэма” (0 сут).
Для каждого варианта инокуляции использовали по два отверстия. В первом контрольном варианте (поранение) в каждое из двух отверстий было внесено 50 мкл воды, во втором – 50 мкл водного раствора, содержащего белковую фракцию из мицелия офиостомового гриба C. laricicola, в третьем – 50 мкл водного раствора, содержащего грибные экстрактивные вещества (10 мг/мл), в четвертом – мицелий C. laricicola на кусочке агара (10–15 мм3), вырезанном из растущего края колонии на агаризованной среде. Отверстия закрывали высечками коры.
Через 7 сут после инокуляции на каждом дереве высекали по четыре прямоугольных образца луба размером 2 × 4 см (по одному образцу каждого из четырех вариантов инокуляции) с инокуляционным отверстием в центре. Образцы луба фиксировали в этаноле для последующего анализа.
Такие же манипуляции проводили через 14 сут после начала опыта. Удельную массу луба рассчитывали как массу образца луба на 1 см2 площади камбия.
Определение содержания фенольных соединений и крахмала. Растительные образцы растирали в жидком азоте. Проводили исчерпывающую экстракцию 70%-ным этанолом. Сухую массу растительного материала определяли как сумму масс высушенного экстракта и нерастворимого в этаноле остатка. Высушенный экстракт растворяли в дистиллированной воде для определения содержания свободных ПА.
Для определения содержания свободных ПА анализируемый водный раствор нагревали со смесью н-бутанол-НCl (9 : 1) в течение 60 мин при 95°С, затем измеряли его оптическую плотность в 1-сантиметровой кювете при 550 нм. Концентрацию ПА рассчитывали как произведение оптической плотности на коэффициент 150 и выражали в мкг/мл (Stafford, Lester, 1986).
В остатке, не растворимом в этаноле, определяли содержание связанной формы ПА (Stafford, Lester, 1986), лигнина (Venverloo, 1969) и крахмала (Полякова, Сенашова, 2017).
Содержание общих ПА в сухом образце определяли как суммарную концентрацию свободных и связанных ПА. Для определения содержания лигнина 50 мг остатка нагревали с 1.8 мл смеси тиогликолевой кислоты с НCl (10 г кислоты в 100 мл 2 N НCl) в запаянных стеклянных ампулах в течение 8 ч при 100°С. Остаток лигнотиогликолевой кислоты промывали подкисленной водой (рН 3), затем экстрагировали 20 мл 0.5 N NaOH. Лигнотиогликолевую кислоту осаждали 5 N HCl. Осадок высушивали и взвешивали (масса лигнина – 75% массы лигнотиогликолевой кислоты) (Venverloo, 1969).
Для определения содержания крахмала 20 мг остатка выдерживали в 0.6 мл 7.2 М HClO4 (хлорной кислоты) 30 мин для гидролиза целлюлозных компонентов. Добавляли 5 мл воды. Супернатант с помощью 2 N NaOH нейтрализовали до pH 8, затем с помощью 2 N CH3COOH – до pH 6. Постепенно добавляли 0.5 мл 10%-ного раствора KJ и 1 мл 0.01 М раствора KJO3. Через 30 мин определяли оптическую плотность при 650 нм. Для калибровки использовали чистый крахмал, с которым проводили такие же манипуляции, как с растительным остатком (Полякова, Сенашова, 2017). Содержание крахмала, лигнина и связанных ПА приведено в мг на 1 г сухой массы нерастворимого остатка.
Статистическая обработка данных. Для оценки достоверности влияния различных факторов на параметры защитного ответа использовали факторный дисперсионный анализ ANOVA. Оценивали, в частности, влияние повреждения кроны молью, обработки места искусственного поранения ствола грибным индуктором, длительности воздействия и способа приготовления (формы) грибного индуктора.
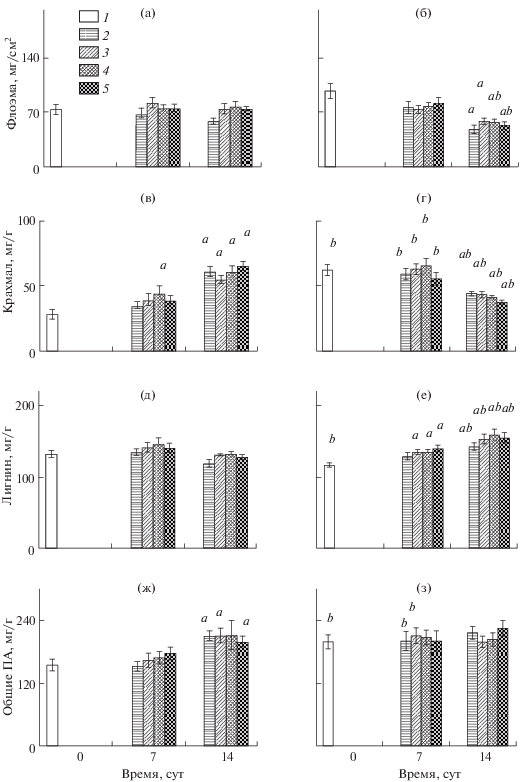
На рис. 1а–з указаны средние значения для семи деревьев, стандартные ошибки, а также достоверность различия средних значений, рассчитанная по t-критерию.
Рис. 1.
Удельная масса флоэмы, прилегающей к инокуляционному отверстию (а, б), а также содержание крахмала (в, г), лигнина (д, е) и общих проантоцианидов (ПА) (ж, з) в начале опыта (0 сут) и через 7, 14 сут при разных вариантах повреждения флоэмы ствола. 1 – неповрежденная флоэма, 2 – поранение, 3 – инокуляция белковой фракцией Ceratocystis laricicola, 4 – инокуляция экстрактом C. laricicola, 5 – инокуляция мицелием C. laricicola. а, в, д, ж – деревья без признаков повреждения молью; б, г, е, з – деревья, дефолиированные молью. Указаны средние значения и их стандартные ошибки для семи контрольных деревьев без признаков повреждения хвои и семи дефолиированных. а – достоверное различие (p < 0.05 по t-критерию) между вариантом 1 и вариантами 2–5, b – между двумя группами деревьев (контрольные и дефолиированные) при одинаковых вариантах повреждения флоэмы.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В начале эксперимента в середине июля (0 сут) у лиственниц с поврежденной молью хвоей было отмечено более высокое содержание крахмала и ПА во флоэме ствола по сравнению с таковым у контрольных деревьев (p < 0.05) (рис. 1в, г, ж, з).
Контрольные деревья реагировали на искусственное повреждение ствола (поранение либо инокуляция) достоверным накоплением крахмала (p < 0.05), а дефолиированные – снижением (p < 0.05) (рис. 1в, г).
У контрольных деревьев не отмечено снижения массы флоэмы в зоне реакции, в то время как у дефолиированных деревьев наблюдалось существенное изменение данного показателя через 2 нед после начала опыта (p < 0.05) (рис. 1а, б).
В начале опыта (0 сут) во флоэме контрольных деревьев содержание лигнина было существенно выше (p < 0.05), а ПА ниже (p < 0.05) по сравнению с дефолиированными лиственницами (рис. 1д–з). Контрольные лиственницы отвечали на инокуляцию ствола достоверным накоплением ПА в реагирующей флоэме (рис. 1ж), а дефолиированные – лигнина (рис. 1е).
Проведенный эксперимент не показал статистически значимого изменения концентрации лигнина во флоэме ствола после искусственного ее повреждения у контрольных лиственниц (рис. 1д) и ПА у дефолиированных (рис. 1з). Возможно, это связано с недостаточностью объема выборки.
С помощью факторного дисперсионного анализа ANOVA было доказано достоверное влияние на характеристики защитного ответа большинства исследованных факторов (р ≤ 0.005) (табл. 1). Влияние фактора “форма грибного индуктора C. Laricicola” оказалось незначимым (р ≥ 0.918) (табл. 1), т.е. измеренные параметры сверхчувствительного ответа флоэмы не зависели от того, живой мицелий вносится в инокуляционное отверстие или выделенные из него экстрактивные вещества.
Таблица 1.
Уровни значимости воздействия различных факторов на параметры флоэмы (содержание общих ПА, лигнина, крахмала, удельную массу флоэмы), прилегающей к инокуляционному отверстию, при использовании различных форм грибного индуктора в соответствии с результатами анализа ANOVA
| Фактор (градации фактора) | 1 | 2 | 3 |
|---|---|---|---|
| Повреждение хвои чехликовой молью Coleophora sibiricella (без повреждения молью, дефолиирование) | 0.000 | 0.000 | 0.000 |
| Время после начала опыта (0, 7, 14 сут) | 0.000 | 0.000 | 0.000 |
| Наличие грибного индуктора Ceratocystis laricicola в инокуляционном отверстии (пустое инокуляционное отверстие, инокулят внесен) | 0.000 | 0.005 | 0.000 |
| Форма грибного индуктора C. laricicola (мицелий, экстракт, белковая фракция) | 0.918 | 0.998 | 0.995 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Хвойные растения имеют два механизма защиты от повреждения насекомыми-ксилофагами и ассоциированными с ними офиостомовыми грибами. Первичная защита присуща интактным тканям хозяина, индуцированная возникает в ответ на действие вредителя-патогена (в нашем случае короедно-грибного комплекса) (Lieutier, 1999). Эксперимент с искусственной инокуляцией ствола грибным мицелием и выделенными из него экстрактами показал, что первичная защита тканей флоэмы ствола у лиственниц без признаков повреждения кроны отличалась от таковой у дефолиированных деревьев; то же относится и к индуцированной защите.
Первичная защита. В начале опыта (0 сут), еще до экспериментального повреждения ствола, во флоэме был зарегистрирован более высокий уровень резервных углеводов (крахмал) и протекторных соединений (конденсированные дубильные вещества) у дефолиированных лиственниц по сравнению с контрольными деревьями (рис. 1в, г, ж, з). Повышение содержания крахмала и ПА в конституционной флоэме свидетельствует об иррадиации адаптивных изменений от места повреждения хвои молью до тканей ствола и может, по нашему мнению, рассматриваться как один из факторов высокой устойчивости таких деревьев к воздействию стволовых вредителей (Плешанов, 1982).
Отмеченный эффект повышенного содержания крахмала в стволе дефолиированных деревьев по сравнению с контрольными деревьями согласуется с концепцией активного резервирования неструктурных углеводов у деревьев в случае нарушения работы ассимилирующего аппарата стрессирующими факторами (Wiley, Helliker, 2012; Rocha, 2013; Palacio et al., 2014). Эта концепция, предложенная для оценки состояния деревьев, дефолиируемых при засухе, выдвинута в противовес концепции пассивного накопления ассимилятов. Сторонники пассивной модели считают, что неструктурные углеводы не могут накапливаться, когда рост лимитируется недостаточным поступлением СО2 в ткани растения. Приверженцы активной модели (концепции консервативной стратегии) считают, что формирование резервов этих углеводов возможно при редуцированном росте. Это обеспечивает эволюционное преимущество для выживания при стрессе (Wiley, Helliker, 2012; Palacio et al., 2014). Зарегистрированное в нашем эксперименте накопление крахмала в интактной флоэме ствола лиственниц, дефолиированных молью, свидетельствует о том, что деревья переключают ресурсы в пользу активного накопления резервных углеводов в тканях ствола в ущерб радиальному приросту.
В соответствии с гипотезой углеродного баланса хронический стресс может привести растение к гибели в том случае, если потери углерода превышают его поглощение (Mueller-Dumbois, 1987, цит. по McDowell et al., 2008). В этом случае наблюдается отрицательный углеродный баланс – углеродное голодание (carbon starvation). Более высокое содержание крахмала во флоэме ствола, отмеченное в начале опыта (0 сут), у хронически повреждаемых молью лиственниц по сравнению с таковым у контрольных деревьев подтверждает положительный углеродный баланс (рис. 1в, г), несмотря на уменьшение прироста ствола при дефолиации молью (Плешанов, 1982). Высокая адаптивная способность деревьев к хронической дефолиации подтверждается и ранее опубликованными данными. Так, у деревьев, которые в течение 11 лет искусственно дефолиировали и затем на 6 лет оставили без повреждения, отмечено более высокое содержание неструктурных углеводов по сравнению с таковым у контрольных экземпляров (Palacio et al., 2014).
Индуцированная защита. Искусственное повреждение тканей ствола (поранение либо инокуляция) индуцировало во флоэме, прилегающей к инокуляционному отверстию, различное изменение регистрируемых характеристик у контрольных и дефолиированных молью лиственниц. Так, контрольные деревья характеризовались накоплением ПА в зоне реакции флоэмы (рис. 1ж), а дефолиированные – лигнина (рис. 1е).
Активный синтез лигнина, отмеченный в зоне защитной реакции флоэмы на ее повреждение у дефолиированных лиственниц, вероятно, обеспечивается высоким содержанием крахмала, отмеченным в начале опыта у таких деревьев (рис. 1г, е). На сосне обыкновенной Pinus sylvestris L. с помощью 13С доказано, что резервные углеводы ствола используются в защитной реакции флоэмы, вызванной инокуляцией ствола офиостомовым грибом Ophiostomoa brunneo-ciliatum (Guérard et al., 2007, цит. по Goodsman et al., 2013). В опыте с инокуляцией сосны P. contorta Dougl. офиостомовым грибом Grosmannia clavigera резкое снижение содержания углеводов во флоэме наблюдалось в случае успешной защитной реакции, когда размер некроза был небольшим (Goodsman et al., 2013).
У дефолиированных деревьев масса флоэмы через 2 нед после ее повреждения снизилась почти в 2 раза по сравнению с массой неповрежденной флоэмы в начале опыта (рис. 1а, б). Такое резкое снижение массы, по-видимому, обусловлено ослаблением транспорта ассимилятов к месту искусственного повреждения ствола и восполнения ресурсов в зоне реакции у дефолиированных лиственниц. О нарушении нисходящего транспорта ассимилятов в стволе при термическом или химическом повреждении хвои свидетельствуют результаты нашего опыта с инокуляцией ствола 60-летних сосен экстрактивными веществами из C. laricicola (Полякова и др., 2014).
Накопление протекторных соединений (лигнина и ПА) было отмечено не только в вариантах с инокуляцией грибного индуктора, но и после поранения (рис. 1е, ж). Однако грибное воздействие существенно усилило синтез фенольных соединений, что было подтверждено дисперсионным анализом (р ≤ 0.005) (табл. 1).
С помощью анализа ANOVA показано, что параметры сверхчувствительного ответа флоэмы не зависели от того, помещен в инокуляционное отверстие живой мицелий или выделенный из него препарат (табл. 1). Это позволяет применять экстрактивные вещества из мицелия вместо живой культуры гриба для изучения механизмов защитного ответа лиственницы и повышает значимость модельных экспериментов с инокуляцией ствола различных видов хвойных деревьев экстрактивными веществами из мицелия офиостомовых грибов (Ветрова и др., 1995; Полякова и др., 2011, 2014).
Полученные результаты, доказывающие изменение физиологических параметров ствола при повреждении хвои чехликовой молью, объясняют высокую устойчивость таких лиственниц с поврежденной кроной к стволовым вредителям, так как дефолиированные деревья в отличие от контрольных характеризовались более высоким содержанием протекторных соединений ПА в интактной флоэме ствола и активным накоплением лигнина в зоне реакции флоэмы на ее искусственное повреждение. Также была подтверждена возможность использования экстрактивных веществ из мицелия офиостомового гриба для изучения механизмов иммунитета на взрослых деревьях без риска внесения инфекции в насаждение.
Авторы благодарят В.П. Ветрову (Камчатский филиал Тихоокеанского института географии ДО РАН) за помощь в организации полевого эксперимента и Ю.Н. Баранчикова (Институт леса им. В.Н. Сукачева СО РАН) за помощь при выборе лесного массива.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (грант 15-04-06575).
Список литературы
Ветрова В.П., Полякова Г.Г., Пашенова Н.В., Осипов В.И. Защитная реакция на инфекцию – индикатор устойчивости пихты сибирской к черному пихтовому усачу и связанным с ним микромицетам // Лесоведение. 1995. № 6. С. 34–42.
Ермолаев И.В., Ермолаева М.В. Оценка влияния лиственничной чехликовой моли на прирост и генеративную сферу лиственницы сибирской // Физиология растений. 2003. Т. 50. С. 224–230.
Исаев А.С., Гирс Г.И. Взаимодействие дерева и насекомых-ксилофагов. Новосибирск: Наука, 1975. 346 с.
Метлицкий Л.В., Озерецковская О.Л., Юрганова Л.А., Савельева О.Н., Чалова Л.И., Дьяков Ю.Т. Индукция фитоалексинов в клубнях картофеля метаболитами гриба Phytophtora infestans (Mont.) De Bary // Докл. АН СССР. 1976. Т. 226. № 5. С. 1217–1220.
Плешанов А.С. Насекомые-дефолианты лиственничных лесов Восточной Сибири. Новосибирск: Наука, 1982. 209 с.
Полякова Г.Г., Сенашова В.А. Влияние гриба Melampsorella caryophyllacearum на динамику углеводов и вторичных соединений пихты сибирской // Микология и фитопатология. 2017. Т. 51. Вып. 3. С. 168–177.
Полякова Г.Г., Стасова В.В., Пашенова Н.В. Защитная реакция флоэмы ствола сосны на поранение и действие экстракта из мицелия Ceratocystis laricicola // Физиология растений. 2011. Т. 58. С. 702–710.
Полякова Г.Г., Сенашова В.А., Поляков М.В., Пашенова Н.В. Иммунные характеристики пригородных сосняков Красноярска на ранней стадии антропогенного повреждения // Сиб. лес. журн. 2014. № 3. С. 117–128.
Смагин В.И., Ильинская Д.И., Назимова Д.И., Новосельцева И.Ф., Чередникова Ю.С. Типы лесов гор Южной Сибири. Новосибирск: Наука, 1980. 336 с.
Шеин И.В., Полякова Г.Г., Зражевская Г.К., Пашенова Н.В., Ветрова В.П. Накопление фенольных соединений каллусными культурами хвойных как реакция на грибы синевы древесины // Физиология растений. 2001. Т. 48. С. 251–256.
Benz G. Negative Ruckkopplung durh Raum und Nahrungskonkurrenz sowie zyklische Veranderung der Nahrungsgrundlage als Regelprinzip in der Populationsdynamikdes grauen Larchenwicklers Zeiraphera diniana Guence (Lep., Tortricidae) // Z. Ang. Entomol. 1974. Bd 76. S. 196–228.
Gibbs J.N. The biology of Ophiostomatoid fungi causing sapstain in trees and freshly cut logs // Ceratocystis and Ophiostoma / Eds Wingfild M.J., Seifert K.A., Webber J.F. 2nd ed. St. Paul, Minnesota, USA: APS Press, 1999. P. 153–160.
Goodsman D.W., Lusebrink I., Landhäusser S.M., Erbilgin N., Lieffers V.J. Variation in carbon availability, defense chemistry and susceptibility to fungal invasion along the stems of mature trees // New Phytolog. 2013. V. 197. Iss. 2. P. 586–594.
Guérard N., Maillard P., Brechet C., Lieutier F., Dreyer E. Do trees use reserve or newly assimilated carbon for their defense reactions? A 13C labeling approach with young Scots pines inoculated with a bark beetle-associated fungus (Ophiostomoa brunneo ciliatum) // Ann. Forest Sci. 2007. V. 64. P. 601–608.
Hammerbacher A., Schmidt A., Wadke N., Wright L.P., Schneider B., Bohlmann J., Brand W.A., Fenning T.M., Gershenzon J., Paet C.A Common Fungal Associate of the Spruce Bark Beetle Metabolizes the Stilbene Defenses of Norway Spruce // Plant Physiol. 2013. V. 162. № 3. P.1324–1336.
Lieutier F. Induced defence reaction of conifers to bark beetles and their associated Ophiostoma species // Ceratocystis and Ophiostoma / Eds Wingfild M.J., Seifert K.A., Webber J.F. 2nd ed. St. Paul, Minnesota, USA: APS Press, 1999. P. 225–234.
McDowell N., Pockman W.T., Allen C.D., Breshears D.D., Cobb N., Kolb T., Plaut J., Sperry J., West A., Williams D.G., Yepez E.A. Mechanisms of plant survival and mortality during drought: why do some plants survive while others succumb to drought? // New Phytolog. 2008. V. 178. P. 719–739.
Mueller-Dumbois D. Natural dieback in forests // Bioscience. 1987. V. 37. P. 575–583.
Paine T.D., Raffa K.F., Harrington T.C. Interactions among scolytid bark beetles, their associated fungi and live host conifers // Annu. Rev. Entomol. 1997. V. 42. P. 179–206.
Palacio S., Hoch G., Sala A., Körner C., Millard P. Does carbon storage limit tree growth? // New Phytologist. 2014. V. 201. Iss. 4. P. 1096–1100.
Rocha A.V. Tracking carbon within the tree // New Phytolog. 2013. V. 197. P. 685–686.
Stafford H.A., Lester H.H. Proanthocyanidins in needles from six genera of the Taxodiaceae // Am. J. Bot. 1986. V. 73. № 11. P. 1555–1563.
Venverloo C.J. A comparative study of the lignified structures in tissue cultures and the tissues of the tree // Acta Bot. Neerl. 1969. V. 18. № 2. P. 241–314.
Vidhyasekaran P. Fungal pathogenesis in plants and crops. Molecular biology and host defense Mechanisms. Boca Raton; London; New York: CRC Press, 2008. 522 p.
Vîlcan A., Tăut I., Holonec L., Mihalte L., Sestras R.E. The variability of different larch clone provenances on the response to the attack by its main pests and fungal diseases // Trees. 2013. Iss. 3. V. 27. P. 697–705.
VonSchrenk H. The ‘blueing’ and the ‘red rot’ of the western yellow pine, with special reference to the Black Hills forest reserve, USDA // Bur. Plant Ind. Bull. 1903. V. 36. 40 p.
Wiley E., Helliker B. A re-evaluation of carbon storage in trees lends greater support for carbon limitation to growth // New Phytolog. 2012. V. 195. P. 285–289.
Wright L.C., Berryman A.A., Gurusiddaiah S. Host resistance to the fir engraver beetle, Scolytus ventralis (Coleoptera: Scolytidae). 4. Effect of defoliation on wound monoterpene and inner bark carbohydrate concentrations // Can. Ent. 1979. V. 111. № 11. P. 1255–1262.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


