Известия РАН. Серия биологическая, 2020, № 2, стр. 205-212
Влияние тиреоидных гормонов на развитие асимметричного пигментного рисунка у костистых рыб: экспериментальные данные на примере Amatitlania nigrofasciata (Cichlidae) и Poecilia wingei (Poeciliidae)
Д. В. Праздников *
Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
* E-mail: pdvfish3409@rambler.ru
Поступила в редакцию 26.08.2019
После доработки 25.10.2019
Принята к публикации 25.10.2019
Аннотация
Отмечено, что тиреоидные гормоны (ТГ) – важнейшие регуляторы онтогенеза окраски костистых рыб. Экспериментально показано, что изменение гормонального статуса вследствие продолжительной обработки трийодтиронином (биологически активной формы ТГ) вызывает изменения в развитии взрослого пигментного рисунка у двусторонне-симметричных Amatitlania nigrofasciata и Poecilia wingei. Установлено, что индуцированный гипертиреоидизм у модельных рыб приводит к ускорению темпов онтогенеза окраски и росту частоты встречаемости асимметрии по различным меланистическим элементам рисунка.
Среди позвоночных животных наибольшим разнообразием пигментных рисунков и типов хроматофоров обладают костистые рыбы. У рыб к настоящему времени найдено восемь типов хроматофоров (меланофоры, иридофоры, ксантофоры, эритрофоры, лейкофоры, цианофоры, эритроиридофоры, цианоэритрофоры), отличающихся по химическому составу и светоотражающим способностям (Fujii, 1993; Schartl et al., 2015). Взрослый пигментный рисунок костистых рыб формируется в результате взаимодействия разных линий хроматофоров, клеток и тканей интегумента, нервной системы, а также эндокринной регуляции на различных этапах онтогенеза.
Тиреоидные гормоны (ТГ) – важнейшие регуляторы онтогенеза костистых рыб, влияющие на активность широкого круга тканей и процессов (Janz, 2000; Blanton, Specker, 2007). Биологически активная форма ТГ – трийодтиронин (Т3) – контролирует сложные каскады генов-мишеней посредством взаимодействия со специфическими ТГ-рецепторами (транскрипционными факторами, принадлежащими к суперсемейству ядерных рецепторов) и действует как прямой активатор экспрессии многих генов (Basset et al., 2003; Cheng et al., 2010; Grøntved et al., 2015). Т3 координирует онтогенез различных линий хроматофоров и регулирует уровень экспрессии генов, ответственных за формирование взрослого пигментного рисунка костистых рыб (McMenamin et al., 2014; Guillot et al., 2016; Saunders et al., 2019). Также ТГ участвуют во многих плейотропных процессах у рыб, в том числе метаморфных преобразованиях, развитии симметричных и асимметричных морфологических структур (McMenamin, Parichy, 2013; Campinho et al., 2018; Campinho, 2019).
Ранее было показано влияние Т3 на изменчивость пигментного рисунка у различных видов костистых рыб (Yoo et al., 2000; Clement et al., 2001; McMenamin et al., 2014; Prazdnikov, Shkil, 2019). Кроме этого у цихловых рыб (Cichlidae) было обнаружено, что изменение гормонального статуса приводит к изменению типа онтогенеза окраски и росту фенотипической изменчивости (Праздников, Шкиль, 2019; Prazdnikov, Shkil, 2019). Однако до настоящего времени практически неизученным остается влияние ТГ на развитие асимметричного пигментного рисунка у двусторонне-симметричных рыб.
Цель работы – оценить влияние ТГ на развитие асимметричного пигментного рисунка у двух филогенетически отдаленных видов модельных костистых рыб, выращиваемых в условиях гипертиреоидизма.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве модельных объектов использовали рыб Amatitlania nigrofasciata (Günther, 1867) (Perciformes, Cichlidae, Cichlasomatinae) и Poecilia wingei Poeser, Kempkes & Isbrücker, 2005 (Cyprinodontiformes, Poeciliidae, Poeciliinae). Выбор этих видов модельных рыб был обусловлен участием основных типов хроматофоров (меланофоров, ксантофоров, эритрофоров и иридофоров) в формировании окраски, разной степенью метаморфных преобразований рисунка (рис. 1, 2), а также высокой значимостью пигментного рисунка в жизнедеятельности и эволюции. Кроме того, вышеперечисленные виды удобны для экспериментальной работы, так как относительно просты в содержании, способны легко размножаться в неволе и являются короткоцикловыми видами рыб.
Рис. 1.
Развитие пигментного рисунка у Amatitlania nigrofasciata. а, б – стадия ранней личинки; в, г – стадия поздней личинки; д–ж – мальковая стадия; з – взрослая рыба. Цифры – номера вертикальных полос на туловище. Масштаб: 1 мм.

Рис. 2.
Развитие малькового (а–в) и взрослого (г) пигментного рисунка у самцов Poecilia wingei. Цифры – меланистические элементы рисунка. Масштаб: 1 мм.

В эксперименте с A. nigrofasciata была использована кладка оплодотворенной икры, полученная в результате естественного нереста пары рыб. С момента ранней личиночной стадии (рис. 1а) были разделены на две группы (по 80 особей в каждой), которые содержали до формирования дефинитивной окраски в двух гормональных режимах: контрольная группа (естественный гормональный статус) и гипертиреоидная группа (повышенный уровень ТГ). Для экспериментальной работы с P. wingei было взято потомство от самок, родивших в одни и те же сутки, и разделено случайным образом на две равные группы (по 74 особи), которые также содержали в двух гормональных режимах (естественный гормональный статус и гипертиреоидизм) до формирования взрослого пигментного рисунка. Изменение гормонального статуса было достигнуто традиционным методом (Brown, 1997; Prazdnikov, Shkil, 2019). Гипертиреоидизм у модельных рыб был индуцирован путем добавления в аквариумную воду активной формы ТГ – 3,5,3'-трийод-L-тиронина (T3) (Sigma-Aldrich, КНР) до концентрации 0.15 мкг/мл. Концентрация T3 была подобрана таким образом, чтобы спровоцировать изменения темпов и сроков развития пигментного рисунка, но не вызывать значимого повышения смертности и сильного физиологического стресса у рыб в экспериментальных группах. Другие условия эксперимента (температура, кормление, аэрация, плотность посадки рыб, световой режим, фон дна и боковых стенок, наличие растений и укрытий) были одинаковы для всех групп. Через день 1/3 объема воды в аквариумах заменяли водой с добавлением T3 в нужных концентрациях.
В экспериментальных группах рыб регистрировали время формирования дефинитивного пигментного рисунка: для A. nigrofasciata – сутки после оплодотворения (сут п. о.), а для P. wingei – сутки после рождения (сут п. р.), так как вид относится к яйцеживородящим рыбам. Взрослые рыбы были сфотографированы в аквариуме, оборудованном линейкой (деление 1 мм), фотокамерой Canon EOS100D (Япония). Снимок каждой особи делали с двух сторон. Стандартную длину (SL, мм) взрослых рыб определяли по фотографиям.
Основные элементы пигментного рисунка у модельных рыб преимущественно состоят из меланофоров, поэтому при анализе асимметрии пигментного рисунка учитывались только меланистические элементы с правой и левой сторон тела. Для анализа пигментного рисунка A. nigrofasciata была использована классификация меланистических элементов, предложенная для мезоамериканских цихлид (Říčan et al., 2005; Prazdnikov, Shkil, 2019), с выделением восьми посткраниальных вертикальных полос (рис. 1з). В связи с тем что у обоих полов был отмечен одинаковый меланистический рисунок, у самцов и самок учитывали изменения полос, разрывы и слияния с левой стороны тела относительно правой стороны. У P. wingei для анализа использовали только самцов, так как самки имеют простой сетчатый рисунок из меланофоров без дополнительных элементов. Согласно классификации элементов окраски самцов P. wingei (Kottler et al., 2013) выделяли четыре меланистических элемента (рис. 2г). В пигментном рисунке самцов учитывали изменения формы и положения меланофорных полос и пятен слева относительно правой стороны тела.
При оценке асимметрии использовали показатели, предложенные для анализа асимметрии животных (Захаров, 1987; Zakharov et al., 2001) с модификациями, учитывающими особенности анализируемых признаков у модельных объектов. Для оценки асимметрии пигментного рисунка в экспериментальных группах рыб рассчитывали частоту асимметричного проявления на особь (Ао), среднюю частоту асимметричного проявления на элемент рисунка (Ас) и относительную частоту встречаемости асимметричного элемента рисунка (Аот). Ао рассчитывали как отношение числа особей, имеющих асимметричный рисунок, к общему числу всех особей в группе. Ас рассчитывали по формуле Ас = (ΣEp)/n, где Ep – число асимметричных элементов рисунка у каждой особи, деленное на число использованных в анализе элементов пигментного рисунка, n – число особей в группе. Аот рассчитывали как отношение числа особей, асимметричных по данному элементу рисунка, к общему числу асимметричных особей в группе. При анализе асимметрии учитывали изменения в меланистических элементах пигментного рисунка с левой стороны относительно таковых с правой стороны тела.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Развитие пигментного рисунка у A. nigrofasciata – сложный процесс с отчетливыми онтогенетическими этапами, выраженными метаморфными преобразованиями личиночного типа пигментного рисунка во взрослый (рис. 1). Личиночный пигментный рисунок состоит из двух горизонтальных меланофорных полос (рис. 1б, в). Взрослый рисунок начинает развиваться во время личиночно-мальковых преобразований окраски, когда формируются участки вертикальных меланофорных полос (рис. 1г, д).
В контрольной группе A. nigrofasciata взрослый меланофорный рисунок с восемью вертикальными полосами на туловище окончательно сформировался к 100-м сут п.о. Из 79 изученных особей асимметричный рисунок был только у одной, одновременно по двум вертикальным полосам (рис. 3).
Рис. 3.
Асимметрия пигментного рисунка (а, б) в контрольной группе Amatitlania nigrofasciata. Цифры – номера меланистических элементов. Цифры в рамках – асимметричные элементы рисунка относительно правой стороны тела. Масштаб: 10 мм.

В гипертиреоидной группе A. nigrofasciata развитие меланистического пигментного рисунка было ускоренным по сравнению с таковым в контрольной группе. Так, развитие взрослых элементов рисунка – вертикальных полос – было завершено к 65-м сут п. о. У большинства гипертиреоидных рыб было пять полос на туловище в результате отсутствия либо слияния в рисунке полос 3а, 5, 6 (рис. 4). При этом гетерохронии привели к отклонениям в развитии плавниковых структур и росту частоты встречаемости асимметрии по меланистическим элементам пигментного рисунка (рис. 4, табл. 1). Наибольшая относительная частота встречаемости среди асимметричных элементов рисунка у полосы 3 (Аот = 0.61), которая была представлена в рисунке рыб различными вариантами разрывов и слияний с вертикальной полосой 2 (Аот = 0.42) (рис. 4а–е, о). Наименьшая относительная частота встречаемости асимметрии была отмечена по полосам 4 (Аот = 0.16) (рис. 4к) и 5 (Аот = 0.06) (рис. 4г, ф). Среди асимметричных гипертиреоидных A. nigrofasciata у 29% особей встречалась асимметрия одновременно по двум элементам рисунка (рис. 4а–г, 4ж–к, 4н–р).
Рис. 4.
Асимметрия пигментного рисунка (а–ю) в гипертиреоидной группе Amatitlania nigrofasciata. Цифры – номера меланистических элементов. Цифры в рамках – асимметричные элементы рисунка относительно правой стороны тела. Масштаб: 5 мм.
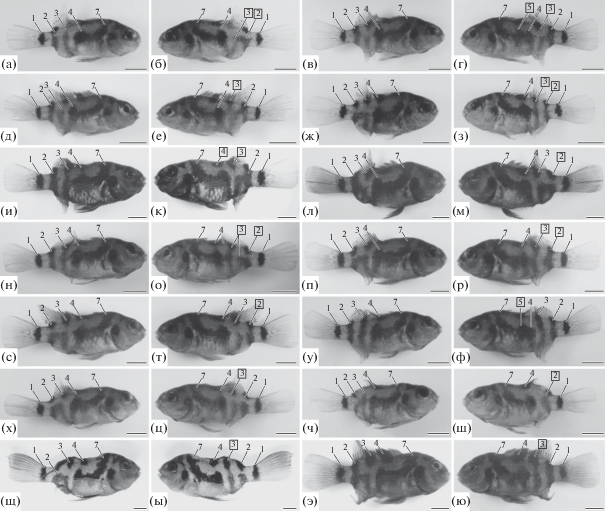
Таблица 1.
Частота встречаемости асимметрии пигментного рисунка в экспериментальных группах Amatitlania nigrofasciata и Poecilia wingei
| Вид | Контрольная группа | Гипертиреоидная группа | ||
|---|---|---|---|---|
| Ао | Ас | Ао | Ас | |
| A. nigrofasciata | 0.01 (n = 79) | – | 0.41 (n = 75) | 0.10 |
| P. wingei | 0.04 (n = 47) | 0.01 | 0.26 (n = 38) | 0.12 |
У P. wingei метаморфные преобразования пигментного рисунка менее выражены (рис. 2), чем у A. nigrofasciata. Личиночный рисунок у P. wingei состоит из меланофоров, образующих ромбическую сетчатую структуру на туловище (рис. 2а). У самок на протяжении всего онтогенеза сохраняется меланофорный сетчатый рисунок, в то время как у самцов на этот рисунок накладываются помимо элементов из ксантофоров дополнительные меланофорные элементы (рис. 2б–г): пятно-полоса (элемент 1), передняя (элемент 2) и задняя (элемент 3) дорсальные горизонтальные полосы, вентральная подкладка на хвостовом стебле (элемент 4).
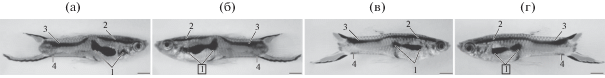
В контрольной группе P. wingei дефинитивный меланофорный рисунок на туловище самцов сформировался к 95-м сут п.р. Асимметрия наблюдалась только по одному элементу рисунка – пятну-полосе (рис. 5а–г).
Рис. 5.
Асимметрия пигментного рисунка (а–г) в контрольной группе Poecilia wingei. Цифры – номера меланистических элементов. Цифры в рамках – асимметричные элементы рисунка относительно правой стороны тела. Масштаб: 2 мм.
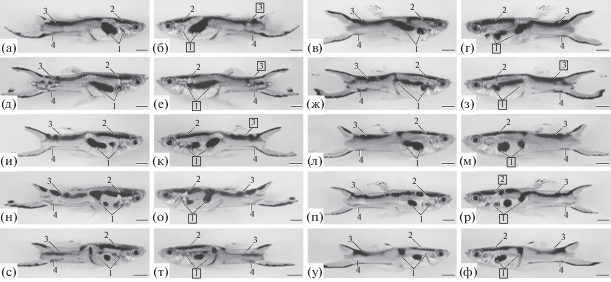
В гипертиреоидной группе P. wingei онтогенез пигментного рисунка был ускоренным по сравнению с таковым у самцов из контрольной группы, формирование меланистических элементов рисунка было завершено к 60-м сут п. р. При этом у гипертиреоидных самцов наблюдался рост фенотипической изменчивости и частоты встречаемости асимметрии по меланистическим элементам пигментного рисунка (рис. 6, табл. 1). Наибольшая относительная частота встречаемости асимметрии была у первого элемента рисунка (Аот = 1), который трансформировался в отдельную короткую полосу и пятно, либо пятна различных размеров и форм (рис. 6), в том числе глазоподобные пятна (рис. 6р, с). Наименьшая относительная частота асимметрии была у передней дорсальной полосы (Аот = 0.1), которая образовывала асимметричные разрывы с другими меланистическими элементами рисунка (рис. 6р). Среди асимметричных гипертиреоидных самцов у 40% была отмечена асимметрия одновременно по элементам 1 и 3 пигментного рисунка (рис. 6б, д–к).
Рис. 6.
Асимметрия пигментного рисунка (а–ф) в гипертиреоидной группе Poecilia wingei. Цифры – номера меланистических элементов. Цифры в рамках – асимметричные элементы рисунка относительно правой стороны тела. Масштаб: 2 мм.
У двух видов модельных рыб в состав всех анализируемых элементов окраски кроме подавляющей популяции меланофоров входил и другой тип пигментных клеток – иридофоры, которые располагались, как правило, под слоем меланофоров либо на периферии меланистических элементов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Экспериментальные данные свидетельствует о влиянии ТГ на развитие асимметричного пигментного рисунка у двух модельных видов рыб. У A. nigrofasciata и P. wingei, выращенных в условиях гипертиреоидизма, происходило ускорение темпов онтогенеза и увеличение частоты встречаемости асимметрии пигментного рисунка относительно таковой у рыб из контрольной группы.
Гетерохронии в развитии окраски у A. nigrofasciata привели к выраженным морфологическим последствиям и к росту фенотипической изменчивости. Уменьшение числа вертикальных полос в рисунке связано с гормонально индуцированными изменениями в сроках развития линий пигментных клеток, которые, в свою очередь, вызвали изменения в типе онтогенеза окраски, как было показано ранее на этом же виде цихловых рыб (Prazdnikov, Shkil, 2019). Среди гипертиреоидных A. nigrofasciata наибольшая относительная частота встречаемости среди асимметричных элементов наблюдалась у полос 3 и 2, которые образовывали в пигментном рисунке различные вариации слияний и/или разрывов как с правой, так и с левой стороны тела. Асимметрия этих двух полос, вероятно, обусловлена более поздним формированием во время личиночно-мальковых преобразований окраски по сравнению с другими вертикальными полосами и большей “чувствительностью” к повышенному уровню ТГ.
У гипертиреоидных самцов P. wingei, как и у A. nigrofasciata, наблюдался рост фенотипической изменчивости. Среди четырех меланистических элементов рисунка на туловище наибольшая изменчивость была у элемента 1 – пятно-полоса. По этому элементу наблюдалась асимметрия у всех гипертиреоидных самцов, имеющих асимметричные пигментные рисунки.
Мы предполагаем, что высокая частота асимметрии по меланистическим элементам взрослого пигментного рисунка у двух видов гипертиреоидных рыб связана с разным уровнем экспрессии генов, участвующих в меланосомальных путях развития, в коже с правой и левой сторон тела, так как ТГ могут регулировать локальные события на тканевом/клеточном уровне. Известно, что у различных видов камбаловых рыб асимметричная окраска развивается во время метаморфных преобразований, контролируемых ТГ, когда двусторонне-симметричная личинка превращается во взрослую особь с асимметричной морфологией. При этом, несмотря на то что непигментированные предшественники меланофоров располагаются с двух сторон тела, взрослая линия меланофоров дифференцируется только на верхней стороне, тем самым обусловливая асимметричную пигментацию (Watanabe et al., 2008; Yamada et al., 2010; Darias et al., 2013; Washio et al., 2013). Изменение уровня ТГ во время онтогенеза костистых рыб влияет на сроки появления, морфогенетическое поведение различных линий хроматофоров, в том числе на общее число клеток и каскад взаимодействий, что в итоге приводит к резким изменениям во взрослом пигментном рисунке (McMenamin et al., 2014; Parichy, Spiewak, 2015; Prazdnikov, Shkil, 2019; Saunders et al., 2019). Индуцированный гипертиреоидизм у экспериментальных рыб, вероятно, повлиял на двустороннюю миграцию, дифференцировку, а также взаимодействие популяций меланофоров и иридофоров, что привело к развитию асимметричных пигментных рисунков, в том числе с переходным состоянием меланистических элементов.
Ранее асимметрия по меланистическим элементам окраски – пятнам и полосам – была отмечена у других видов из семейства Poeciliidae (Sheridan, Pomiankowski, 1997; Morris et al., 2005). Предполагается, что асимметрия по пигментному рисунку у самцов в популяции поддерживается в результате полового отбора (Gross et al., 2007; Morris et al., 2012). У гипертиреоидных самцов P. wingei встречается асимметрия не только по меланистическим элементам, но и по оранжевым элементам рисунка, образованным ксантофорами (неопубликованные данные автора), поэтому, вероятно, такие самцы могут иметь преимущество во время брачного ухаживания за счет увеличения своей потенциальной привлекательности при демонстрации окраски перед самками. Предыдущие исследования на Andinoacara rivulatus (Cichlidae) показали, что гипертиреоидизм влияет, в частности, и на развитие вторичных половых признаков и нерестовое поведение (Праздников, 2018; Праздников, Шкиль, 2019). Все эти данные свидетельствуют в пользу того, что ТГ способны регулировать многие онтогенетические процессы у костистых рыб, в том числе координировать работу других гормональных систем. Однако выдвинутые выше предположения требуют дополнительных исследований.
ЗАКЛЮЧЕНИЕ
Развитие взрослого пигментного рисунка у A. nigrofasciata и P. wingei координируется ТГ. Изменение гормонального статуса, вызванное продолжительной обработкой Т3, приводит к ускорению онтогенеза окраски и росту частоты асимметрии по меланистическим элементам взрослого пигментного рисунка. Схожесть реакций на изменения уровня ТГ у двух филогенетически отдаленных видов модельных рыб с разными степенями метаморфных преобразований окраски указывает на общность механизмов регуляции развития пигментного рисунка у двусторонне-симметричных рыб. Полученные результаты свидетельствуют в пользу участия ТГ в координации двусторонней миграции хроматофоров, а также открывают новые перспективы для экспериментальных исследований роли тиреоидного сигнального пути в онтогенезе окраски и поведении костистых рыб.
Исследование выполнено при финансовой поддержке РФФИ (грант 18-34-00685).
Список литературы
Захаров В.М. Асимметрия животных. М.: Наука, 1987. 216 с.
Праздников Д.В. Влияние трийодтиронина на размножение и развитие бирюзовой акары Andinoacara rivulatus (Cichlidae) // Вопр. ихтиологии. 2018. Т. 58. № 6. С. 757–762.
Праздников Д.В., Шкиль Ф.Н. Роль гетерохроний в эволюции пигментного рисунка американских цихлид (Teleostei: Cichlidae: Cichlasomatinae): экспериментальный подход // Изв. РАН. Сер. биол. 2019. № 1. С. 62–71.
Bassett J.D., Harvey C.B., Williams G.R. Mechanisms of thyroid hormone receptor-specific nuclear and extra nuclear actions // Mol. Cell. Endocrinol. 2003. V. 213. P. 1–11.
Blanton M.L., Specker J.L. The hypothalamic-pituitary-thyroid (HPT) axis in fish and its role in fish development and reproduction // Crit. Rev. Toxicol. 2007. V. 37. P. 97–115.
Brown D.D. The role of thyroid hormone in zebrafish and axolotl development // Proc. Nat. Acad. Sci. 1997. V. 9. P. 13011–13016.
Campinho M.A. Teleost metamorphosis: the role of thyroid hormone // Frontiers in Endocrinol. 2019. V. 10. P. 383.
Campinho M.A., Silva N., Martins G.G., Anjos L., Florindo C., Roman-Padilla J., Garcia-Cegarra A., Louro B., Manchado M., Power D.M. A thyroid hormone regulated asymmetric responsive centre is correlated with eye migration during flatfish metamorphosis // Sci. Rep. 2018. V. 8. P. 12267.
Cheng S.Y., Leonard J.L., Davis P.J. Molecular aspects of thyroid hormone actions // Endocrine Rev. 2010. V. 31. P. 139–170.
Clement S.E., Lichtenbert J.H., Kohler C.C. Stripping clowns: induced meristic changes in common clownfish (Amphiprion ocellaris) // Bull. Inst. Oceanograph. Monaco. 2001. V. 20. P. 283–288.
Darias M.J., Andree K.B., Boglino A., Fernández I., Estévez A., Gisbert E. Coordinated regulation of chromatophore differentiation and melanogenesis during the ontogeny of skin pigmentation of Solea senegalensis (Kaup, 1858) // PloS One. 2013. V. 8. e63005.
Fujii R. Cytophysiology of fish chromatophores // Int. Rev. Cytol. 1993. V. 143. P. 191–255.
Janz D.M. Endocrine system // The laboratory fish / Ed. Ostrander G.K. London: Acad. Press, 2000. P. 189–217.
Grøntved L., Waterfall J.J., Kim D.W., Baek S., Sung M.H., Zhao L., Park J.W., Nielsen R., Walker R.L., Zhu Y.J., Meltzer P.S., Hager G.L., Cheng S. Transcriptional activation by the thyroid hormone receptor through ligand-dependent receptor recruitment and chromatin remodeling // Nat. Comm. 2015. V. 6. P. 7048.
Gross M.R., Suk H.Y., Robertson C.T. Courtship and genetic quality: asymmetric males show their best side // Proc. Roy. Soc. B: Biol. Sci. 2007. V. 274. P. 2115–2122.
Guillot R., Muriach B., Rocha A., Rotllant J., Kelsh R.N., Cerdá-Reverter J.M. Thyroid hormones regulate zebrafish melanogenesis in a gender-specific manner // PloS One. 2016. V. 11. e0166152.
Kottler V.A., Fadeev A., Weigel D., Dreyer C. Pigment pattern formation in the guppy, Poecilia reticulata, involves the Kita and Csf1ra receptor tyrosine kinases // Genetics. 2013. V. 194. P. 631–646.
McMenamin S.K., Parichy D.M. Metamorphosis in teleosts // Curr. Top. Dev. Biol. 2013. V. 103. P. 127–165.
McMenamin S.K., Bain E.J., McCann A.E., Patterson L.B., Eom D.S., Waller Z.P., Hamill J.C., Kuhlman J.A., Eisen J.S., Parichy D.M. Thyroid hormone-dependent adult pigment cell lineage and pattern in zebrafish // Science. 2014. V. 345. P. 1358–1361.
Morris M.R., Rios-Cardenas O., Scarlett Tudor M. Larger swordtail females prefer asymmetrical males // Biol. Lett. 2005. V. 2. P. 8–11.
Morris M.R., Rios-Cardenas O., Lyons S.M., Scarlett Tudor M., Bono L.M. Fluctuating asymmetry indicates the optimization of growth rate over developmental stability // Functional Ecol. 2012. V. 26. P. 723–731.
Parichy D.M., Spiewak J.E. Origins of adult pigmentation: diversity in pigment stem cell lineages and implications for pattern evolution // Pigment Cell Melanoma Res. 2015. V. 28. P. 31–50.
Prazdnikov D.V., Shkil F.N. Experimental evidence of the role of heterochrony in evolution of the Mesoamerican cichlids pigment patterns // Evol. Develop. 2019. V. 21. P. 3–15.
Říčan O., Musilová Z., Muška M., Novák J. Development of coloration patterns in Neotropical cichlids (Teleostei: Cichlidae: Cichlosomatinae). Brno: Folia Zoologica, 2005. 46 p.
Saunders L.M., Mishra A.K., Aman A.J., Lewis V.M., Toomey M.B., Packer J.S., Qiu X., McFaline-Figueroa J.L., Corbo J.C., Trapnell C., Parichy D.M. Thyroid hormone regulates distinct paths to maturation in pigment cell lineages // Elife. 2019. V. 8. P. 1–29.
Schartl M., Larue L., Goda M., Bosenberg M.W., Hashimoto H., Kelsh R.N. What is a vertebrate pigment cell? // Pigment Cell Melanoma Res. 2016. V. 29. P. 8–14.
Sheridan L., Pomiankowski A. Fluctuating asymmetry, spot asymmetry and inbreeding depression in the sexual coloration of male guppy fish // Heredity. 1997. V. 79. P. 515–523.
Washio Y., Aritaki M., Fujinami Y., Shimizu D., Yokoi H., Suzuki T. Ocular-side lateralization of adult-type chromatophore precursors: development of pigment asymmetry in metamorphosing flounder larvae // J. Experim. Zool. P. B: Mol. Develop. Evol. 2013. V. 320. P. 151–165.
Watanabe K., Washio Y., Fujinami Y., Aritaki M., Uji S., Suzuki T. Adult-type pigment cells, which color the ocular sides of flounders at metamorphosis, localize as precursor cells at the proximal parts of the dorsal and anal fins in early larvae // Develop. Growth Different. 2008. V. 50. P. 731–741.
Yamada T., Okauchi M., Araki K. Origin of adult-type pigment cells forming the asymmetric pigment pattern, in Japanese flounder (Paralichthys olivaceus) // Develop. Dyn. 2010. V. 239. P. 3147–3162.
Yoo J.H., Takeuchi T., Tagawa M., Seikai T. Effect of thyroid hormones on the stage-specific pigmentation of the Japanese flounder Paralichthys olivaceus // Zool. Sci. 2000. V. 17. P. 1101–1106.
Zakharov V.M., Zhdanova N.P., Kirik E.F., Shkil F.N. Ontogenesis and population: evaluation of developmental stability in natural populations // Russ. J. Develop. Biol. 2001. V. 32. P. 336–351.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


