Известия РАН. Серия биологическая, 2020, № 3, стр. 318-324
Разложение корней луговых и лесных растений в зольном субстрате отвалов электростанций: лабораторный эксперимент
А. А. Бетехтина 1, *, О. А. Некрасова 1, М. И. Дергачева 2, Т. А. Радченко 1, В. Н. Большаков 3
1 Уральский федеральный университет имени первого Президента России Б.Н. Ельцина
620083 Екатеринбург, просп. Мира, 19, Россия
2 Институт почвоведения и агрохимии СО РАН
630090 Новосибирск, просп. Лаврентьева, 8/2, Россия
3 Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
* E-mail: betechtina@mail.ru
Поступила в редакцию 17.07.2019
После доработки 30.07.2019
Принята к публикации 01.08.2019
Аннотация
Отмечено, что корни растений вносят существенный вклад в формирование техноземов при самозарастании техногенного субстрата. В лабораторном 150-суточном эксперименте изучены скорости разложения смеси тонких корней (диаметром <0.5 мм) луговых арбускулярно-микоризных (АМ) видов и смеси корней лесных экто- и микоризных видов в золе золоотвала электростанции. Выявлены различия скоростей разложения смесей корней, а также содержания углерода и азота до и после разложения в разных вариантах опыта, заключающиеся в больших потерях биомассы, углерода и азота у АМ-видов.
Тепловые электростанции, работающие на твердом топливе, обусловливают появление больших площадей золоотвалов. Последние сложены золой углей, которая характеризуется неблагоприятными водными, тепловыми и питательными условиями, прежде всего полным отсутствием азота (N) (Пасынкова, 1974). Одни золоотвалы рекультивируются, другие зарастают самостоятельно. В последнем случае главную роль в возникновении образующихся техноземов играют растительный опад и формирующееся после его разложения органическое вещество (ОВ) почвы (Махонина, 2003). В последние десятилетия показано, что на особенности накопления ОВ в почве влияет тип микориз (Averill et al., 2014), что во многом определяет цикл углерода (С) в наземных экосистемах (McClaugherty et al., 1984; Gill, Jackson, 2000; Silver, Miya, 2001).
Исследование сообществ с доминированием эктомикоризных (ЭМ) и арбускулярно-микоризных (АМ) растений показало, что ЭM-грибы, характерные для лесных сообществ, способствуют накоплению C в полуразложившейся подстилке, тогда как AM-грибы, преобладающие в травянистых сообществах, способствуют быстрому круговороту C и образованию плодородных, богатых гумусом почв (Averill et al., 2014; Soudzilovskaia et al., 2015). Ранее (Дергачева и др., 2012) было отмечено, что С/N в гуминовых кислотах варьирует от 17–24 в лесных почвах с преобладанием ЭМ‑ассоциированных растений до 12–17 в степных почвах с доминированием АМ-видов.
Различия в круговороте С в экосистемах с преобладанием AM- и ЭM-растений традиционно объясняют следующим:
ЭM-грибы (в отличие от АМ-грибов) имеют специфические ферменты, позволяющие им получать N из органических источников. Поэтому предполагается, что его поглощение ЭМ-растениями замедляет скорость разложения растительного опада и увеличивает накопление С (Averill et al., 2014; Макаров, 2019);
в экосистемах, где преобладают AM-растения, наблюдается более высокая валовая и чистая первичная продукция растений, что в конечном итоге приводит к увеличению производства опада (Read, 1991; Averill et al., 2014);
ЭМ-растения выделяют больше С грибным партнерам, чем АМ-растения (Jones et al., 1998; Orwin et al., 2011);
опад ЭM-растений разлагается вдвое медленнее, чем опад AM-растений (Cornelissen et al., 2001; Phillips et al., 2013). Последнее утверждение чаще относится к наземному опаду. Однако показано, что корни растений вносят более существенный вклад в формирование ОВ почвы, чем наземные части растений (Balesdent, Balabane, 1996; Ghafoor et al., 2017). Скорость разложения корневого опада и пути высвобождения питательных веществ контролируются разнообразными факторами, в том числе морфологическими, физиологическими, симбиотическими и химическими характеристиками корней (Poirier et al., 2018). Разложение корней коррелирует положительно с содержанием N, Ca, P, гемицеллюлозы и водорастворимых соединений и отрицательно с содержанием C, целлюлозы и лигнина, а также с соотношениями C/N, лигнин/N и лигнин/P (Silver, Miya, 2001; Roumet et al., 2016).
Тип микоризы – ведущий фактор, влияющий на скорость разложения корней: ЭM-корни более устойчивы к разложению, чем AM-корни, предположительно за счет плотного и многослойного грибного чехла и относительно высокого содержания гидрофобных белков в гифах (Fernandez et al., 2016; Beidler, Pritchard, 2017). В литературе есть сведения о разложении в почве корней деревьев с разным типом микориз и без микориз (Langley, Hungate, 2003; Langley et al., 2006). Однако необходимо иметь в виду, что корни разных видов растут и разлагаются совместно, а единичные сведения о поведении смеси корней растений сообщества в процессе разложения свидетельствуют о том, что скорость деструкции смеси корней в почве не может быть спрогнозирована на основе скорости разложения компонентов по отдельности (Robinson et al., 1999; Prieto et al., 2017). Интерпретация результатов изучения процесса разложения корней в сложных объектах, таких как почва, затруднена из-за взаимодействия большого комплекса факторов, влияющих на этот процесс. Использование техногенных субстратов, например золы электростанций, значительно упрощает анализ результатов изучения влияния типа микориз на процессы деструкции и химического изменения корней сообщества. В литературе нет сведений о СN-составе смеси корней ни луговых, ни лесных сообществ золоотвалов, а также о скорости их разложения в зольном субстрате и направленности изменения содержания С и N в процессе деструкции.
Цель работы – анализ особенностей разложения корней с разным типом микориз в зольном субстрате в процессе 150-суточного лабораторного эксперимента для смеси корней растений как луговых, так и лесных сообществ.
МАТЕРИАЛЫ И МЕТОДЫ
Субстрат и образцы корней отбирались с нерекультивированных участков золоотвала Верхнетагильской государственной электростанции (ВТГЭС) (57°20′ с.ш., 59°56′ в.д.) в окрестностях г. Верхний Тагил (Средний Урал, Россия), приуроченного к зоне с умеренно-континентальным бореальным климатом.
Физико-химические характеристики зольного субстрата, определенные общепринятыми методами (Воробьева, 1998), позволили обнаружить преобладание в гранулометрическом составе золы физического песка. Доля физической глины составляет 7–11%, что в соответствии с почвенной классификацией (Качинский, 1965) позволяет отнести субстрат к пескам связанным или супесям. Преобладание частиц диаметром >0.01 мм и низкая объемная масса (0.72–0.97 г/см3) обусловливают рыхлость зольного субстрата и наличие дефляции с поверхности золоотвала. Самозарастающие отвалы золы имеют щелочную реакцию среды (рНводный ~ 8.3), содержат в среднем 2.3% общего органического углерода (Собщ), отличаются низким содержанием подвижного калия (4–9 мг/100 г почвы) и повышенным содержанием фосфора (16–24 мг/100 г), а также преобладанием в составе обменных катионов Са2+ (2–8 мг-экв/100 г) по сравнению с Mg2+ (0.6–0.9 мг-экв/100 г) (Бетехтина и др., 2019).
В результате самозарастания на золоотвале ВТГЭС за последние 50 лет сформировались как луговые, так и лесные сообщества. В луговом разнотравно-злаковом сообществе преобладают такие виды злаков, как Calamagrostis epigeios (L.) Roth (обилие по шкале Друде – сор1, класс постоянства IX), Poa pratensis L. (сор1, X), а также присутствуют следующие виды разнотравья: Pimpinella saxifraga L. (сор1–сор2, X), Silene nutans L. (сор1–сор2, VI), Achillea millefolium L. (sp gr, V), Plantago media L. (sp gr, IV), Erigeron acris L. (sp gr, IV) и др. На изученных участках с лесной растительностью (смешанным лесом с преобладанием мелколиственных деревьев Betula pendula Roth. и Populus tremula L.) единично встречается Pinus sylvestris L., а в напочвенном покрове – Pyrola rotundifolia L.
Для изучения особенностей корней с разными типами микориз были заложены три участка по 300 м2 в каждом из сообществ (в общей сложности шесть участков). У доминирующих на этих участках растений были отобраны корневые мочки с корнями последнего порядка из верхней 10-сантиметровой части субстрата по 4–6 проб на вид на каждом участке (в общей сложности 53 пробы). В одной части тонких корней диаметром <0.5 мм после фиксации в 70%-ном растворе спирта анализировались микоризы. Другая часть после высушивания при 60°C использовалась для проведения эксперимента и определения содержания у каждого вида С и N в корнях с помощью CHNS-анализатора. При отборе корней мы руководствовались современной классификацией (McCormack et al., 2015), по которой к тонким корням относят все поглощающие корни первичного строения (в нашем случае диаметром <0.5 мм). Такие корни можно считать функционально однородными и сопоставимыми между собой. При расчете содержания элементов в составе смеси корней доминантных видов растений каждого из сообществ в инкубационном эксперименте использовались их средневзвешенные значения для отдельных видов с учетом обилия вида в конкретном фитоценозе.
Развитие микоризы оценивалось количественно по общепринятым методикам: для АМ-видов учитывалось обилие мицелия, арбускул и везикул, для ЭМ-видов – доля микоризированных и деградированных корневых окончаний в общем числе изученных поглощающих корней (Селиванов, 1981).
Для эксперимента отбирали тонкие корни диаметром <0.5 мм с учетом обилия вида в конкретном фитоценозе. Для первого варианта опыта (ЭМ) была составлена смесь из тонких корней двух ЭМ-видов B. pendula (0.12 г сухого веса), P. tremula (0.12 г) и P. rotundifolia (0.01 г); для второго АМ-варианта опыта – смесь тонких корней АМ-видов P. pratensis (0.14 г), E. acris (0.01 г), S. nutans (0.05 г), P. media (0.03 г), P. saxifraga (0.02 г). Предварительно высушенные при 60°C смеси корней инкубировали в течение 150 сут в лабораторных условиях в нейлоновых мешочках. Каждый мешочек содержал 0.25 г корней и закладывался в отдельный пластиковый стакан, заполненный 40 г подготовленной для эксперимента золой отвала ВТГЭС (повторность пятикратная). Зола отбиралась с глубины 50–60 см и перед началом эксперимента прокаливалась при 850°C в течение 5 ч, чтобы полностью исключить влияние предшествующей истории функционирования золоотвала. Перед началом эксперимента в ней было зафиксировано присутствие следовых количеств С и полное отсутствие N. В процессе эксперимента поддерживалась влажность на уровне 60% полной влагоемкости субстрата дистиллированной водой при 20–23°С. Неразложившиеся корни после 150-суточного эксперимента высушивали при 60°С, затем взвешивали, определяли долю неразложившейся массы корней и анализировали содержание в них С и N. Статистический анализ проводили с использованием однофакторного дисперсионного анализа (ANOVA). Учетная единица для статистического анализа – один сосуд с одним мешочком корневой смеси.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Микроскопический анализ показал, что все выбранные травянистые виды в условиях самозарастающего золоотвала формируют микоризы, в том числе S. nutans, который ранее считался немикоризным (Wang, Qiu, 2006). Развитие микоризы варьировало от 6.6% у S. nutans до 98.9% у E. acris (табл. 1). Анализ также показал, что у древесных ЭМ-видов B. pendula и P. tremula на зольном субстрате треть корней имеет дегенеративные изменения. Большая часть (72–87%) недеградированных корней заселена грибом и имеет чехлы различного строения. У P. rotundifolia в этом местообитании ранее была зафиксирована микориза с единичными рыхлыми чехлами, а в отдельных коровых клетках – клубки мицелия и продукты переваривания гриба, фрагменты сети Гартига (Глазырина и др., 2012).
Таблица 1.
Элементный состав и микоризация корней видов с эктомикоризой (ЭМ) и арбускулярной микоризой (АМ)
| Вид | Интенсивность микоризации, % | C, % | N, % | C/N |
|---|---|---|---|---|
| ЭМ-виды | ||||
| Betula pendula | 86.6 ± 3.9 | 45.56 ± 0.99 | 1.41 ± 0.06 | 33.49 ± 2.45 |
| Populus tremula | 71.8 ± 11.5 | 44.73 ± 1.38 | 1.21 ± 0.05 | 37.30 ± 2.42 |
| Pyrola rotundifolia | Низкая* | 42.42 ± 0.63 | 1.28 ± 0.07 | 34.43 ± 2.24 |
| АМ-виды | ||||
| Erigeron acris | 98.9 ± 0.6 | 41.46 ± 0.47 | 1.51 ± 0.07 | 27.67 ± 1.02 |
| Pimpinella saxifraga | 60.9 ± 11.4 | 40.76 ± 0.56 | 1.50 ± 0.06 | 27.58 ± 1.08 |
| Plantago media | 88.6 ± 3.5 | 42.99 ± 0.35 | 1.32 ± 0.04 | 32.90 ± 0.89 |
| Poa pratensis | 63.4 ± 8.6 | 43.60 ± 0.65 | 1.00 ± 0.07 | 42.50 ± 1.80 |
| Silene nutans | 6.6 ± 1.1 | 41.05 ± 0.42 | 1.11 ± 0.06 | 37.83 ± 1.42 |
Концентрация С в корнях ЭМ-видов составила от 42% у P. rotundifolia до 46% у B. pendula, содержание N варьировало от 1.2% у P. tremula до 1.4% у B. pendula, поэтому С/N было закономерно выше в корнях P. tremula и одинаково в корнях B. pendula и P. rotundifolia (табл. 1). Травянистые растения не различались по содержанию С в корнях (F3, 6 = 3.38, Р = 0.076, где F – критерий Фишера с указанными числами степеней свободы для фактора и для ошибки, P – значимость различий). Наибольшие значения этого показателя были отмечены у P. media и P. pratensis, наименьшие – у E. acris, P. saxifraga и S. nutans. Были отмечены различные значения содержания N в корнях (F3, 6 = 4.55, Р = 0.04): наибольшие – у E. acris, P. saxifraga и P. media, наименьшие – у P. pratensis и S. nutans. Низкое содержание N у P. pratensis и S. nutans стало причиной высоких значений С/N по сравнению с таковыми у остальных изученных травянистых растений (табл. 1).
Анализ содержания C, N и отношения С/N у групп видов с разными типами микориз не показал значимых различий (F1, 6 = 5.00, Р = 0.116; F1, 6 = 0.01, Р = 0.947; F1, 6 = 0.11, Р = 0.752) между ними.
Химический состав смеси корней АМ и ЭМ рассчитывали по доле биомассы корней в составе смеси и средним значениям содержания С, N и С/N для каждого вида. В смеси корней АМ-видов доминировал мятлик, для которого были характерны сравнительно высокое содержание С и низкое содержание N в корнях, поэтому исходно смесь АМ-видов содержала в среднем меньше N (1.16%) и С (42.64%), чем смесь корней ЭМ (N, 1.33% и С, 44.86%), в которой в равной доле были представлены корни осины и березы с относительно высоким содержанием С и существенным варьированием содержания N. Отношение С и N было закономерно выше в варианте АМ (С/N = 36.8) по сравнению с ЭМ (С/N = 33.7) (табл. 2).
Таблица 2.
Биомасса, содержание азота и углерода в смеси тонких корней ЭМ- и АМ-видов до и после 150-суточной инкубации
| Варианты опыта | Биомасса, г | N, % | C, % | С/N | ||||
|---|---|---|---|---|---|---|---|---|
| исходная | после инкубации* | исходное | после инкубации | исходное | после инкубации | исходное | после инкубации | |
| ЭМ | 0.25 | 0.21(0.00) | 1.33 | 1.47(0.02) | 44.86 | 41.55(1.42) | 33.7 | 28.3(0.69) |
| АМ | 0.25 | 0.17(0.00) | 1.16 | 1.04(0.04) | 42.64 | 42.36(0.58) | 36.8 | 41.0(1.60) |
| Р | 0.000 | 0.000 | 0.616 | 0.000 | ||||
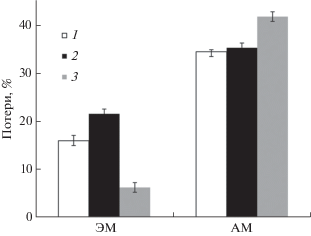
В ЭМ-варианте при 150-суточной инкубации корни разлагались медленнее и потеряли 15.9% первоначальной массы в отличие от АМ-варианта, где потери составили 34.4% (рис. 1). При этом потери C смеси АМ-корней составили 35.2 против 21.5% в другом варианте, а потери N – 41.7 и 6.2% соответственно. В результате в смеси корней в варианте ЭМ, которые первоначально характеризовались более высоким содержанием N, произошло относительное увеличение его содержания на 10%, в то время как в AМ-корнях – относительное его снижение на 10% первоначального количества.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Как показали представленные выше результаты, среди АМ-видов высокое содержание С и низкое содержание N были характерны для P. pratensis. Корни двудольных растений отличались более высоким содержанием N и более низким содержанием С (за исключением S. nutans, которая характеризовалась низким содержанием N). Похожие закономерности содержания С и N показаны в тонких корнях травянистых альпийских растений северо-западной части Кавказа (Салпагарова и др., 2013). У ЭМ-видов содержание С и N и С/N в тонких корнях варьировали в меньшей степени. Растения разных типов сообществ достоверно не отличались по содержанию С, N и С/N, однако средневзвешенный элементный состав смеси корней луговых растений характеризовался более низким содержанием С и N и высоким значением С/N из-за доминирования в ее составе корней мятлика лугового.
Несмотря на более высокое содержание N, смесь корней в зольном субстрате варианта ЭМ разлагалась значительно медленнее, чем в варианте АМ, что не согласуется с опубликованными ранее данными о том, что тонкие корни растений с высоким содержанием N и низким значением C/N в лабораторных и природных условиях разлагаются быстрее (Melillo et al., 1982; Roumet et al., 2016). Низкая скорость разложения корней наряду с относительно высоким содержанием N была отмечена только у P. sylvestris при сравнении у нее эктомикоризных и немикоризных корней (Langley et al., 2006). Тесных связей между содержанием С и N, а также отношением С/N смеси корней и потерей биомассы при инкубации в зольном субстрате выявлено не было.
Таким образом, основные различия между смесями корней состояли не в исходном содержании в них элементов, а в потерях биомассы и разных путях изменения содержания С, N и отношения С/N в процессе разложения: в случае со смесью ЭМ-растений потеря биомассы составила ∼16%, углерода ∼22%, а доля N в массе неразложившихся растений с этим типом микоризы возросла, тогда как в варианте со смесью АМ-растений потеря биомассы и С была более чем в 2 раза выше, a потеря N составила 10% первоначального его содержания в смеси корней. При анализе неопубликованных данных, полученных нами при исследовании подстилки лесных участков и ветоши трав луговых участков, обнаружилась близкая закономерность содержания N: подстилка лесных участков отличалась в среднем бóльшим содержанием N (1.77%), чем ветошь луговых сообществ (1.18%), при сопоставимом содержании С (37.90 и 36.60% соответственно). Следовательно, луговые сообщества отличаются от лесных по N-составу не только полуразложившегося корневого, но и листового опада. Относительное обогащение N при разложении опада ЭМ-растений направлено на поддержание высокого содержания N в устойчивых к разложению органических соединениях. Поскольку основной источник N у ЭМ-растений – ОВ опада, накопление N в корневом опаде может иметь большое значение для азотного питания древесных растений в следующий вегетационный период.
По некоторым данным содержание С и N может иметь значение для оценки процесса разложения корней растений только в случае сравнения разных видов одной жизненной формы (Mao et al., 2011). Мы изучали скорость разложения смеси корней трав путем сравнения со скоростью разложения смеси корней древесных растений, причем химический состав тканей и грибов корней трав АМ и ЭМ древесных растений принципиально различался. Корни с ЭМ имеют более высокую долю грибных структур (20–40%), чем AM-корни, в которых эта доля составляет лишь 3–17% (Langley, Hungate, 2003). Основной структурный полимер грибов – хитин, который богат N (его масса 7%), но при этом устойчив к разложению (Swift et al., 1979). В ЭM-грибах присутствуют гидрофобные белки, которые покрывают наружные стенки гиф, делают их несмачиваемыми, что замедляет их ферментативное разложение (Fernandez et al., 2016). Кроме того, ЭM-корни могут быть более устойчивы к разложению из-за плотной структуры грибного чехла (Beidler, Pritchard, 2017). Действительно, изученная в эксперименте смесь ЭМ-корней характеризовалась не только слабыми потерями С, но и существенно более низкими потерями N. Последнее может косвенно указывать на устойчивость к разложению гифов ЭМ-грибов.
В современной литературе практически отсутствуют данные о скорости разложения смеси корней в техногенных субстратах, обедненных N, таких как зола, а также точные количественные данные о потерях С и N при разложении смеси корней с разным типом микориз. Констатируется, что разложение корней обычно зависит от наличия N в почве, что положительно связано с концентрацией N в корне, а также с активностью и численностью деструкторов (Fog, 1988; Manning et al., 2008). При этом вопрос о связи между разложением корней и доступностью субстратного N все еще не имеет однозначного ответа. В некоторых исследованиях было обнаружено, что скорость разложения сильно возрастает при увеличении доступности N (Van der Krift et al., 2001; King et al., 2002), тогда как в других не наблюдалось подобной зависимости (King et al., 1997; Ludovici, Kress, 2006).
Полученные нами результаты о скорости разложения смеси корней с разным типом микориз будут способствовать выявлению общих закономерностей накопления одних из наиболее важных биогенных элементов – С и N – в техногенном субстрате и превращения его в технозем, обладающий плодородием. Корневой опад ЭМ-видов представляет собой большой пул органических С и N, который медленно минерализуется и имеет значение для накопления этих элементов в экосистемах на начальных стадиях сукцессии при заселении субстратов, обедненных N (в золе). Ранее было показано, что тип микоризы имеет большое значение для циклов С и N за счет косвенных связей поглощения и разложения питательных веществ в системе растение–гриб–почва (Averill et al., 2014). В нашей работе установлено прямое воздействие типа микоризы на направленность изменения содержания С и N в опаде корней в процессе разложения на начальных этапах почвообразования.
Работа выполнена при финансовой поддержке РФФИ (грант 18-04-00714). Геоботанические описания растительных сообществ, сформировавшихся в результате самозарастания 50-летнего золоотвала ВТГЭС получены при выполнении государственного задания № 6.7696.2017/8.9 Министерства образования и науки РФ.
Список литературы
Бетехтина А.А., Большаков В.Н., Некрасова О.А., Радченко Т.А., Малыгин М.В., Дергачева М.И. Самозарастание золоотвалов: оценка микоризообразования, содержания азота и углерода в тонких корнях Betula pendula Roth. и Populus tremula L. // Эко- и техносферная безопасность горно-промышленных регионов: Тр. VII Междунар. науч.-практ. конф. Екатеринбург: Ин-т экономики УрО РАН, Урал. гос. горн. ун-т, 2019. С. 34–39.
Воробьева Л.А. Химический анализ почв. М.: Изд-во МГУ, 1998. 324 с.
Глазырина М.А., Лукина Н.В., Чукина Н.В. Pyrola rotundifolia L. на нарушенных промышленностью землях // Изв. ОГАУ. 2012. № 37. С. 244–246.
Дергачева М.И., Некрасова О.А., Оконешникова М.В., Васильева Д.И., Гаврилов Д.А., Очур К.О., Ондар Е.Э. Соотношение элементов в гуминовых кислотах как источник информации о природной среде формирования почв // Сиб. экол. журн. 2012. № 5. С. 667–676.
Качинский Н.А. Физика почвы. Ч. 1. М.: Высш. шк., 1965. 321 с.
Макаров М.И. Роль микоризообразования в трансформации соединений азота в почве и азотном питании растений (обзор) // Почвоведение. 2019. № 2. С. 220–233.
Махонина Г.И. Экологические аспекты почвообразования в техногенных экосистемах Урала. Екатеринбург: Изд-во Урал. ун-та, 2003. 355 с.
Пасынкова М.В. Зола углей как субстрат для выращивания растений // Растения и промышленная среда. Свердловск: УрГУ, 1974. Сб. 3. С. 29–44.
Салпагарова Ф.С., ван Логтестайн Р., Онипченко В.Г., Ахметжанова А.А., Агафонов В.А. Содержание азота в тонких корнях и структурно-функциональные адаптации высокогорных растений // Журн. общ. биологии. 2013. Т. 74. № 3. С. 190–200.
Селиванов И.А. Микосимбиотрофизм как форма консортивных связей в растительном покрове Советского Союза. М.: Наука, 1981. 231 с.
Averill C., Turner B.L., Finzi A.C. Mycorrhiza–mediated competition between plants and decomposers drives soil carbon storage // Nature. 2014. V. 505. № 7484. P. 543–545.
Balesdent J., Balabane M. Major contribution of roots to soil carbon storage inferred from maize cultivation soils // Soil Biol. Biochem. 1996. V. 28. P. 1261–1263.
Beidler K.V., Pritchard S.G. Maintaining connectivity: understanding the role of root order and mycelial networks in fine root decomposition of woody plants // Plant Soil. 2017. V. 420. P. 19–36.
Cornelissen J., Aerts R., Cerabolini B., Werger M., van der Heijden M. Carbon cycling traits of plant species are linked with mycorrhizal strategy // Oecologia. 2001. V. 129. P. 611–619.
Fernandez C.W., Langley J.A., Chapman S., McCormack M.L., Koide R.T. The decomposition of ectomycorrhizal fungal necromass // Soil Biol. Biochem. 2016. V. 93. P. 38–49.
Fog K. The effect of added nitrogen on the rate of decomposition of organic matter // Biol. Rev. 1988. V. 63. № 3. P. 433–462.
Ghafoor A., Poeplau C., Kätterer T. Fate of straw–and root–derived carbon in a Swedish agricultural soil // Biol. Fertility Soils. 2017. V. 53. № 2. P. 257–267.
Gill R.A., Jackson R.B. Global patterns of root turnover for terrestrial ecosystems // New Phytol. 2000. V. 147. № 1. P. 13–31.
Jones M.D., Durall D.M., Tinker P.B. A comparison of arbuscular and ectomycorrhizal Eucalyptus coccifera: growth response, phosphorus uptake efficiency and external hyphal production // New Phytol. 1998. V. 140. № 1. P. 125–134.
King J.S., Allen H.L., Dougherty P., Strain B.R. Decomposition of roots in loblolly pine: effects of nutrient and water availability and root size class on mass loss and nutrient dynamics // Plant Soil. 1997. V. 195. № 1. P. 171–184.
King J.S., Albaugh T.J., Allen H.L., Boyd M.B., Phillip R.S. Dougherty Below-ground carbon input to soil is controlled by nutrient availability and fine root dynamics in loblolly pine // New Phytol. 2002. V. 154. № 2. P. 389–398.
Langley A.J., Chapman S.K., Hungate B.A. Ectomycorrhizal colonization slows root decomposition: the post-mortem fungal legacy // Ecol. Lett. 2006. V. 9. № 8. P. 955–959.
Langley J.A., Hungate B.A. Mycorrhizal controls on belowground litter quality // Ecology. 2003. V. 84. № 9. P. 2302–2312.
Leake J., Johnson D., Donnelly D., Muckle G., Boddy L., Read D. Networks of power and influence: the role of mycorrhizal mycelium in controlling plant communities and agroecosystem functioning // Can. J. Bot. 2004. V. 82. № 8. P. 1016–1045.
Ludovici K.H., Kress L.W. Decomposition and nutrient release from fresh and dried pine roots under two fertilizer regimes // Can. J. Forest Res. 2006. V. 36. № 1. P. 105–111.
Manning P., Saundersa M., Bardgett R.D., Bonkowski M., Bradford M.A., Ellis R.J., Kandeler E., Marhan S., Tscherko D. Direct and indirect effects of nitrogen deposition on litter decomposition // Soil Biol. Biochem. 2008. V. 40. № 3. P. 688–698.
Mao R., Zeng D.H., Li L.J. Fresh root decomposition pattern of two contrasting tree species from temperate agroforestry systems: effects of root diameter and nitrogen enrichment of soil // Plant Soil. 2011. V. 347. № 1–2. P. 115.
McClaugherty C.A., Aber J.D., Melillo J.M. Decomposition dynamics of fine roots in forested ecosystems // Oikos. 1984. V. 42. № 3. P. 378–386.
McCormack M.L., Dickie I.A., Eissenstat D.M., Fahey T.J., Fernandez C.W., Guo D., Helmisaari H., Hobbie E.A., Iversen C.M., Iversen C.M., Jackson R.B., Leppälammi-Kujansuu J., Norby R.J., Phillips R.P., Pregitzer K.S., Pritchard S.G., Rewald B., Zadworny M. Redefining fine roots improves understanding of below-ground contributions to terrestrial biosphere processes // New Phytol. 2015. V. 207. № 3. P. 505–518.
Melillo J.M., Aber J.D., Muratore J.F. Nitrogen and lignin control of hardwood leaf litter decomposition dynamics // Ecology. 1982. V. 63. № 3. P. 621–626.
Orwin K.H., Kirschbaum M.U., St John M.G., Dickie I.A. Organic nutrient uptake by mycorrhizal fungi enhances ecosystem carbon storage: a model-based assessment // Ecol. Lett. 2011. V. 14. № 5. P. 493–502.
Phillips R.P., Brzostek E., Midgley M.G. The mycorrhizal-associated nutrient economy: a new framework for predicting carbon–nutrient couplings in temperate forests // New Phytol. 2013. V. 199. № 1. P. 41–51.
Poirier V., Roumet C., Munson A.D. The root of the matter: linking root traits and soil organic matter stabilization processes // Soil Biol. Biochem. 2018. V. 120. P. 246–259.
Prieto I., Birouste M., Zamora-Ledezma E., Gentit A., Goldin J., Volaire F., Roumet C. Decomposition rates of fine roots from three herbaceous perennial species: combined effect of root mixture composition and living plant community // Plant Soil. 2017. V. 415. № 1–2. P. 359–372.
Read D.J. Mycorrhizas in ecosystems // Experientia. 1991. V. 47. № 4. P. 376–391.
Robinson C.H., Kirkham J.B., Littlewood R. Decomposition of root mixtures from high arctic plants: a microcosm study // Soil Biol. Biochem. 1999. V. 31. № 8. P. 1101–1108.
Roumet C., Birouste M., Picon-Cochard C., Ghestem M., Osman N., Vrignon-Brenas S., Cao K., Stokes A. Root structure-function relationships in 74 species: evidence of a root economics spectrum related to carbon economy // New Phytol. 2016. V. 210. № 3. P. 815–826.
Silver W.L., Miya R.K. Global patterns in root decomposition: comparisons of climate and litter quality effects // Oecologia. 2001. V. 129. № 3. P. 407–419.
Soudzilovskaia N.A., van der Heijden M.G.A., Cornelissen J.H.C., Makarov M.I., Onipchenko V.G., Maslov M.N., Akhmetzhanova A.A., van Bodegom P.M. Quantitative assessment of the differential impacts of arbuscular and ectomycorrhiza on soil carbon cycling // New Phytol. 2015. V. 208. № 1. P. 280–293.
Swift M.J., Heal O.W., Anderson J.M., Anderson, J.M. Decomposition in terrestrial ecosystems. Berkeley; Los Angeles; Univ. California Press, 1979. 372 p.
Van der Krift T.A.J., Kuikman P.J., Möller F., Berendse F. Plant species and nutritional-mediated control over rhizodeposition and root decomposition // Plant Soil. 2001. V. 228. № 2. P. 191–200.
Wang B., Qiu Y.L. Phylogenetic distribution and evolution of mycorrhizas in land plants // Mycorrhiza. 2006. V. 16. № 5. P. C. 299–363.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая