Известия РАН. Серия биологическая, 2020, № 3, стр. 266-273
Генетическое разнообразие посткриогенных растений Fragaria vesca L. после длительного культивирования in vitro и стрессового воздействия абиотических факторов
А. И. Соловьева 1, *, О. Н. Высоцкая 1
1 Институт физиологии растений им. К.А. Тимирязева РАН
127276 Москва, ул. Ботаническая, 35, Россия
* E-mail: slvjova.aleksandra@rambler.ru
Поступила в редакцию 24.12.2018
После доработки 17.10.2019
Принята к публикации 07.11.2019
Аннотация
Исследовано воздействие повышенной температуры и яркого солнечного света на генетическое разнообразие клона Fragaria vesca L., восстановленного из замороженных в жидком азоте меристем. Показано, что в ходе культивирования in vitro посткриогенного растительного материала доля полиморфных ДНК-маркеров, которая сразу после криосохранения снизилась вдвое (4.5%), в течение 2 лет вернулась к исходному значению (9%). Установлено, что показатель генетического разнообразия – информационный индекс Шеннона исследованного клона – незначительно увеличился за это время. Отмечено, что стрессовые воздействия повышенной температуры и яркого солнечного света на растения клона через 2 года после криосохранения не вызвали появления новых полиморфных фрагментов и достоверного изменения индекса Шеннона.
Стремительное внедрение в производство современных высокопродуктивных сортов сокращает разнообразие культивируемых растений (Govindaraj et al., 2015). Сохранение коллекций растительного материала в биобанках может противодействовать стремительному исчезновению “традиционных” сортов. Известно, что наиболее перспективными способами долговременного сохранения живого растительного материала считаются методы культивирования in vitro и криосохранение.
Процесс криосохранения растительного материала и некоторые технологии культивирования растительного материала in vitro имеют свои особенности, которые могут приводить к генетическим изменениям клеток растений (Akdemir et al., 2013; Markovic et al., 2015; Gonzales-Benito et al., 2016). Возникновение подобных изменений может быть связано с экстремальным осмотическим воздействием на клетки растений в ходе подготовки к замораживанию и в процессе восстановления растительного материала in vitro (Aronen et al., 1999; Соловьева и др., 2011; Kaity et al., 2013; Markovic et al., 2015). Кроме того, в ходе использования технологий криосохранения и культивирования in vitro клетки могут получать повреждения, не совместимые с жизнью, и в результате часть растительного материала неизбежно будет потеряна. Это приводит к отбору устойчивых к замораживанию форм. В связи с этим нет достаточных оснований отрицать, что образцы, восстановленные после криосохранения, могут отличаться от исходного материала. Так, в нашем предыдущем исследовании у растений земляники Fragaria vesca, регенерированных in vitro из дегидратированных апексов, после замораживания в жидком азоте было обнаружено сокращение доли полиморфных фрагментов ДНК от 9.0 до 4.5% (Соловьева и др., 2016).
Опубликованная информация позволяет предполагать, что использование метода in vitro в протоколах криосохранения при культивировании растительного материала на питательных средах с биологически активными веществами может вызывать появление измененных форм растительного материала с генетическими отклонениями (De Verno et al., 1999; Kaity et al., 2013). В связи с этим мы исследовали генетическое разнообразие внутри клона F. vesca как до, так и после различных воздействий на растительный материал.
Мы полагаем, что после криосохранения и восстановления in vitro растительный материал при культивировании в естественных условиях может испытать такие стрессовые воздействия, которые также могут приводить к изменениям последовательности ДНК. Так, в одном из проведенных ранее исследований генетической стабильности растений папайи, восстановленных после криосохранения, было показано, что после этапов культивирования in vitro и акклиматизации в теплице у регенерантов не было отмечено отклонений по RAF-маркерам. Однако после перемещения этих растений в полевые условия были выявлены изменения генома по 0.45–4.15% маркеров (Kaity et al., 2009). Обратный эффект наблюдали две другие группы исследователей. Полиморфизм некоторых маркеров ДНК, обнаруженный сразу после криосохранения Picea glauca и Rubus grabowskii, через 1 год после высаживания растений-регенерантов в полевые условия не был зарегистрирован (De Verno et al., 1999; Castillo et al., 2010).
Современные изменения климата на нашей планете приводят к тому, что культивируемые в открытом грунте растения могут подвергаться повреждающему действию температуры и/или яркого солнечного света. Исследования последействия таких факторов становятся весьма актуальными.
Цель работы – изучение генетического разнообразия клона F. vesca, восстановленного из меристем после криосохранения и 2 лет культивирования растительного материала in vitro, а также после стрессового воздействия на посткриогенные растения F. vesca природных факторов: повышенной температуры и яркого солнечного света.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования были проведены с помощью растения земляники F. vesca L., var. alpina сорта Reine des Vallees из клона, который был восстановлен из апикальных меристем после криосохранения в соответствии с протоколом (Высоцкая и др. 2007), использованным в предыдущем исследовании (Соловьева и др., 2016). Данный растительный материал культивировали in vitro на средах Мурасиге–Скуга (MS), дополненных 30 г/л сахарозы, 1 мг/л бензиламинопурина (БАП) и 0.05 мг/л индолилмасляной кислоты (ИМК) (Sigma Aldrich, США) в течение 2 лет. Растения пересаживали на свежие питательные среды 1 раз в 3 мес. Климатическая камера фитотрона ИФР РАН обеспечивала стабильные условия культивирования: температура 20 ± 2°С, 16-часовой день (лампы ЛБ-40 OSRAM) при интенсивности света 180–190 мкмоль/(м2 ∙ с). Измерения интенсивности света были выполнены на уровне листьев экспериментальных растений с помощью Quantum sensor Cosine Corrector LP 471 PAR (Италия).
Параметры солнечного света и температуры, использованные для достаточно сильного стрессового воздействия на экспериментальные растения, определяли на основании предварительных тестов. Для этого использовали растительный материал земляники, выращенный на 20 мл агаризованной MS-среды с 30 г/л сахарозы, 1 мг/л БАП и 0.05 мг/л ИМК в стеклянных сосудах (100 мл), которые изолировали от внешней среды тремя слоями прозрачной пищевой стрейч-пленки (20 мкм). Влияние повышенной температуры (42°C) на растительный материал исследовали с использованием термостата ТС-1/80 (Россия) при непрерывном искусственном освещении (интенсивность света 70 мкмоль/(м2 ∙ с)) в течение 12, 24, 36 и 48 ч. Изучение влияния прямого солнечного света на растения землянки in vitro проводили в ясную погоду (интенсивность света на уровне экспериментального материала варьировала от 1000 до 2400 мкмоль/(м2 ∙ с)) при температуре воздуха от 25°C (в тени) до 32°С (на свету) в течение 1, 2, 3 и 4 ч. После соответствующего воздействия через 1 сут регистрировали внешние признаки повреждения, а через 4 нед – число выживших растений (доля исходного числа растений в процентах). В каждом варианте данного эксперимента использовали по 7–10 растений. Опыт повторяли трижды.
Для анализа генетического разнообразия в посткриогенном клоне земляники альпийской использовали растительный материал после 2 лет культивирования in vitro. От каждого из 16 экспериментальных растений были отобраны отдельные пробы листьев для выделения ДНК.
При анализе стабильности ДНК-маркеров после воздействия изучаемых факторов листовой материал от каждого из выбранных растений также изучали индивидуально. Пробы листьев отбирали до стрессовых воздействий на растения и через 1 мес. после них. В каждом варианте также анализировали по 16 растений.
Выделение ДНК и ПЦР-анализ проводили по методике, описанной ранее (Соловьева и др., 2016). ДНК из листьев выделяли по модифицированной методике с помощью бромистого цетилтриметиламмония (CTAB) (Nunes et al., 2011). Реакционная смесь для ПЦР объемом 25 мкл содержала 2.5 мкл 10× Taq буфера (TermoScientific, Латвия), по 0.12 мМ каждого dNTP, 0.2–0.5 пМ праймера (табл. 1), 50 нг ДНК и 2 ед. Taq ДНК-пoлимеразы (TermoScientific). RAPD-, ISSR- и LTR-праймеры, которые использовали для ПЦР-анализа, были синтезированы (Литех, Россия) (табл. 1). Температура отжига зависела от последовательности олигонуклеотидов и составляла для RAPD-праймеров 36, для ISSR-праймеров 48–52, для сочетания LTR- и ISSR-праймеров (REMAP-метод) 54–56°C. В реакционную смесь для амплификации объемом 25 мкл вносили 50 нг ДНК. Амплификацию проводили в программируемом термоциклере MC2 (ДНК-Технология, Россия). Продукты реакции разделяли электрофорезом в 2%-ном агарозном геле в трис-боратном буфере с последующим окрашиванием бромистым этидием. Анализ повторяли дважды, а в случае выявления полиморфных фрагментов – 5 раз.
Таблица 1.
Праймеры, использованные для генетического анализа
| Праймер | Нуклеотидная последовательность (5'–3') | Температура отжига, °С |
|---|---|---|
| RAPD-праймеры | ||
| 474 | Agg-Cgg-gAA-C | 36 |
| 389 | Cgg-AgA-gCC-C | 36 |
| ISSR-праймеры | ||
| A1 | (Ag)8T | 52 |
| A2 | (AC)8g | 48 |
| A6 | (gCT)4CT | 48 |
| A8 | (CA)6Ag | 48 |
| LTR- и ISSR-праймеры | ||
| Wis + M1 | CTA-ggg-CAT-AAT-TCC-AAC-AА + (CA)8AC | 55 |
| Wis + M2 | CTA-ggg-CAT-AAT-TCC-AAC-AА + (Ag)8CA | 55 |
| Wis + M7 | CTA-ggg-CAT-AAT-TCC-AAC-AА + (gA)8CAG | 56 |
| Tar + M1 | CTC-CCA-gTT-gAC-CAA-CAA + (CA)8AC | 54 |
Для того чтобы оценить влияние использованных нами стрессовых факторов в каждой группе растений, были рассчитаны доля полиморфных фрагментов в общем числе амплифицированных фрагментов и генетическое расстояние между контрольными и опытными группами (Nei, 1972). Кроме того, для оценки генетического разнообразия в вариантах опытов был использован информационный индекс Шеннона (Chalmers et al., 1992).
Оценку статистической значимости разницы между долями полиморфных ампликонов в разных вариантах проводили с использованием критерия Фишера при 95%-ном уровне достоверности (Лакин, 1990).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Определение параметров стрессовых воздействий повышенной температурой и ярким солнечным светом. Необходимые для проведения запланированных исследований параметры температуры и света были определены экспериментально, а также на основании опубликованной информации о стрессовых значениях этих факторов для растений F. vesca в естественном ареале обитания. Основанием для определения параметров исследуемых факторов, необходимых для стрессовых воздействий, были визуальные признаки повреждения растений, которые проявлялись в течение 1 мес. после стресса. После пребывания на ярком естественном дневном свету растения увядали. Сначала на кромках крайних листьев этих растений появлялись ожоги, а в течение последующего месяца культивирования такие листья отмирали. Светло-зеленые черешки внутренних листьев розетки становились после светового воздействия буро-красными. После температурного воздействия наблюдали частичное обесцвечивание листьев (хлороз) и потемнение корней.
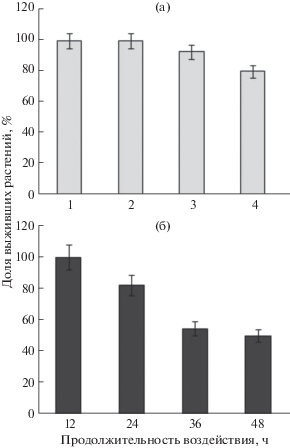
Данные о выживании растений через 1 мес. после стрессовых воздействий различной длительности (рис. 1) были использованы для планирования предстоящих экспериментов. Так, в дальнейших тестах использовали 3-часовое воздействие яркого солнечного света или 24-часовое температурное воздействие (42°С). Именно при таких параметрах стрессовых воздействий происходила гибель 20% растений, что аналогично значению этого показателя, приведенному ранее (Соловьева и др., 2016).
Рис. 1.
Выживание растений Fragaria vesca через 1 мес. культивирования in vitro после воздействия ярким солнечным светом (а) и повышенной температурой (б) в течение различных периодов времени.
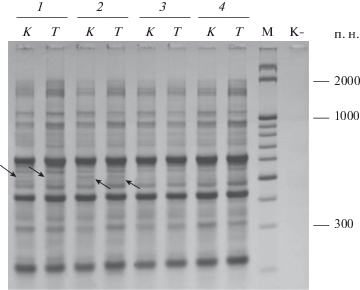
Генетическое разнообразие внутри клона F. vesca через 2 года после криосохранения. В результате анализа генетической вариабельности растений, культивируемых в течение 2 лет после криосохранения, с помощью RAPD-, ISSR- и REMAP-маркеров было выявлено разнообразие по ДНК-маркерам той же молекулярной массы, что и у исходных растений исследуемого клона (табл. 2) (Соловьева и др., 2016). Доля таких фрагментов составила 9%. Индекс генетического сходства между данными опытными группами составил 0.9933, т.е. свидетельствует о том, что они были практически идентичны друг другу. Значение информационного индекса Шеннона у группы растений, проанализированных через 2 года посткриогенного культивирования, было выше, чем в группе исходных растений клона и чем у растений, восстановленных после криосохранения за 2 мес. культивирования in vitro, однако эти отличия не были статистически значимы (табл. 2).
Таблица 2.
Общее число ДНК-фрагментов, амплифицированных с разными праймерами, число и доля полиморфных фрагментов, индекс Шеннона для in vitro растений клона Fragaria vesca в опытных вариантах
| Праймер | Число амплифицированных фрагментов | Число полиморфных фрагментов | ||||
|---|---|---|---|---|---|---|
| К* | Кр1* | Кр2 | Т | С | ||
| 474 | 10 | 1 | 0 | 1 | 1 | 1 |
| 389 | 7 | 0 | 0 | 0 | 0 | 0 |
| A1 | 7 | 0 | 0 | 0 | 0 | 0 |
| A2 | 9 | 0 | 0 | 0 | 0 | 0 |
| А6 | 15 | 0 | 0 | 0 | 0 | 0 |
| A8 | 14 | 2 | 1 | 2 | 2 | 2 |
| Wis + M1 | 13 | 1 | 1 | 1 | 1 | 1 |
| Wis + M2 | 10 | 3 | 2 | 3 | 3 | 3 |
| Wis + M7 | 11 | 1 | 1 | 1 | 1 | 1 |
| Tar + M1 | 15 | 2 | 1 | 2 | 2 | 2 |
| N | 111 | 10 | 6 | 10 | 10 | 10 |
| H, % | – | 9.0a | 4.5b | 9.0a | 9.0a | 9.0a |
| H0 | – | 2.0140 | 1.9479 | 2.3226 | 2.6383 | 2.5307 |
Примечание. К – растения до криосохранения; Кр1 – растения, восстановленные после криосохранения через 2 мес. культивирования in vitro; Кр2 – растения через 2 года культивирования in vitro после криосохранения; Т – растения через 2 года культивирования in vitro после криосохранения, подверженные воздействию повышенной температурой; С – растения через 2 года культивирования in vitro после криосохранения, подверженные интенсивному освещению; N – общее число фрагментов; H – доля полиморфных ДНК-маркеров; H0 – информационный индекс Шеннона. Достоверно различающиеся между собой значения отмечены разными буквами (p < 0.05). * (Соловьева и др., 2016).
Генетическое разнообразие после действия повышенной температурой и ярким солнечным светом. При сравнении профилей ДНК-маркеров листьев растений до и после воздействия природных стрессовых факторов не было зарегистрировано появление дополнительных ампликонов. Тем не менее после стрессовых воздействий у некоторых растений были выявлены минимальные изменения, выражавшиеся в отсутствии некоторых ДНК-фрагментов, амплифицированных с различными праймерами. Например, в пробе одного из растений через месяц после воздействия на него прямого солнечного света не наблюдали REMAP-фрагмент размером ~350 п. н., амплифицированный с праймерами Wis + M2 (рис. 2).
Рис. 2.
REMAP-профили проб ДНК листьев in vitro растений Fragaria vesca, полученные при амплификации с праймерами Wis + M2. К – пробы листьев, отобранные с отдельных растений (1–4) до стресса; С – пробы с тех же растений через 1 мес. после воздействия ярким солнечным светом в течение 3 ч; М – маркер молекулярной массы; К– – отрицательный контроль; стрелкой указан полиморфный фрагмент; для рис. 2 и 3.
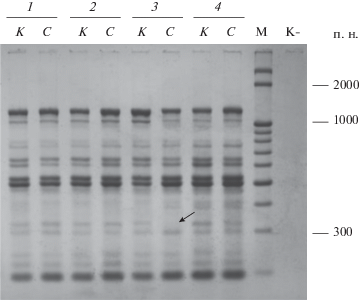
После воздействия на растения повышенной температуры анализ проб листьев с другой комбинацией праймеров Tar + M1 показал, что фрагмент размером ~450 п. н., который присутствовал в ДНК-профиле листьев того же растения до стресса, не был зарегистрирован (рис. 3). Выборка растений анализируемого клона до стрессовых воздействий была полиморфна по тем же фрагментам. Кроме того, уровень полиморфизма растений клона не изменялся в результате стрессового воздействия исследованных факторов, причем доля полиморфных фрагментов соответствовала данному показателю в контроле (табл. 2). Индексы генетического сходства между группами растений, анализированных до и после воздействий повышенной температуры и яркого солнечного света, были минимальными (0.9995 и 0.9989 соответственно). Изменения информационного индекса Шеннона у данных групп растений также были недостоверны.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Общепринятая система культивирования и размножения растительного материала in vitro предусматривает возможное появление уклоняющихся форм в связи с использованием биологически активных веществ в составе питательных сред (Bairu at el., 2011). Современные протоколы криосохранения, разработанные для различных вегетативно размножаемых растений, как правило, предполагают обязательное использование технологии культивирования in vitro, особенно на стадии восстановления роста и последующего размножения растительного материала. Следствием этого может стать изменение уровня генетического разнообразия. В рамках нашего исследования через 2 года культивирования и размножения растений, полученных после замораживания в жидком азоте, было зарегистрировано восстановление исходного уровня генетической изменчивости, снижение которого было отмечено непосредственно после криосохранения растительного материала. В работе канадских исследователей было показано появление сомаклональной вариабельности у некоторых клонов эмбриогенной культуры P. glauca как через 2, так и через 12 мес. после криосохранения, которая впоследствии не наблюдалась после выращивания регенерированных растений в полевых условиях (De Verno et al., 1999).
В связи с изменениями климата Земли, обусловленными увеличением среднегодовой температуры и инсоляции поверхности, приобретают все большее значение исследования влияния таких стрессовых факторов, как повышенная температура и свет. Воздействия этих факторов на генетический аппарат растений исследовали в основном на трансгенных линиях арабидопсиса и табака, в которые был встроен дефектный ген gus, восстанавливающий активность при определенных изменениях генома. Данная экспериментальная модель позволила обнаружить увеличение частоты гомологичной рекомбинации (Ries et al., 2000; Boyko et al., 2006), частоты точечных мутаций и нестабильность микросателлитов после соответствующих стрессовых воздействий (Yao, Kovalchuk, 2011). Кроме того, ранее при исследовании влияния повышенной температуры на генетическую стабильность каллусной ткани Arabidopsis thaliana, которую культивировали в течение 7 лет, изменения в RAPD- и ISSR-профилях отмечено не было, но с помощью AFLP-метода было зарегистрировано сокращение числа полиморфных фрагментов с 4.6 до 1.6% (Долгих и др., 2017). Однако влияние данных стрессоров на интактные нетрансгенные растения исследовали крайне мало. Были опубликованы результаты экспериментов, свидетельствующие о полном совпадении RAPD-профилей клонированных растений табака в контрольных условиях и после инкубирования при 42°C (Cvjetko et al., 2014). В нашем исследовании генетической стабильности посткриогенных растений F. vesca после действия повышенной температуры также не было зарегистрировано каких-либо изменений в RAPD- и ISSR-профилях.
Неоднократно было показано, что ультрафиолетовый (УФ) компонент солнечного света может быть триггером мутагенеза как у животных, так и у растений. Ранее были опубликованы данные исследования мутагенного эффекта УФ и быстрых нейтронов на проростки Vicia faba, в котором были обнаружены некоторые изменения в числе RAPD-фрагментов после воздействия УФ в течение 1 и 3 ч (Haliem et al., 2013). До воздействия УФ было зарегистрировано 46 фрагментов, а после – 50 (1 ч УФ) и 45 (3 ч УФ). Исследование воздействия яркого солнечного света на регенеранты земляники в наших экспериментах показало, что только в ДНК одного из растений (2 года культивирования in vitro посткриогенных клонов растительного материала) было зарегистрировано отсутствие единичного REMAP-фрагмента. Аналогичные результаты были получены американскими исследователями, которые также анализировали стабильность генома посткриогенного растительного материала. Сразу после криосохранения у регенерантов Prunus авторы данной публикации обнаружили отличия по AFLP-маркерам. Однако эти отличия через 1 год после высадки экспериментальных растений в полевые условия зарегистрировать больше не удалось (Castillo et al., 2010).
Таким образом, показано, что культивирование in vitro растений земляники альпийской в течение 2 лет, а также повышенная температура и интенсивное освещение не приводили к появлению новых полиморфных фрагментов у данного растительного материала.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (грант 14-04-31615).
Список литературы
Высоцкая О.Н., Данилова С.А., Попов А.С. Способ криосохранения in vitro меристем, изолированных из растений земляники садовой (Fragaria L.) (Патент РФ № 2302107) // Бюл. Федеральной службы по интеллектуальной собственности, патентам и товарным знакам. 2007. № 19. С. 166.
Долгих Ю.И., Соловьева А.И., Терешонок Д.В. Вариабельность ДНК-маркеров в культивируемых клетках Arabidopsis thaliana в стандартных условиях выращивания и при действии абиотических стрессов // Изв. РАН. Сер. биол. 2017. Т. 2. С. 88–96.
Лакин Г.Ф. Биометрия: Учеб. пособие для биол. спец. вузов. М.: Высш. шк., 1990. 352 с.
Соловьева А.И., Высоцкая О.Н., Долгих Ю.И. Влияние продолжительности дегидратации апексов на характеристики in vitro растений Fragaria vesca после криосохранения // Физиология растений. 2016. Т. 63. С. 258–266.
Соловьевa А.И., Долгих Ю.И., Высоцкая О.Н., Попов А.С. Спектры ISSR- и REMAP-маркеров ДНК каллусов яровой пшеницы после этапов криосохранения по методу дегидратации // Физиология растений. 2011. Т. 58. С. 359–366.
Akdemir H., Suzerer V., Tilkat E., Yildirim H., Onay A., Ciftci Y.O. In vitro conservation and cryopreservation of mature pistachio (Pistacia vera L.) germplasm // J. Plant Biochem. Biotechnol. 2013. V. 22. P. 43–51.
Aronen T.S., Krajnakova J., Häggman H.M., Ryynänen L.A. Genetic fidelity of cryopreserved embryogenic cultures of open-pollinated Abies cephalonica // Plant Sci. 1999. V. 142. P. 163–172.
Bairu M.W., Aremu O.A., van Staden J. Somaclonal variation in plants: causes and detection methods // Plant Growth Regul. 2011. V. 63. P. 147–173.
Boyko A., Greer M., Kovalchuk I. Acute exposure to UVB has a more profound effect on plant genome stability than chronic exposure // Mutat. Res. 2006. V. 606. P. 100–109.
Castillo F.V., Bassil V., Wad S., Reed M. Genetic stability of cryopreserved shoot tips of Rubus germplasm // In Vitro Cell and Dev. Biol. – Plant. 2010. V. 46. P. 246–256.
Chalmers K.J., Waugh R., Sprent J.I. Simons A.J., Powell W. Detection of genetic variation between and within populations of Gliricidia sepium and G. maculata using RAPD markers // Heredity. 1992. V. 69. P. 465–472.
Cvjetko P., Balen B., Peharec Š.P., Debogović L., Pavlica M. Dynamics of heat-shock induced DNA damage and repair in senescent tobacco plants // Biol. Plantarum. 2014. V. 58. P. 71–79.
De Verno L.L., Park Y.S., Bonga J.M., Barrett J.D. Somaclonal variation in cryopreserved embryogenic clones of white spruce [Picea glauca (Moench) Voss.] // Plant Cell Rep. 1999. V. 18. P. 948–953.
Gonzales-Benito M.E., Kremer C., Ibáñez M.A., Martin C. Effect of antioxidants on the genetic stability of cryopreserved mint shoot tips by encapsulation–dehydration // Plant Cell Tiss. Cult. 2016. V. 127. P. 359–368.
Govindaraj M., Vetriventhan M., Srinivasan M. Importance of genetic diversity assessment in crop plants and its recent advances: an overview of its analytical perspectives // Genet. Res. Int. 2015. 14 p.: Art. ID: 431487.
Haliem E.A., Abdullah H., AL-Huqail A.A. Oxidative damage and mutagenic potency of fast neutron and UV-B radiation in pollen mother cells and seed yield of Vicia faba L. // BioMed Res. Int. 2013. 12 p. Art. ID 824656.
Kaity A., Ashmore S.E., Drew R.A. Field performance evaluation and genetic integrity assessment of cryopreserved papaya clones // Plant Cell Rep. 2009. V. 28(9). P. 1421–1430.
Kaity A., Drew R.A., Ashmore S.E. Genetic and epigenetic integrity assessment of acclimatized papaya plants regenerated directly from shoot-tips following short- and long-term cryopreservation // Plant Cell Tiss. Org. 2013. V. 112. P. 75–86.
Markovic Z., Preiner D., Stupić D., Andabaka Z., Šimon S., Vončina D., Maletić E., Karoglan Kontić J., Chatelet P., Engelmann F. Cryopreservation and cryotherapy of grapevine (Vitis vinifera L.) // Vitis. 2015. V. 54. P. 247–251.
Nei M. Genetic distance between populations // Am. Nat. 1972. V. 106. P. 283–292.
Nunes C.F., Ferreira J.L., Nunes-Fernandes M.C., de Souza Breves S., Generoso A.L., Fontes-Soares B.D., Carvalho-Dias M.S., Pasqual M., Borem A., de Almeida Cancado G.M. An improved method for genomic DNA extraction from strawberry leaves // Ciencia Rural. 2011. V. 41. P. 1383–1389.
Ries G., Heller W., Puchta H., Sandermann H., Seidlitz H.K., Hohn B. Elevated UV-B radiation reduces genome stability in plants // Nature. 2000. V. 406. P. 98–101.
Yao Y., Kovalchuk I. Abiotic stress leads to somatic and heritable changes in homologous recombination frequency, point mutation frequency and microsatellite stability in Arabidopsis plants // Mutat. Res. 2011. V. 707. P. 61–66.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая