Известия РАН. Серия биологическая, 2020, № 3, стр. 235-247
Использование антимикробных растительных пептидов для эмбриогенной культуры Larix Sibirica in vitro
И. Н. Третьякова 1, 5, *, Е. А. Рогожин 2, 4, 3, М. Э. Пак 1, И. А. Петухова 5, А. С. Шуклина 1, А. П. Пахомова 1, В. С. Садыкова 3
1 Институт леса им. В.Н. Сукачева СО РАН – обособленное подразделение ФИЦ КНЦ СО РАН
660036 Красноярск, Академгородок, 50, стр. 28, Россия
2 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
3 Научно-исследовательский институт по изысканию новых антибиотиков им. Г.Ф. Гаузе
119021 Москва, ул. Большая Пироговская, 11, стр. 1, Россия
4 Тюменский государственный университет
625003 Тюмень, ул. Володарского, 6, Россия
5 Федеральное государственное автономное образовательное учреждение высшего образования “Сибирский федеральный университет”
660041 Красноярск, просп. Свободный, 79, Россия
* E-mail: culture@ksc.krasn.ru
Поступила в редакцию 21.08.2018
После доработки 19.11.2018
Принята к публикации 19.11.2018
Аннотация
Испытано влияние антимикробных растительных пептидов на инициацию каллуса и эмбрионально-суспензорной массы, образование соматических зародышей и прорастание регенерантов лиственницы сибирской. В качестве объектов растительного происхождения использованы белково-пептидные экстракты семян щирицы запрокинутой, семян чернушки посевной и колосьев пырея удлиненного. Пептиды введены в питательную среду на стадии инициации эмбриогенных культур и прорастания соматических зародышей. Выявлена стимуляция образования эмбриогенных культур лиственницы сибирской под действием пептидов. Различий в росте контрольных и опытных регенерантов не отмечено. Предположено, что проведенные исследования могут повысить иммунитет клонированных саженцев лиственницы сибирской.
В последние 30 лет наиболее перспективное направление в микроклональном размножении хвойных – соматический эмбриогенез в культуре in vitro. С помощью данного метода можно не только осуществлять массовое тиражирование хвойных видов с селекционно-значимыми признаками, но и проводить фундаментальные исследования в области биологии развития – изучение морфогенетических программ в раннем онтогенезе (Lelu et al., 1994; Lelu-Walter et al., 2008; Klimaszewska et al., 2000, 2008; Cairney, Pullman, 2007; Lelu-Walter, Pâques, 2009; Pullman, Bucalo, 2011; Трeтьякова, Барсукова, 2012, 2015; Третьякова, 2013; Третьякова и др., 2016).
С помощью соматического эмбриогенеза можно сохранять генетические ресурсы в течение длительного времени благодаря криоконсервации и способности эмбрионально-суспензорной массы (ЭСМ) длительно пролиферировать, сохраняя эмбриогенный потенциал. Так, в культуре мегагаметофитов Larix decidua и культуре зародышей гибридов лиственницы (Larix × eurolepis и Larix × marschlinsii) образование соматических зародышей происходило в течение 9 лет (von Aderkas, Anderson, 1993; von Aderkas et al., 2003; Lelu-Walter, Pâques, 2009). В полученных нами клеточных линиях (Кл) L. sibirica эмбриогенная продуктивность сохранялась 9 лет и более (Третьякова, Пак, 2018). Такие Кл продуцировали от 2000 до 11 000 глобулярных зародышей на 1000 мг ЭСМ. Однако не все зародыши созревали, а часть зрелых зародышей и регенерантов имели морфологические нарушения в доменах, особенно базальном (Пак и др., 2016). Аномальные по фенотипу регенеранты не всегда были жизнеспособны (Третьякова и др., 2016).
Для повышения своего врожденного иммунитета к комплексу стрессовых факторов окружающей среды (биотической и абиотической природы) растения часто используются защитные пептиды. Большинство из них – антимикробные пептиды (АМП), которые синтезируются конститутивно и индуцированно для борьбы с патогенами и являются важнейшими эффекторными молекулами иммунной системы животных и растений. Обладая широким спектром антимикробной активности, пептиды представляют несомненный интерес для повышения устойчивости растений (Егоров, Одинцова, 2012). В настоящее время десятки АМП выделены и охарактеризованы из семян растений, таких как ежовник обыкновенный Echinochloa crusgalli, пшеница Triticum kiharae, чернушка посевная Nigella sativa, звездчатка средняя Stellaria media (Odintsova et al., 2008, 2009; Ощепкова и др., 2009; Рогожин и др., 2009; Rogozhin et al., 2011; Slavokhotova et al., 2011, 2014; и др.). Эти АМП подавляют рост и развитие патогенных грибов и бактерий и в целом повышают устойчивость растений к другим стрессовым факторам среды. Влияние растительных АМП на хвойные растения до сих пор не исследовалось. Поэтому изучение запуска механизмов, индуцирующих устойчивость, а также исследование морфогенеза и ростовой активности растений, обработанных пептидами, – перспективное направление для хвойных, введенных в культуру in vitro, где можно ожидать повышения выхода устойчивых к патогенам регенерантов и соматических сеянцев. Для усиления иммунитета хвойных растений, введенных в культуру in vitro, и возможного повышения улучшения ростовых процессов, а также выхода регенерантов было проведено экспериментальное воздействие АМП, выделенных из семян ряда дикорастущих растений, обладающих более высоким биоэкологическим потенциалом по сравнению с культурными формами, а следовательно, и большей степенью устойчивости.
Цель работы – выращивание эмбриогенных культур лиственницы сибирской на питательной среде с различными концентрациями защитных пептидов растительного происхождения in vitro для достижения прямого антимикробного эффекта, а также запуска механизмов индуцированной устойчивости (регуляторной функции эмбриогенных культур), изучение морфогенеза и ростовой активности соматических зародышей и проростков.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве эксплантов были взяты незрелые семена лиственницы сибирской дерева № А4, произрастающего в дендрарии Института леса (Красноярск) (Пак и др., 2016; Третьякова и др., 2016).
Инициацию эмбриогенных культур проводили из незрелых зиготических зародышей данного дерева лиственницы на среде АИ (Третьякова, 2012), (патент РФ № 2456344 http://www.freepatent.ru/images/patents/5/2456344/patent-2456344.pdf, зарегистрирован в Государственном реестре изобретений РФ 22. 07. 2012). В среду АИ добавляли регуляторы роста 2,4-дихлорфеноксиуксусную кислоту (2,4-Д) (2 мг/л) и 6-бензиламинопурин (БАП) (0.5 и 1 мг/л соответственно). Для поддержания пролиферирующих эмбриогенных культур через каждые две недели проводили субкультивирование.
Созревание соматических зародышей лиственницы сибирской выполняли на базовой питательной среде АИ, содержащей сахарозу (40 г/л), абсцизовую кислоту (АБК) (32 мг/л), индолилмасляную кислоту (ИМК) (0.2 мг/л) и полиэтиленгликоль (ПЭГ 8000) (10%). В качестве желирующего агента использовали Gelrite (4 г/л). Культивирование осуществляли в темноте при 24 ± 1°С. В охлажденную питательную среду после автоклавирования добавляли регуляторы роста (АБК и ИМК), а также L-глутамин (500 мг/л) и аскорбиновую кислоту (400 мг/л) методом холодной стерилизации с использованием бактериальных фильтров (ТРР, Швейцария). Созревшие зародыши переносили на базовую среду 1/2АИ для прорастания, свободную от растительных регуляторов роста.
В качестве объектов растительного происхождения были использованы белкового-пептидные экстракты (БПЭ) следующих видов растений: семена щирицы запрокинутой Amarantus retroflexus, собранной в 2003 г. в г. Пущино (Московская обл.); семена черного тмина, или чернушки посевной Nigella sativa, выращенные в 2008 г. и предоставленные сотрудниками Института биоорганической химии РАН, и колосья пырея удлиненного Elytrigia elongata, собранные в 2010 г. на побережье (г. Севастополь). Биологический материал хранился в сухом проветриваемом помещении при 16–18°С.
БПЭ получали по ранее разработанной и апробированной схеме (Egorov et al., 2005). Она основана на комбинировании экстракции тотальной белково-пептидной составляющей буфером на базе водной органической кислоты (или смесью органической и неорганических кислот) с последующим фракционированием трехстадийной жидкостной хроматографией среднего и высокого давления с предварительной твердофазной экстракцией (ТФЭ). Экстракцию измельченного растительного материала осуществляли 10-кратным количеством (w/v) экстрагирующего буфера, содержащего 1 М соляную кислоту, 1%-ную муравьиную кислоту, 1%-ную трифторуксусную (ТФУ) кислоту и 1%-ный хлорид натрия, взмучивали и интенсивно перемешивали в течение 2 ч при комнатной температуре. После завершения данного этапа экстракции и центрифугирования (6000 об./мин, 10 мин, 4°С) надосадочную жидкость фильтровали через бумажный фильтр и концентрировали с помощью роторного упаривателя примерно вдвое. Полученный упаренный экстракт по каждому растению разделяли на две равные части. Первую часть использовали для высаживания охлажденным 2-пропанолом (Химмед, ОСЧ) в соотношении 1 : 10 (объем/объем) при добавлении 50 мкл ледяной уксусной кислоты в течение 14 ч при 4°С, а вторую дробно высушивали досуха с помощью вакуумного центрифугиконцентратора. Осадок, образовавшийся после высаживания 2-пропанолом, собирали центрифугированием (5000 об./мин, 5 мин, 4°С) и высушивали на воздухе при комнатной температуре и интенсивном механическом измельчении. После этого осадки по обеим частям независимо перерастворяли в 0.1%-ном растворе ТФУ и обессоливали от низкомолекулярных гидрофильных алифатических метаболитов, разнообразных ароматических соединений, органических кислот методом ТФЭ на гидрофобном сорбенте, представляющем собой силикагельную основу с ковалентно-присоединенной алкильной фазой длиной С8 углеродных атомов. Данный метод грубого фракционирования позволяет проводить концентрирование белков (в среднем диапазоне молекулярных масс) и пептидов при довольно существенном отделении многочисленных примесей, имеющих небелковую природу. Элюирование суммарной фракции, связавшейся с неподвижной фазой колонки, по каждому варианту элюировали 60%-ным водным раствором ацетонитрила с добавлением 0.1%-ной ТФУ, после чего упаривали избыток растворителя и лиофилизовали в целях полного удаления свободной жидкости и остаточных количеств ТФУ.
Первичную структурную характеристику компонентов БПЭ проводили с использованием масс-спектрометрического анализа. Молекулярные массы целевого БПЭ измеряли на МАЛДИ-времяпролетном масс-спектрометре Ultraflex (Bruker Daltonics, Германия), оснащенном УФ-лазером (337 нм), в режиме положительных ионов. В качестве матрицы использовали 2,5-дигидроксибензойную кислоту. На мишени смешивали равные объемы (по 0.7 мкл) образцов и матрицы (15 мг матрицы/мл в 80%-ном CH3CN, 0.1%-ная ТФУ в воде MQ), и полученную смесь высушивали на воздухе. Масс-спектры анализировали с помощью программы Bruker DataAnalysis for TOF. Точность измерения составляла 0.015%.
Обработка пептидами растительного происхождения каллусных культур лиственницы сибирской in vitro на стадии инициации. В среду АИ вводили пептиды растительного происхождения, полученные из семян щирицы, чернушки и колосьев пырея (50, 100, 200, 400, 800, 1600 мкг/л). На данную среду помещали незрелые зародыши, полученные культуры выдерживались 1 мес., затем образовавшиеся каллусы и ЭСМ переносили на пролиферационную среду, где измеряли растущие каллусы и при необходимости вычленяли ЭСМ. Для проведения гистологического анализа готовили давленые препараты по стандартной методике (Круглова и др., 2013). Каллус помещали на предметное стекло, взвешивали, окрашивали сафранином в течение 3–5 мин, добавляли каплю глицерина, накрывали предметным стеклом, после чего слегка придавливали. Препараты просматривали на микроскопе МИКРОМЕД-6 ЛОМО (Санкт-Петербург) при увеличениях 10 × 4, 10 × 10 и 10 × 40. Замеры клеток и эмбриональных структур проводили с помощью системы ScopePhoto 3.0 (ScopeTek), с последующим переводом полученных единиц в микрометры.
Обработка пептидами растительного происхождения регенерантов лиственницы сибирской in vitro. Регенеранты лиственницы сибирской, полученные из длительно пролиферирующих клеточных культур Кл4 (8 лет пролиферации), помещали на безгормональную среду АИ, в которую вводили пептидные экстракты, полученные из семян щирицы, чернушки и колосьев пырея в концентрациях 25, 50, 100, 200, 400 и 800 мкг/л. На 28-е сутки прорастания измеряли длину проростков и число регенерантов, сформировавших корень. Статистическую обработку данных проводили по стандартным методикам (Лакин, 1973) с помощью программы Microsoft Excel 2003.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Культивирование эксплантов лиственницы сибирской на среде АИ, дополненной белково-растительными экстрактами для получения эмбриогенных культур. При вводе экспланта лиственницы сибирской в культуру in vitro с белково-пептидными компонентами щирицы, чернушки и пырея (стадия инициации) уже через 1 мес. культивирования наблюдались различия в росте культур. При перенесении каллусов на среду пролиферации через 6 нед культивирования можно было вычленить эмбриогенные культуры, представляющие собой ЭСМ. Белая и рыхлая ЭСМ была отмечена во всех опытных вариантах (рис. 1, 2). Цитологические данные показали, что в варианте с использованием экстракта щирицы было получено 8 Кл ЭСМ (табл. 1), 6 Кл были образованы на среде АИ, дополненной пептидами (50 мкг/л), 1 Кл при концентрации пептидов 200 мкг/л и 1 Кл при концентрации пептидов 400 мкг/л (табл. 1). Кроме того, начальная стадия образования ЭСМ (образование эмбриональных трубок) была отмечена у 25 Кл всех опытных вариантов экстракта щирицы (табл. 1). При обработке экстрактом чернушки было получено только 2 Кл при концентрациях 100 и 200 мкг/л. Наибольшее число Кл (10) в опытных вариантах было получено у пырея. При этом ЭСМ образовывалась во всех культурах, обработанных разными концентрациями экстракта пырея. Начальная стадия инициации эмбриогенных культур также была отмечена на всех средах, обработанных пептидами (всего 22 Кл).
Рис. 1.
Каллусообразование и соматический эмбриогенез Larix sibirica на средах, дополненных пептидами растительного происхождения. а–в – среда (контроль); г–и – среда, дополненная пептидами щирицы запрокинутой: г – 50, д – 100, е – 200, ж – 400, з – 800, и – 1600 мкг/л; к–п – среда, дополненная пептидами чернушки посевной: к – 50, л – 100, м – 200, н – 400, о – 800, п – 1600 мкг/л; р–х – среда, дополненная пептидами пырея удлиненного: р – 50 с – 100, т – 200, у – 400, ф – 800, х – 1600 мкг/л. Стрелками отмечены: 1 – эмбрионально-суспензорная масса, 2 – каллус.

Рис. 2.
Эмбрионально-суспензорная масса лиственницы сибирской, полученная в результате обработки эксплантов пептидами растительного происхождения. а – щирица запрокинутая, 50 мкг/л; б – чернушка посевная, 200 мкг/л; в – пырей удлиненный, 50 мкг/л; г – пырей удлиненный, 1600 мкг/л. Стрелками отмечены: 1 – суспензор, 2 – глобула зародыша.
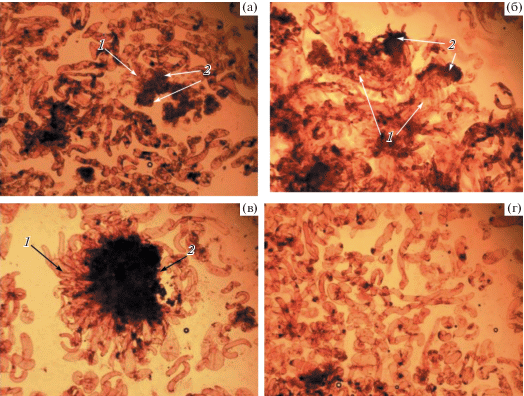
Таблица 1.
Число клеточных линий с эмбрионально-суспензорной массой, обработанных белково-пептидными экстрактами растений на стадии инициации (2 мес. пролиферации)
| Источник пептидов | Концентрация, мкг/л | Число клеточных линий с удлиненными эмбриональными трубками* | Число эмбриогенных клеточных линий |
|---|---|---|---|
| Контроль | – | 10 | 5 |
| Щирица запрокинутая | 50 | 10 | 6 |
| 100 | 2 | 0 | |
| 200 | 2 | 1 | |
| 400 | 1 | 1 | |
| 800 | 3 | 0 | |
| 1600 | 7 | 0 | |
| Чернушка посевная | 50 | 0 | 0 |
| 100 | 2 | 1 | |
| 200 | 0 | 1 | |
| 400 | 2 | 0 | |
| 800 | 0 | 0 | |
| 1600 | 2 | 0 | |
| Пырей удлиненный | 50 | 4 | 3 |
| 100 | 3 | 1 | |
| 200 | 3 | 2 | |
| 400 | 5 | 1 | |
| 800 | 2 | 1 | |
| 1600 | 4 | 2 |
Объем каллусов в контрольных и опытных вариантах варьировал. Наиболее интенсивный рост каллуса был отмечен в варианте обработки экстрактом щирицы в концентрации 100 мкг/л. Менее интенсивное нарастание каллуса наблюдалось в вариантах обработки экстрактами щирицы в высокой концентрации. У чернушки более активный рост каллуса был отмечен при низких концентрациях пептидов по сравнению с высокими концентрациями. У пырея наибольший объем каллуса наблюдался при концентрации пептидов 400 мкг/л. В вариантах обработки пептидами и контроле достоверных различий в росте каллусов не было.
Таким образом, в вариантах обработки пептидами в 2017 г. было получено 18 Кл, активно формирующих ЭСМ, и 52 Кл, у которых была выявлена начальная стадия образования ЭСМ (образование эмбриональных трубок). В контрольном варианте (среда АИ без пептидов) было обнаружено 5 Кл с ЭСМ и 10 Кл с начальной стадией образования эмбриогенных культур. В дальнейшем полученные клеточные линии будут подвергаться регулярным пересадкам на среду АИ для пролиферации, а затем будут переводиться на среду для созревания соматических зародышей, которые далее будут перенесены на среду для прорастания и получения регенерантов лиственницы сибирской.
Обработка прорастающих регенерантов белково-пептидными экстрактами растительного происхождения разных концентраций. Исследования проводились на прорастающих регенерантах, полученных из длительно пролиферирующей Кл 4 (8 лет пролиферации). Для экспериментов были использованы экстракты, полученные из семян щирицы, чернушки, а также из колосьев пырея. Для каждого биопрепарата были изучены концентрации 25, 50, 100, 200, 400 и 800 мкг/л. Обработка биопрепаратов в большинстве опытных вариантов не оказала значительного влияния на динамику роста в длину регенерантов L. sibirica. Лишь на 21-е сутки культивирования измерения проростков на среде для прорастания, содержащей биопрепарат из семян щирицы (100 мкг/л), показали достоверно более высокие значения длины, однако к 28-м суткам общие длины проростков во всех вариантах достоверно не различались (рис. 3, табл. 2). Повышение концентрации биопрепаратов до 200–800 мкг/л в большинстве случаев вызывало ингибирование роста соматических проростов. Исключение составил лишь вариант экстракта щирицы (800 мкг/л), у которого средняя длина проростков не отличалась от контроля.
Рис. 3.
Динамика роста регенерантов Larix sibirica, обработанных биопептидами растительного происхождения. а – низкие концентрации (25–100 мкг/л); б – высокие концентрации (200–800 мкг/л). 1 – щирица запрокинутая, 25 мкг/л; 2 – щирица запрокинутая, 50 мкг/л; 3 – щирица запрокинутая, 100 мкг/л; 4 – чернушка посевная, 25 мкг/л; 5 – чернушка посевная, 50 мкг/л; 6 – чернушка посевная, 100 мкг/л; 7 – пырей удлиненный, 25 мкг/л; 8 – пырей удлиненный, 50 мкг/л; 9 – пырей удлиненный, 100 мкг/л; 10 – щирица запрокинутая, 200 мкг/л; 11 – щирица запрокинутая, 400 мкг/л; 12 – щирица запрокинутая, 800 мкг/л; 13 – чернушка посевная, 200 мкг/л; 14 – чернушка посевная, 400 мкг/л; 15 – чернушка посевная, 800 мкг/л; 16 – пырей удлиненный, 200 мкг/л; 17 – пырей удлиненный, 400 мкг/л; 18 – пырей удлиненный, 800 мкг/л; К – контроль, базовая среда.
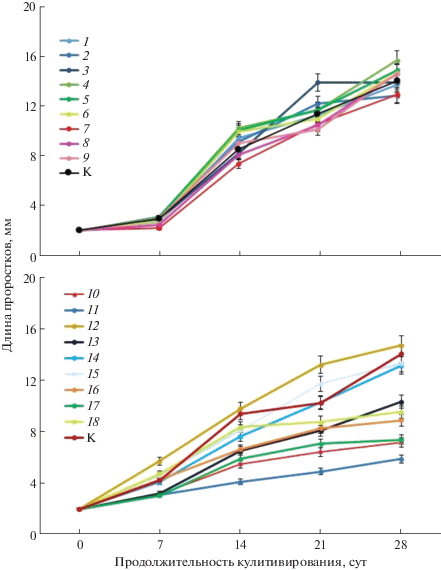
Таблица 2.
Длина регенерантов Larix sibirica на среде с добавлением биопрепаратов растительного происхождения на 28-е сут культивирования
| Источник пептидов | Концентрация, мкг/л | Длина, мм |
|---|---|---|
| Контроль | – | 14.00 ± 0.70 |
| Щирица запрокинутая | 25 | 13.69 ± 0.68 |
| 50 | 12.79 ± 0.64 | |
| 100 | 13.87 ± 0.69 | |
| 200 | 7.17 ± 0.72 | |
| 400 | 5.87 ± 0.59 | |
| 800 | 14.65 ± 0.73 | |
| Чернушка посевная | 25 | 15.62 ± 0.78 |
| 50 | 14.83 ± 0.74 | |
| 100 | 14.61 ± 0.73 | |
| 200 | 10.30 ± 0.52 | |
| 400 | 13.10 ± 0.66 | |
| 800 | 13.25 ± 0.66 | |
| Пырей удлиненный | 25 | 12.89 ± 0.64 |
| 50 | 14.56 ± 0.73 | |
| 100 | 14.58 ± 0.73 | |
| 200 | 8.87 ± 0.44 | |
| 400 | 7.37 ± 0.37 | |
| 800 | 9.50 ± 0.48 |
Ранее было отмечено, что при прорастании регенерантов не все проростки лиственницы сибирской развиваются нормально. Наблюдались растения с нарушениями развития доменов зародыша: гипокотиля, корня и семядолей (Пак и др., 2016; Третьякова и др., 2016). В проведенных нами экспериментах у контрольного варианта растения без отклонения составили только 22% общего числа. При обработке пептидами в большинстве вариантов наблюдалось повышение каллусообразования и снижение формирования нормальных проростков по сравнению с контролем. Доля формирования нормальных проростков, обработанных биопептидами, превышающая контрольную, была отмечена только у 10 вариантов из 18 (табл. 3).
Таблица 3.
Развитие проростков Larix sibirica на среде для прорастания на 28-е сут культивирования
| Источник пептидов | Концентрация, мкг/л | Морфогенный ответ*, % | ||
|---|---|---|---|---|
| каллус | ризогенез | регенерация без аномалий** | ||
| Контроль | – | 35.0 | 48.0 | 22.0 |
| Щирица запрокинутая | 25 | 33.0 | 38.0 | 8.0 |
| 50 | 48.0 | 44.0 | 8.0 | |
| 100 | 36.0 | 50.0 | 23.0 | |
| 200 | 25.0 | 55.0 | 35.0 | |
| 400 | 45.0 | 45.0 | 10.0 | |
| 800 | 25.0 | 85.0 | 65.0 | |
| Чернушка посевная | 25 | 44.0 | 48.0 | 17.0 |
| 50 | 33.0 | 29.0 | 14.0 | |
| 100 | 48.0 | 44.0 | 28.0 | |
| 200 | 45.0 | 55.0 | 15.0 | |
| 400 | 25.0 | 50.0 | 30.0 | |
| 800 | 15.0 | 60.0 | 45.0 | |
| Пырей удлиненный | 25 | 29.0 | 54.0 | 38.0 |
| 50 | 21.0 | 53. 0 | 16.0 | |
| 100 | 50.0 | 38.0 | 17.0 | |
| 200 | 35.0 | 80.0 | 45.0 | |
| 400 | 30.0 | 55.0 | 30.0 | |
| 800 | 45.0 | 80.0 | 35.0 | |
Было обнаружено, что как контрольные регенеранты, так и обработанные БПЭ имеют наплывы в области корня, гипокотиля и на границе корня и гипокотиля (рис. 4). На 28-е сутки культивирования на питательной среде для прорастания наилучший результат был получен у варианта обработки биопрепаратом щирицы запрокинутой (800 мкг/л), пырея удлиненного (200 и 800 мкг/л), где наблюдалось максимальное число регенерантов, сформировавших корень (соответственно 85, 80 и 80%), а также максимальное число нормально сформированных регенерантов (65, 45 и 35% соответственно) (табл. 3). Вариант обработки биопрепаратом чернушки посевной в концентрации 50 мкг/л оказал ингибирующее действие на развитие проростков L. sibirica, где показатели корнеобразования и формирования нормальных регенерантов были ниже, чем в контрольном варианте.
Рис. 4.
Регенеранты Кл4 Larix sibirica на стадии прорастания на средах с добавлением биопрепаратов растительного происхождения на 28-e сут культивирования. а – контроль, базовая среда; б – щирица запрокинутая, 200 мкг/л; в – щирица запрокинутая, 400 мкг/л; г – щирица запрокинутая, 800 мкг/л; д – чернушка посевная, 200 мкг/л; е – чернушка посевная, 400 мкг/л; ж – чернушка посевная, 800 мкг/л; з – пырей удлиненный, 200 мкг/л; и – пырей удлиненный; 400 мкг/л; к – пырей удлиненный, 800 мкг/л. Окончание на следующей странице.

Рис. 4.
Окончание.

Выявлено, что на контрольных регенерантах и регенерантах, обработанных белково-пептидными экстрактами, развивался каллус в области корня. Таким образом, при добавлении антимикробных пептидов растительного происхождения в клеточные культуры L. sibirica большинство опытных вариантов не отличалось от контроля. АМП растительного происхождения не оказали стимулирующего эффекта. Прорастание соматических зародышей в опытах с АМП шло так же, как в контрольном варианте. Однако в вариантах с щирицей запрокинутой (800 мкг/л), пыреем удлиненным (200 и 800 мкг/л) была отмечена стимуляция корнеобразования. Ряд регенерантов, обработанных пептидами, формировали длинные прямые корни. Такие соматические сеянцы были способны укореняться.
Первичная структурная характеристика белково-пептидных компонентов активных экстрактов семян щирицы A. retroflexus и пырея E. elongata. Ранее был исследован состав АМП семян щирицы, в которых был идентифицирован преобладающий в количественном отношении пептид Ar-AMP, принадлежащий к подсемейству 6-цистеиновых гевеиноподобных антимикробных пептидов с хитинсвязывающим доменом (Lipkin et al., 2005). Данный пептид, обладающий выраженными антимикробными свойствами по отношению к ряду грибных фитопатогенов in vitro, – гомолог идентифицированного на начальных этапах исследования растительных АМП молекуле Ac-AMP2 из близкородственного вида Amaranthus caudatus, структура и функциональная активность которого были детально изучены ранее (Broekaert et al., 1992; de Bolle et al., 1993; Martins et al., 1996). Кроме того, семена вида A. caudatus богаты источником других защитных пептидов, обладающих помимо антимикробных (содержание липидпереносящих белков) свойствами ингибиторов протеиназ, а также прямым инсектотоксическим действием за счет наличия лектинов и ингибиторов гидролитических ферментов насекомых (Rinderle et al., 1990; Hejgaard et al., 1994; del Carmen Ramírez-Medeles et al., 2003; Conforti et al., 2005).
Пырей удлиненный E. eliongata в первую очередь исследовался как донор генов в традиционной селекции при создании полиплоидных форм культурных злаков, в частности пшеницы Triticum aestivum (He et al., 2017; Yang et al., 2017), а также как источник генетического материала, обеспечивающего повышенную устойчивость к солевому стрессу (Colmer et al., 2006). Характерно, что ранее не исследовался белково-пептидный состав данного вида (поиск и характеристика защитных белков и пептидов). Аналогичное заключение можно сделать и в отношении близкородственного вида E. elongata – злостного сорного растения Agropyron repens. Мы провели масс-спектрометрический анализ БПЭ колосьев пырея, в результате которого идентифицировали набор молекулярных масс в пептидном диапазоне (3.1–9.6 кДа). Хорошо известно, что у большинства защитных пептидов отмечена довольно определенная привязка к молекулярной массе. Это выражается в том, что молекулы, принадлежащие к определенному семейству АМП, характеризуются достаточно узким диапазоном молекулярных масс. Наши данные позволяют предположить локализацию в колосьях пырея пептидов, принадлежащих к семействам растительных дефензинов, тионинов, липидпереносящих белков (подсемейства I и II), а также ряда ингибиторов гидролаз типа Боуман–Бирка, Кунитца и бифункциональных ингибиторов трипсина/α-амилазы злаков. Дальнейшие исследования позволят выделить и структурно идентифицировать пептидные молекулы, в том числе обеспечивающие рострегулирующие свойства (сигнальную активность) при их аппликации на хвойных растениях.
ЗАКЛЮЧЕНИЕ
Впервые получены соматические сеянцы лиственницы сибирской в результате обработки их пептидами растительного происхождения. Выявлено, что наличие в питательной среде АМП исследованных видов растений не ингибирует образование эмбриогенных культур лиственницы сибирской.
Контрольные регенеранты и варианты, обработанные БПЭ, имели наплывы в области корня, гипокотиля, а также на границе корня и гипокотиля. АМП растительного происхождения не оказали стимулирующего эффекта. Дальнейшие наблюдения за ростом соматических сеянцев позволят определить устойчивость их к фитопатогенам при выращивании в теплице и в лесопитомнике.
Исследование выполнено в рамках бюджетного проекта ФГБНУ ИЛ СО РАН, ФИЦ КНЦ СО РАН (проект № 0356-2017-0741) и при финансовой поддержке Российского фонда фундаментальных исследований, Правительства Красноярского края, Красноярского краевого фонда науки в рамках научных проектов № 16-44-240509 “Разработка биотехнологии получения устойчивых к грибным болезням и вредителям эмбриогенных культур лиственницы сибирской с использованием защитных антимикробных пептидов in vitro” и № 18-44-243004 “Изучение влияния биологически активных пептидов растительного и микробного происхождения на рост и развитие хвойных in vitro в раннем онтогенезе”.
Список литературы
Егоров Ц.А., Одинцова Т.И. Защитные пептиды иммунитета растений // Биоорган. химия. 2012. Т. 38. № 1. С. 7–17.
Круглова Н.Н., Егорова О.В., Сельдимирова Д.Ю., Зайцев Д.Ю., Зинатуллина А.Е. Световой микроскоп как инструмент в биотехнологии растений: Ин-т биологии Уфимского НЦ РАН; ООО “Консалтинговая фирма "Микроскоп Плюс”. Уфа: Гилем, 2013. 128 с.
Лакин Г.Ф. Биометрия. М.: Высш. шк., 1973. 343 с.
Ощепкова Ю.И., Вешкурова О.Н., Рогожин Е.А., Мусолямов А.Х., Смирнов А.Н., Одинцова Т.И., Егоров Ц.А., Гришин Е.В., Салихов Ш.И. Выделение липидпереносящего белка Ns-LTP1 из семян чернушки посевной (Nigella sativa) // Биоорган. химия 2009, Т. 35. № 3. С. 344–349.
Пак М.Э., Иваницкая А.С., Двойнина Л.М., Третьякова И.Н. Эмбриогенный потенциал длительно пролиферирующих клеточных линий Larix sibirica in vitro // Сиб. лес. журн. 2016. № 1. С. 27–38.
Рогожин Е.А., Одинцова Т.И., Мусолямов А.Х., Смирнов А.Н., Бабаков А.В., Егоров Ц.А., Гришин Е.В. Выделение и характеристика нового липидпереносящего белка из зерновок ежовника обыкновенного (Echinochloa сrusgalli) // Прикл. биохимия и микробиология. 2009. Т. 45. № 4. С. 403–409.
Третьякова И.Н. Способ микроклонального размножения лиственницы сибирской в культуре in vitro через соматический эмбриогенез на среде АИ для плантационного лесовыращивания. Патент РФ RU 2456344 C2. М.: Федеральная служба по интеллектуальной собственности, 2012.
http://www.freepatent.ru/images/patents/5/2456344/patent-2456344.pdf
Третьякова И.Н. Эмбриогенные клеточные линии и соматический эмбриогенез в культуре in vitro у лиственницы сибирской // Докл. РАН. 2013. Т. 450. № 1. С. 122.
Третьякова И.Н., Барсукова А.В. Соматический эмбриогенез в культуре in vitro трех видов лиственницы // Онтогенез. 2012. Т. 43. № 6. С. 425–425.
Третьякова И.Н., Барсукова А.В. Соматический эмбриогенез лиственниц и кедра сибирского в Сибири // Лесоведение. 2015. № 6. С. 63–70.
Третьякова И.Н., Пак М.Э. Соматический полиэмбриогенез Larix sibirica в эмбриогенной культуре in vitro // Онтогенез. 2018. Т. 49. № 4. С. 1–13.
Третьякова И.Н., Пак М.Э., Иваницкая А.С., Орешкова Н.В. Особенности соматического эмбриогенеза длительно пролиферирующих эмбриогенных клеточных линий Larix sibirica in vitro // Физиология растений. 2016. Т. 63. № 6. С. 812–822.
Broekaert W.F., Mariën W., Terras F.R., De Bolle M.F., Proost P., Van Damme J., Dillen L., Claeys M., Rees S.B., Vanderleyden J. Antimicrobial peptides from Amaranthus caudatus seeds with sequence homology to the cysteine/glycine-rich domain of chitin-binding proteins // Biochemistry. 1992. V. 31. № 17. P. 4308–4314.
Cairney J., Pullman G.S. The cellular and molecular biology of conifer embryogenesis // New Phytologist. 2007. V. 176. № 3. P. 511–536.
Colmer T.D., Flowers T.J., Munns R. Use of wild relatives to improve salt tolerance in wheat // J. Exp. Bot. 2006. V. 57. № 5. P. 1059–1078.
Conforti F., Statti G., Loizzo M.R., Sacchetti G., Poli F., Menichini F. In vitro antioxidant effect and inhibition of alpha-amylase of two varieties of Amaranthus caudatus seeds // Biol. Pharm. Bull. 2005. V. 28. № 6. P. 1098–1102.
De Bolle M.F., David K.M., Rees S.B., Vanderleyden J., Bruno P., Camue A., Broekaert W.F. Cloning and characterization of a cDNA encoding an antimicrobial chitin-binding protein from amaranth, Amaranthus caudatus // Plant. Mol. Biol. 1993. V. 22. № 6. P. 1187–1190.
del Carmen Ramírez-Medeles M., Aguilar M.B., Miguel R.N., Bolaños-García V.M., García-Hernández E., Soriano-García M. Amino acid sequence, biochemical characterization, and comparative modeling of a nonspecific lipid transfer protein from Amaranthus hypochondriacus // Arch Biochem. Biophys. 2003. V. 415. № 1. P. 24–33.
Egorov T.A., Odintsova T.I., Pukhalsky V.A., Grishin E.V. Diversity of wheat anti-microbial peptides // Peptides. 2005. V. 26. P. 2064–2073.
He F., Xing P., Bao Y., Ren M., Liu S., Wang Y., Li X., Wang H. Chromosome pairing in hybrid progeny between Triticum aestivum and Elytrigia elongata // Front Plant Sci. 2017. V. 8. P. 2161.
Hejgaard J., Dam J., Petersen L.C., Bjørn S.E. Primary structure and specificity of the major serine proteinase inhibitor of amaranth (Amaranthus caudatus L.) seeds // Biochim. Biophys. Acta. 1994. V. 1204. № 1. P. 68–74.
Klimaszewska K., Cyr D.R., Sutton B.C.S. Influence of gelling agents on culture medium gel strength, water availability, tissue water potential, and maturation response in embryogenic cultures of Pinus strobus L. // In vitro Cell. Develop. Biol. Plant. 2000. V. 36. № 4. P. 279–286.
Klimaszewska K., Noceda C., Pelletier G., Label P., Rodriguez R., Lelu-Walter M.A. Biological characterization of young and aged embryogenic cultures of Pinus pinaster // In vitro Cell. Develop. Biol. Plant. 2008. V. 45. № 20. P. 20–33.
Lelu M.A., Bastien C., Klimaszewska K., Ward C., Charest P.J. An improved method for somatic plantlet production in hybrid larch (Larix × leptoeuropaea). Pt 1. Somatic embryo maturation // Plant Cell Tiss. Organ Cult. 1994. V. 36. № 1. P. 107–115.
Lelu-Walter M.A., Pâques L.E. Simplified and improved somatic embryogenesis of hybrid larches (Larix × Eurolepis and Larix × Marschlinsii). Perspectives for breeding // Ann. For. Sci. 2009. V. 66. P. 104–114.
Lelu-Walter M.A., Bernier-Cardou M., Klimaszewska K., Ward C., Charest P.J. Clonal plant production from self-and cross-pollinated seed families of Pinus sylvestris (L.) through somatic embryogenesis // Plant Cell, Tissue and Organ Culture. 2008. V. 92. № 1. P. 31–45.
Lipkin A., Anisimova V., Nikonorova A., Babakov A., Krause E., Bienert M., Grishin E., Egorov T. An antimicrobial peptide Ar-AMP from amaranth (Amaranthus retroflexus L.) seeds // Phytochemistry. 2005. V. 66. № 20. P. 2426–2431.
Martins J.C., Maes D., Loris R., Pepermans H.A., Wyns L., Willem R., Verheyden P. NMR study of the solution structure of Ac-AMP2, a sugar binding antimicrobial protein isolated from Amaranthus caudatus // J. Mol. Biol. 1996. V. 258. № 2. P. 322–333.
Odintsova T.I., Rogozhin E.A., Baranov Yu.V., Musolyamov A.Kh., Yalpani N., Egorov T.A., Grishin E.V. Seed defensins of barnyard grass Echinochloa crusgalli (L.) Beauv // Biochimie. 2008. V. 90. P. 1667–1673.
Odintsova T.I., Vassilevski A.A., Slavokhotova A.A., Musolyamov A.K., Finkina E.I., Khadeeva N.V., Rogozhin E.A., Korostyleva T.V., Pukhalsky V.A., Grishin E.V., Egorov T.A. A novel antifungal hevein-type peptide from Triticum kiharae seeds with a unique 10-cysteine motif // FEBS J. 2009. V. 276. № 15. P. 4266–4275.
Pullman G.S., Bucalo K. Chapter 19: Pine somatic embryogenesis using zygotic embryos as explants / Plant Embryo Culture // Meth. Protocols, Meth. Mol. Biol. 2011. V. 710. P. 267–291.
Rinderle S.J., Goldstein I.J., Remsen E.E. Physicochemical properties of amaranthin, the lectin from Amaranthus caudatus seeds // Biochemistry. 1990. V. 29. № 46. P. 10555–10561.
Rogozhin E.A., Oshchepkova Y.I., Odintsova T.I., Khadeeva N.V., Veshkurova O.N., Egorov T.A., Grishin E.V., Salikhov S.I. Novel antifungal defensins from Nigella sativa L. seeds // Plant Physiol. Biochem. 2011. V. 49. № 2. P. 131–137.
Slavokhotova A.A., Odintsova T.I., Rogozhin E.A., Musolyamov A.K., Andreev Y.A., Grishin E.V., Egorov T.A. Isolation, molecular cloning and antimicrobial activity of novel defensins from common chickweed (Stellaria media L.) seeds // Biochimie. 2011. V. 93. № 3. P. 450–456.
Slavokhotova A.A., Rogozhin E.A., Musolyamov A.K., Andreev Y.A., Oparin P.B., Berkut A.A., Vassilevski A.A., Egorov T.A., Grishin E.V., Odintsova T.I. Novel antifungal α-hairpinin peptide from Stellaria media seeds: structure, biosynthesis, gene structure and evolution // Plant Mol. Biol. 2014. V. 84(1–2). P. 189–202.
Von Aderkas P., Anderson P. Aneuploidy and polyploidization in haploid tissue cultures of Larix decidua // Physiol. Plant. 1993. V. 88. № 1. P. 73–77.
Von Aderkas P., Pattanavibool, R., Hristoforoglu K., Ma Y. Embryogenesis and genetic stability in long term megagametophyte-derived cultures of larch // Plant Cell, Tiss. Organ Cult. 2003. V. 75. № 1. P. 27–34.
Yang Y., Fan X., Wang L., Zhang H.Q., Sha L.N., Wang Y.1., Kang H.Y., Zeng J., Yu X.F., Zhou Y.H. Phylogeny and maternal donors of Elytrigia Desv. sensu lato (Triticeae; Poaceae) inferred from nuclear internal-transcribed spacer and trnL-F sequences // BMC Plant Biol. 2017. V. 17. № 1. P. 207.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


