Известия РАН. Серия биологическая, 2020, № 3, стр. 293-300
Физиологические основы питательной ценности концентрата личинок Hermetia illucens в рационе рыб
Н. А. Ушакова 1, *, С. В. Пономарев 2, Ю. В. Федоровых 2, А. И. Бастраков 1, Д. С. Павлов 1
1 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
2 Астраханский государственный технический университет
164140 г. Астрахань, ул. Татищева, 56, Россия
* E-mail: naushakova@gmail.com
Поступила в редакцию 12.11.2018
После доработки 16.08.2019
Принята к публикации 16.08.2019
Аннотация
В физиологических опытах по оценке переваримости концентрата личинок Hermetia illucens у рыб с желудочно-кишечным пищеварением (радужной форели Oncorhynchus mykiss, русского осетра Acipenser gueldenstaedtii, красной тиляпии Oreochromis mosambicus × O. niloticus) установлено, что данный показатель составил 67–74%. Отмечено, что потребление протеина личинок всеми рыбами – 91–97%, переваримость остаточного жира – 90–94%, легкогидролизуемых углеводов – 52–68%. Обнаружено, что хитин насекомого переваривался на 25–35% и не оказал негативного влияния на пищеварение протеина и жира у исследованных видов рыб. Показатели переваривания концентрата личинок H. illucens, протеина и легкоусвояемых углеводов у красной тиляпии достоверно выше, чем у радужной форели, а у русского осетра носили промежуточный характер по сравнению с тиляпией и форелью. Это соответствовало продолжительности прохождения пищи по кишечному тракту, которая у тиляпии, осетра и форели составляла соответственно 7.8, 9.6, и 15.7 ч. Степень перевариваемости форелью жира и хитина была достоверно выше таковой у других видов рыб.
В настоящее время переваримость насекомых особенно актуальна в связи с использованием их в качестве белкового корма для рыб, рептилий, птиц и других животных (Müller et al., 2017). Большое внимание уделяется возможности использования личинок мухи черная львинка Hermetia illucens в рационах рыб (Bondari, Sheppard, 1987; St-Hilaire et al., 2007; Sealey et al., 2011). Эти личинки содержат в зависимости от стадии развития и субстрата, на котором они выращивались, 35–45% протеина, 25–40% жира, до 15% безазотистых экстрагируемых углеводов и 5–9% хитина – азотсодержащего полисахарида кутикулы (Diener et al., 2009; Tschirner, Simon, 2015; Бастраков и др., 2016; Liu et al., 2017).
Питательная ценность личинок черной львинки во многом определяется способностью рыб переваривать основные компоненты личинок (протеин, жир, углеводы, включая хитин), что связано с возможностями пищеварительного тракта рыб. Особенность эффективного искусственного питания рыб – высокий уровень в корме протеина, который составляет 40–50%, а в период интенсивного роста – 55– 60% (Пономарев и др., 2013). При введении личинок черной львинки в корма рыб в качестве основного источника протеина, обеспечивающего их полноценное питание, одновременно существенно увеличивается содержание липидов львинки. Особенность липидов H. illucens – доминирование насыщенных жирных кислот (Ушакова и др., 2016). Для большинства видов рыб к незаменимым жирным кислотам относят полиненасыщенные ряда ω3 (линоленовые), которые образуют липидную мембрану клеток и отвечают за ее проницаемость при температуре водной среды 0–26°С. Потребность рыб в эссенциальных жирных кислотах составляет 1–1.5% массы корма (Щербина, Гамыгин, 2006). При замещении таких кислот твердыми насыщенными кислотами клеточные мембраны работают не должным образом. Поэтому присутствие в корме повышенного количества насыщенных жирных кислот личинок H. illucens может отрицательно сказаться на метаболизме рыб. Перспективный кормовой элемент – концентрат, полученный после обезжиривания личинок. При этом в концентрате повышается массовая доля не только протеина, но и углеводов, включая труднопереваримый хитин, влияние которого на кормовую ценность концентрата личинок в настоящее время не изучено.
Несмотря на множество опубликованных данных о ферментативных системах рыб с желудочно-кишечным пищеварением, информация о переваримости таких труднодоступных ферментам нутриентов, как хитин, крайне ограничена. Хитиназа, расщепляющая гликозидные связи хитина, секретируется у некоторых видов рыб, ракообразных, рептилий, амфибий, птиц и млекопитающих, в рационах которых присутствуют хитинсодержащие организмы (Jauniaux, 1993; Strobel et al., 2013; Caligiani et al., 2018). Однако не ясно, в какой степени ферменты пищеварительного тракта могут быть активны в отношении хитина личинок черной львинки. Подобно хитину ракообразных, который образует комплекс с протеинами и минералами (главным образом кальцием) (Johnson, Peniston, 1982; No et al., 1989), хитин кутикулы личинок львинки как представителя семейства Stratiomyidae связан с кальцием, протеинами, а также липидами и пигментами (Тыщенко, 1986; Kramer et al.,1995). Некоторые авторы считают, что такие комплексы могут негативно повлиять на доступ хитиназы или протеиназы к их субстратам и снизить усвоение не только хитина, но и протеинов и липидов (Tanaka et al., 1997).
Ранее нами был проведен опыт по 100%-ной замене в рационе молоди красной тиляпии (гибрид альбиносных самок мозамбикской Oreochromis mossambicus и самцов нильской O. niloticus тиляпии) рыбной муки на концентрат личинок черной львинки (Ушакова и др., 2018). Полнорационный экспериментальный корм для рыб включал в себя вместо 45% рыбной муки такое же количество концентрата личинок. Массовая доля хитина насекомого в полученной кормовой смеси составила 8.24%. По результатам выращивания молоди не было выявлено статистически достоверных различий в рыбоводно-биологических и физиолого-биохимических показателях для контрольной и опытной групп рыб (масса рыбы в начале и в конце эксперимента, абсолютный и среднесуточный прирост, коэффициент массонакопления, кормовой коэффициент, биохимические параметры крови), что свидетельствовало об адекватности полной замены рыбной муки на концентрат личинок черной львинки. Поскольку высокое содержание труднопереваримого хитина в составе концентрата личинок должно было бы снизить его кормовую ценность (что не подтвердилось в описанном эксперименте), было предположено, что эффективность выращивания молоди красной тиляпии на рационе с концентратом личинок черной львинки связана с возможностью переваривания хитина и высокой питательной ценностью остальных компонентов корма.
Цель работы – изучение перевариваемости питательных веществ частично обезжиренного концентрата личинок черной львинки в рационе рыб с желудочно-кишечным типом пищеварения.
МАТЕРИАЛЫ И МЕТОДЫ
Химический состав и питательная ценность частично обезжиренного концентрата личинок черной львинки H. illucens – продукта прямого отжима сухой биомассы насекомого (Экобелок, Россия) – представлены в табл. 1. Состав анализировали в отделе физиологии и биохимии сельскохозяйственных животных ФНЦ ВИЖ им. Л.К. Эрнста по общепринятым методикам (табл. 1). Результаты параллельных измерений получены в условиях сходимости при 5%-ном пороге повторяемости при доверительной вероятности Р = 0.95 (Арефьева, 2017). В концентрате содержалось 50.8% протеина, 7.6% жира, 21.4% безазотистых углеводов, 7.8% хитина.
Таблица 1.
Химический состав и питательная ценность белкового концентрата личинок черной львинки Hermetia illucens
| Показатель | Содержание, г/кг | Источник |
|---|---|---|
| Первоначальная влага | 17.4 | ГОСТ Р 54951-2012* |
| ВСВ | 982.6 | ГОСТ 31640-2012* |
| Протеин | 508.5 | ГОСТ 32044.1-2012* |
| Хитин | 78.31 | ГОСТ 31675-2012* |
| Жир | 76.45 | ГОСТ 32905-2014* |
| БЭВ | 214.5 | Расчетный метод |
| Зола | 61.71 | ГОСТ 32933-2014* |
Примечание. ВСВ – воздушно-сухое вещество, БЭВ – безазотистые экстрактивные вещества; для табл. 1–3. * – см. список литературы.
Объектами исследований служили рыбы с желудочно-кишечным пищеварением, разводимые в условиях замкнутого водоснабжения, – сеголетки красной тиляпии Oreochromis mosambicus × O.niloticus, радужной форели Oncorhynchus mykiss и годовики русского осетра Acipenser gueldenstaedtii. Было проведено два опыта. Начальная масса и длина рыб (Правдин, 1966) составляли: красная тиляпия в опыте 1 – 93.1 г и 17.04 см, в опыте 2 – в 98.1 г и 17.28 см соответственно; радужная форель в опыте 1 – 50.4 г и 16.83 см, в опыте 2 – 61.2 г и 17.24 см соответственно; русский осетр в опыте 1 – 273.1 г и 32.16 см, в опыте 2 – 279.6 г и 32.23 см соответственно. В эксперименте использовали конусообразные емкости объемом 200 л с искусственными аэрацией и фильтрацией, а также c подогревом (для тиляпии и осетра). Сливной шланг установки был снабжен зажимом для возможности сбора фекалий.
Гидрохимический и термический режим поддерживали на уровне оптимальных значений для каждого объекта (Хрусталев и др., 2017). Температура воды в аквариумах с красной тиляпией составляла 26–28°С, c русским осетром – 21–22°С, c радужной форелью – 15–16°С. Содержание кислорода в воде и ее температуру устанавливали с помощью термооксиметра СyberScanDO 300 (Eutech Instruments, Голландия), значения рН определяли с помощью рН-метра (Hanna Instruments, Германия).
Перевариваемость компонентов концентрата личинок черной львинки определяли на рыбах in vivo балансовым методом, т.е. прямым учетом количества съеденной пищи и выделенных экскрементов (Карзинкин, 1932; Карзинкин, Кривобок, 1955; Щербина, Гамыгин, 2006). Для этого в каждом опыте в качестве корма рыбам давали точно учтенное количество этого концентрата без каких-либо добавок в зависимости от средней начальной массы рыб. Количество корма рассчитывали исходя из суточной нормы корма для старших возрастных групп, составляющей 3% массы тела. Для этого среднюю массу особей умножали на общее число рыб. Опыт был проведен в два этапа – подготовительный и учетный. На подготовительном этапе у рыб достигалось полное удаление из пищеварительного тракта остатков предыдущего корма. Его продолжительность, как и продолжительность учетного этапа, составила 3 сут. На этом этапе учитывали количество съеденного корма, его остаток и количество выделенных экскрементов. Остаток корма отбирали сифоном сразу после кормления, когда рыба теряла к нему интерес и переставала его потреблять, высушивали при 60°C. Корм давали в начале подготовительного и в начале учетного этапов опыта. Число рыб каждого вида в опыте – 25.
Потребленный корм определяли по разности сухой массы полученного рыбами корма и его остатка. Так как в конце учетного этапа остатков корма не было, то в расчетах принимали, что масса потребленного корма – это масса полученного рыбами концентрата личинок. Также учитывали количество выделенных за опыт экскрементов и определяли их химический состав. Биохимические анализы проводили согласно общепринятым методикам (табл. 1). Количество хитина оценивали методом определения клетчатки. Легкогидролизуемые углеводы были представлены суммарным показателем безазотистых экстрактивных веществ (БЭВ).
На основе данных о массе и составе потребленного корма и выделенных экскрементов рассчитывали количество потребленных питательных веществ. Количество переваренных веществ – коэффициент переваримости (КП) – определяли как отношение переваренной части рациона (потребленного питательного вещества) к полученной с кормом:
где а – количество потребленного питательного вещества, б – количество выделенных экскрементов (Щербина и др., 1982).
Продолжительность прохождения пищи по желудочно-кишечному тракту (ЖКТ) определяли с фиксированием времени захвата пищи и выхода последней порции экскрементов. Разность времени начала питания и времени полного освобождения кишечника от пищи принимали за продолжительность переваривания (Карзинкин, 1932; Бокова, 1938; Карзинкин, Кривобок, 1955).
Статистические параметры (средняя величина, стандартное отклонение), используемые в экспериментах, вычисляли с помощью программы Excel и Statistica v 6.0. Достоверность отличий оценивали по критерию Стьюдента (Лакин, 1990).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты исследования длительности полного прохождения корма (белкового концентрата личинок мухи черная львинка H. illucens) по кишечнику у тиляпии, русского осетра и форели представлены на рис. 1. Среднее время прохождения пищи у тиляпии составило 7.8 ± 0.6 ч (при температуре воды 26–28°C), а у русского осетра 9.6 ± 0.4 ч (при температуре воды 21–22°C), что несколько больше, чем у тиляпии, но значительно меньше, чем у форели, у которой время прохождения пищи по кишечнику 15.7 ± 0.2 ч (при температуре воды 15–16°C).
Рис. 1.
Время полного прохождения концентрата личинок Hermetia illucens по желудочно-кишечному тракту исследуемых видов рыб. 1, 2 – опыты 1 и 2 соответственно.
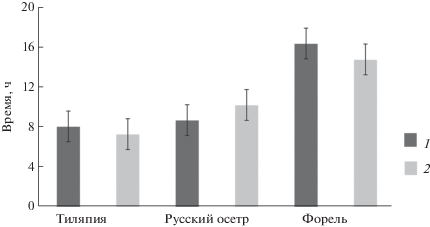
Биохимический состав экскрементов рыб, потреблявших концентрат личинок, приведен в табл. 2. Коэффициенты переваримости у рыб всех исследованных видов достоверно не различались в опытах 1 и 2, что позволило обобщить и усреднить данные по перевариваемости компонентов концентрата между двумя опытами (табл. 3).
Таблица 2.
Химический состав экскрементов рыб
| Показатель, г | Опыт* | |||||
|---|---|---|---|---|---|---|
| 1 | 2 | 1 | 2 | 1 | 2 | |
| Масса корма экскрементов |
Тиляпия | Русский осетр | Форель | |||
| 53.25 13.12 |
64.2 17.18 |
213.4 53.94 |
242.1 65.43 |
74.2 23.49 |
77.9 26.36 |
|
| Переварено корма | 40.13 (5.4)** |
47.02 (73.2)** |
159.46 (74.7)** |
176.67 (73)** |
50.71 (68.3)** |
51.54 (66.2)** |
| Первоначальная влага | 2.18 ± 0.01 | 3.96 ± 0.012 | 8.99 ± 0.86 | 15.1 ± 0.67 | 3.91 ± 0.008 | 6.08 ± 0.012 |
| ВСВ | 10.93 ± 0.94 | 13.22 ± 0.23 | 44,95 ± 0.94 | 50.33 ± 1.17 | 19.57 ± 0.96 | 20.28 ± 1.03 |
| Протеин | 0.81 ± 0.001 (97)** |
0.97 ± 0.002 (97.4)** |
5.42 ± 0.01 (95)** |
6.16 ± 0.08 (95)** |
3.4 ± 0.02 (91)** |
3.56 ± 0.07 (91)** |
| Жир | 0.4 ± 0.004 (89.9)** |
0.49 ± 0.001 (90.)** |
0.82 ± 0.009 (94.9)** |
0.93 ± 0.006 (94.9)** |
0.42 ± 0.001 (92.6)** |
0.45 ± 0.006 (92.4)** |
| БЭВ | 3.66 ± 0.012 (68)** |
4.41 ± 0.036 (68)** |
14.64 ± 0.98 (68)** |
16.62 ± 1.13 (68)** |
7.64 ± 0.12 (52.9)** |
8.02 ± 0.26 (52)** |
| Хитин | 3.13 ± 0.04 (24.6)** |
3.77 ± 0.07 (24.7)** |
11.36 ± 0.09 (31.8)** |
12.89 ± 0.36 (31.7)** |
3.67 ± 0.03 (36.6)** |
3.97 ± 0.009 (34.7)** |
| Зола | 2.93 ± 0.027 | 3.57 ± 0.009 | 12.7 ± 0.19 | 13.74 ± 1.1 | 4.12 ± 0.02 | 4.31 ± 0.02 |
Таблица 3.
Усредненная переваримость питательных веществ концентрата личинок черной львинки Hermetia illucens
| Показатель | Перевариваемость, % | ||
|---|---|---|---|
| Тиляпия | Русский осетр | Форель | |
| Концентрат личинок | 74 ± 2.4 | 74 ± 1.8 | 67 ± 2.1** |
| Протеин | 97 ± 2.1 | 95 ± 2.1 | 91 ± 2.19** |
| Жир | 90 ± 1.9 | 93 ± 2.1 | 94 ± 3.1 |
| БЭВ | 68 ± 2.3 | 68 ± 1.9 | 52 ± 3.0* |
| Хитин | 25 ± 1.75 | 32 ± 1.8 | 35 ± 2.7*** |
| Время полного прохождения концентрата личинок по ЖКТ, ч | 7.8 ± 0.6 | 9.6 ± 0.4 | 15.7 ± 0.2* |
Расчетные показатели перевариваемости протеина концентрата личинок черной львинки составили 91% у форели, 95% у осетра и 97% у тиляпии. Также хорошо использовались остаточные жиры концентрата. В ходе экспериментов было установлено, что липиды экспериментального корма обладали высокой доступностью и были усвоены на 90% у тиляпии, на 92% у осетра и на 94% у форели. Коэффициент переваримости легкогидролизуемых углеводов концентрата личинок у тиляпии и русского осетра составил 68, у форели – 52%.
Выявлено, что у тиляпии перевариваемость хитина 25, у осетра – 32, у форели – 35%. Достоверно более высокий коэффициент перевариваемости хитина у форели по сравнению с таковым у тиляпии можно объяснить различиями в активности пищеварительных ферментов у этих видов рыб, особенностями строения ЖКТ, составом их кормового рациона в природных условиях. В желудке форели, питающейся хитинсодержащими беспозвоночными, в том числе насекомыми, обнаружена хитиназа (Kapoor et al., 1975). Участие этого фермента может определять выявленный уровень перевариваемости хитина, несмотря на короткий кишечник, относительная длина которого (отношение длины кишечника к длине тела) составляет у форели 0.7–1.0 (Щербинина, Гамыгин, 2006). Эффективности ферментативного расщепления хитина может также способствовать длительный период полного прохождения пищи по кишечнику форели (15.7 ч), позволяющий пищеварительным ферментам работать дольше.
В отличие от форели у всеядной тиляпии, которая хорошо использует корма как растительного, так и животного происхождения (Куракин и др., 2015), относительная длина кишечника составляет 4.9–5.4 ед. (Завьялов, 2001). Однако время прохождения пищи по кишечнику 7.8 ч. Но, хотя в рационе тиляпии присутствуют и насекомые, и мелкие ракообразные типа артемии, времени нахождения в пищеварительном тракте, видимо, недостаточно для более полного расщепления этого полисахарида.
Показатели перевариваемости хитина у осетра носили промежуточный характер между таковыми у тиляпии и форели. Возможно, это связано с более продолжительным временем прохождения пищи по ЖКТ у осетра (9.6 ч) по сравнению с тиляпией, но меньшим, чем у форели. Отмеченная способность осетра частично переваривать хитин свидетельствует о присутствии ферментов, способных расщеплять хитиновые компоненты корма.
Полученные результаты не противоречат имеющимся литературным данным. Длительность прохождения корма через пищеварительный тракт – один из важных показателей функционирования пищеварительной системы рыб, по которому можно определить влияние корма на моторику ЖКТ. Опубликовано много данных, характеризующих скорость продвижения пищи по пищеварительному тракту желудочных рыб (Мантейфель и др., 1965; Привольнев, 1969; Киселев, Рекубратский, 1982; Пономарев и др., 2013), которая зависит от потребленной массы и от времени расщепления компонентов корма пищеварительными ферментами. При этом скорость гидролиза как углеводных, так и белковых составляющих в большой степени определяется составом пищи. Известно, что у форели коэффициенты переваримости белков составляют 76–84% при питании рачками, личинками ручейников и хирономид, а при использовании в рационе комбикормов этот диапазон шире (65–91%); у осетровых рыб коэффициенты переваримости комбикормового сырья составляют 62–95%, у тиляпии – 53–97% (Колобова, 1997). Переваримость концентрата личинок черной львинки у исследованных видов рыб составила 74% для тиляпии и русского осетра и 67% для форели, при этом использование протеина личинок черной львинки у всех рыб было >90%, что свидетельствует о высокой кормовой ценности концентрата личинок, протеин которых переваривается рыбами практически полностью.
К легкопереваримым веществам кроме протеинов относятся жиры. В случае оптимального содержания жиров в корме коэффициенты их переваримости близки к аналогичным показателям для белка (Щербина, Гамыгин, 2006). Остаточный жир в концентрате личинок черной львинки переваривался на 90–94%, что соответствует ранее опубликованным данным.
Всасывание углеводов в пищеварительном тракте начинается после их расщепления до моносахаридов гидролитическими ферментами, при этом на степень утилизации углеводов влияют видовая принадлежность рыбы и химическая структура гидролизуемого вещества (Сорвачев, 1982). Перевариваемость исследуемыми видами рыб безазотистых экстрактируемых веществ (БЭВ) концентрата личинок черной львинки составила 52–67%. Поскольку легкопереваримые углеводы личинок черной львинки представлены в основном гликогеном (Тыщенко, 1986), перевариваемость которого у рыб >90% (Гамыгин, 1996; Щербина, Гамыгин, 2006), очевидно, что кроме гликогена в составе БЭВ концентрата личинок львинки присутствуют также плохо перевариваемые вещества, что требует специального исследования.
Структурные полисахариды, объединенные в группу трудногидролизуемых углеводов, к которым относится хитин, мало доступны пищеварительным ферментам, возможно, из-за отсутствия у многих видов рыб соответствующих ферментных систем. Однако известны результаты исследований, показывающие высокую переваримость креветочной и крабовой муки, на которую не повлияло наличие хитина и хитинсодержащих веществ. Так, были получены данные об увеличении усвоения протеина при кормлении трески крабовой мукой, содержащей 3% хитина, или креветочной мукой с 10% хитина. Добавление от 1 до 10% хитина в корма простимулировали рост карпа, японского угря, желтохвоста и пагра (Gopalakannan, Arul, 2006; Fines, Holt, 2010). Хитиновые оболочки беспозвоночных и насекомых расщепляются под действием как ферментов микрофлоры, так и панкреатических и кишечных ферментов, что доказывает присутствие специфической хитиназы в желудке форели (Kapoor et al., 1975). Выявленная частичная перевариваемость хитина черной львинки всеми видами исследуемых рыб свидетельствует о некоторой его питательной ценности, в том числе как дополнительного источника аминного азота.
ЗАКЛЮЧЕНИЕ
Эффективное использование рыбами с желудочно-кишечным пищеварением концентрата личинок черной львинки H. illucens и его компонента протеина является научным обоснованием возможности замены рыбной муки на высокобелковые муку или обезжиренный протеин из личинок, несмотря на относительно высокое содержание в них хитина. Впервые показано, что хитин может использоваться рыбами как дополнительный питательный элемент корма, который не препятствует пищеварению и не снижает кормовой ценности насекомого. Жир личинок также практически полностью переваривается, в большей степени у холодноводной форели, что вызвано необходимостью обеспечения энергетических потребностей рыбы. Форель отличается высоким показателем перевариваемости хитина черной львинки (35%), что может определяться длительным прохождением пищи по ЖКТ, позволяющим пищеварительным ферментам более полно расщеплять этот полисахарид.
Работа выполнена при финансовой поддержке ФАНО России, тема АААА-А18-118042490053-3.
Список литературы
Арефьева Р.П. Метрология в химическом анализе: Учебное пособие. Н. Новгород: ННГУ, 2017. 60 с.
Бастраков А.И., Донцов А.Е., Ушакова Н.А. Муха черная львинка Hermetia illucens в условиях искусственного разведения – возобновляемый источник меланин-хитозанового комплекса // Изв. УфимНЦ РАН. Биология, биохимия и генетика. 2016. № 4. С. 77–79.
Бокова Е.Н. Суточное потребление и скорость переваривания корма воблой // Рыб. хоз-во. 1938. № 6. С. 29–32.
Гамыгин Е.А. Кормление лососевых рыб в индустриальной аквакультуре: Дис. в виде науч. докл. докт. биол. наук. М.: ВНИИПРХ, 1996. 76 с.
ГОСТ 31640-2012 Корма. Методы определения содержания сухого вещества (с поправкой) (дата введения 2013-07-01). М.: Стандартинформ, 2012.
ГОСТ Р 54951-2012 (ИСО 6496:1999) Корма для животных. Определение содержания влаги (дата введения 2013-07-01). М.: Стандартинформ, 2013.
ГОСТ 31675-2012 Корма. Методы определения содержания сырой клетчатки с применением промежуточной фильтрации (дата введения 2013-07-01). М.: Стандартинформ, 2014.
ГОСТ 32044.1-2012 (ISO 5983-1:2005) Корма, комбикорма, комбикормовое сырье. Определение массовой доли азота и вычисление массовой доли сырого протеина. Ч. 1. Метод Къельдаля (дата введения 2014-07-01). М.: Стандартинформ, 2014.
ГОСТ 32905-2014 (ISO 6492:1999) Корма, комбикорма, комбикормовое сырье. Метод определения содержания сырого жира (с поправкой) (дата введения 2016-01-01). М.: Стандартинформ, 2015.
ГОСТ 32933-2014 (ISO 5984:2002) Корма, комбикорма. Метод определения содержания сырой золы (дата введения 2016-01-01). М.: Стандартинформ, 2015.
Завьялов А.П. Выращивание тиляпии в установке с замкнутым циклом водоснабжения при различных способах кормления: Дис. канд. с.-х. наук. М.: ТСХА, 2001. 129 с.
Карзинкин Г.С. К изучению физиологии пищеварения рыб // Тр. лимнол. ст. в Косино. 1932. Вып. 15. С. 85–123.
Карзинкин Г.С., Кривобок М.Н. Методика изучения физиологии питания и потребности рыб в кормах // Тр. совещания ихтиол. комиссии АН СССР. 1955. Вып. 6. С. 40–53.
Киселев А.Ю., Рекубратский Н.В. Особенности ритма питания сеголетков и двухлетков карпа в разные периоды кормления // Сб. науч. тр. ВНИИ пруд. рыб. хоз-ва. М.: ВНИИПРХ, 1982. № 34. С. 117–127.
Колобова И.Ю. Время прохождения пищи через кишечник белого и пестрого толстолобика // Вестн. АГТУ. Рыб. хоз-во. Астрахань: АГТУ, 1997. С. 27–28.
Куракин И.В., Михайличенко Д.В., Пономарев С.В., Федоровых Ю.В., Баканева Ю.М., Мирошникова Е.П. Рецептура кормов для тиляпии, выращиваемой в индустриальных условиях // Вестн. ОГУ. 2015. № 6(181). С. 49–56.
Лакин Г.Ф. Биометрия. М.: Высш. шк., 1990. С. 263–264.
Мантейфель Б.П., Гирса И.И., Лещева Т.С., Павлов Д.С. Суточный ритм питания и двигательной активности некоторых пресноводных хищных рыб // Питание хищных рыб и их взаимоотношения с кормовыми организмами / Отв. ред. Мантейфель Б.П. М.: Наука, 1965. С. 2–82.
Пономарев С.В., Грозеску Ю.Н., Бахарева А.А. Корма и кормление рыб в аквакультуре. М.: Моркнига, 2013. 416 с.
Правдин П.Ф. Руководство по изучению рыб. М.: Пищ. пром-сть. 1966. С. 37–48.
Привольнев Т.И. Эколого-физиологические и рыбохозяйственные особенности радужной форели (Salmo irideus Gib.) // Изв. ГНИИ озер. и реч. рыб. хоз-ва. 1969. Т. 68. С. 3–22.
Сорвачев К.Ф.Основы биохимии питания рыб. М.: Лег. и пищ. пром-сть, 1982. 246 с.
Тыщенко В.П. Физиология насекомых. М.: Высш. шк., 1986. 303 с.
Ушакова Н.А., Пономарев С.В., Федоровых Ю.В., Бастраков А.И. Использование протеин-хитинового концентрата личинок черной львинки Hermetia illucens в рационе всеядных рыб на примере красной тиляпии // Изв. УфимНЦ РАН. 2018. № 3. С. 57–62.
Ушакова Н.А., Бродский Е.С., Коваленко А.А., Бастраков А.И., Козлова А.А., Павлов Д.С. Особенности липидной фракции личинок черной львинки Hermetia illucens // Докл. РАН. 2016. Т. 468. № 4. С. 462–465.
Хрусталев Е.И., Курапова Т.М., Гончаренок О.Е., Молчанова К.А. Современные проблемы и перспективы развития аквакультуры. СПб.: Лань, 2017. 416 с.
Щербина М.А., Гамыгин Е.А. Кормление рыб в пресноводной аквакультуре. М.: Изд-во ВНИРО, 2006. 360 с.
Щербина М.А., Рекубратский Н.В., Киселев А.Ю. К методике определения суточных рационов у карпов при питании концентрированными комбикормами // Тез. докл. V Всесоюз. конф. по экол. физиологии и биохимии рыб. Киев: Наук. думка, 1982. С. 185–186.
Bondari K., Sheppard D.C. Soldier fly Hermetia illucens L., as feed for channel catfish, Ictalurus punctatus (Rafinesque), and blue tilapia, Oreochromis aureus (Steindachner) // Aquacult. Fish. Manag. 1987. V. 18. P. 209–220.
Caligiani A., Marseglia A., Lenia G., Baldassarre S., Maistrello L., Dossena A., Sforza S. Composition of black soldier fly prepupae and systematic approaches for extraction and fractionation of proteins, lipids and chitin // Food Res. Inter. 2018. V. 105. P. 812–820.
Diener S., Zurbrugg C., Tockner K. Conversion of organic material by black soldier fly larvae: establishing optimal feeding rates // Waste Manag. Res. 2009. V. 27. P. 603–610.
Fines B.C., Holt G.J. Chitinase and apparent digestibility of chitin in the digestive tract of juvenile cobia // Rachycent. Canad. Aquacult. 2010. V. 303. P. 34–39.
Gopalakannan A., Arul V. Immunomodulatory effects of dietary intake of chitin, chitosan and levamisole on the immune system of Cyprinus carpio and control of Aeromonas hydrophila infection in ponds // Aquacult. Mag. 2006. V. 255. P. 179–187.
Jauniaux C. Chitinolytic systems in the digestive tract of vertebrates: a review // Chitin Enzymol. / Ed. Muzarelli R.A.A. Ancona: Eur. Chitin Soc., 1993. P. 233–244.
Johnson E.L., Peniston Q.P. Utilization of shell waste for chitin and chitosan production // Chemistry and Biochemistry of Marine Food Products / Eds Martin R.E., Flick G.H., Hebard C.E., Ward D.R. West Port: AVI Publ. Co., 1982. P. 514–522.
Kapoor B.G., Smith H., Verigina I.A. The alimentary canal and digestion in teleosts // Adv. Mar. Biol. 1975. V. 13. P. 109–239.
Kramer K.J., Hopkins T.L., Schaefer J. Applications of solids NMR to the analysis of insect sclerotized structures // Insect Biochem. Mol. Biol. 1995. V. 25. P. 1067–1080.
Liu X., Chen X., Wang H., Yang O., Rehman K., Li W., Cai M., Li Q., Mazza L., Zhang J., Yu Z., Zheng L. Dynamic changes of nutrient composition throughout the entire life cycle of black soldier fly // PLoS One. 2017. V. 12. № 8. e0182601. https://doi.org/10.1371/journal.pone.0182601
Müller A., Wolf D., Gutzeit H. O. The black soldier fly, Hermetia illucens – A promising source for sustainable production of proteins, lipids and bioactive substances // Z. Naturforsch. 2017. V. 72. № 9. P. 351–363. https://doi.org/10.1515/znc-2017-0030
No H.K., Meyers S.P., Lee K.S. Isolation and characterization of chitin from crawfish shell waste // J. Agric. Food Chem. 1989. V. 37. P. 575–579.
Sealey W.M., Gaylord T.G., Barrows F.T., Tomberlin J.K., McGuire M.A., Ross C., St-Hilaire S. sensory analysis of rainbow trout, Oncorhynchus mykiss, fed enriched black soldier fly prepupae, Hermetia illucens // J. World Aquacult. Soc. 2011. V. 42. № 1. P. 34–45.
St-Hilaire S., Sheppard C., Tomberlin J.K., Irving S., Newton L., McGuire M.A., Mosley E.E., Hardy R.W., Sealey W. Fly prepupae as a feedstuff for rainbow trout, Oncorhynchus mykiss // J. World Aquacult. Soc. 2007. V. 38. № 1. P. 59–67.
Strobel S., Roswag A., Becker N.I., Trenczek T., Encarnacao J.A. Insectivorous bats digest chitin in the stomach using acidic mammalian chitinase // PLoS One. 2013. V. 8. № 9. e72770.
Tanaka Y., Tanioka S., Tanaka M., Tanigawa T., Kitamura Y., Minami S., Okamoto Y., Miyashita M., Namo M. Effects of chitin and chitosan particles on BALB/c mice by oval and paranteral administration // Biomaterials. 1997. V. 18. P. 591–595.
Tschirner M., Simon A. Influence of different growing substrates and processing on the nutrient composition of black soldier fly larvae destined for animal feed // J. Insects Food Feed. 2015. V. 1. № 1. P. 1–12.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


