Известия РАН. Серия биологическая, 2020, № 4, стр. 401-410
Автотомия и регенерация у чешуйчатых пресмыкающихся (Squamata, Reptilia): стратегии защитного поведения и морфологические особенности (с использованием методов компьютерной микротомографии)
Д. А. Гордеев 1, Н. Б. Ананьева 2, *, Д. В. Корост 3
1 Волгоградский государственный университет
400062 Волгоград, Университетский просп., 100, Россия
2 Зоологический институт РАН
199034 Санкт-Петербург, Университетская наб., 1, Россия
3 Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: nananjeva09@gmail.com
Поступила в редакцию 12.01.2020
После доработки 06.02.2020
Принята к публикации 06.02.2020
Аннотация
Отмечено, что каудальная автотомия как способ защиты от хищников у современных рептилий характерна исключительно для лепидозавров и отсутствует у крокодилов и черепах. Обнаружено, что у клювоголовых отряда Rhynchocephalia, а также у представителей большинства семейств ящериц широко распространена интравертебральная (интраВБ) автотомия, тогда как у агамовых ящериц и некоторых змей нет плоскости разлома, а обрыв хвоста происходит между соседними позвонками (интервертебральная, интерВБ-автотомия). Проанализированы частоты встречаемости интерВБ- автотомии и регенерации у шести видов агам рода Paralaudakia. Описаны шесть типов регенератов, характерных для исследуемой группы, и анатомическое строение шишковидного зазубренного регенерата на основе результатов компьютерной микротомографии (микро-КТ). Обсуждены проявления автотомии и регенерации в филогенетическом контексте.
Автотомия в форме отбрасывания хвоста – одна из наиболее примечательных черт многих лепидозавров, не известная для крокодилов и черепах. Каудальная автотомия характерна для большинства семейств современных ящериц, некоторых змей (преимущественно ужеобразных) и большинства семейств амфисбен (Arnold, 1984, 1988; Ananjeva, Orlov, 1994; Savage, Slowinski, 1996; Bowen, 2004; Costa et al., 2014; Crnobrija-Isalović et al., 2016). Известны два способа защиты от хищников. Чаще отмечается интраВБ-автотомия, при которой разрыв происходит через тело позвонка в “местах слабости”, характерная для лепидозавров отряда Rhynchocephalia, а также чешуйчатых рептилий семейств Scincidae, Cordylidae, Teiidae, Xantusiidae, Anguidae, Lacertidae, некоторых Iguanidae и большинства Gekkota (семейства Carphodactylidae, Diplodactylidae, Gekkonidae, Eublepharidae, Phyllodactylidae, Sphaerodactylidae). Реже встречается интерВБ (межпозвонковая) автотомия, когда плоскости разлома отсутствуют, а обрыв хвоста происходит между соседними позвонками. Она достоверно отмечена у способных к автотомии ящериц сем. Agamidae, а также у некоторых змей, преимущественно сем. Colubridae, Lamprophiidae и Natricidae. ИнтерВБ-автотомия у змей не сопровождается последующей регенерацией. Согласно предложенной ранее терминологии (Savage, Slowinski, 1996; Costa et al., 2014) различаются следующие типы разломов: уротомия (любой тип, как интер-, так и интравертебральный); собственно автотомия, к которой авторы относят только интраВБ-тип разлома с последующей регенерацией утраченной части, а также псевдоавтотомия (межпозвонковый неспонтанный тип разломов хвоста без регенерации). Анализ опубликованных за весь период изучения данных (Crnobrija-Isalović et al., 2016) свидетельствует о следующих частотах встречаемости псевдоавтотомии в разных семействах змей: у Colubridae у 46 видов 34 родов (41% видов), у Lamprophiidae (у четырех видов двух родов (25%.), у Viperidae (у двух видов двух родов) и у Elapidae только у одного вида. В этой классификации агамовые ящерицы не отнесены ни к одной из вышеназванных категорий, они заняли неопределенное положение “промежуточного состояния” (“intermediate condition”) (Savage, Slowinski, 1996).
Первый способ рассматривается как плезиоморфное состояние у чешуйчатых рептилий (Reptilia: Squamata), но независимо утрачивается во многих эволюционных линиях (Arnold, 1984). По-видимому, отсутствие интраВБ-автотомии у представителей многих монофилетических семейств указывает на то, что способность отбрасывать хвост таким способом была утрачена в ходе исторического развития несколько раз (Arnold, 1988). В большинстве случаев образующийся регенерат хорошо отличался от исходной, не подвергшейся автотомии части хвоста по изменению окраски, характера щиткования и общим пропорциям.
Были исследованы различные экологические, функциональные, морфологические и эволюционные аспекты автотомии как стратегии защитного поведения: каудальная би- и трифуркация (Ananjeva, Danov, 1991; Dudek, Ekner-Grzyb, 2014; Pheasey et al., 2014; Koleska, Jablonski, 2015; Passos et al., 2016; Pelegrin, Leão, 2016; Гордеев, 2017; Kolenda et al., 2017; Vergilov, Natchev, 2017; Кукушкин, 2018; Koleska, 2018; Maria, Al-Razi, 2018; Ramadanović, Zimić, 2019), регуляция формирования хрящевой трубки (Lozito, Tuan, 2015), гистохимия и ультраструктура регенерирующего эпидермиса (Alibardi, Maderson, 2003). Были проведены также эксперименты по имплантации спинного мозга (Lozito, Tuan, 2016), локализации пролиферирующих клеток (Alibardi, 2016), физиологии (Meyer et al., 2002), энергетике автотомии, регенерации и поставтотомной локомоции (Pafilis et al. 2005; Lin et al., 2006; Seligmann et al., 2008; Sun et al., 2009; Fleming et al., 2013), скорости и молекулярным механизмам регенерации (Pillai et al., 2013; Yadav et al., 2014; Hutchins et al., 2016; Alibardi, 2017). Исследовались частоты встречаемости автотомии и псевдоавтотомии (Bowen, 2004; Arribas, 2014; Costa et al., 2014) и влияние регенерации хвоста на двигательную активность ящериц (Chapple, Swain, 2002; Jagnandan et al., 2014; Zamora-Camacho et al., 2016). В обобщающей работе, где резюмированы наиболее значимые сведения за последние 200 лет, описаны перспективы будущих исследований (Higham et al., 2013). В большинстве многочисленных публикаций по проблемам автотомии рассмотрено ограниченное число видов с интраВБ-механизмом автотомии, тогда как морфология регенератов, формирующихся у видов с межпозвонковым разломом, рассматривалась крайне редко (Schall et al., 1989).
Цель работы – анализ автотомии и морфологии регенератов хвоста агамовых ящериц на примере рода Paralaudakia Baig Wagner, Ananjeva and Böhme, 2012 с использованием методов микрокомпьютерной томографии (микро-КТ).
МАТЕРИАЛЫ И МЕТОДЫ
Материалом для данного исследования послужили герпетологические коллекции Зоологического института РАН (ЗИН РАН, Санкт-Петербург) и Зоологического музея МГУ им. М.В. Ломоносова (ЗМ МГУ, Москва). Всего было исследовано 614 экз., представленных сериями из шести видов: кавказская агама Paralaudakia caucasia (Eichwald, 1831), хорасанская агама P. erythrogaster (Nikolsky, 1896), гималайская агама P. himalayana (Steindachner, 1867), туркестанская агама P. lehmanni (Nikolsky, 1896), мелкочешуйчатая агама P. microlepis (Blanford, 1875) и агама Столички P. stoliczkana (Blanford, 1875). Для анализа локализации автотомии была применена следующая классификация (Arribas, 2014): неповрежденный хвост; автотомия в дистальной трети, в середине хвоста и в проксимальной трети. Для оценки частот встречаемости автотомии и различного состояния регенерации применяли непараметрическую статистику. Для оценки возможности сравнения различного состояния регенерации в сериях провели анализ соразмерности числа самок, самцов и экземпляров на ювенильной стадии (критерии Краскела–Уоллиса, Манна–Уитни и F-тест, или критерий Фишера). Расчеты проводили в программе PAST 3.22.
Анатомическое строение регенератов было изучено методом микро-КТ (МГУ, Москва) с использованием настольного сканера SkyScan-1172 (Bruker micro-CT, Kontich, Бельгия), оснащенного цифровой камерой Hamamatsu 10 Mp. Было проведено сканирование хвоста P. caucasia (R-15396, ЗМ МГУ) и P. himalayana (36556, ЗМ МГУ). Образцы хвостов были помещены в полиэтиленовый сосуд и сканировались поочередно. Сканирование проводилось с разрешением 6.19 мкм при напряжении источника 40 кВ, силе тока 250 мкА с шагом поворота 0.2° и выдержкой 1600 мс для образца P. caucasia и с разрешением 12.39 мкм при напряжении источника 40 кВ и силе тока 250 мкА с шагом поворота 0.3° и выдержкой 800 мс для образца P. himalayana. Полученные блоки данных субсканирований были соединены вертикально для получения общей томограммы. Обработка данных проводилась с использованием программного обеспечения Skyscan: DataViewer, CTAn и CTVol (создание и визуализация 3D-моделей).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Большинство экземпляров горных кольцехвостых агам Paralaudakia Baig Wagner, Ananjeva and Böhme, 2012, изученных нами, имели неповрежденные хвосты (табл. 1): от 53.6% у P. erythrogaster до 87.4% у P. lehmanni. У P. microlepis частота встречаемости экземпляров с целыми хвостами составила 40.0%, что может объясняться малой выборкой (n = 5). Число особей с автотомией в представленных сериях меньше: от 12.6% у P. lehmanni до 46.4% у P. erythrogaster.
Таблица 1.
Частота каудальной автотомии у горных кольцехвостых агам рода Paralaudakia
| Вид | Число особей в серии | Число особей в серии с неповрежденными хвостами | Автотомия с последующей регенерацией | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| в дистальной трети хвоста | в середине хвоста | в проксимальной трети хвоста | |||||||||||||
| ♀ | ♂ | juv. | ♀ | ♂ | juv. | ♀ | ♂ | juv. | ♀ | ♂ | juv. | ♀ | ♂ | juv. | |
| P. caucasia | 105 (43.3) |
130 (54.9) |
2 (0.8) |
66 (27.8) |
80 (33.8) |
2 (0.8) |
31 (13.1) |
41 (17.3) |
0 (0.0) |
4 (1.7) |
8 (3.4) |
0 (0.0) |
4 (1.7) |
1 (0.4) |
0 (0.0) |
| P. erythrogaster | 9 (32.1) |
19 (67.9) |
0 (0.0) |
5 (17.9) |
10 (35.7) |
0 (0.0) |
3 (10.7) |
7 (25.0) |
0 (0.0) |
0 (0.0) |
1 (3.6) |
0 (0.0) |
1 (3.6) |
1 (3.6) |
0 (0.0) |
| P. himalayana | 15 (33.3) |
20 (44.4) |
10 (22.2) |
6 (13.3) |
14 (31.1) |
10 (22.2) |
6 (13.3) |
3 (6.7) |
0 (0.0) |
3 (6.7) |
2 (4.4) |
0 (0.0) |
0 (0.0) |
1 (2.2) |
0 (0.0) |
| P. lehmanni | 113 (62.1) |
66 (36.3) |
3 (1.6) |
104 (57.1) |
53 (29.1) |
2 (1.1) |
9 (4.9) |
11 (6.0) |
0 (0.0) |
0 (0.0) |
2 (1.1) |
1 (0.5) |
0 (0.0) |
0 (0.0) |
0 (0.0) |
| P. microlepis | 1 (20.0) |
4 (80.0) |
0 (0.0) |
0 (0.0) |
2 (40.0) |
0 (0.0) |
1 (20.0) |
2 (40.0) |
0 (0.0) |
0 (0.0) |
0 (0.0) |
0 (0.0) |
0 (0.0) |
0 (0.0) |
0 (0.0) |
| P. stoliczkana | 51 (43.6) |
65 (55.6) |
1 (0.9) |
40 (34.2) |
44 (37.6) |
1 (0.9) |
11 (9.4) |
21 (17.9) |
0 (0.0) |
0 (0.0) |
0 (0.0) |
0 (0.0) |
0 (0.0) |
0 (0.0) |
0 (0.0) |
У P. caucasia доли самок и самцов с отброшенными хвостами были очень близки (37.1 и 38.5% соответственно), у большинства экземпляров (13.1% самок и 17.3% самцов) автотомия происходила в дистальной трети хвоста, а другие случаи (автотомия в середине или в проксимальной трети хвоста) были довольно редки и не превышали 4.0%.
У P. erythrogaster частоты встречаемости автотомных экземпляров и таковых с неповрежденными хвостами по сравнению с другими рассматриваемыми видами были наиболее близки (46.4 и 53.6% соответственно), а частоты встречаемости самок и самцов с отброшенными хвостами были практически идентичны (44.4 и 47.4%). Но соответствие полов по данному признаку нарушается преобладанием в серии самцов над самками (67.9 и 32.1% соответственно) и не может считаться достоверным. Как и в предыдущем случае, автотомия чаще всего происходит в дистальной трети хвоста, случаи с автотомией в середине и в проксимальной трети хвоста единичны.
Из 45 экземпляров P. himalayana 30 (66.7%) имели неповрежденные хвосты, а 15 (33.3%) – автотомию в дистальной (13.3% самки и 6.7% самцы), проксимальной трети (2.2% самцы) и середине хвоста (6.7% самки и 4.4% самцы).
Наименьшее число особей с автотомией в представленных сериях было отмечено для P. lehmanni (12.6%). Поскольку в данной выборке самок достоверно больше, чем самцов (для всех непараметрических критериев Р < 0.05), анализ половых различий не дал бы корректного результата и по этой причине не проводился. Тем не менее большинство особей (10.9%) были с автотомией в дистальной трети, а 1.6% (2 экз., один из которых ювенильный) – в середине хвоста. Поскольку выборка P. microlepis нерепрезентативна (5 экз.), проведение детального анализа частот встречаемости автотомии было бы неоправданным. Тем не менее были зарегистрированы три особи с автотомией в дистальной трети хвоста.
У P. stoliczkana доля особей с автотомией составляла 27.4%, доли самок 9.4 и самцов 17.9% соответственно. Все экземпляры отбросили хвосты в дистальной трети хвоста. Из 614 анализируемых экземпляров 16 были ювенильными, из которых только один (P. lehmanni, инв. номер ZISP 13462) – с автотомией в дистальной трети хвоста.
Несмотря на различия частот встречаемости автотомных и неавтотомных экземпляров самцов и самок, вероятность обнаружить самку или самца с отброшенным или регенерированным хвостом одинакова для всех рассмотренных видов, что характерно для большинства видов ящериц (Bateman, Fleming, 2009; Arribas, 2014; Pafilis et al., 2017). Как показывают исследования частоты встречаемости автотомии (Bowen, 2004) на примере Nerodia sipedon (Linnaeus, 1758), решающим фактором может быть объем выборки. Между самцами и самками также не выявлены существенные различия частот встречаемости разных категорий состояния хвоста, но наиболее вероятно его отбрасывание в дистальной части.
Локализация части, в которой будет отбрасываться хвост, зависит от ряда обстоятельств. Во-первых, это обусловлено возможностью автотомии в конкретном участке: различают неавтотомные (пигальные), расположенные у основания хвоста, и автотомные (постпигальные), следующие за ними позвонки. Их число варьирует у разных родов и видов, а также в пределах изменчивости одного вида (Bellairs, Bryant, 1985). Это справедливо для видов с интраВБ-механизмом автотомии. Для ряда видов (например, Iguana iguana (Linnaeus, 1758), Cyclura spp., Ctenosaura acanthura (Shaw, 1802), а также видов родов Sauromalus Duméril, 1856, Basiliscus Laurenti, 1768, Enyalioides Boulenger, 1885 и др.) характерны возрастные изменения в анатомии хвостовых позвонков: слияние обоих фрагментов интраВБ-позвонков в дистальной части или на всем протяжении хвоста, что приводит к частичной или полной потере способности к автотомии (Arnold, 1988). Во-вторых, положение места разлома зависит от участка хвоста, за который схвачена хищником (Боркин и др., 2007) или другой особью того же вида ящерица, причем автотомный разрыв тканей всегда происходит лишь немного (не более трех сегментов) выше места захвата. Это объясняется существенными энергозатратами на последующую регенерацию и снижение двигательной активности таких особей (Lin et al., 2006). Вероятна также и зависимость от образа жизни конкретного вида.
Как известно, за автотомией у большинства ящериц следует регенерация хвоста (истинная автотомия в отличие от псевдоавтотомии, которая завершается заживлением раны без образования регенерата), при этом регенерат почти всегда короче исходного хвоста и хорошо отличается от него по структуре фолидоза. Скорость, с которой протекают процессы регенерации, зависит от экологических условий, возраста, интенсивности питания, индивидуальных особенностей, а также от биологии вида (Bellairs, Bryant, 1985; Arnold, 1988); конечный размер, достигнутый регенератом, также может демонстрировать межвидовые различия (Bellairs, Bryant, 1985).
Как отмечено выше, некоторые агамовые ящерицы способны к интерВБ-автотомии и к регенерации, что отличает их от всех остальных лепидозавров. Регенерированные участки имеют специфическую форму, которая может несколько варьировать в пределах вида. Для Agama agama и A. stellio (=Stellagama stellio (Linnaeus 1758)) известны три типа регенератов (Schall et al., 1989): зауженный, булавовидный и конически регенерированный хвост, который, как правило, образует гораздо более короткие регенерированные структуры. В проанализированном нами музейном материале у шести видов агам рода Paralaudakia было выявлено шесть типов регенератов (рис. 1):
Рис. 1.
Хвосты агам рода Paralaudakia. а – P. caucasia: 1 – шишковидный зазубренный (с. Ходжиб, 08.05.1904, Зарудный Н.А., ZISP 10426), 2 – шишковидный гладкий (Иран, 31.05.1942, Павловский Е.Н., ZISP 18245.1), 3 – булавовидный (Туркменистан, долина р. Атрек, 29.09.1972, Еремин, ZISP 19116.4), 4 – зауженный (Туркменистан, окрест. г. Ашхабада, 07.1972, Зубарев Р.И., ZISP 19117.8); б – P. stoliczkana: 5 – шишковидный зазубренный (Монголия, горы Хатан-Хайрхан-Ула, 17.07.1986, Орлова В.Ф., ZMMSU R-5740), 6 – шишковидный гладкий (Монголия, Гоби-Алтайский аймак, 21.08.2005, Суров А.В, ZMMSU R-12041), 7 – конусовидный зазубренный (Монголия, Гоби-Алтайский аймак, г. Элген, 13.07.1983, Боркин Л.Я., Орлов Н.Л., Семенов Д.В., ZISP 19839), 8 – конусовидный гладкий (Монголия, Гоби-Алтайский аймак, г. Элген, 13.07.1983, Боркин Л.Я., Орлов Н.Л., Семенов Д.В., ZISP 19839), 9 – зауженный (Монголия, Гоби-Алтайский аймак, г. Элген, 13.07.1983, Боркин Л.Я., Орлов Н.Л., Семенов Д.В., ZISP 19839); в – P. erythrogaster: 10 – шишковидный зазубренный (Туркменистан, Бадхызский заповедник, 01.06.1970, Камалова З.Я., ZISP 18844), 11 – булавовидный (Иран, окрест. Маздуран, пров. Хорасан, 2010 г., Назаров Р.А., ZMMSU R-13517), 12 – зауженный (Туркменистан, Бадхыз, 22.06.1948, Гептнер В.Г., ZMMSU R-9562); г – P. himalayana: 13 – шишковидный зазубренный (Дарваз, 1987 г., Казнаков А.Н., ZMMSU 251), 14 – шишковидный гладкий (Номан-Гут, отроги Тянь-Шаня, Бухарские владения, Богоявленский Н.В., ZMMSU 256), 15 – зауженный (Таджикистан, берег Пянджа, Западный Памир, 07.1966, Банников А.Г., ZMMSU 3324); д – P. lehmanni: 16 – шишковидный зазубренный (Узбекистан, Самаркандская обл., северные склоны Ак-Тау, окрест. пос. Сарай-Булак, 08.1972, Должанский И., ZISP 20117).
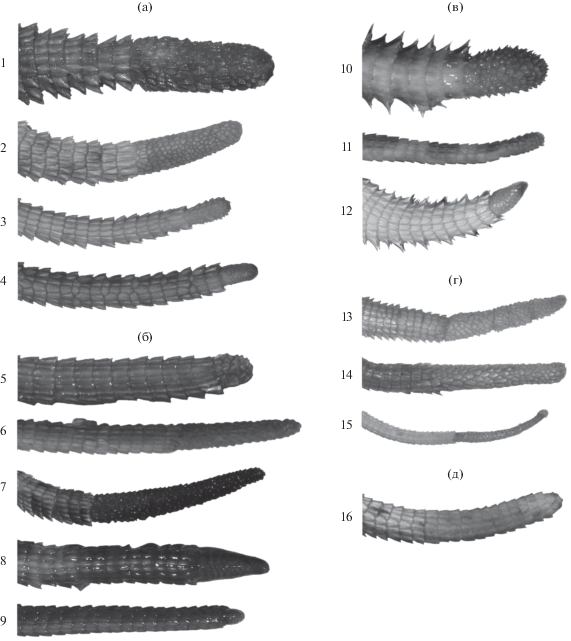
шишковидный зазубренный – ширина регенерата на всем его протяжении примерно равна ширине последнего кольца хвоста до места автотомии; покрывающие его чешуи имеют зубцевидные формы, один край которых несколько отогнут кнаружи;
шишковидный гладкий – сходен с предыдущим типом, но покрывающие его чешуи плотно прилегают к регенерату и не образуют подобий колючек;
конусовидный зазубренный – постепенно сужающийся регенерат от основания к концу хвоста, покрывающие его чешуи имеют зубцевидные формы, один край которых несколько отогнут кнаружи;
конусовидный гладкий – сходен с конусовидным зазубренным, но покрывающие его чешуи плотно прилегают к регенерату и не образуют подобий колючек;
булавовидный – имеются “зубцы”, ширина регенерата примерно равна или несколько больше, а его основание существенно ýже ширины последнего кольца хвоста до места автотомии;
зауженный – “зубцы” отсутствуют, регенерат на всем протяжении одинаковой ширины, существенно ýже последнего кольца хвоста до места автотомии.
Соотношение указанных типов регенератов у разных видов агам неодинаково. Ввиду того, что большая часть осмотренных особей была с поврежденными хвостами (достоверность автотомии под сомнением) либо с регенератами на ранней стадии, надежно установить тип регенерата удалось лишь для небольшой части экземпляров (табл. 2). Из пяти экземпляров P. microlepis три (одна самка и два самца) были с автотомией, но размеры регенератов не позволили надежно установить их типы. Шишковидный зазубренный регенерат, наиболее распространенный и отмеченный нами у всех рассматриваемых видов, доминирует у P. caucasia, P. himalayana, P. lehmanni и составляет в зависимости от вида от 42.9 до 100.0% надежно определенных регенератов. Редкие формы регенератов – конусовидный зазубренный и конусовидный гладкий – характерны только для P. stoliczkana. Наиболее полно разнообразие типов регенератов (пять из шести) представлено у P. stoliczkana, тогда как у P. lehmanni единственной формой был шишковидный зазубренный. Зауженный регенерат преобладает в выборках P. erythrogaster и P. stoliczkana (50.0 и 30.8% соответственно).
Таблица 2.
Частоты встречаемости типов регенератов у некоторых агам рода Paralaudakia
| Пол | Число особей с надежно определенным регенератом | Типы регенератов | |||||
|---|---|---|---|---|---|---|---|
| шишковидный зазубренный | шишковидный гладкий | конусовидный зазубренный | конусовидный гладкий | булавовидный | зауженный | ||
| P. caucasia | |||||||
| ♀ | 16 | 8 (22.9) | 1 (2.9) | 0 (0.0) | 0 (0.0) | 2 (5.7) | 0 (0.0) |
| ♂ | 19 | 7 (20.0) | 3 (8.6) | 0 (0.0) | 0 (0.0) | 7 (20.0) | 0 (0.0) |
| P. erythrogaster | |||||||
| ♀ | 3 | 1 (16.7) | 0 (0.0) | 0 (0.0) | 0 (0.0) | 1 (16.7) | 1 (16.7) |
| ♂ | 3 | 1 (16.7) | 0 (0.0) | 0 (0.0) | 0 (0.0) | 0 (0.0) | 2 (33.3) |
| P. himalayana | |||||||
| ♀ | 5 | 2 (22.2) | 1 (11.1) | 0 (0.0) | 0 (0.0) | 0 (0.0) | 2 (22.2) |
| ♂ | 4 | 3 (33.3) | 0 (0.0) | 0 (0.0) | 0 (0.0) | 0 (0.0) | 1 (11.1) |
| P. lehmanni | |||||||
| ♀ | 3 | 3 (75.0) | 0 (0.0) | 0 (0.0) | 0 (0.0) | 0 (0.0) | 0 (0.0) |
| ♂ | 1 | 1 (25.0) | 0 (0.0) | 0 (0.0) | 0 (0.0) | 0 (0.0) | 0 (0.0) |
| P. stoliczkana | |||||||
| ♀ | 9 | 1 (7.7) | 1 (7.7) | 3 (23.1) | 1 (7.7) | 0 (0.0) | 3 (23.1) |
| ♂ | 4 | 1 (7.7) | 0 (0.0) | 0 (0.0) | 2 (15.4) | 0 (0.0) | 1 (7.7) |
Некоторым близким к роду Paralaudakia видам, например Laudakia nupta (De Filippi, 1843) свойственны аналогичные типы регенератов: шишковидный зазубренный, шишковидный гладкий и конусовидный гладкий (Гордеев, Ананьева, 2019). Объем наших данных не позволяет судить о половых различиях типов регенератов, но доминирует у большинства видов шишковидный зазубренный (булавовидный) (Schall et al., 1989) как у самцов, так и у самок.
На основе результатов полевого эксперимента (Schall et al., 1989), в котором большинство самцов (78.6% против 19.3% самок) имеют булавовидные регенераты, а самки – зауженные, была выдвинута гипотеза о том, что такая форма регенерата имеет некоторое адаптивное преимущество в социальном поведении (при состязаниях между самцами, поскольку массивные хвосты могут наносить более мощные удары).
После того как хвост был отброшен, из оставшейся его части заметно выступают позвонок и частично мышцы. В дальнейшем ставший дистальным позвонок подвергается частичной абляции, что хорошо видно на рентгеноплотностных срезах микро-КТ (рис. 2).
Рис. 2.
Результат компьютерной микротомографии хвоста Paralaudakia caucasia (Туркменистан, Балханский велаят, Чандырская долина, вниз по р. Сумбар, 04.03.1968, ZMMSU №15396) с зауженным регенератом. а – 3D-модель дистальной части хвоста с регенератом: слева – фронтальная, справа – сагиттальная плоскости. б – рентгеноплотностные срезы через фронтальную плоскость в середине регенерата (слева) и сагиттальную плоскость через середину хвоста. в – рентгеноплотностные срезы через фронтальную плоскость в начале последнего позвонка, предшествующего автотомной области (слева), и сагиттальную плоскость через середину хвоста (справа). 1 – чешуя; 2 – хвостовая вена; 3 – хвостовая артерия; 4 – нижний остистый отросток позвонка; 5 – тело хвостового позвонка; 6 – спинной мозг; 7 – мышцы; 8 – радиальные продольные перегородки; 9 – регенерировавшие мышцы; 10 – регенерировавшая чешуя; 11 – хрящевая трубка; 12 – спинной мозг в регенерировавшем участке хвоста; о. с. – области среза во фронтальной плоскости, отображенные в левой части рисунка. Во избежание загромождения рисунка некоторые элементы повторно не обозначены.
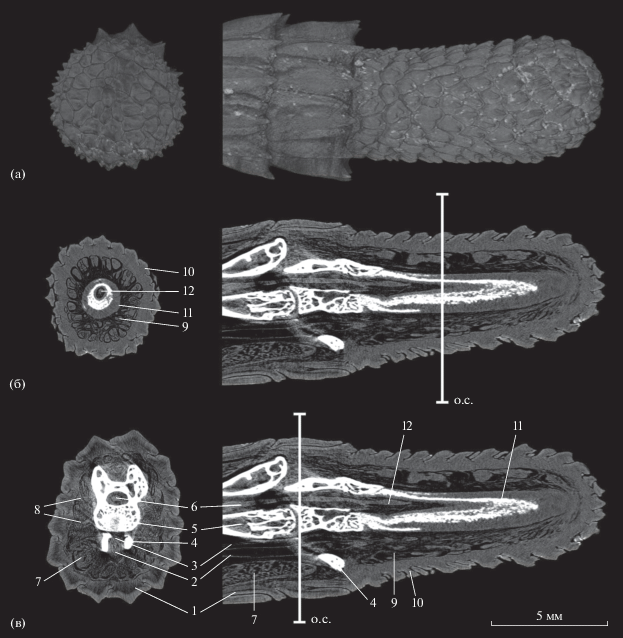
Анализ изображения, полученного с помощью микро-КТ, и визуальный осмотр отброшенного хвоста свидетельствуют о том, что область автотомии не проходит четко между позвонками, а многократно изгибается. Поверхностно (дорсально) область автотомии располагается между чешуями хвоста напротив соединения двух позвонков. Далее она несколько отклоняется к головному отделу и, дойдя до позвонка, следует к дистальной его части, проходит между соседними позвонками и снова направляется к головному отделу. Затем происходит разрыв хвостовой артерии и вены, плоскость перелома направляется к нижнему остистому отростку соседнего позвонка и снова поворачивает вперед, проходя между соседними чешуями хвоста. У рассматриваемых здесь видов Paralaurakia среди структур, связанных с областью автотомии, отсутствует жировая ткань, в отличие от таковой в хвостах у ящериц с интраВБ-способом автотомии (Bellairs, Bryant, 1985). Отсутствие жировой ткани, вероятно, свойственно большинству Agamidae (Bellairs, Bryant, 1985). В дальнейшем большая часть ставшего дистальным позвонка и окружающие его мягкие ткани облитерируют.
Образующийся регенерат (рис. 2) включает в себя регенерировавшие кожу, мышцы, хрящевую трубку, выполняющую функцию позвоночника, с проходящим в ней спинным мозгом. От хрящевой трубки радиально отходят продольные соединительно-тканные перегородки, разделяющие мышечные пучки. Анализ анатомического строения двух типов регенератов (зауженного и шишковидного зазубренного) не выявил существенных различий во входящих в их состав элементов и структур, но дополнительные исследования анатомии, гистологии и биохимии типов регенератов представляются желательными, поскольку помогут объяснить механизм их образования.
Тем не менее есть существенные анатомо-морфологические различия в строении регенерата и исходного хвоста, что свойственно большинству ящериц: чешуя, покрывающая регенерат, более мелкая, не имеет строгой формы, на которую могут влиять (по крайней мере у гекконов) температурные колебания (Bellairs, Bryant, 1985); мышечные волокна менее структурированы, число радиальных соединительно-тканных перегородок значительно больше; хрящевая трубка регенерировавшего участка, заменяющая позвонки, остается пожизненно.
Другой важный аспект в исследованиях каудальной автотомии – филогенетические преобразования способов отбрасывания хвоста и возможности его осуществления в различных эволюционных линиях рептилий. Согласно современным представлениям монофилия клады Acrodonta (Chamaeleonidae + Agamidae) надежно подтверждается (Ананьева, 2004; Pyron et al., 2013). В нее входят как виды, не способные к автотомии, так и виды с интерВБ- автотомией, а также отбрасывающие хвост без образования регенерата либо с выраженной способностью к регенерации. Chamaeleonidae как сестринская группа для Agamidae объединяет только неавтотомные виды. Сем. Agamidae более интересно в этом отношении, поскольку включает в себя виды с интерВБ-механизмом автотомии, утратившие его, а также способные к отбрасыванию хвоста без последующей регенерации либо с образованием регенератов. Подсемейство Uromastycinae включает в себя только неавтотомные виды, тогда как среди агам подсемейства Amphibolurinae ящерицы терминальных таксонов Diporiphora Gray, 1842 могут отбрасывать хвост, но не регенерируют его, а ящерицы таксонов (родов), близких к базальным (Intellagama Wells and Wellington, 1985; Ctenophorus Fitzinger, 1843), способны отбрасывать и регенерировать хвост. Роды Laudakia Gray, 1845 и Paralaudakia Baig, Wagner, Ananjeva and Böhme, 2012, базальные для остальных Agaminae и Agama Daudin, 1802 (терминальная группа) достаточно легко автотомируют, тогда как многие другие представители этого подсемейства (например, Phrynocephalus Kaup, 1825; Trapelus Cuvier, 1817) полностью утратили этот защитный механизм. Некоторые представители подсемейства Draconinae, например Sitana Cuvier, 1829; Otocryptis Wagler, 1830, не регенерируют оторванные хвосты. Таким образом, во многих филогенетических линиях Agamidae способность к автотомии была вторично утрачена, а у тех видов, которые сохранили (или восстановили) ее, она никогда не проходит интраВБ-способом. Вероятно, данный способ автотомии был утрачен предковыми формами Acrodonta, а его восстановление требует существенной перестройки анатомии хвоста и затруднительно. Присутствие плоскостей перелома и интраВБ-способа автотомии у представителей инфраотряда Iguania, например Dipsosaurus dorsalis (Baird and Girard, 1852), сестринских для Chamelionidae + Agamidae, вероятно, свидетельствует о том, что последние отделились от общего ствола Iguania, утратив плоскость перелома в теле позвонка.
ЗАКЛЮЧЕНИЕ
Таким образом, для шести видов рассмотренных здесь агам рода Paralaudakia автотомия с последующей регенерацией может считаться обычным явлением, но число таких особей меньше числа особей с неповрежденными хвостами. Отбрасывание хвоста происходит, как правило, в дистальной трети, что компенсирует затраты на последующую регенерацию, а также позволяет избежать нежелательного снижения двигательной активности и способности к репродукции. Число особей с автотомией в середине и проксимальной трети хвоста для всех видов минимально. Внешне регенерат существенно отличается от первоначального хвоста, ввиду чего можно выделить как минимум шесть его вариаций: шишковидный зазубренный, шишковидный гладкий, зауженный, булавовидный, конусовидный зазубренный и конусовидный гладкий. Среди них наиболее часто встречается шишковидный зазубренный регенерат. Для P. caucasia характерны 4, для P. erythrogaster и P. himalayana – 3, для P. stoliczkana – 5 и для P. lehmanni – 1 тип регенератов. Анализ анатомического строения, зауженного и шишковидного зазубренного регенератов не выявил существенных различий во входящих в их состав элементов и структур, но дополнительные исследования анатомии, гистологии и биохимии типов регенератов представляются желательными, поскольку помогут объяснить механизм их образования.
Авторы выражают благодарность заведующей сектором герпетологии ЗМ МГУ В.Ф. Орловой за предоставление возможности работы с герпетологической коллекцией ЗМ МГУ, Р.А. Назарову (ЗМ МГУ) за помощь в организации использования метода компьютерной микротомографии и И.В. Доронину (ЗИН РАН) за помощь в подборе литературы.
Работа выполнена при финансовой поддержке РФФИ (гранты 19-14-50038 “Экспансия” и 18-04-00040).
Список литературы
Ананьева Н.Б. Филогения и биогеография агамовых ящериц (Agamidae, Lacertilia, Reptilia): обзор концепций и результатов молекулярных и морфологических исследований // Успехи соврем. биологии. 2004. Т. 124. № 1. С. 44–46.
Боркин Л.Я., Еремченко В.К., Панфилов А.М. Об экологии сцинкового геккона (Teratoscincus scincus) // Соврем. герпетология. 2007. Т. 7. Вып. 1/2. С. 16–56.
Гордеев Д.А. Случаи неполной автотомии и нарушения регенерации хвоста разноцветной ящурки (Eremias arguta (Pallas, 1773)) и прыткой ящерицы (Lacerta agilis Linnaeus, 1758) в Волгоградской области // Соврем. герпетология. 2017. Т. 17. Вып. 1/2. С. 3–9.
Гордеев Д.А., Ананьева Н.Б. К вопросу стратегии защитного поведения некоторых представителей агам рода Paralaudakia Baig, Wagner, Ananjeva and Böhme // Изв. вузов. Поволжск. регион. Естеств. науки. 2019. № 1(25). С. 20–27.
Кукушкин О.В. Об аномалиях регенерации и автотомии хвоста у крымского геккона, Mediodactylus danilewskii (Reptilia, Sauria, Gekkonidae) // Соврем. герпетология. 2018. Т. 18. Вып. 3/4. С. 180–187.
Alibardi L. Localization of proliferating cells in the inter-vertebral region of the developing and adult vertebrae of lizards in relation to growth and regeneration // Anatom. Record. 2016. V. 299. P. 461–473.
Alibardi L. Review: Biological and molecular differences between tail regeneration and limb scarring in lizard: An inspiring model addressing limb regeneration in amniotes // J. Exp. Zool. (Mol. Dev. Evol.) 2017. V. 328(6). P. 493–514.
Alibardi L., Maderson P.F.A. Observations on the histochemistry and ultrastructure of regenerating caudal epidermis of the Tuatara Sphenodon punctatus (Sphenodontida, Lepidosauria, Reptilia) // J. Morphol. 2003. V. 256. P. 134–145.
Ananjeva N.B., Danov R.A. A rare case of bifurcated caudal regeneration in the Caucasian Agama, Stellio caucasius // Amphibia–Reptilia. 1991. V. 12. P. 343–356.
Ananjeva N.B., Orlov N.L. Caudal autotomy in colubrid snake Xenochrophis piscator from Vietnam // Russ. J. Herpetol. 1994. V. 1. № 2. P. 169–171.
Arnold E.N. Evolutionary aspects of tail autotomy in lizards and their relatives // Nat. Hist. 1984. V. 18. P. 127–169.
Arnold E.N. Caudal autotomy as a defense. // Biology of the Reptilia. V. 16. Ecology B / Eds Gans C., Huey R. N.Y.: Alan R. Liss, inc., 1988. P. 235–273.
Arribas O.J. Autotomía caudal en las lagartijas de alta montaña de los Pirineos (Iberolacerta Arribas, 1997) // Butll. Soc. Catalana d’Herpetologia. 2014. V. 21. P. 115–126.
Bateman P.W., Fleming P.A. To cut a long tail short: a review of lizard caudal autotomy studies carried out over the last 20 years // J. Zool. 2009. V. 277. Iss. 1. P. 1–14.
Bellairs A.d’A., Bryant S.V. Autotomy and regeneration in reptiles. Biology of the reptilia. V. 15. Development B. / Eds Gans C., Billett F. N.Y.: Wiley and Sons, 1985. P. 303–410.
Bowen K.D. Frequency of tail breakage of the Northern Watersnake, Nerodia sipedon sipedon // Can. Field Natur. 2004. V. 118(3). P. 435–437.
Chapple D.G., Swain R. Effect of caudal autotomy on locomotor performance in a viviparous skink, Niveoscincus metallicus // Funct. Ecol. 2002. V. 16. P. 817–825.
Costa H.C., Moura M.R., Feio R.N. A tale of lost tails: pseudoautotomy in the Neotropical snake genus Drymoluber (Serpentes: Colubridae) // Can. J. Zool. 2014. V. 92. P. 811–816.
Crnobrnja-Isalović J., Corović J., Halpern B. Deliberate tail loss in Dolichophis caspius and Natrix tessellate (Serpentes: Colubridae) with a brief review of pseudoautotomy in contemporary snake families // North-Western J. Zool. 2016. V. 12(2). P. 367–372.
Dudek K., Ekner-Grzyb A. Field observation of two-tailed sand lizard Lacerta agilis Linnaeus, 1758 and a common lizard Zootoca vivipara (Jacquin, 1787) in Poland // Nat. Sloveniae. 2014. V. 16. Iss. 1. P. 65–66.
Fleming P.A., Valentine L.E., Bateman P.W. Telling Tails: Selective pressures acting on investment in lizard tails // Physiol. Biochem. Zool. 2013. V. 86. № 6. P. 645–658.
Higham T.E., Anthony P. Russell A.P., Peter A., Zani P.A. Integrative biology of tail autotomy in lizards // Physiol. Biochem. Zool. 2013. V. 86. Iss. 6. P. 603–610.
Hutchins E.D., Eckalbar W.L., Wolter J.M., Mangone M., Kusumi K. Differential expression of conserved and novel microRNAs during tail regeneration in the lizard Anolis carolinensis // BMC Genom. 2016. https://doi.org/10.1186/s12864-016-2640-3
Jagnandan K., Russell A.P., Higham T.E. Tail autotomy and subsequent regeneration alter the mechanics of locomotion in lizards // J. Experim. Biol. 2014. V. 217. P. 3891–3897.
Kolenda K., Wieczorek M., Najbar A., Najbar B., Skawiński T. Limb malformation and tail bifurcation in sand lizards (Lacerta agilis) and common lizards (Zootoca vivipara) from Poland // Herpetol. Not. 2017. V. 10. P. 713–716.
Koleska D. First record of tail bifurcation in Asaccus gallagheri from the United Arabian Emirates // Herpetol. Not. 2018. V. 11. P. 115–116.
Koleska D., Jablonski D. Tail trifurcation recorded in Algyroides nigropunctatus (Duméril & Bibron, 1839) // Ecol. Montenegr. 2015. V. 3. P. 26–28.
Lin Z-H., Qu Y-F., Ji X. Energetic and locomotor costs of tail loss in the Chinese skink, Eumeces chinensis // Comp. Biochem. Physiol. A. 2006. V. 143. P. 508–513.
Lozito T.P., Tuan R.S. Lizard tail regeneration: regulation of two distinct cartilage regions by Indian hedgehog // Develop. Biol. 2015. V. 399. P. 249–262.
Lozito T.P. Tuan R.S. Lizard tail skeletal regeneration combines aspects of fracture healing and blastema-based regeneration // Development. 2016. V. 143. P. 2946–2957.
Maria M., Al-Razi H. Observation of tail bifurcation in Hemidactylus frenatus (Schlegel, 1836) // Herpetol. Not. 2018. V. 11. P. 953–954.
Meyer V., Preest M.R., Lochetto S.M. Physiology of original and regenerated lizard tails // Herpetologica. 2002. V. 58(1). P. 75–86.
Pafilis P., Valakos E.D., Foufopoulos J. Comparative postautotomy tail activity in six Mediterranean lacertid lizard species // Physiol. Biochem. Zool. 2005. V. 78(5). P. 828–838.
Pafilis P., Sagonas K., Kapsalas G., Foufopoulos J., Valakos E. Sex does not affect tail autotomy in lacertid lizards // Acta Herpetol. 2017. V. 12(1). P. 19–27.
Passos D.C., Pedro Fonseca H.M., Romo de Vivar P.R., Kanayama C.Y., Teixeira V.P.A., Martinelli A.G. Tail trifurcation in the lizard Salvator merianae (Squamata: Teiidae) investigated by computer tomography // Phyllomedusa. 2016. V. 15(1). P. 79–83.
Pelegrin N., Leão S.M. Injured Salvator merianae (Teiidae) regenerates six tails in central Argentina // Cuad. Herpetol. 2016. V. 30(1). P. 21–23.
Pheasey H., Smith P., Brouard J.P., Atkinson K. Vanzosaura rubricauda (Red-tailed Vanzosaur) bifurcation and trifurcation // Herpetol. Rev. 2014. V. 45. P. 138–139.
Pillai A., Desai I., Balakrishnan S. Pharmacological inhibition of FGFR1 signaling attenuates the progression of tail regeneration in the northern house gecko Hemidactylus flaviviridis // Int. J. Life Sci. Biotechn. Pharmac. Res. 2013. V. 2. № 4. P. 263–278.
Pyron R.A., Burbrink F.T., Wiens J.J. A phylogeny and revised classification of Squamata, including 4161 species of lizards and snakes // BMC Evol. Biol. 2013. V. 13(93). P. 1–53.
Ramadanović D., Zimić A. Record of a Lacerta agilis Linnaeus, 1758 with erythronotus colour morph and tail bifurcation // Herpetol. Not. 2019. V. 12. P. 779–781.
Savage J.M., Slowinski J.B. Evolution of coloration, urotomy and coral snake mimicry in the snake genus Scaphiodontophis (Serpentes: Colubridae) // Biol. J. Linnean Soc. 1996. V. 57. P. 129–194.
Schall J.J., Bromwich C.R., Werner Y.L., Midlege J. Clubbed regenerated tails in Agama agama and their possible use in social interactions // J. Herpetol. 1989. V. 23. P. 303–305.
Seligmann H., Moravec J., Werner Y. L. Morphological, functional and evolutionary aspects of tail autotomy and regeneration in the ‘living fossil’ Sphenodon (Reptilia: Rhynchocephalia) // Biol. J. Linnean Soc. 2008. V. 93. P. 721–743.
Sun Y.-Y., Yang J., Ji X. Many-lined sun skinks (Mabuya multifasciata) do not compensate for the costs of tail loss by increasing feeding rate or digestive efficiency // J. Exp. Zool. 2009. V. 311 A. P. 125–133.
Vergilov V., Natchev N. First record of tail bifurcations in the snake–eyed skink Ablepharus kitaibelii Bibron & Bory de Saint-Vincent, 1833 from Pastrina hill (northwestern Bulgaria) // Arxius de Miscel. Zool. 2017. V. 15. P. 224–228.
Yadav M., Buch P., Desai I., Balakrishnan S. Exogenous administration of EGF augments nucleic acid biosynthesis and cell proliferation in the regenerating tail of wall lizard // Europ. J. Exp. Biol. 2014. V. 4(2). P. 113–123.
Zamora-Camacho F.J., Rubiño-Hispán M.V., Reguera S., Moreno-Rueda G. Does tail regeneration following autotomy restore lizard sprint speed? Evidence from the lacertid Psammodromus algirus // Herpetol. J. 2016. V. 26. P. 213–218.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


