Известия РАН. Серия биологическая, 2020, № 4, стр. 434-448
Пространственно-генетическая структура населения Eptesicus nilssonii (Chiroptera, Vespertilionidae) на южной границе ареала в пределах Европейской части России
Д. Г. Смирнов 1, *, Ф. З. Баишев 1, В. А. Безруков 1, В. П. Вехник 2, Н. М. Курмаева 1
1 Пензенский государственный университет
440026 Пенза, ул. Красная, 40, Россия
2 Жигулевский заповедник
445362 Самарская обл., Бахилова Поляна, ул. Жигулевская, 1, Россия
* E-mail: eptesicus@mail.ru
Поступила в редакцию 08.08.2017
После доработки 03.10.2018
Принята к публикации 14.12.2019
Аннотация
Изучена пространственная и генетическая структура населения Eptesicus nilssonii. Установлено, что для вида характерен консерватизм к зимовочным подземельям. Отмечено, что ключевые территории в потоке генов между колониями – места роения. Обнаружено, что после зимовки большинство особей разлетаются на расстояние, не превышающее 15 км, что подтверждается положительными значениями генетической изоляции расстоянием (p ≤ 0.05). Определено, что для самок характерна натальная филопатрия, а для самцов – натальная дисперсия. В местах зимовок и в районах летнего обитания выявлены высокое генное разнообразие и умеренная генетическая дифференциация. Большинство внутрипопуляционных группировок гетерогенны, однако в некоторых фиксируются отклонения от равновесия Харди–Вайнберга (p < 0.05) и возможный инбридинг.
Eptesicus nilssonii (Keyseling et Blasius, 1983) – широко распространенный в Палеарктике вид, который в европейской части России населяет хвойные, смешанные и лиственные леса северной и средней полосы, где приурочен к горам, крупным по площади возвышенностям и выраженным карстовым формам рельефа (Ильин, Смирнов, 2000). В переделах своего европейского ареала немногочисленный вид ведет оседлый образ жизни. Южный предел его распространения в европейской части России – расположенная в среднем течении Волги Самарская Лука. Здесь отмечена самая высокая плотность населения этого вида и сосредоточены его крупнейшие зимовки, где ежегодно регистрируют от 700 до 1000 зимующих особей (Смирнов и др., 2007, 2013б; Смирнов, Вехник, 2011).
Несмотря на широкое распространение вида, его экология остается практически неизученной. До сих пор еще мало сведений о пространственной экологии. Известно, что E. nilssonii образует структурно-стабильные группы, характеризующиеся натальной дисперсией самцов и привязанностью самок к натальной территории (Rydell, 1989). При этом летом в одних и тех же местах обитания встречаются как размножающиеся самки, так и взрослые самцы (Смирнов и др., 2016). Однако на примере Южного Урала показано, что по окончании спячки у половых групп происходит пространственная дифференциация. В этом случае большинство репродуктивных самок перемещаются на другие территории, далеко за пределы области зимовок. Там самки доминируют по численности над самцами, тогда как последние остаются в районах зимних убежищ (Снитько, 2007). Эти данные не согласуются с результатами, полученными на Самарской Луке, которые свидетельствуют о том, что сегрегации полов не происходит, а репродуктивные самки после спячки не покидают область зимовки (Смирнов, Вехник, 2014). Небольшие перемещения (до 40 км) между зимними укрытиями и летними местами обитания, а следовательно, отсутствие половой дифференциации также установлены у подавляющего большинства особей этого вида в Эстонии, Восточной Германии, Чехии и Словакии (Мазинг, 1990; Gaisler et al., 2003; Steffens et al., 2007).
Для изучения пространственной структуры популяционных группировок у таких малодоступных для наблюдения животных, как рукокрылые, весьма эффективным в макро- и в микрогеографических масштабах считается использование методов популяционной генетики. Их привлечение уже позволило у небольшого ряда европейских видов с оседлым образом жизни (Myotis myotis, M. bechsteinii, M. daubentonii, Plecotus auritus и Eptesicus serotinus) выявить уровень генетического разнообразия, генетической дифференциации популяций и поток генов (Рetri et al., 1997; Burland et al., 1999; Kerth et al., 2000, 2003; Castella et al., 2001; Veith et al., 2004; Furmankiewicz, Altringham, 2007; Atterby et al., 2010; Bogdanowicz et al., 2013; Laine et al., 2013). Показано, что у оседлых видов поток генов между популяциями более ограничен, чем у мигрирующих (Вurland, Wilmer, 2001). Многие оседлые виды достаточно филопатричны и образуют небольшие колонии из родственных особей, что предполагает генетическую подразделенность их популяционных группировок (Burland et al., 1998, 1999; Kerth et al., 2002). До настоящего времени популяционно-генетических исследований E. nilssonii не проводилось; также до недавнего времени не было известно ни одного специально разработанного для этого вида микросателлитного ДНК-маркера.
Цель работы – изучение пространственной и генетической структуры населения E. nilssonii, обитающего на крайней южной границе ареала в пределах европейской части России.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводили в северной части Самарской Луки (Самарская обл.) – в основном горной и лесной территории Жигулевской возвышенности – с 2011 по 2016 г. Местами массовой локализации животных здесь зимой служат восемь искусственных подземелий, выработанных и заброшенных еще в 1950-х гг. в правобережных склонах Жигулевских гор (Бурлак, Попова, СХТ-1–СХТ-5 и Верблюд) (рис. 1). Штольни находятся на расстоянии 0.2–6 км одна от другой, а протяженность их ходов 0.4–11.6 км. Весной и осенью у подземелий регулярно отмечается роение рукокрылых.
Рис. 1.
Места отлова Eptesicus nilssonii (1–3 – лето, 4, 5 – зимовки) и точки сбора биопроб (БП, Рб, тЖ, Тх, Рж, Ст, СПб, Спи, СПл, СП1, СП2, Бурлак, Попова, Верблюд, СХТ-1) на Самарской Луке. 1 – летние возвраты особей, окольцованных на зимовке; 3 – места, где вид не зарегистрирован; 4 – зимние возвраты особей, окольцованных в летних местах обитания.
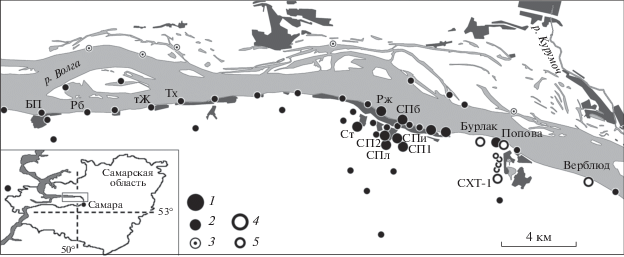
Методы отлова и отбора проб. Изучение пространственно-генетической структуры населения E. nilssonii осуществляли с применением как прямых (повторные отловы ранее окольцованных животных), так и косвенных (молекулярно-генетический анализ) методов. Для выяснения того, как животные из мест летнего обитания связаны с местами зимовок и насколько велика послезимовочная дисперсия, на зимовках и в летних местах обитания проводили массовое кольцевание зверьков. Всего было окольцовано 1215 особей и получено 204 возврата.
Летом в ночное время животных отлавливали с помощью паутинных сетей (Kunz, Kurta, 1988). Поиск колоний осуществляли методом радиослежения (Смирнов и др., 2013а). Всего было помечено трансмиттерами 16 особей. Зимой поиск зверьков проводили в ходе тотального осмотра зимовочного подземелья и учета всех зимующих рукокрылых.
Для изучения генетической структуры населения E. nilssonii нами были исследованы выборки из 11 мест летнего обитания, находящихся на разных расстояниях одно от другого, а также из четырех зимовочных убежищ. В двух местах летнего обитания животные были отобраны непосредственно из колоний, а в девяти пойманы паутинными сетями. Поскольку большинство зверьков сразу после вылета на охоту на протяжении некоторого времени кормится в непосредственной близости от своих дневных убежищ (Rydell, 1989; Смирнов и др., 2013а), то в случае отлова сетями для генетических исследований нами были взяты биопробы только у особей, пойманных в первые 30 мин после вылета из убежищ. Такой подход позволил считать всех пойманных за это время особей относящимися к данному месту обитания и существенно снизить вероятность поимки “транзитных” животных с других смежных с местом отлова территорий. Мы не исключали вероятность того, что пойманные таким образом зверьки могли относиться к разным, но пространственно близко расположенным одна к другой колониям. При отборе проб в местах зимовок, для того чтобы минимизировать вероятность попадания особей из разных колоний в одну выборку и снизить искажения данных по генетическому разнообразию, нами в самых крупных штольнях (Бурлак, Попова, СХТ-1) было проведено несколько выборок из удаленных одно от другого мест. Особи, повторно отловленные на зимовках и летом, были включены в обе группы анализа.
При проведении генетического анализа из-за небольшого объема некоторых выборок, а также низкой доли в них самцов, мы не проводили дифференциацию особей по половому признаку, а рассматривали самцов в составе каждой выборки вместе с самками. Список выборок и их характеристики приведены в табл. 1.
Таблица 1.
Места отбора биопроб и их характеристика
| Место сбора | Обозначение* | Время сбора | Число особей в выборке | Характеристика |
|---|---|---|---|---|
| Южная окраина с. Солнечная Поляна, опушка леса |
СПл | Лето | 13 | Добыты сетями |
| 0.5 км западнее с. Солнечная Поляна, лесной массив | СП2 | » | 13 | Выводковая колония |
| Восточная окраина с. Солнечная Поляна, опушка леса |
СПи | » | 30 | Добыты сетями |
| с. Солнечная Поляна, берег Волги | СПб | » | 8 | То же |
| 0.5 км восточнее с. Солнечная Поляна, лесной массив | СП1 | » | 14 | Выводковая колония |
| Пос. Рижский, берег Волги | Рж | » | 22 | Добыты сетями |
| Окраина пос. Ставропольский, опушка леса | Ст | » | 7 | То же |
| 2 км западнее пос. Зольное, берег р. Волга | Тх | » | 7 | » |
| 4.2 км западнее пос. Зольное, т/б “Жигули”, берег Волги | тЖ | » | 7 | » |
| 2 км восточнее пос. Бахилова Поляна, берег Волги | РБ | » | 7 | » |
| Пос. Бахилова Поляна, берег Волги | БП | » | 8 | » |
| Штольни | Выборки | |||
| Бурлак, участок 1 | Бур1 | Зима | 7 | |
| Бурлак, участок 2 | Бур2 | » | 7 | |
| Попова, участок 1 | Поп1 | » | 7 | |
| Попова, участок 2 | Поп2 | » | 7 | |
| Попова, участок 3 | Поп3 | » | 7 | |
| СХТ-1, участок 1 | СХТ1 | » | 7 | |
| СХТ-1, участок 2 | СХТ2 | » | 11 | |
| Верблюд | Верб | » | 7 |
Примечание. * – для табл. 1–3 и рис. 1, 4, 5.
Выделение и анализ ДНК. ДНК экстрагировали из фрагмента перепонки крыла (d = 5 мм), зафиксированного в 96%-ном этаноле. ДНК из тканей животных выделяли фенолхлороформным методом (Sambrook et al., 1989). Для анализа генетической структуры специально для E. nilssonii были разработаны два микросателлитных маркера – EnTCA и EnTCTA (Smirnov et al., 2016). Мы пытались также применить другие микросателлитные маркеры, которые были выделены для ряда видов (Burland et al., 1998; Castella, Ruedi, 2000; Vonhof et al., 2002), однако все они оказались неэффективными. В целях определения числа микросателлитных повторов и выявления аллелей проводили секвенирование отдельных ампликонов. PCR-фрагменты для секвенирования выделяли после их фракционирования в 6%-ном полиакриламидном геле элюцией высокосолевым раствором. Секвенирование осуществляли с использованием набора реактивов для секвенирования ДНК BigDye® Terminator v3.1 Cycle Sequencing Kit и генетического анализатора ABI PRISM 3500 (Applied Biosystems, США). По разработанным маркерам у вида было выявлено 9–15 аллелей со средним значением этого показателя на локус 6.07 ± 0.38. Диапазон наблюдаемой гетерозиготности в выборках оказался несколько больше ожидаемого (HO = 0.143–0.893, HE = 0.403–0.847, где HO – наблюдаемая, HE – ожидаемая гетерозиготность).
После измерений и взятия биопсии все животные были отпущены в местах их поимки. Отлов животных и отбор проб осуществляли согласно руководящим принципам использования диких млекопитающих в научных исследованиях (Sikes et al., 2011).
Популяционно-генетический анализ. Статистический анализ молекулярно-генетического полиморфизма ДНК проводили с помощью программы GenAlEx6 (Peakall, Smouse, 2006) с определением значений HO и HE, установления соответствия закону Харди–Вайнберга, вычисления F-статистики Райта (Wright, 1978), генетической дифференциации и интенсивности потока генов (Nm). Также оценивали изоляцию расстоянием (тест Мантела), которая позволяет выявить, насколько дистанции (км) между местами сбора образцов коррелируют с их попарными уровнями генетической дифференциации (Fst). Это может служить доказательством наличия потока генов между удаленными субпопуляциями. Согласно рекомендациям Роуссет (Rousset, 1997), были сформированы две матрицы на основе попарной генетической подразделенности (Fst) с трансформацией Fst/(1 – Fst) и попарных натуральных логарифмов географических расстояний. Статистическая значимость корреляции была достигнута с помощью 9999 пермутаций. Выборки были протестированы на отклонение от равновесия по сцеплению по всем попарным сочетаниям локусов в программе Arlequin v3.1 (Excoffier et al., 2005). Для коррекции уровня значимости на множественное сравнение использовали поправку Бонферрони.
Генетическая структура была проанализирована на основе частот встречаемости аллелей в программе STRUCTURE 2.3.4 (Pritchard et al., 2000; Falush et al., 2007), в которой применяется байесовский подход марковских цепей Монте-Карло (Markov Chain Monte Carlo, MCMC). Алгоритм подразумевает наличие нескольких кластеров (K, или предполагаемых популяций) для выборки особей, генотипированных по ряду локусов. Анализ, позволяющий определить вклад (Q) каждого из кластеров в генотип особи, проводили с использованием модели генетического смешения и скоррелированности частот аллелей в разных выборках. Предварительный выбор стартовой точки марковской цепи осуществляли в течение 50 тыс. итераций, с последующим построением марковской цепи в течение 500 тыс. итераций для предполагаемого числа (K) кластеров (1–9). Для каждого значения K анализ повторялся 10 раз в целях сбора необходимой статистики по значениям и средней дисперсии логарифма значения функции правдоподобия. Для определения оптимального числа кластеров, на которые делятся выборки, был применен метод анализа значения delta-K, предложенный Эванно и др. (Evanno et al., 2005) и реализованный в приложении STRUCTURE Harvester (Earl, von Holdt, 2012).
В качестве меры количественной оценки различий между выборками были использованы генетические расстояния, определенные методом Нея (Nei, 1972). На основе матрицы генетических расстояний был проведен кластерный анализ с представлением его результатов в виде дендрограммы, выполненной в программе Past.1.8 (Hammer et al., 2001).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Места летнего обитания и убежища. В условиях Самарской Луки оптимальными местами летнего обитания E. nilssonii служат кленово-липовые леса паркового типа, произрастающие по северным склонам Жигулевских гор. Эти склоны круто опускаются к Волге и разрезаны множеством ущельеобразных оврагов на отдельные отроги. Однако численность и встречаемость вида здесь не везде одинаковая. Максимальное число животных зарегистрировано в зоне 1–2 км от берега Волги, где сосредоточены наиболее кормные биотопы (Смирнов и др., 2013а). По мере удаления от этой зоны встречаемость вида сокращается. На юге Самарской Луки, где горный рельеф не выражен и значительную часть составляют степные ландшафты, находки E. nilssonii, несмотря на наши тщательные поиски, практически отсутствуют.
Летом взрослые самки E. nilssonii формируют выводковые колонии, которые размещаются исключительно в дуплах деревьев (Смирнов и др., 2013а). Однако известно, что в других частях ареала особи этого вида в качестве дневных убежищ используют преимущественно постройки человека (Rydell, 1986, 1989; Снитько, Снитько, 2015). В районе исследований нами осмотрено ∼300 жилых и брошенных строений, однако признаков обитания в них животных не обнаружено.
Самцы селятся отдельно от самок и совместно с ними в убежищах не встречаются. Радиослежение показало, что летом животные занимают 2–5 постоянных убежищ, которые располагаются, как правило, в непосредственной близости одно от другого. Эти укрытия всегда служат местом дневки. Кроме того, во время ночной активности часть особей для непродолжительного отдыха используют временные убежища, которые могут располагаться на значительном удалении от постоянных. Из числа помеченных нами трансмиттерами особей три регулярно останавливались в 1–2 таких убежищах. В конце мая–начале июня самки рожают по одному, реже по два детеныша. В период родов и выкармливания молодняка взрослые самки привязаны к одному убежищу, тогда как в остальное время меняют их через 2–4 сут.
Результаты возвратов ранее окольцованных особей показали, что для взрослых и рожденных в прошлый сезон самок характерна привязанность к натальным территориям (n = 26). Ежегодно в период выведения потомства самки используют, как правило, одни и те же убежища. В местах летнего обитания вместе с взрослыми самками встречаются взрослые самцы (до 50%). У взрослых самцов натальная филопатрия не выявлена, что согласуется с результатами более ранних исследований (Rydell, 1989). Однако многим из них свойственно стремление ежегодно возвращаться на территории, где они обитали предыдущим летом (n = 6). При наблюдении за окольцованными (n = 43) и меченными трансмиттерами животными (n = 11) установлено, что после распада выводковых колоний молодые особи остаются в местах рождения, используя их как кормные территории и как места, где расположены дневные убежища. Взрослые самки покидают выводковые убежища, подыскивая новые на более обширной территории. При этом самки продолжают сохранять привязанность к своим кормовым участкам и посещают их каждую ночь.
Места зимовок. Всего в местах зимовок окольцовано 459 особей, 116 из них отловлены повторно на зимовках и три – летом за пределами зимовочных убежищ. Все зимние возвраты животных были в те же убежища, где их кольцевали. В местах летнего обитания было окольцовано 756 особей. В последующие годы повторно было отловлено 140 особей, 67 из которых в местах зимовок и 73 в местах летнего обитания.
С помощью кольцевания наибольшее число возвратов (n = 41) из летних мест обитания было зафиксировано у животных, которые в качестве зимовки использовали штольню Попова. Эта пещера самая крупная из обследованных подземелий. Здесь были отмечены зверьки из колоний СП1, СП2 и еще из шести летних мест отлова (СПб, Рж, Спи, СПл, пос. Южный, пос. Богатырь). Часть животных (n = 11), повторно отловленных в этой штольне, была ранее окольцована летом у самого ее входа (n = 13). Значительно меньше возвратов было у особей, зимовавших в штольне Бурлак (n = 12), где были отмечены зверьки из шести летних мест отлова (Ст, СПб, Рж, Спи, СПл, пос. Южный). Три особи, окольцованные летом в колонии СП2, одна в СПл и еще две около входов в штольню Попова позже были найдены на зимовке в штольне СХТ-1. Еще один зверек из Рж был обнаружен в штольне Верблюд. Кроме того, часть особей из колонии СП1 (n = 3), обнаруженные на зимовке в штольне Попова, были найдены в одном зале и в непосредственной близости одна к другой. Аналогично зимовали в штольне СХТ-1 особи из колонии СП2 (n = 2).
Генетическая дифференциация и разнообразие. Оба локуса, использованные в анализе, были высокополиморфными. Во многих летних выборках, за исключением Ст и РБ по локусу EnTCA и за исключением СП2, СП1, Ст, Тх, тЖ по локусу EnTCTA, наблюдаемая гетерозиготность оказалась ниже ожидаемой (табл. 2). По первому локусу статистически значимые отклонения от равновесия Харди–Вайнберга были отмечены в выборках СП2, СПи и Рж, а по второму локусу – в СПи и Рж. В суммарной летней выборке среднее выборочное генное разнообразие по всем локусам (HS) оказалось несколько меньше общего генного разнообразия (HT). Коэффициент подразделенности (Fst) показывает, что на межвыборочную компоненту генетического разнообразия E. nilssonii приходится 14.7% всего разнообразия. Эти данные свидетельствуют об умеренной генетической дифференциации выборок, а положительные значения Fis и Fit – о небольшом дефиците гетерозигот и возможном отклонении от пропорции Харди–Вайнберга.
Таблица 2.
Значения наблюдаемой (HO) и ожидаемой (HE) гетерозиготности, индекса фиксации (F), соответствие (p-уровень) закону Харди–Вайнберга (Х–В), генного разнообразия (HT и HS) и F-статистики (Fst, Fis, Fit) в летних и зимних выборках Eptesicus nilssonii
| Летние выборки | Зимние выборки | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| СПл | СП2 | СПи | СПб | СП1 | Рж | Ст | Тх | тЖ | РБ | БП | Бур1 | Бур2 | Поп1 | Поп2 | Поп3 | СХТ1 | СХТ2 | Верб | |
| Локус EnTCA | |||||||||||||||||||
| HO | 0.538 | 0.385 | 0.533 | 0.375 | 0.786 | 0.682 | 0.333 | 0.333 | 0.000 | 0.667 | 0.625 | 0.800 | 0.333 | 0.429 | 0.571 | 0.600 | 0.143 | 0.545 | 0.571 |
| HE | 0.817 | 0.713 | 0.837 | 0.719 | 0.781 | 0.827 | 0.278 | 0.278 | 0.500 | 0.611 | 0.648 | 0.740 | 0.292 | 0.827 | 0.857 | 0.760 | 0.724 | 0.704 | 0.624 |
| F | 0.341 | 0.461 | 0.363 | 0.478 | –0.007 | 0.176 | –0.200 | –0.200 | 1.000 | –0.091 | 0.036 | –0.081 | –0.143 | 0.481 | 0.333 | 0.211 | 0.803 | 0.188 | 0.126 |
| Х–В | 0.426 | 0.002* | 0.001* | 0.088 | 0.352 | 0.025* | 0.729 | 0.729 | 0.157 | 0.506 | 0.590 | 0.654 | 0.971 | 0.018* | 0.263 | 0.366 | 0.017* | 0.070 | 0.744 |
| Локус EnTCTA | |||||||||||||||||||
| HO | 0.692 | 0.769 | 0.633 | 0.625 | 1.000 | 0.727 | 1.000 | 1.000 | 1.000 | 0.333 | 0.625 | 0.800 | 0.667 | 0.857 | 1.000 | 0.600 | 0.143 | 0.909 | 1.000 |
| HE | 0.701 | 0.731 | 0.749 | 0.813 | 0.829 | 0.868 | 0.611 | 0.722 | 0.750 | 0.611 | 0.695 | 0.760 | 0.514 | 0.867 | 0.827 | 0.820 | 0.806 | 0.796 | 0.793 |
| F | 0.013 | –0.053 | 0.155 | 0.231 | -0.206 | 0.162 | –0.636 | –0.385 | –0.333 | 0.455 | 0.101 | –0.053 | –0.297 | 0.012 | –0.210 | 0.268 | 0.823 | –0.256 | –0.146 |
| Х–В | 0.850 | 0.576 | 0.035* | 0.553 | 0.197 | 0.027* | 0.392 | 0.609 | 0.423 | 0.343 | 0.876 | 0.820 | 0.959 | 0.096 | 0.834 | 0.290 | 0.017* | 0.898 | 0.248 |
| HT = 0.803, HS = 0.686, Fst = 0.147, Fis = 0.105, Fit = 0.230 |
HT = 0.837, HS = 0.732, Fst = 0.126, Fis = 0.156, Fit = 0.257 |
||||||||||||||||||
| HT = 0.825, HS = 0.705, Fst = 0.146, Fis = 0.127, Fit = 0.248 | |||||||||||||||||||
Результаты расчета попарных генетических дистанций между выборками отражены в табл. 3. В летних выборках наибольшее сходство с минимальными генетическими дистанциями демонстрируют пары СПл–СП2, Рж–СП1, СПб–СПи. Все места сбора этих пар расположены на незначительном удалении одно от другого и в непосредственной близости от мест массовых зимовок. Не исключено, что эти генетически близкие пары выборок могут быть родственными вследствие обмена между их колониями особями, на что косвенно указывают самые высокие значения Nm. Выборка Ст расположена территориально близко к предыдущим, однако хорошо от них отличается. Наоборот, пространственно удаленная выборка Тх демонстрирует с первыми большее сходство.
Таблица 3.
Значения генетических дистанций (под диагональю) и интенсивности потока генов Nm (над диагональю) между летними и зимними выборками Eptesicus nilssonii
| Бур1 | Бур2 | Поп1 | Поп2 | Поп3 | СХТ1 | Верб | СХТ2 | СП1 | СП2 | Рж | СПб | СПи | СПл | Ст | Тх | тЖ | РБ | БП | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Бур1 | 1.644 | 4.976 | 4.046 | 2.665 | 3.122 | 3.429 | 3.457 | 6.477 | 3.969 | 5.316 | 7.753 | 8.617 | 6.967 | 1.045 | 1.473 | 2.240 | 2.491 | 2498 | |
| Бур2 | 0.435 | 1.587 | 1.594 | 0.981 | 1.376 | 1.390 | 4.191 | 2.379 | 4.145 | 2.072 | 2.995 | 2.359 | 3.083 | 1.442 | 4.174 | 0.675 | 1.335 | 0.961 | |
| Поп1 | 0.477 | 0.527 | 9.738 | 5.493 | 6.033 | 4.437 | 4.846 | 12.24 | 4.420 | 27.07 | 10.14 | 7.631 | 5.029 | 1.909 | 2.198 | 2.063 | 2.224 | 2.584 | |
| Поп2 | 0.652 | 0.510 | 0.327 | 6.945 | 4.253 | 5.023 | 5.089 | 9.094 | 5.290 | 10.15 | 6.223 | 6.177 | 5.724 | 1.755 | 2.028 | 1.647 | 2.271 | 2.469 | |
| Поп3 | 0.992 | 1.224 | 0.515 | 0.377 | 2.983 | 4.899 | 2.284 | 3.636 | 2.289 | 4.985 | 3.015 | 2.713 | 2.571 | 1.166 | 1.241 | 1.508 | 1.454 | 1.695 | |
| СХТ1 | 0.691 | 0.615 | 0.396 | 0.636 | 0.872 | 3.127 | 3.715 | 4.659 | 3.401 | 7.190 | 5.457 | 5.909 | 3.646 | 1.521 | 1.811 | 2.330 | 3.375 | 2.906 | |
| Верб | 0.585 | 0.562 | 0.555 | 0.464 | 0.424 | 0.682 | 3.244 | 3.852 | 3.816 | 4.216 | 3.623 | 4.399 | 4.270 | 1.100 | 1.466 | 1.477 | 2.039 | 1.993 | |
| СХТ2 | 0.487 | 0.101 | 0.391 | 0.363 | 1.026 | 0.457 | 0.518 | 10.22 | 53.03 | 8.642 | 7.751 | 6.861 | 10.06 | 2.962 | 4.249 | 1.365 | 2.712 | 2.172 | |
| СП1 | 0.307 | 0.226 | 0.208 | 0.291 | 0.779 | 0.488 | 0.600 | 0.138 | 9.960 | 22.53 | 16.05 | 11.72 | 14.28 | 2.060 | 2.474 | 2.383 | 2.778 | 2.829 | |
| СП2 | 0.443 | 0.092 | 0.490 | 0.374 | 1.120 | 0.553 | 0.461 | 0.024 | 0.160 | 7.180 | 7.442 | 8.590 | 15.57 | 2.115 | 3.363 | 1.484 | 3.093 | 2.500 | |
| Рж | 0.437 | 0.304 | 0.107 | 0.312 | 0.593 | 0.315 | 0.600 | 0.173 | 0.104 | 0.252 | 16.52 | 8.922 | 7.183 | 2.260 | 2.704 | 2.282 | 2.835 | 2.951 | |
| СПб | 0.223 | 0.155 | 0.207 | 0.380 | 0.861 | 0.351 | 0.559 | 0.184 | 0.114 | 0.211 | 0.112 | 17.54 | 9.661 | 1.776 | 2.833 | 1.972 | 2.923 | 2.569 | |
| СПи | 0.220 | 0.241 | 0.344 | 0.439 | 1.205 | 0.353 | 0.503 | 0.232 | 0.185 | 0.192 | 0.284 | 0.104 | 15.19 | 1.440 | 2.284 | 2.384 | 4.488 | 3.892 | |
| СПл | 0.254 | 0.154 | 0.498 | 0.403 | 1.099 | 0.580 | 0.467 | 0.142 | 0.128 | 0.096 | 0.309 | 0.181 | 0.115 | 1.498 | 2.237 | 2.123 | 3.648 | 3.011 | |
| Ст | 1.092 | 0.448 | 0.426 | 0.507 | 1.005 | 0.579 | 0.959 | 0.247 | 0.375 | 0.378 | 0.316 | 0.477 | 0.719 | 0.644 | 2.375 | 0.570 | 0.793 | 0.706 | |
| Тх | 0.703 | 0.117 | 0.405 | 0.488 | 1.096 | 0.556 | 0.683 | 0.158 | 0.323 | 0.213 | 0.281 | 0.254 | 0.389 | 0.395 | 0.269 | 0.724 | 1.471 | 1.030 | |
| тЖ | 0.634 | 1.418 | 0.987 | 1.697 | 1.502 | 0.613 | 1.338 | 1.291 | 0.670 | 1.212 | 0.822 | 0.803 | 0.676 | 0.735 | 3.087 | 1.648 | 2.282 | 2.669 | |
| РБ | 0.578 | 0.456 | 0.823 | 0.785 | 1.589 | 0.372 | 0.740 | 0.427 | 0.521 | 0.382 | 0.539 | 0.449 | 0.270 | 0.340 | 1.208 | 0.513 | 0.424 | 7.878 | |
| БП | 0.711 | 0.887 | 0.871 | 0.937 | 1.598 | 0.560 | 0.983 | 0.719 | 0.670 | 0.629 | 0.702 | 0.693 | 0.425 | 0.550 | 2.009 | 1.022 | 0.403 | 0.117 |
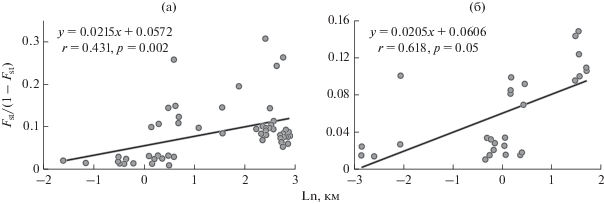
Отдельную хорошо генетически обособленную группу формируют БП и РБ. Они максимально удалены от исследованных мест массовых зимовок вида, а между собой образуют относительно небольшую генетическую дистанцию. Наибольшую от всех генетическую дистанцию имеет выборка тЖ. Проверка генетической изоляции исследуемых выборок расстоянием выявила достоверную положительную корреляцию между Fst и географической удаленностью отдельных летних выборок (рис. 2а).
Рис. 2.
Корреляция между значениями логарифма географической дистанции и уровнем генетической подразделенности при попарном сравнении летних (а) и зимних (б) выборок Eptesicus nilssonii. Линии – оптимальная линейная регрессия; приведены уравнения регрессии, коэффициенты корреляции теста Мантеля (r) и уровни статистической значимости (p).
В местах массовых зимовок преобладание наблюдаемой гетерозиготности над ожидаемой как по локусам EnTCA, так и по локусу EnTCTA было отмечено в выборках штольни Бурлак, тогда как в штольнях Поп2, СХТ2 и Верб было отмечено преобладание только по второму локусу (табл. 2). Во всех остальных случаях наблюдаемая гетерозиготность была меньше ожидаемой. Несоответствие равновесию Харди–Вайнберга было выявлено лишь в штольнях СХТ1 и Поп1. В суммарной зимней выборке по всем локусам общее генное разнообразие было больше среднего внутривыборочного разнообразия, что близко к аналогичным показателям по летним выборкам. Коэффициент подразделенности (Fst), значения Fis и Fit, как и по летним сборам, указывают на умеренную их генетическую дифференциацию, на отклонение от пропорции Харди–Вайнберга и дефицит гетерозигот.
Результаты расчета генетических дистанций между выборками, взятыми из разных мест зимовок, подтверждают средний уровень их подразделенности (табл. 3). Наибольшая генетическая дистанция была выявлена между выборками Поп3 и Бур2, где значение потока генов (Nm) не превышает единицы. Минимальную дистанцию демонстрируют выборки СХТ2 и Бур2. При этом наибольший поток генов отмечен между всеми выборками штольни Попова, а также между выборками Поп1 и СХТ1.
Симуляция популяционной структуры на основе распределения генотипов 196 особей E. nilssonii в программе STRUCTURE показала, что средние значения логарифма функции правдоподобия при оптимизации модели демонстрировали максимальный рост до K = 2, затем рост замедлялся, а стандартные отклонения каждой из 10 репликаций начинали возрастать. Из этого следует, что наиболее вероятное число возможных группировок высшей иерархии (популяционного уровня) находится в интервале 2–4. Однако при одновременном учете разности значений логарифма функции правдоподобия модели для каждого предыдущего и последующего шага и стандартного отклонения функции правдоподобия для 10 репликаций (статистика delta-K) (Evanno et al., 2005) наибольшую поддержку получает число возможных кластеров K = 2. Картина кластеризации выборок представлена на рис. 3 и 4.
Рис. 3.
Результаты STRUCTURE-анализа 196 особей Eptesicus nilssonii. а – зависимость логарифма апостериорной вероятности разбиения общей совокупности выборок на K групп от числа таких групп; б – изменение статистики delta-K для функции правдоподобия.
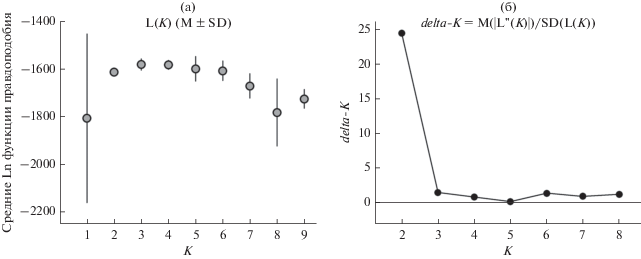
Рис. 4.
Апостериорные вероятности принадлежности особей разных выборок к выявленным популяционным кластерам для различного числа возможных кластеров (K).
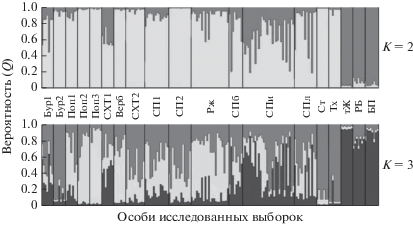
В простейшей модели (K = 2) группы выборок подразделяются на два кластера. Первый (темно-серый цвет) с вероятностью >91% включает в себя тЖ, РБ и БП, что подтверждает их генетическую обособленность от всех других при попарном расчете генетической дистанции (табл. 3). Второй кластер (светло-серый цвет) с вероятностью от 62 до 99% объединяет большинство остальных выборок. Однако в выборках СПб, СПи и СПл присутствуют отдельные особи, которые с вероятностью >71% относятся к первому кластеру. Неоднородный генетический состав имеют выборки СХТ1 и СПи, которые почти в равной степени несут признаки первого и второго кластеров.
С усложнением модели (K = 3) в отдельный кластер (светло-серый цвет) с вероятностью 90% выделяется выборка Поп3. С ней наиболее близки выборки Верб и Поп2 (70 и 71% соответственно). Более или менее однородную генетическую структуру по второму кластеру (черный цвет) сохраняют тЖ, РБ и БП (77–95%), а по третьему (темно-серый цвет) – Бур2, Ст и Тх (87–91%). Все остальные выборки гетерогенны и демонстрируют разные вероятности принадлежности особей к трем генетическим кластерам.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Данное исследование на сегодня – одно из немногих, рассматривающих генетическую структуру локальных популяционных группировок у оседлых видов рукокрылых и показывающих связь их летних мест обитания с местами зимовок. Похожие исследования генетической структуры у европейских видов на разномасштабном уровне проводили лишь на примере Myotis bechsteinii (Kerth et al., 2003) и Plecotus auritus (Veith et al., 2004; Furmankiewicz, Altringham, 2007). Нами была охвачена небольшая по площади территория и применено минимальное число генетических маркеров, однако это не снижает качество полученных результатов, а выявленные структурные элементы локальных группировок свидетельствует о ключевых тенденциях, которые реально могут наблюдаться на внутри- и межпопуляционных уровнях.
Согласно возвратам E. nilssonii, отмеченным на Самарской Луке, максимальное расстояние от зимних убежищ, на котором были отловлены особи этого вида летом, составило не более 15 км (рис. 1). В этой области встречались как взрослые самцы, так и репродуктивные самки, что подтверждает идею об отсутствии сегрегации полов летом (Смирнов, Вехник, 2014).
В целом полученные результаты крайне неоднозначны. Исследования показали, что животные из разных мест летнего обитания в качестве зимовки могут использовать одно общее подземелье, а особи из одного летнего места обитания, а в отдельных случаях и из одной колонии иногда встречаются зимующими в совершенно разных убежищах. Сходная тенденция была ранее прослежена у P. auritus (Furmankiewicz, Altringham, 2007). В то же время было выявлено, что из отдельно взятой летней колонии часть взрослых особей прилетают на зимовку в одно убежище, где размещаются компактно в одной группе или на небольшом удалении одна от другой. Нам не удалось обнаружить на зимовках всех окольцованных особей из числа тех колоний, которые находились под наблюдением, однако обнаружение даже их части свидетельствует о возможной “семейственности” в выборе зимовочных убежищ и мест локализации.
Результаты возвратов показывают, что рукокрылые крайне “привязаны” к своим зимовочным подземельям. Выбрав 1 раз одно из них, они никогда более не встречаются в других, даже близко расположенных. Такая закономерность была выявлена у всех повторно отловленных на зимовках особей (n = 116). Более того, многие животные из года в год встречаются не только в одних и тех же залах одного подземелья (66.7%), но даже в конкретных местах на стенах и потолках (18.8%). Поэтому большинство особей вида, которые были отловлены летом сетями в одной отдельной взятой точке, но зимующих в разных подземельях, априори можно считать принадлежащими к разным колониям. Такую точку зрения подтверждают результаты анализа генетической структуры выборок в программе STRUCTURE. Так, выборки Рж, СПб, Спи и СПл демонстрируют высокую гетерогенность, что может быть следствием попадания в их совокупность особей из генетически разных, но проживающих летом в непосредственной близости колониях.
Несмотря на изоляцию группировок особей E. nilssonii, зимующих в разных штольнях, обмен генами все же происходит, а между отдельными подземельями даже достаточно интенсивно. В отсутствие возможности зимой перелетать из одного подземелья в другие многие особи могут это осуществлять, вероятно, в конце лета и осенью – в период перемещения от мест летнего обитания к местам роения.
Роение для рукокрылых – сезонное явление, когда много особей собирается осенью в местах зимовок. Животные “гоняются” здесь одно за другим, летая около входов в подземелья, то залетая, то вылетая из них. Осень считается основным периодом спаривания, поэтому места роения являются ключевыми территориями. Возможно, что некоторые животные, стремящиеся попасть к своим местам зимовок или роения, оказываются привлеченными к “чужим”, участвуя там в спаривании. Так, например, в конце июля 2009 г. у входов в штольню Попова было окольцовано 13 особей E. nilssonii. Позже из этого числа два зверька в течение нескольких лет были отмечены зимующими в штольне СХТ-1, а остальные – в штольне Попова. Стремление особей в период осенних перекочевок не только использовать свои места роения, но и посещать чужие может объяснить тот факт, что уровень дифференциации между выборками в целом в местах зимовок оказался ниже, чем в местах летнего обитания, а разнообразие внутри выборок, наоборот, немного большим. Последнее обстоятельство связано еще и с тем, что на места зимовок особи собираются со значительной по площади территории, а формирующиеся здесь зимовки представлены большим числом колоний из разных летних мест обитания. Такие тенденции были отмечены не только для E. nilssonii, но и для ряда других европейских оседлых видов (Furmankiewicz, Górniak 2002; Kerth et al., 2003; Parsons et al., 2003; Veith et al., 2004; Rivers et al., 2005, 2006; Furmankiewicz, Altringham, 2007). Все это свидетельствует о важной роли места роения в потоке генов между колониями и косвенно о, возможно, широком “размахе” дисперсии особей этого вида в послезимовочный период.
Если спаривание происходит в местах роения, где встречаются особи разных колоний, то вероятность спаривания родственных самцов и самок должна быть крайне низкой, что снижает инбридинг и потерю гетерозиготности. Если в местах роения встречаются особи из изолированных летних колоний, то значения Fis в местах зимовок будут близки к значениям Fst у летнего населения (Humphrey, Cope, 1976), что мы и наблюдали (табл. 2). Однако в некоторых зимних выборках нами был отмечен высокий индекс фиксации (F), который указывает на соответствующую степень близкого родства формирующих их особей, а также еще и косвенно подтверждает привязанность к местам зимовок. Поскольку самцам вида не свойственна натальная филопатрия, то велика вероятность спаривания самок с родственными самцами именно в местах роения и во время зимовки. Такой вариант событий становится возможным, если молодые самцы и самки одной колонии в первый год жизни зимуют в одном убежище, а в последующие годы вследствие импринтинга регулярно сюда возвращаются. Кроме того, небольшая часть самцов остается в местах зимовок и летом использует подземелье как дневное убежище, а осенью “встречает” прилетающих на зимовку самок (Смирнов и др., 2012).
По нашему мнению, поток генов не может ограничиваться спаривание только в местах роения. Не исключено, что часть самцов присоединяется к колониям самок еще в конце лета и спаривание происходит частично в летних убежищах. Позже самцы и самки вместе перемещаются к местам роения. Весной филопатричные самки опять возвращаются в места своего летнего обитания и формируют там выводковые колонии. Состав таких выводковых колоний, как показали результаты кольцевания, очень часто пополняется за счет рожденных здесь же в прошлый год молодых самок (n = 7). Похожее уже было отмечено в других частях ареала вида (Rydell, 1989; Снитько, Снитько, 2015). Здесь вопрос о том, самцы какой степени родства имеют больший репродуктивный успех, пока остается открытым. Выявленные в некоторых летних выборках высокие значения F и некоторый дефицит гетерозигот в суммарных расчетах показывают, что при спаривании инбридные отношения не исключены.
Мы также допускаем вероятность того, что на дополнительный приток генов и увеличение генетического разнообразия популяций в местах зимовок могут влиять молодые особи. После распада выводковых колоний молодые животные, как правило, живут обособленно от взрослых и осенью выбирают маршруты следования к местам зимовок самостоятельно. Во время таких перемещений они могут быть случайно привлечены к любому месту роения или зимовочному подземелью, которое, например, не используется особями “родной” колонии, и остаться здесь на зимовку. Впоследствии импринтинг и свойственный им консерватизм обусловят в следующие годы регулярное возвращение и использование для зимовок только этих мест. Сходные предположения были сделаны ранее для P. auritus (Veith et al., 2004). В наших исследованиях подтверждением этого может быть пример распределения особей по местам зимовок из двух летних материнских колоний СП1 и СП2, помеченных кольцами весной и летом 2014 г. Старых особей из колонии СП2 регулярно отмечали зимующими в штольне СХТ-1, а из колонии СП1 – в штольне Попова. Однако некоторые молодые особи (n = 5), рожденные и помеченные в этих колониях, позже были отмечены зимующими в штольне Бурлак. Повторно отловленные зверьки могли оказаться здесь на зимовке потому, что это подземелье находится на пути между местом летнего обитания и штольнями Попова и СХТ-1. Вероятно, аналогично можно объяснить тот факт, что один зверек из материнской колонии СП2 был найден зимующим в штольне Попова, тогда как другие – в СХТ-1.
В ходе исследований была выявлена генетическая изоляция расстоянием между выборками. Полученные результаты, по нашему мнению, связаны с дальностью перелетов, которые осуществляют оседлые виды из мест зимовок в районы летнего обитания. Межсезонные перекочевки E. nilssonii небольшие по дальности (вероятно, не более 15 км), поэтому колонии, проводящие лето за пределами этого расстояния, используют другие места зимовок и имеют относительно “изолированный” поток генов. Наоборот, у видов, перелетающих на большее расстояние, но не превышающее 100 км, такая изоляция в большинстве случаев не была обнаружена (Rivers et al., 2005; Furmankiewicz, Altringham, 2007). Однако при проведении исследований в более крупных географических масштабах изоляция расстоянием не исключена. Например, хорошая связь между географической дистанцией и Fst была выявлена в популяциях M. daubentonii из Северной Великобритании (Atterby et al., 2010).
Сопоставление всех выборок E. nilssonii позволило оценить генетическую связь особей из летних мест обитания с местами зимовок и подтвердить описанные выше варианты потока генов и генетическую структуру построений в программе STRUCTURE (рис. 5). Так, минимальная генетическая дистанция была выявлена между колонией СП2 и выборкой из СХТ2. Образуемый ими кластер показывает существенное сходство с выборкой Бур2, что подтверждает идею о возможном потоке генов за счет молодых особей во время перелетов из летних мест обитания к местам зимовок. С выборками СХТ2 и Бур2 также генетически связаны особи, обитающие летом в местах СПл, СПб и СПи, а полученные возвраты “лето–зима” (n = 9) только подтверждают эту схему. Отдельный кластер формируют выборки из колоний СП1, Рж и Поп1, где генетическая связь особей из летних мест обитания с особями из зимовок также доказывается возвратами ранее окольцованных животных (n = 8). Из всех других исследованных мест летнего обитания возвратов в зимовочные убежища отмечено не было. Исключение составляет выборка Ст, откуда одна окольцованная особь была поймана на зимовке в штольне Бурлак, однако сильной генетической связи ни с этим местом зимовки, ни с какими-либо другими выявлено не было. Генетически обособленными от всех проанализированных летних выборок оказались Поп2, Поп3 и Верб, несмотря на то что в последней однажды была добыта особь, ранее окольцованная в Рж. По-видимому, значительная часть особей, зимующих в этих частях указанных штолен, прилетает сюда с иных территорий, которые не были охвачены нашими исследованиями. Генетическая связь выборок из БП, РБ и тЖ с местами зимовок также не была выявлена, а их группировки с определенной вероятностью можно считать частями другой популяции вида. Обращает на себя внимание положение Тх, которая демонстрирует среднюю генетическую дистанцию с зимовками из СХТ2 и Бур2. Такая ситуация показывает, что поток генов на расстояние >15 км не исключен.
Рис. 5.
Дендрограмма генетического сходства между летними (1) и зимними выборками (2) Eptesicus nilssonii (метод кластеризации UPGMA).
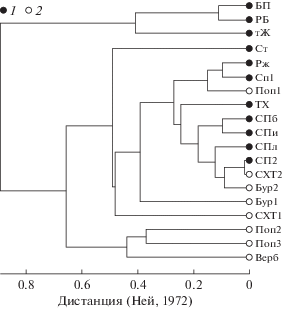
Осталось выяснить, сколько колоний E. nilssonii участвует в зимовках, расположенных в искусственных подземельях Самарской Луки. Приблизительно это значение можно рассчитать с помощью числа особей, образующих выводковые колонии, и общего числа зверьков, отмеченных на зимовке. В районе исследований нами были обнаружены материнские колонии (n = 10) численностью 10–40 особей. Если предположить, что средняя численность особей в колониях равна 25, а в период появления потомства увеличивается как минимум вдвое, то минимальное число колоний, особи которых встречаются в местах массовых зимовок, где численность вида в разные годы колеблется от 700 до 1000 особей, предположительно должно составлять 28–40. По штольням СХТ-1, Бурлак, Верблюд и Попова этот показатель будет равен ~4, 9, 3 и ~15 колониям соответственно. Однако эти числа будут несколько заниженными. Обусловлено это тем, что не все особи из каждой колонии зимуют в одном подземелье, поэтому все зимующее в нем население вида будет формироваться особями, скорее всего, из большего числа колоний.
ЗАКЛЮЧЕНИЕ
Проведенный анализ позволил выявить, что на крайней южной границе ареала в европейской части России у внутрипопуляционных группировок E. nilssonii имеется неоднозначный и сложный механизм формирования пространственно-генетической структуры. К ключевым факторам здесь относятся такие свойства, как натальная филопатрия самок, натальная дисперсия самцов и их привязанность к летним местам обитания, филопатрия к конкретным местам зимовок (штольням), отсутствие летом пространственной дифференциации полов, небольшие расстояния послезимовочных перекочевок и, следовательно, генетическая изоляция расстоянием между группировками особей. Байесовский подход, реализованный в STRUCTURE, показал, что все исследованные выборки должны рассматриваться как две группы популяционного ранга: первая распространена в 15-километровой зоне от мест зимовок, вторая – за пределами этой территории. Эти результаты также доказывают, что площадь территории, с которой слетаются животные в конкретные места зимовок, ограничена определенным расстоянием от них, за пределами которого обитают группировки с иной генетической структурой.
Важнейшие территории в потоке генов между колониями – места роения и зимовочные убежища. Между населениями, зимующими в разных, но находящихся в непосредственной близости одна от другой штольнях, во время зимовки обмена особями не происходит. Однако это возможно в конце лета и осенью – в период перемещения от мест летнего обитания к местам зимовок. Дополнительный приток генов и увеличение генетического разнообразия в зимовочных скоплениях вида, вероятно, привносят необремененные в первый год жизни импринтингом и привязанностью к зимовкам молодые животные.
В локальных местах обитания ряд соседних колоний могут быть неродственными, что определяет причину генетической неоднородности всего летнего населения. Однако, несмотря на гетерогенность большинства группировок особей, в некоторых отмечаются отклонения от равновесия Харди–Вайнберга и возможный инбридинг. Есть предположение, что репродуктивный успех в таких случаях имеют те самцы, которые в конце лета прилетают на натальные территории и посещают родственные колонии.
Работа выполнена при финансовой поддержке РФФИ (грант 15-04-01055-а).
Список литературы
Ильин В.Ю., Смирнов Д.Г. Особенности распространения оседлых видов рукокрылых (Chiroptera: Vespertilionidae) на востоке Русской равнины и в смежных регионах // Экология. 2000. № 2. С. 118–124.
Мазинг М. Пещеры Эстонии – уникальные места массовой зимовки рукокрылых. Тарту: Редакционно-издательский совет АН Эстонии, 1990. 83 с.
Смирнов Д.Г., Вехник В.П. Численность и структура сообществ рукокрылых (Chiroptera: Vespertilionidae), зимующих в искусственных подземельях Самарской Луки // Экология. 2011. № 1. С. 64–72.
Смирнов Д.Г., Вехник В.П. Соотношение полов и пространственная структура популяций у оседлых видов рукокрылых (Chiroptera: Vespertilionidae) Среднего Поволжья // Зоол. журн. 2014. Т. 93. № 9. С. 1117–1127.
Смирнов Д.Г., Вехник В.П., Курмаева Н.М., Баишев Ф.З. Использование кормовых участков и убежищ Eptesicus nilssonii на Самарской Луке // Изв. вузов. Поволж. регион. Естеств. науки. 2013а. № 4. С. 69–75.
Смирнов Д.Г., Вехник В.П., Курмаева Н.М., Шепелев А.А. Сезонные особенности формирования пространственной структуры населения рукокрылых в штольнях Самарской Луки // Поволж. экол. журн. 2012. № 1. С. 73–82.
Смирнов Д.Г., Баишев Ф.З., Безруков В.А., Вехник В.П., Курмаева Н.М. Особенности пространственно-генетической дифференциации населения Eptesicus nilssonii на Самарской Луке // Актуальные вопросы современной зоологии и экологии животных. Матер. Всерос. науч. конференции, посвященной 70-летнему юбилею кафедры “Зоология и экология” ПГУ и памяти проф. В.П. Денисова (1932–1997). Пенза: ПГУ, 2016. С. 84.
Смирнов Д.Г., Вехник В.П., Курмаева Н.М., Шепелев А.А., Ильин В.Ю. Видовая структура и динамика сообщества рукокрылых (Chiroptera: Vespertilionidae), зимующих в искусственных подземельях Самарской Луки // Изв. РАН. Сер. биол. 2007. № 5. С. 608–618.
Смирнов Д.Г., Вехник В.П., Курмаева Н.М., Шепелев А.А., Степанова С.В., Безруков В.А., Гришина Т.А., Ильин В.Ю. Итоги многолетнего мониторинга численности зимующих рукокрылых в искусственных подземельях Самарской Луки // Сб. ст. Междунар. науч. конференции, посвящ. 140-летию со дня рождения И.И. Спрыгина. Пенза: ПГУ, 2013б. С. 331–333.
Снитько В.П. Сезонная пространственная дифференциация половых групп в популяциях оседлых видов рукокрылых (Chiroptera, Vespertilionidae) Южного Урала // Экология. 2007. № 5. С. 362–368.
Снитько В.П., Снитько Л.В. К экологии северного кожанка (Eptesicus nilssonii, Chiroptera, Vespertilionidae) на Южном Урале (Ильменский заповедник, Челябинская область) // Зоол. журн. 2015. Т. 94. № 11. С. 1330–1337.
Atterby H., Aegerter J.N., Smith G.C., Conyers C.M., Allnutt T.R., Ruedi M., MacNicoll A.D. Population genetic structure of the Daubenton’s bat (Myotis daubentonii) in western Europe and the associated occurrence of rabies // Europ. J. Wildlife Res. 2010. V. 56. P. 67–81.
Bogdanowicz W., Lesiński G., Sadkowska-Todys M., Gajewska M., Rutkowski R. Population genetics and bat rabies: a case study of Eptesicus serotinusin Poland // Acta Chiropterol. 2013. V. 15. Iss. 1. P. 35–56.
Burland T.M., Wilmer J.W. Seeing in the dark: molecular approaches to the study of bat populations // Biol. Rev. Camb. Philos. Soc. 2001. V. 76. Iss. 3. P. 389–409.
Burland T.M., Barratt E.M., Racey P.A. Isolation and characterization of microsatellite loci in the brown long-eared bat, Plecotus auritus, and cross-species amplification within the family Vespertilionidae // Mol. Ecol. 1998. V. 7. P. 136–138.
Burland T.M., Barratt E.M., Beaumont M.A., Racey P.A. Population genetic structure and gene flow in a gleaning bat, Plecotus auritus // Proc. Roy Soc. B: Biol Sci. 1999. V. 266. P. 975–980.
Castella V., Ruedi M. Characterization of highly variable microsatellite loci in the bat Myotis myotis (Chiroptera: Vespertilionidae) // Mol. Ecol. 2000. V. 9. P. 1000–1002.
Castella V., Ruedi M., Excoffier L. Contrasted patterns of mitochondrial and nuclear structure among nursery colonies of the bat Myotis myotis // J. Evol. Biol. 2001. V. 14. P. 708–720.
Earl A., von Holdt M. STRUCTURE HARVESTER: a website and program for visualizing STRUCTURE output and implementing the Evanno method // Conserv. Genet. Resour. 2012. V. 4. Iss. 2. P. 359–361.
Evanno G., Regnaut S., Goudet J. Detecting the number of clusters of individuals using the software STRUCTURE: a simulation study // Mol. Ecol. 2005. V. 14. P. 2611–2620.
Excoffier L., Laval G., Schneider S. Arlequin ver. 3.0: an integrated software package for population genetics data analysis // Evol. Bioinform. Online. 2005. V. 1. P. 47–50.
Falush D., Stephens M., Pritchard J. Inference of population structure using multilocus genotype data: dominant markers and null alleles // Mol. Ecol. Notes. 2007. V. 7. P. 574–578.
Furmankiewicz J., Altringham J. Genetic structure in a swarming brown long-eared bat (Plecotus auritus) population: evidence for mating at swarming sites // Conserv. Genet. 2007. V. 8. P. 913–923.
Furmankiewicz J., Górniak J. Seasonal changes in number and diversity of bat species (Chiroptera) in the Stolec mine (SW Poland) // Przyroda Sudetów Zachodnich Suppl. 2002. V. 2. P. 49–70.
Gaisler J., Hanák V., Hanzal V., Jarský V. Výsledky kroužkováni netopýrů v České republice a na Slovensku, 1948–2000 // Vespertilio. 2003. № 7. P. 3–61.
Hammer O., Harper D.A.T., Ryan P.D. PAST: Palaeonto_logical statistics software package for education and data analysis // Palaeontol electronica. 2001. V. 4. Iss. 1. Art. 4. 9 p. http://palaeo_electronica.org/2001_1/past/issue1_01.htm
Humphrey S.R., Cope J.B. Population ecology of the little Brown Bat Myotis lucifugus, in Indiana and North-Central Kentucky // Special Publ. Amer. Soc. Mamm. 1976. Oklahoma: 4. P. 1–81.
Kerth G., Mayer F., König B. Mitochondrial DNA (mtDNA) reveals that female Bechstein’s bats live in close societies // Mol. Ecol. 2000. V. 9. P. 793–800.
Kerth G., Mayer F., Petit E. Extreme sex-biased dispersal in the communally breeding, nonmigratory Bechstein’s bat (Myotis bechsteinii) // Mol. Ecol. 2002. V. 11. P. 1491–1498.
Kerth G., Kiefer A., Trappmann C., Weishaar M. High gene diversity at swarming sites suggest hot spots for gene flow in the endangered Bechstein’s bat // Conserv. Genet. 2003. V. 4. P. 491–499.
Kunz T.H., Kurta A. Capture methods and holding devices // Ecological and behavioral methods for the study of bats. Washington, D.C.: Smithsonian Inst. Press., 1988. P. 1–29.
Laine V.N., Lilley T.M., Norrdahl K., Primmer C.R. Population genetics of Daubenton’s bat (Myotis daubentonii) in the Archipelago Sea, SW Finland // Ann. Zool. Fennici. 2013. V. 50. Iss. 5. P. 303–315.
Nei M. Genetics distance between populations // Amer. Nat. 1972. V. 106. № 949. P. 283–292.
Parsons K.N., Jones G., Davidson-Watts I., Greenaway F. Swarming of bats at underground sites in Britain – implications for conservation // Biol. Conserv. 2003. V. 111. P. 63–70.
Peakall R., Smouse P.E. GENALEX 6: genetic analysis in Excel. Population genetic software for teaching and research // Mol. Ecol. Not. 2006. V. 6. P. 288–295.
Petri B., Paabo S., von Haeseler A., Tautz D. Paternity assessment and population subdivision in a natural population of the larger mouse-eared bat Myotis myotis // Mol. Ecol. 1997. V. 7. P. 639–655.
Pritchard J.K., Stephens M., Donnelly P. Inference of population structure using multilocus genotype data // Genetics. 2000. V. 155. P. 945–959.
Rivers N.M., Butlin R.K., Altringham J.D. Genetic population structure of Natterer’s bats explained by mating at swarming sites and philopatry // Mol. Ecol. 2005. V. 14. P. 4299–4312.
Rivers N.M., Butlin R.K., Altringham J.D. Autumn swarming behaviour of Natterer’s bats in the UK: Population size, catchment area and dispersal // Biol. Conserv. 2006. V. 27. P. 215–226.
Rousset F. Genetic differentiation and estimation of gene flow from F-statistics under isolation by distance // Genetics. 1997. V. 145. P. 1219–1228.
Rydell J. Feeding territoriality in female northern bats, Eptesicus nilssoni // Ethology. 1986. V. 72. P. 329–337.
Rydell J. Site Fidelity in the Northern Bat (Eptesicus nilssoni) during pregnancy and lactation // J. Mamm. Amer. Soc. Mamm. 1989. V. 70. № 3. P. 614–617.
Sambrook J., Fritch E., Maniatis T. Molecular Cloning: A Laboratory Manual. N.Y.: Cold Spring Harbor Lab. Press, 1989. 398 p.
Sikes R.S., Gannon W.L. Animal Care and Use Committee of the American Society of Mammalogists. Guidelines of the American Society of Mammalogists for the use of wild mammals in research // J. Mamm. 2011. V. 92. P. 235–253.
Smirnov D.G., Titov S.V., Baishev F.Z. New microsatellite markers for Myotis daubentonii and Eptesicus nilssonii (Vespertilionidae, Chiroptera) // Russ. J. Theriol. 2016. V. 15. Iss. 2. P. 81–83.
Steffens R., Zöphel U., Brockmann D. 40th anniversary bat marking Centre Dresden – evaluation of methods and overview of results. Materialien zu Naturschutz und Landschaftspflege. Dresden: Sächsisches Landesamt Umwelt Geologie, 2007. 127 p.
Veith M., Kiefer A., Johannesen J., Seitz A. The role of swarming sites for maintaining gene flow in the brown longeared bat (Plecotus auritus) // Heredity. 2004. V. 93. P. 342–349.
Vonhof M.J., Davis C.S., Fenton M.B., Strobeck C. Characterization of dinucleotide microsatellite loci in big brown bats (Eptesicus fuscus), and their use in other North American vespertilionid bats // Mol. Ecol. Not. 2002. V. 2. P. 167–169.
Wright S. Evolution and the genetics of populations, V. 4: Variability within and among natural populations // Chicago, Illinois: Univ. Chicago Press, 1978. 590 p.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


