Известия РАН. Серия биологическая, 2020, № 5, стр. 526-533
Водные плесени порядка Saprolegniales (Oomycota) в ассоциации с байкальскими видами рыб и губок
Е. В. Дзюба 1, И. Г. Кондратов 1, *, О. О. Майкова 1, И. А. Небесных 1, И. В. Ханаев 1, Н. Н. Деникина 1
1 Лимнологический институт СО РАН
664033 Иркутск, ул. Улан-Баторская, 3, Россия
* E-mail: kondratovig@mail.ru
Поступила в редакцию 09.04.2018
После доработки 16.08.2018
Принята к публикации 05.09.2018
Аннотация
Впервые проведены молекулярная идентификация и сравнение спектра представителей порядка Saprolegniales (Oomycota) в байкальских губках и на внешних покровах рыб в нативных условиях оз. Байкал и в условиях аквариумной экспозиции. Установлен сходный спектр видов водных плесеней у рыб и байкальских губок в аквариумной экспозиции и наличие у губок из оз. Байкал вида, близкого к Leptolegnia chapmanii, паразитирующего на личинках насекомых. Проанализированы результаты детекции представителей порядка Saprolegniales и факторы, влияющие на частоту их встречаемости в образцах губок из оз. Байкал.
Эндемичные пресноводные байкальские губки (семейство Lubomirskiidae) доминируют по биомассе среди бентосных организмов фотической зоны литорали и являются основой сложного симбиотического сообщества (Pile et al., 1997). Среди эндосимбионтов губок определены одноклеточные водоросли, дрожжи и бактерии (Парфенова и др., 2008; Калюжная и др., 2012; Гладких и др., 2014; Kulakova et al., 2014; и др.). В настоящее время во многих районах озера прогрессируют заболевания и гибель различных видов губок (Грачев и др., 2015; Khanaev et al., 2018). Результаты сравнительного анализа метагеномов здоровой и больной губок Lubomirskia baicalensis (Pallas, 1771) показали элиминацию узких специалистов, монодоминирование отдельных филотипов гетеротрофных микроорганизмов и разбалансирование их метаболических взаимосвязей в больной губке (Деникина и др., 2016). При длительном содержании губок в аквариумной экспозиции с использованием проточных систем водоснабжения нарушение обменных процессов и снижение жизненности симбиотического сообщества также приводят к их гибели (Глызина и др., 2010).
Представители порядка Saprolegniales считаются сапротрофами, однако некоторые виды родов Saprolegnia и Achlya являются паразитами рыб (van West, 2006; Phillips et al., 2008; и др.) и ракообразных (Wolinska et al., 2008). В ассоциациях с пресноводной зеленой губкой Ephydatia muelleri (Lieberkühn, 1855) из олигомезотрофного оз. Ханьца (Hańcza) были обнаружены следующие роды порядка Saprolegniales: Achlya, Dictyuchus, Saprolegnia и Scoliolegnia (Czeczuga et al., 2015). Данные об ассоциациях представителей порядка Saprolegniales с эндемичными байкальскими губками отсутствуют.
Цель работы – сравнение спектра представителей порядка Saprolegniales в байкальских губках и на внешних покровах рыб в нативных условиях оз. Байкал и в условиях аквариумной экспозиции.
МАТЕРИАЛЫ И МЕТОДЫ
Образцы L. baicalensis с белыми слизистыми обрастаниями 16 экз. из аквариумов живой экспозиции Байкальского музея Иркутского научного центра СО РАН (БМ ИНЦ СО РАН) брали для исследования с 2014 по 2016 г. В этот же период были собраны соскобы с внешних покровов леща Abramis brama (Linnaeus, 1758) (3 экз.), байкальского омуля Coregonus migratorius (Georgi, 1775) (5 экз.), окуня Perca fluviatilis Linnaeus, 1758 (2 экз.), длиннокрылой широколобки Cottocomephorus inermis (Yakovlev, 1890) (3 экз.), щуки Esox lucius Linnaeus, 1758 (5 экз.), большеголовой широколобки Batrachocottus baicalensis (Dybowski, 1874) (1 экз.).
Пробы губок (736 образцов визуально здоровых и с признаками заболевания) отбирали с 27 мая по 16 июня 2015 г. и с 30 мая по 18 июня 2016 г. с помощью легкого водолазного снаряжения по всей акватории оз. Байкал (табл. 1 и 2, рис. 1).
Таблица 1.
Места сборов образцов губок, оз. Байкал
| № места сбора | Координаты (с.ш., в.д.) |
|---|---|
| 2015 г. | |
| 1 – пос. Большие Коты | 51°54′08.1′′, 105°04′20.2′′ |
| 2 – зал. Лиственничный | 51°51′46.3′′, 104°50′51.1′′ |
| 3 – бух. Ая | 52°47′27.0′′, 106°36′40.0′′ |
| 4 – м. Турали | 55°17′16.7′′, 109°45′31.4′′ |
| 2016 г. | |
| 5 – пос. Большие Коты | 51°54′08.1′′, 105°04′20.2′′ |
| 6 – падь Варначка | 51°54′08.9′′, 105°06′17.3′′ |
| 7 – пристань Уланово | 51°47′49.1′′, 104°31′31.8′′ |
| 8 – прол. Ольхонские Ворота | 53°01′03.4′′, 106°55′47.0′′ |
| 9 – м. Ухан | 53°05′50.9′′, 107°26′17.4′′ |
| 10 – м. Елохин | 54°33′06.9′′, 108°39′53.0′′ |
| 11 – м. Ижимей | 53°13′05.3′′, 107°42′15.6′′ |
Таблица 2.
Список проанализированных видов губок
| Вид | № места сбора |
Число особей | |
|---|---|---|---|
| общее | больных | ||
| Baikalospongia bacillifera Dybowsky, 1880 | 1 | 16 | 3 |
| 2 | 36 | 11 | |
| 5 | 7 | 1 | |
| 6 | 12 | 10 | |
| 7 | 8 | 6 | |
| 9 | 6 | 3 | |
| B. fungiformis (Makuschok, 1927) | 1 | 2 | 0 |
| 2 | 6 | 1 | |
| 5 | 2 | 0 | |
| 6 | 1 | 1 | |
| 10 | 3 | 3 | |
| B. intermedia Dybowsky, 1880 | 1 | 16 | 4 |
| 2 | 17 | 1 | |
| 5 | 299 | 0 | |
| 6 | 36 | 32 | |
| 8 | 17 | 7 | |
| 9 | 24 | 12 | |
| 10 | 20 | 16 | |
| B. martinsoni Efremova, 2004 | 1 | 1 | 0 |
| 2 | 5 | 0 | |
| 5 | 5 | 0 | |
| 7 | 1 | 0 | |
| B. recta Efremova, 2004 | 2 | 7 | 0 |
| 5 | 4 | 0 | |
| 6 | 3 | 2 | |
| 7 | 2 | 2 | |
| 8 | 2 | 0 | |
| Lubomirskia abietina Swartschewsky, 1901 | 1 | 3 | 1 |
| 2 | 14 | 2 | |
| 5 | 7 | 0 | |
| 6 | 2 | 1 | |
| 7 | 8 | 6 | |
| 9 | 10 | 6 | |
| 10 | 4 | 4 | |
| L. baicalensis (Pallas, 1771) | 1 | 2 | 0 |
| 2 | 1 | 0 | |
| 3 | 2 | 1 | |
| 4 | 2 | 1 | |
| 5 | 1 | 0 | |
| 6 | 23 | 21 | |
| 7 | 10 | 9 | |
| 8 | 25 | 14 | |
| 9 | 17 | 14 | |
| 11 | 3 | 2 | |
| L. fusifera Soukatschoff, 1895 | 1 | 10 | 4 |
| 5 | 2 | 0 | |
| 10 | 7 | 5 | |
| L. incrustans Efremova, 2004 | 1 | 3 | 1 |
| 2 | 4 | 1 | |
| 4 | 2 | 0 | |
| 5 | 11 | 0 | |
| Rezinkovia echinata Efremova, 2004 | 2 | 1 | 0 |
| Swartschewskia рapyracea (Dybowsky, 1880) | 2 | 1 | 1 |
| 5 | 1 | 0 | |
| 7 | 2 | 1 | |
Рис. 1
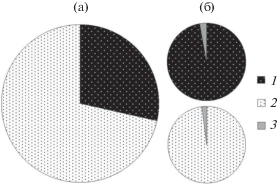
Образцы губок из оз. Байкал. а – соотношение больных (1) и визуально здоровых (2) губок, %; б – доля образцов, зараженных представителями Saprolegniales, % (3).
Экземпляры каменной широколобки Paracottus knerii (Dybowski, 1876) с явными признаками поражений внешних покровов были отловлены с помощью легкого водолазного снаряжения в створе прол. Ольхонские ворота (табл. 1) и в районе м. Немнянка 55°32′23.9′′ с.ш., 109°48′25.7′′ в.д. (2017 г.).
Видовая идентификация образцов губок проведена на основе морфологии внешнего вида, спикул и скелета согласно действующей классификации (Ефремова, 2001, 2004). Все собранные образцы были фиксированы 70%-ным этанолом. В лабораторных условиях из них была выделена суммарная ДНК с использованием коммерческого набора ДНК-сорб В (ЦНИИ эпидемиологии Роспотребнадзора, Москва) по протоколу фирмы-производителя. Идентификацию представителей порядка Saprolegniales осуществляли с помощью ПЦР со специфичными праймерами, фланкирующими фрагмент ITS1–ITS2 рибосомного оперона OmFd 5'-cggaaggatcawwaccacacc и OmRd 5'-gattkrwttcccwatttgcctcc (Дзюба и др., 2014) с последующим секвенированием полученного ампликона длиной 665 п.н. Сравнительный анализ нуклеотидных последовательностей c международной базой генетических данных GenBank проводили с помощью программы BLAST (URL: http://blast.ncbi.nlm.nih.gov), редактировали с использованием пакета программы BioEdit. Последовательности были зарегистрированы в GenBank (№ LT992337, LT992835–LT992837, LT992841–LT992855, LT992859–LT992865).
Частоту встречаемости представителей порядка Saprolegniales в образцах губок из оз. Байкал рассчитывали в долях (%) общего числа проанализированных образцов в целом и отдельно для больных и здоровых губок.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Губки. Анализ ДНК из соскобов тканей с пораженных участков губок из живой экспозиции Байкальского музея позволил идентифицировать в пробах нуклеотидные последовательности, с высокой степенью гомологии (95–100%) совпадающие с имеющимися в международной базе генетических данных GenBank последовательностями представителей порядка Saprolegniales: Achlya oligocantha de Bary 1888 (=Newbya oligocantha (de Bary) Mark A. Spencer (2002)), Saprolegnia delica Coker 1923 и S. parasitica Coker 1923 (табл. 3).
Таблица 3.
Результаты молекулярной идентификации представителей Saprolegniales, ассоциированных с губками и рыбами оз. Байкал и аквариумов живой экспозиции
| № гомологичных последовательностей в GenBank | Вид оомицетов | Хозяин | Гомология, % |
|---|---|---|---|
| JQ974990 | Achlya oligocantha de Bary 1888 (=Newbya oligocantha (de Bary) Mark A. Spencer (2002)) |
L. baicalensis (11)* P. fluviatilis (1)* |
95 |
| KF718178 | Saprolegnia asterophora de Bary 1860 (=Cladolegnia asterophora (de Bary) Johannes (1955), =Scoliolegnia asterophora (de Bary) M.W. Dick (1969)) |
C. migratorius (1)* E. lucius (1)* |
98 |
| KF717972 | S. australis R.F. Elliott, 1968 | C. migratorius (2)* E. lucius (1)* P. fluviatilis (1)* |
100 |
| KF718022 | S. delica Coker 1923 | L. baicalensis (3)* A. brama (2)* E. lucius (1)* B. baicalensis (1)* |
100 99 |
| KX945386 | S. parasitica Coker 1923 (=Isoachlya parasitica (Coker) Nagai (1931)) |
L. baicalensis (2)* A. brama (1)* C. migratorius (3)* E. lucius (2)* P. knerii (2) C. inermis (3)* |
100 99 |
| KU896917 | Leptolegnia chapmanii R.L. Seym 1984 | B. intermedia (4)* L. abietina (4)* L. baicalensis (7)* L. incrustans (2)* |
93–95 |
Из всех проанализированных образцов губок, собранных в оз. Байкал, лишь в 17, принадлежащих к видам L. abietina, L. baicalensis, L. incrustance и B. intermedia, обнаружили представителей порядка Saprolegniales (табл. 3). В отличие от образцов из аквариумов живой экспозиции Байкальского музея в губках фотической зоны оз. Байкал были обнаружены последовательности, близкие (93–95% гомологии) к таковым у Leptolegnia chapmanii R.L. Seym 1984 (табл. 3).
Рыбы. В образцах тканей рыб из аквариумной экспозиции были выявлены S. parasitica (лещ, щука, длиннокрылая широколобка, байкальский омуль), S. delica (лещ, щука, большеголовая широколобка), S. asterophora de Bary 1860 (щука, байкальский омуль), S. australis R.F. Elliott 1968 (щука, окунь, байкальский омуль) и A. oligocantha (=N. oligocantha) у окуня (табл. 3). Ранее на внешних покровах леща, желтокрылки Cottocomephorus grewingkii (Dybowski, 1874) и северобайкальской желтокрылки Cottocomephorus alexandrae Taliev, 1935 из аквариумной экспозиции были выявлены S. parasitica и S. delica (Дзюба и др., 2014). У обеих особей каменной широколобки, собранных в оз. Байкал, была обнаружена S. parasitica (табл. 3).
Представители порядка Saprolegniales играют важную роль в разложении остатков растительного и животного происхождения в водных экосистемах. Ранее было отмечено, что A. oligocantha (=N. oligocantha) растет на мертвых особях пресноводных ракообразных (Czeczuga et al., 2002), на яйцах и трупах рыб (Czeczuga, Muszyńska, 2000; Czeczuga et al., 2005). Вместе с тем S. asterophora в качестве субстрата не только использует останки ракообразных (Czeczuga et al., 2002), но способна колонизировать перья водоплавающих птиц (Czeczuga et al., 2004) и является паразитом водорослей рода Spirogyra (Пыстина, 2005). S. parasitica, S. ferax и S. australis часто рассматриваются не как сапротрофы, а как паразиты различных видов ракообразных (Hirsch et al., 2008; Wolinska et al., 2008; Kestrup et al., 2010), моллюсков (Czeczuga, 2000) и рыб (Noga, 1993; Phillips et al., 2008; van den Berg et al., 2013; Cao et al., 2014; Rezinciuc et al., 2014). Вызванные ими заболевания наносят экономический ущерб аквакультуре и способствуют снижению численности диких популяций лососевых (Phillips et al., 2008). L. chapmanii – паразит личинок комаров (Diptera: Culicidae) (McInnis, Zattau, 1982; Seymour, 1984). Специфичность этого вида для комаров подтверждена отрицательными результатами заражения других водных беспозвоночных (McInnis et al., 1985). Однако в экспериментальных условиях было показано, что представители семейства Chironomidae восприимчивы к инфекции (López Lastra et al., 2004).
В консорциях байкальских губок отмечено 12 таксонов: Turbellaria, Hirudinea, Nematoda, Oligochaeta, Polychaeta, Copepoda, Ostracoda, Isopoda, Amphipoda, Trichoptera, Chironomidae и Mollusca (Kamaltynov et al., 1993; Weinberg et al., 2004). Полученные нами последовательности, гомологичные (93–95%) L. chapmanii, возможно, принадлежат не описанным к настоящему времени видам Saprolegniales, паразитирующим на беспозвоночных животных оз. Байкал.
Присутствие представителей порядка Saprolegniales в байкальских губках может быть результатом фильтрационной способности последних. Губки – типичные фильтраторы, питающиеся органической взвесью, простейшими и бактериями (Pile et al., 1997). Логично предположить, что зооспоры грибов могут отфильтровываться губкой в процессе питания. Другим возможным путем контаминации губок сапролегниевыми грибами может быть прямой перенос с зараженных животных.
Необходимо отметить низкую частоту встречаемости представителей порядка Saprolegniales в образцах губок из оз. Байкал (2.4%). При этом существенных различий в степени обсемененности между пораженными и условно-здоровыми губками не было выявлено: 11 здоровых (2.09%) и 6 больных (2.85%) (рис. 1). Данный факт, вероятно, объясняется влиянием нескольких факторов. Во-первых, прибрежная зона изобилует потенциальными хищниками (зоопланктерами). Представители порядка Saprolegniales в цикле своего развития имеют планктонные стадии – зооспоры. Зооспоры находятся в пределах предпочтительного диапазона размеров пищевых частиц, потребляемых зоопланктоном (Geller, Muller, 1981; Kagami et al., 2004, 2007; Searle et al., 2013; Maier et al., 2016). Известно, что зооспоры низших грибов потребляются простейшими, коловратками и ракообразными (Yassin, El-Said, 2011; Schmeller et al., 2014; Valois, Burns, 2016). Однако данные о питании байкальских видов беспозвоночных животных зооспорами представителей порядка Saprolegniales отсутствуют. Во-вторых, в оз. Байкал как в олиготрофном водоеме сапролегниевые грибы в целом представлены незначительно. Известно, что в олигомезотрофных водоемах отмечено их более низкое видовое разнообразие, чем в эвтрофных (Воронин, 2005). При этом в тундровых озерах оомицеты родов Saprolegnia и Achlya встречаются редко, предпочитая загрязненные водоемы.
Незначительная частота встречаемости представителей порядка Saprolegniales на байкальских губках может определяться и особенностями последних как субстратов. Губки в отличие от рыб – достаточно бедный субстрат. Однако отмечено, что органические вещества, выделяемые симбионтами пресноводных зеленых губок, могут служить питательной средой для некоторых видов водных плесеней (Czeczuga et al., 2015). В то же время известно, что многие губки, а также населяющие их микроорганизмы вырабатывают биологически активные вещества, способные подавлять развитие патогенной микрофлоры. Исследования изолятов Pseudomonas spp. в пресноводной зеленой губке Ephydatia fluviatilis (Linnaeus, 1759) показали их высокую активность в отношении оомицетов (Keller-Costa et al., 2014). По-видимому, в естественных условиях активного развития представителей порядка Saprolegniales не происходит в силу действия всех факторов.
В аквариумной экспозиции результаты молекулярно-генетического анализа выявили сходный спектр видов оомицет у рыб и байкальских губок (S. parasitica, S. delica и N. oligocantha). Частота встречаемости этих видов в исследованных образцах L. baicalensis составила 100%. Данный факт, скорее всего, свидетельствует об их переносе на губок с больных рыб. В экспозиции байкальские губки находились в аквариумах вместе с различными видами рыб, манипуляции с которыми во время отлова, транспортировки и последующей адаптации к искусственным условиям содержания часто приводили к травмированию их внешних покровов и были основными факторами стресса, что в совокупности приводило к возникновению заболеваний (Пастухов, 2010). Большинство видов Saprolegniales – этиологические агенты микозов рыб. Это условно-патогенные организмы, которые вызывают заболевание “сапролегниоз” у всех искусственно воспроизводимых видов рыб. Сапролегниозом обычно поражается травмированная или ослабленная рыба как в искусственных, так и в естественных условиях. У обеих особей каменной широколобки из оз. Байкал была детектирована S. parasitica, обнаруженная и в аквариумной экспозиции (табл. 3). Ранее у байкальского омуля из Баргузинского залива оз. Байкал была отмечена S. ferax (Дзюба и др., 2011).
Повреждение участков и отсутствие слизи на внешних покровах рыб способствуют прикреплению подвижных зооспор видов Saprolegnia и дальнейшему их прорастанию в здоровые ткани (Noga, 1993; Beakes et al., 1994). Гифы Saprolegnia не только вторгаются в эпидермальные ткани и приводят к клеточному некрозу, вызывающему повреждения кожи, глаз и жабр (Pickering, Willoughby, 1982; Bruno, Wood, 1999), но также проникают в мышцы и кровеносные сосуды (Hatai, Hoshiai, 1992; Shin et al., 2017). Кроме того, вторичные зооспоры рыбных патогенов S. parasitica обладают характерными пучками длинных крючковатых структур, которые способствуют их адгезии к субстрату. Установлено, что на длину структур влияет характер поверхности: зооспоры активизируются при перемешивании, добавлении углерода в среду и воздействии шероховатых поверхностей, таких как чешуя рыб (Rezinciuc et al., 2018). Возможно, в аквариумной экспозиции формируются условия гиперинфекции и эпителий губок также становится привлекательным субстратом для зооспор.
ЗАКЛЮЧЕНИЕ
Впервые проведен сравнительный анализ представителей порядка Saprolegniales в байкальских губках и на внешних покровах рыб в нативных условиях оз. Байкал и в условиях аквариумной экспозиции. Однородный спектр водных плесеней порядка Saprolegniales, ассоциированных c рыбами и байкальскими губками в аквариумной экспозиции, можно рассматривать как свидетельство заражения губок от больных рыб либо в результате прямого переноса, либо в процессе фильтрации губками планктонных стадий представителей порядка Saprolegniales. Действием схожего механизма можно объяснить наличие у губок из оз. Байкал вида, близкого к L. chapmanii, паразитирующего на водных личинках насекомых. Поскольку полученные данные не позволяют полностью оценить предполагаемое разнообразие представителей порядка Saprolegniales в ассоциациях с байкальскими губками, требуется проведение дальнейших исследований организмов консорций с учетом сезонной динамики их развития.
Работа выполнена в рамках темы 0345-2019-0002 (АААА-А16-116122110066-1) “Молекулярная экология и эволюция живых систем Центральной Азии в условиях глобальных экологических изменений”.
Список литературы
Воронин Л.В. Грибы на растительных субстратах в малых озерах тундровой и лесной зон Восточной Европы: Автореф. дис. докт. биол. наук. М.: Яросл. гос. пед. ун-т, 2005. 299 с.
Гладких А.С., Калюжная О.В., Белых О.И., Ан Т.С., Парфенова В.В. Анализ бактериального сообщества двух эндемичных видов губок из озера Байкал // Микробиология. 2014. Т. 83. № 6. С. 682–693.
Глызина О.Ю., Глызин А.В., Любочка С.А. Изучение симбиотических сообществ в условиях живых музейных экспозиций // Матер. междунар. науч. конф. “Актуальные вопросы деятельности академических естественно-научных музеев”. пос. Листвянка Иркутск. обл. Новосибирск: ГЕО, 2010. С. 82–84.
Грачев М.А., Гранин Н.Г., Синюкович В.Н., Макаров М.М., Дзюба Е.В., Тимошкин О.А., Ханаев И.В., Белых О.И., Чебыкин Е.П., Федотов А.П. Выступление на бюро Совета по науке РАН и ФАНО. Иркутск: Репроцентр А1, 2015. 44 с.
Деникина Н.Н., Дзюба Е.В., Белькова Н.Л., Ханаев И.В., Феранчук С.И., Макаров М.М., Гранин Н.Г., Беликов С.И. Первый случай заболевания губки Lubomirskia baicalensis: исследование микробиома // Изв. РАН. Сер. биол. 2016. № 3. С. 315–322.
Дзюба Е.В., Деникина Н.Н., Пастухов В.В., Суханова Е.В., Белькова Н.Л. Разработка и апробация молекулярно-генетического способа диагностики патогенных микроорганизмов на внешних покровах рыб // Вода: Химия и экология. 2014. № 2. С. 57–62.
Дзюба Е.В., Деникина Н.Н., Суханова Е.В., Белых М.П., Ханаев И.В., Пронин Н.М., Белькова Н.Л. Высокочувствительная детекция возбудителей бактериального язвенного синдрома байкальского омуля Coregonus migratorius (Georgi, 1775) // Изв. ИГУ Сер. Биология. Экология. 2011. Т. 4. № 4. С. 46–52.
Ефремова С.М. Губки (Porifera) // Аннотированный список фауны озера Байкал и его водосборного бассейна. Т. 1. Озеро Байкал. Кн. 1. Новосибирск: Наука, 2001. С. 179–192.
Ефремова С.М. Новый род и новые виды губок сем. Lubomirskiidae Rezvoj, 1936 // Аннотированный список фауны озера Байкал и его водосборного бассейна. Т. 1. Озеро Байкал. Кн. 2. Новосибирск: Наука, 2004. С. 1261–1278.
Калюжная О.В., Кривич А.А., Ицкович В.Б. Разнообразие генов 16S рРНК в метагеномном сообществе пресноводной губки Lubomirskia baicalensis // Генетика. 2012. Т. 48. № 8. С. 1003–1006.
Парфенова В.В., Теркина И.А., Косторнова Т.Я., Никулина И.Г., Черных В.И., Максимова Э.А. Микробное сообщество пресноводных губок озера Байкал // Изв. РАН. Сер. биол. 2008. № 4. С. 435–441.
Пастухов В.В. Методы и условия содержания байкальских гидробионтов // Матер. междунар. науч. конф. “Актуальные вопросы деятельности академических естественно-научных музеев”. пос. Листвянка Иркутск. обл. Новосибирск: ГЕО, 2010. С. 131–134.
Пыстина К.А. Оомицеты Ленинградской области, паразитирующие на водных организмах // Новости систематики низших растений. 2005. Т. 38. С. 171–175.
Beakes G.W., Wood S.E., Burr A.W. Features which characterize Saprolegnia isolates from salmon fish lesions: a review // Environment, fish and wildlife division Salmon Saprolegniasis / Ed. Mueller G.J. Portland, Oregon: Rep. Bonneville Power Administration, 1994. P. 33–66.
Bruno D.W., Wood B.P. Saprolegnia and other Oomycetes // Fish diseases and disorders. V. 3. Viral, bacterial and fungal infections / Eds Woo P.T., Bruno D.W. Wallingford: CABI Publ., 1999. P. 559–659.
Cao H., Ou R., Li G., Yang X., Zheng W., Lu L. Saprolegnia australis R. F. Elliott 1968 infection in Prussian carp Carassius gibelio (Bloch, 1782) eggs and its control with herb extracts // J. Appl. Ichthyol. 2014. V. 30. Iss. 1. P. 145–150.
Czeczuga B. Zoosporic fungi growing on freshwater molluscs // Pol. J. Environ. Stud. 2000. V. 9. № 3. P. 151–156.
Czeczuga B., Muszyńska E. Zoosporic fungi growing on the dead glass eel (montee) and elver’s (Anguilla anguilla) // Acta Ichthyol. Piscat. 2000. V. 30. P. 3–12.
Czeczuga B., Godlewska A., Kiziewicz B. Aquatic fungi growing on feathers of wild and domestic bird species in limnologically different water bodies // Pol. J. Environ. Stud. 2004. V. 13. № 1. P. 21–31.
Czeczuga B., Kozl’owska M., Godlewska A. Zoosporic aquatic fungi growing on dead specimens of 29 freshwater crustacean species // Limnologica. 2002. V. 32. P. 180–193.
Czeczuga B., Czeczuga-Semeniuk E., Semeniuk-Grell A., Semeniuk J. Stimulatory activity of four green freshwater sponges on aquatic mycotal communities // Afr. J. Biotechnol. 2015. V. 14. № 45. P. 3093–3100.
Czeczuga B., Bartel R., Kiziewicz B., Godlewska A., Muszyńska E. Zoosporic fungi growing on the eggs of Sea Trout (Salmo trutta m. trutta L.) in river water of varied trophicity // Pol. J. Environ. Stud. 2005. V. 14. № 3. P. 295–303.
Geller W., Muller H. The filtration apparatus of cladocera – filter mesh-sizes and their implications on food selectivity // Oecologia. 1981. V. 49. P. 316–321.
Hatai K., Hoshiai G. Mass mortality in cultured coho salmon (Oncorhynchus kisutch) due to Saprolegnia parasitica Coker // J. Wildl. Dis. 1992. V. 28. P. 532–536.
Hirsch P.E., Nechwatal J., Fischer P. A previously undescribed set of Saprolegnia spp. in the invasive spiny-cheek crayfish (Orconectes limosus, Rafinesque) // FAL / Arch. Hydrobiol. 2008. V. 172. P. 161–165.
Kagami M., de Bruin A., Ibelings B.W., Van Donk E. Parasitic chytrids: their effects on phytoplankton communities and food-web dynamics // Hydrobiologia. 2007. V. 578. P. 113–129.
Kagami M., Van Donk E., de Bruin A., Rijkeboer M., Ibelings B.W. Daphnia can protect diatoms from fungal parasitism // Limnol. Oceanogr. 2004. V. 49. P. 680–685.
Kamaltynov R.M., Chernykh V.I., Slugina Z.V., Karabanov E.B. The concorcium of the sponge Lubomirskia baikalensis in Lake Baikal, East Sibiria // Hydrobiologia. 1993. V. 271. P. 179–189.
Keller-Costa T., Jousset A., van Overbeek L., van Elsas J.D., Costa R. The freshwater sponge Ephydatia fluviatilis Harbours diverse Pseudomonas species (Gammaproteobacteria, Pseudomonadales) with broad-spectrum antimicrobial activity // PLoS One. 2014. V. 9. № 2. e88429.
Kestrup A.M., Thomas S.H., van Rensburg K., Ricciardi A., Duffy M.A. Differential infection of exotic and native freshwater amphipods by a parasitic water mold in the St. Lawrence River // Biol. Invasions. 2010. V. 13. P. 769–779.
Khanaev I.V., Kravtsova L.S., Maikova O.O., Bukshuk N.A., Sakirko M.V., Kulakova N.V., Butina T.V., Nebesnykh I.A., Belikov S.I. Current state of the sponge fauna (Porifera: Lubomirskiidae) of Lake Baikal: Sponge disease and the problem of conservation of diversity // J. Great Lakes Res. 2018. V. 44. P. 77–85.
Kulakova N.V., Denikina N.N., Belikov S.I. Diversity of bacterial photosymbionts in Lubomirskiidae sponges from Lake Baikal // Int. J. Biodivers. 2014. V. 2014. Art. ID 152097. 6 p.
López Lastra C.C., Scorsetti A.C., Marti G.A., García J.J. Host range and specificity of an Argentinean isolate of the aquatic fungus Leptolegnia chapmanii (Oomycetes: Saprolegniales), a pathogen of mosquito larvae (Diptera: Culicidae) // Mycopathologia. 2004. V. 158. P. 311–315.
Maier M.A., Uchii K., Peterson T.D., Kagami M. Evaluation of Daphnid grazing on microscopic zoosporic fungi by using comparative threshold cycle quantitative PCR // Appl. Environ. Microbiol. 2016. V. 82. № 13. P. 3868–3874.
McInnis T., Jr., Zattau W.C. Experimental infection of mosquito larvae by a species of the aquatic fungus Leptolegnia // J. Invertebr. Pathol. 1982. V. 39. P. 98–104.
McInnis T., Jr., Schimmel L., Noblet R. Host range studies with the fungus Leptolegnia, a parasite of mosquito larvae (Diptera: Culicidae) // J. Med. Entomol. 1985. V. 22. № 2. P. 226–227.
Noga E.J. Water mold infections of freshwater fish: Recent advances // Annu. Rev. Fish Dis. 1993. V. 3. P. 291–304.
Phillips A.J., Anderson V.L., Robertson E.J., Secombes C.J., van West P. New insights into animal pathogenic oomycetes // Trends Microbiol. 2008. V. 16. P. 13–19.
Pickering A.D., Willoughby L.G. Saprolegnia infections of salmonid fish // Microbial diseases of fish / Ed. Roberts R.J. London: Acad. Press, 1982. P. 271–297.
Pile A.J., Patterson M.R., Savarese M., Chernykh V.I., Fialkov V.A. Trophic effects of sponge feeding within Lake Baikal’s littoral zone. 2. Sponge abundance, diet, feeding efficiency, and carbon flux // Limnol. Oceanogr. 1997. V. 42. P. 178–184.
Rezinciuc S., Sandoval-Sierra J.-V., Diéguez-Uribeondo J. Molecular identification of a bronopol tolerant strain of Saprolegnia australis causing egg and fry mortality in farmed brown trout, Salmo trutta // Fungal Biology. 2014. V. 118. Iss. 7. P. 591–600.
Rezinciuc S., Sandoval-Sierra J.V., Ruiz-León Y., van West P., Diéguez-Uribeondo J. Specialized attachment structure of the fish pathogenic oomycete Saprolegnia parasitica // PLOS ONE. 2018. V. 13. № 1. e0190361.
Schmeller D.S., Martel A., Garner T.W.J., Fisher M.C., Azemar F., Clare F.C., Leclerc C., Jäger L., Guevara-Nieto M., Loyau A., Pasmans F. Microscopic aquatic predators strongly affect infection dynamics of a globally emerged pathogen // Curr. Biol. 2014. V. 24. Iss. 2. P. 176–180.
Searle C.L., Mendelson J.R. III, Green L.E., Duffy M.A. Daphnia predation on the amphibian chytrid fungus and its impacts on disease risk in tadpoles // Ecol. Evol. 2013. V. 3. Iss. 12. P. 4129–4138.
Seymour R. Leptolegnia chapmanii an oomycete pathogen of mosquito larvae // Mycologia. 1984. V. 76. P. 670–674.
Shin S., Kulatunga D.C.M., Dananjaya S.H.S., Nikapitiya C., Lee J., De Zoysa M. Saprolegnia parasitica isolated from Rainbow Trout in Korea: characterization, anti-Saprolegnia activity and host pathogen interaction in Zebrafish disease model // Mycobiology. 2017. V. 45. № 4. P. 297–311.
Valois A.E., Burns C.W. Parasites as prey: Daphnia reduce transmission success of an oomycete brood parasite in the calanoid copepod Boeckella // J. Plankton Res. 2016. V. 38. № 5. P. 1281–1288.
van den Berg A.H., McLaggan D., Diéguez-Uribeondo J., van West P. The impact of the water moulds Saprolegnia diclina and Saprolegnia parasitica on natural ecosystems and the aquaculture industry // Fungal Biol. Rev. 2013. V. 27. Iss. 2. P. 33–42.
van West P. Saprolegnia parasitica, an oomycete pathogen with a fishy appetite: New challenges for an old problem // Mycologist. 2006. V. 20. № 3. P. 99–104.
Weinberg I., Glyzina O., Weinberg E., Kravtsova L., Rozhkova N., Sheveleva N., Natyaganova A., Bonse D., Janussen D. Types of interactions in consortia of Baikalian sponges // Boll. Mus. Ist. Biol. Univ. Genova. 2004. № 68. P. 655–663.
Wolinska J., King K.C., Vigneux F., Lively C.M. Virulence, cultivating conditions, and phylogenetic analyses of oomycete parasites in Daphnia // Parasitology. 2008. V. 135. P. 1667–1678.
Yassin E.-K.H., El-Said A.A.N. Control of fish fungal pathogen Saprolegnia parasitica using rotifer Brachionus plicatilis and sodium chloride // Egypt. J. Exp. Biol. (Bot.). 2011. V. 7. № 2. P. 285–291.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


