Известия РАН. Серия биологическая, 2020, № 5, стр. 499-506
Исследование изменений фракционного состава белков при инкубации плероцеркоидов Diphyllobothrium dendriticum (Cestoda) в среде, содержащей сыворотку крови хозяина – байкальского омуля Coregonus migratorius (Coregonidae)
И. А. Кутырев 1, *, О. Б. Горева 2, О. Е. Мазур 1, В. А. Мордвинов 3
1 Институт общей и экспериментальной биологии СО РАН
670047 Улан-Удэ, ул. Сахьяновой, 6, Россия
2 Научно-исследовательский институт молекулярной биологии и биофизики Федерального государственного бюджетного научного учреждения “Федеральный исследовательский центр фундаментальной и трансляционной медицины”
630117 Новосибирск, ул. Тимакова, 2/12, Россия
3 Институт цитологии и генетики СО РАН
630090 Новосибирск, просп. акад. Лаврентьева, 10, Россия
* E-mail: ikutyrev@yandex.ru
Поступила в редакцию 03.05.2018
После доработки 20.12.2018
Принята к публикации 25.03.2019
Аннотация
Исследовано изменение фракционного состава белков плероцеркоидов Diphyllobothrium dendriticum (Cestoda) при инкубации в среде, содержащей сыворотку крови хозяина – байкальского омуля Coregonus migratorius (Coregonidae). Определено изменение фракционного состава белков инкубационной среды. Обнаружено появление новых высокомолекулярных фракций с молекулярной массой (ММ) 193 кДа через 3, 12 и 24 ч после начала инкубации и с ММ 88 кДа через 24 ч, а также уменьшение или исчезновение низкомолекулярных фракций с ММ 57 и 42 кДа через 3, 12 и 24 ч. Отмечено, что у плероцеркоидов это было сопряжено с появлением новой фракции с ММ 189 кДа через 12 ч и исчезновением фракции с ММ 80 кДа через 24 ч.
Паразитизм – один из наиболее успешных образов жизни, демонстрируемых живыми организмами, если учитывать частоту его встречаемости и огромную численность паразитических видов (Poulin, Morand, 2000). Многочисленные способы защиты от иммунного ответа хозяина позволяют паразитам расти, выживать и длительное время сохраняться в организме хозяина (Maizels et al., 2004; Coakley et al., 2016).
Паразиты регулируют иммунный ответ хозяев путем секреции растворимых медиаторов, которые определенным образом взаимодействуют с клетками и молекулами иммунной системы (Lightowlers, Rickard, 1988). В последние годы возрос интерес к идентификации иммунорегуляторных молекул, вырабатываемых паразитическими червями. Паразитарные иммунорегуляторы разнообразны как по функциональной активности, так и по химической природе. Наиболее важная группа иммунорегуляторных веществ паразитов – белки. К ним относятся: гомологи цитокинов, ингибиторы протеаз, гликолитические энзимы и лектины, антиоксиданты, ацетилхолинэстеразы, гомологи аллергенов ядов (VAL) и др. (Jenkins et al., 2005; Hewitson et al., 2009; Львова и др., 2014). Поэтому большой интерес представляет исследование белков секреторно-экскреторных продуктов паразитов, вырабатываемых ими в ответ на взаимодействие с тканями хозяина. Сегодня иммунорегуляторные молекулы паразитов рыб остаются слабоизученными.
Цестодозы в некоторых эндемичных регионах по своему эпидемиологическому и эпизоотическому значению выходят на первый план среди остальных гельминтозов. В ряде северных районов Сибири и в Прибайкалье широко распространен дифиллоботриоз. Его возбудитель – лентец чаечный Diphyllobothrium dendriticum (Сердюков, 1979; Информационный…, 2001, 2010, 2014; Пронин и др., 2009).
К настоящему времени проведены исследования отдельных аспектов регуляции плероцеркоидами D. dendriticum иммунной системы его хозяина – байкальского омуля Coregonus migratorius. Установлено, что при заражении D. dendriticum в крови омуля происходит изменение состава клеток врожденного иммунитета и численности Т-лимфоцитов (Мазур, Толочко, 2015). Показана способность плероцеркоидов D. dendriticum в ответ на стимуляцию сывороткой крови омуля секретировать широкий спектр мембранно-ограниченных везикул (Кутырев, 2017). Известно, что вырабатываемые паразитами внеклеточные везикулы способны передавать информацию и переносить генетический материал к клеткам хозяина (Marcilla et al., 2012; Buck et al., 2014; Coakley et al., 2015, 2016). В качестве потенциальных иммунорегуляторов у D. dendriticum изучены простагландины E2 и D2, а также нейроактивные субстанции серотонин (5-HT), γ‑аминомасляная кислота и нейропептид FMRFамид (Бисерова и др., 2011; Бисерова, Кутырев, 2014; Biserova et al., 2014; Kutyrev et al., 2014, 2017). Исследования фракционного состава белков у D. dendriticum до настоящего времени не проводились.
Цель работы – определение изменений фракционного состава белков плероцеркоидов D. dendriticum при инкубации в среде, содержащей сыворотку крови хозяина – омуля, а также среды, в которой проводилась инкубация плероцеркоидов D. dendriticum.
МАТЕРИАЛЫ И МЕТОДЫ
Омуль был отловлен из оз. Байкал в Кабанском р-не Республики Бурятия на основании разрешения на добычу (вылов) водных биологических ресурсов, выданного ИОЭБ СО РАН. Плероцеркоидов D. dendriticum извлекали из полости тела, промывали в 0.65%-ном растворе хлорида натрия и помещали в инкубационную среду. Инкубационная среда включала в себя раствор Хенкса (Биолот, Россия) и сыворотку крови омуля в соотношении 1 : 1 (пенициллин 105 МЕ/л), линкомицин (100 мг/л) (Давыдов, Микряков, 1988; Kutyrev et al., 2014). Время инкубации составляло 3, 12, 24 ч при 4°С. В каждом эксперименте было использовано по пять плероцеркоидов. Соотношение массы плероцеркоидов и объема инкубационной среды составляло 150 мг/2 мл. Каждый эксперимент был проведен в трех повторах. По окончании эксперимента плероцеркоиды, а также среда, в которой инкубировались плероцеркоиды, фиксировались жидким азотом.
Исследовался фракционный состав белков инкубированных плероцеркоидов. В качестве контроля для белков паразитов использовали плероцеркоидов, непосредственно извлеченных из хозяев (контроль 1). Кроме того, изучался фракционный состав белков инкубационной среды после инкубации в ней плероцеркоидов. В качестве контроля для белков инкубационной среды использовали среду, в которой не инкубировались плероцеркоиды (контроль 2). Контрольную инкубационную среду (контроль 2) фиксировали непосредственно после изготовления (0 ч), а также через 3, 12, 24 ч хранения при 4°С.
Инкубационную среду и плероцеркоидов размораживали, добавляли лизирующий буфер (50 мM Tris-HCl (pH 7.4), 150 мM NaCl, 1 мM этилендиаминтетрауксусная кислота (ЭДТА), 1%-ный Triton X-100, 0.1%-ный додецилсульфат натрия (SDS), 1%-ный дезоксихолат натрия, 1 мM фенилметилсульфонилфторид (PMSF)). Плероцеркоидов гомогенизировали механически и с помощью ультразвука. Инкубационную среду и гомогенизированных плероцеркоидов центрифугировали 1000 g 10 мин при 4°С, супернатант переносили в чистую пробирку.
Концентрацию белка в образцах определяли методом Брэдфорд на планшетном многофункциональном детекторе EnVision 2103 Multilabel Reader (PerkinElmer, Финляндия) с использованием набора Quick Start Bradford Protein Assay (Bio-Rad, США). Далее образцы, содержавшие 20 мкг белка, смешивали с 4-кратным буфером для нанесения (100 мM Tris-HCl (pH 6.8), 200 мM дитиотреитол (DTT), 4%-ный SDS, 10%-ный глицерин, 0.2%-ный бромфеноловый синий) и прогревали 5 мин при 95°С. Фракционирование белков осуществляли электрофорезом в 8–16%-ном градиентном полиакриламидном геле (Mini-Protean TGX Stain-Free Precast Gels, Bio-Rad) в камере для вертикального электрофореза Mini-Protean Tetra Cell (Bio-Rad) при напряжении 150 В. Молекулярную массу белков определяли с помощью маркеров Precision Plus Protein Dual Color Standards (Bio-Rad). Визуализацию белков проводили в неокрашенных Stain-Free и окрашенных флуоресцентным красителем Flamingo (Bio-Rad) гелях на приборе для регистрации изображений ChemiDoc MP Imaging System (Bio-Rad). Для расчета молекулярной массы и относительного содержания фракций использовали программный пакет Image Lab 6.0 (Bio-Rad).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
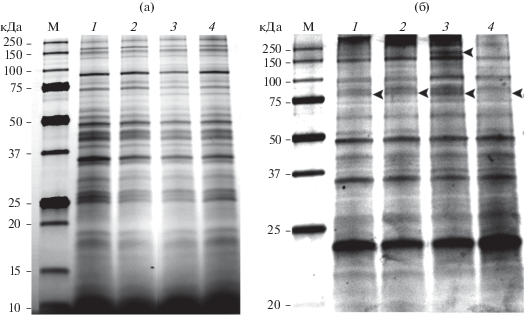
В проведенных экспериментах при воздействии сыворотки крови байкальского омуля нами был изучен протеомный профиль как инкубированных плероцеркоидов, так и инкубационной среды, содержащей сыворотку крови байкальского омуля, в разные моменты времени. При анализе спектра белков плероцеркоидов D. dendriticum было обнаружено 25 дискретных фракций с ММ от 17 до 250 кДа (рис. 1). При визуализации белков с использованием технологии Stain Free изменений протеомного профиля плероцеркоидов после инкубации с сывороткой крови байкальского омуля не наблюдалось (рис. 1а). При окраске тех же самых гелей Flamingo были выявлены изменения фракционного состава белков плероцеркоидов через 12 и 24 ч после начала инкубации. Так, через 12 ч после начала инкубации в протеомном профиле лентеца наблюдалась отчетливо выраженная фракция белков с ММ 189 кДа. В другие моменты времени и у неинкубированных плероцеркоидов (контроль 1) данная фракция либо не наблюдалась, либо была слабо выражена (рис. 1б). Через 24 ч после начала инкубации исчезла белковая фракция с ММ 80 кДа, тогда как через 3 и 12 ч после инкубации, а также у неинкубированных плероцеркоидов (контроль 2) данная фракция присутствовала (рис. 1б).
Рис. 1.
Электрофореграмма белков лентеца D. dendriticum до и после инкубирования в инкубационной среде, содержащей сыворотку крови байкальского омуля и раствор Хенкса (1 : 1), в течение 3, 12 и 24 ч. Визуализация белков с использованием технологии Stain Free (а) и окраски Flamingo (б). 1 – контроль 1 (неинкубированные плероцеркоиды); 2–4 – плероцеркоиды, инкубированные в течение 3, 12, 24 ч соответственно. М – маркерные белки; стрелками указаны белковые фракции, в которых наблюдаются изменения; для рис. 1–4.
При исследовании протеомного профиля инкубационной среды, содержащей сыворотку крови байкальского омуля, были обнаружены 19 дискретных фракций с ММ от 15 до 250 кДа (рис. 2–4). Наиболее высокое относительное содержание наблюдалось для белковых фракций с ММ 75 кДа (36%), 26 кДа (21%) и 15 кДа (10%). После инкубации плероцеркоидов произошли изменения фракционного состава инкубационной среды, содержавшей сыворотку крови байкальского омуля. Через 3, 12 и 24 ч после начала инкубации появилась высокомолекулярная фракция с ММ 193 кДа и высоким относительным содержанием (8, 15 и 14% соответственно). Через 24 ч появилась фракция с ММ 88 кДа. Кроме того, во все моменты времени значительно снижалось содержание фракции с ММ 57 кДа по сравнению с контролем 2. Практически полностью во все моменты времени исчезала фракция с ММ 42 кДа (рис. 2–4) по сравнению с контролем 2.
Рис. 2.
Электрофореграмма белков инкубационной среды, содержащей сыворотку крови байкальского омуля и раствор Хенкса (1 : 1), до и после инкубирования в ней плероцеркоидов лентеца D. dendriticum в течение 3, 12 и 24 ч. Визуализация белков с использованием технологии Stain Free. М – маркерные белки; 1 – контроль 2 (0 ч); 2 – контроль 2 (3 ч); 3 – инкубационная среда через 3 ч после инкубации в ней плероцеркоидов; 4 – контроль 2 (12 ч); 5 – инкубационная среда через 12 ч после инкубации в ней плероцеркоидов; 6 – контроль 2 (24 ч); 7 – инкубационная среда через 24 ч после инкубации в ней плероцеркоидов.
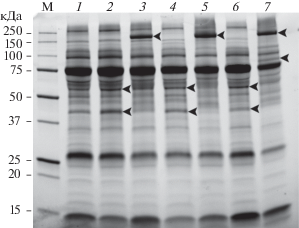
Рис. 3.
Денситограмма полос белков инкубационной среды (к рис. 2), содержащей сыворотку крови байкальского омуля и раствор Хенкса (1 : 1), до и после инкубирования в ней плероцеркоидов лентеца D. dendriticum в течение 3, 12 и 24 ч.
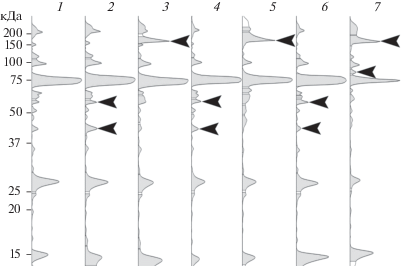
Рис. 4.
Электрофореграмма белков лентеца D. dendriticum до и после инкубирования в инкубационной среде и инкубационной средe, содержащей сыворотку крови байкальского омуля и раствор Хенкса (1 : 1), до и после инкубирования в ней плероцеркоидов лентеца D. dendriticum в течение 3, 12 и 24 ч. Визуализация белков с использованием технологии Stain Free. М – маркерные белки; 1 – контроль 2 (0 ч); 2 – контроль 1; 3 – контроль 2 (3 ч); 4 – инкубационная среда через 3 ч после инкубации в ней плероцеркоидов; 5 – плероцеркоиды, инкубированные в течение 3 ч; 6 – контроль 2 (12 ч); 7 – инкубационная среда через 12 ч после инкубации в ней плероцеркоидов; 8 – плероцеркоиды, инкубированные в течение 12 ч; 9 – контроль 2 (24 ч); 10 – инкубационная среда через 24 ч после инкубации в ней плероцеркоидов; 11 – плероцеркоиды, инкубированные в течение 24 ч.
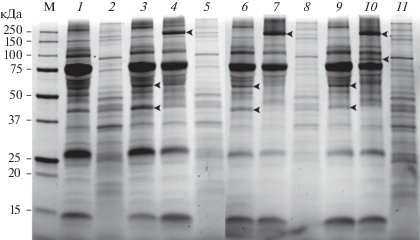
Таким образом, отмечались две тенденции изменения фракционного состава белков инкубационной среды, содержавшей сыворотку крови омуля, после инкубации плероцеркоидов: появлялись одни фракции и исчезнали другие. Через 3 ч появилась высокомолекулярная фракция с ММ 193 кДа, которая сохранилась через 12 и 24 ч (рис. 2–4). Интересно то, что в организме плероцеркоидов через 12 ч после начала инкубации также появилась новая фракция с ММ 189 кДа (рис. 1б). Поэтому можно предположить, что плероцеркоиды в ответ на погружение в инкубационную среду реагируют выработкой и секрецией белков с ММ ~190 кДа. Ранее было установлено, что у плероцеркоидов D. dendriticum при инкубации в среде, содержавшей сыворотку крови омуля, максимум секреции на поверхности тела достигается через 6–12 ч после начала инкубации (Kutyrev et al., 2017). Кроме того, было показано, что через 24 ч после начала инкубации в инкубационной среде обнаруживается фракция белков с ММ 88 кДа (рис. 2–4). В то же время на электрофореграмме белков плероцеркоидов D. dendriticum через 24 ч после инкубации исчезла фракция с ММ 80 кДа (рис. 1б). Можно предположить, что именно через 24 ч произошла интенсивная секреция данной фракции из организма плероцеркоидов в инкубационную среду.
Сложные взаимоотношения паразитов с иммунной системой хозяев реализовались на молекулярном уровне. При проникновении плероцеркоидов в организм рыб активизировались защитные механизмы как у хозяев, так и у паразитов. У плероцеркоидов включались механизмы по уклонению от иммунного ответа рыб или изменению этого ответа (Кутырев, 2017). Важную роль в паразитарной иммунорегуляции играли белковые молекулы, секретируемые паразитами в ткани хозяина (Hewitson et al., 2009). Белковые компоненты секреторно-экскреторных продуктов, в частности иммунорегуляторные молекулы, были изучены главным образом у трематод и нематод, имеющих важнейшее медицинское и ветеринарное значение (Hewitson et al., 2009). Функционально иммунорегуляторные белки изученных паразитов были весьма разнообразны. Одни из них, например фосфорилхолин, ингибировали сигнальные функции клеток иммунной системы (Harnett, Harnett, 2008). Гомологи цитокинов специфически связывались с рецепторами иммунных клеток (Cho, 2007). Лектины С‑типа регулировали в организме млекопитающих множество иммунологических функций (Bulgheresi et al., 2006). Ингибиторы протеаз (цистатины и серпины) нарушали процессинг и презентацию антигена (Gregory, Maizels, 2008). Антиоксиданты (супероксиддисмутазы, каталазы, глутатион- и тиоредоксинпероксидазы, пероксиредоксины) разрушали активные формы кислорода, продуцируемые фагоцитами хозяев (Chiumiento, Bruschi, 2009; Hewitson et al., 2009). Во многих случаях активное паразитарное управление цитокиновым ответом хозяина сдвигало иммунные реакции организма от провоспалительного Th1-ответа в сторону Th2-ответа, что защищало паразита от уничтожения без развития общей иммуносупрессии, которая может привести к гибели хозяина в результате развития вторичных инфекций, вызванных условно-патогенными микроорганизмами (McSorley, Maizels, 2012; Finlay et al., 2014).
Информации об иммунорегуляторных белках в классе Cestoda крайне мало. Известно, что в секреторно-экскреторных продуктах метацестод Taenia solium содержатся иммунорегуляторные белки (антиоксиданты, цистеиновые протеазы; низкомолекулярные белки с ММ с 8 кДа, возможно регулирующие баланс Th1–Th2 иммунного ответа) (Victor et al., 2012). Сдвиг от Th1-ответа в сторону Th2-ответа характерен для человека и высших животных. Th1- и Th2-подобные типы иммунного ответа были также обнаружены у рыб (Li et al., 2007; Wang et al., 2014, 2016). Однако известно, что адаптивный иммунитет у рыб плохо развит и при паразитозах играет меньшую роль по сравнению с врожденным иммунитетом (Knopf et al., 2000). Поэтому, вероятно, изменения в развитии Th1-/Th2-типов иммунного ответа при заражении рыб паразитами играют меньшую роль, чем у теплокровных животных.
В то же время белки, секретируемые цестодами на свою поверхность, могут играть не только защитную роль. Поскольку у цестод полностью отсутствует кишечник, их тегумент участвует в пищеварительно-абсорбционных процессах, включающих в себя мембранное и симбионтное (с помощью ферментов бактерий) пищеварение и всасывание. Мембранное пищеварение осуществляется за счет собственных и адсорбированных из кишечника хозяина ферментов (Извекова, Корнева, 2007; Куклина, Куклин, 2016). У цестод показано наличие таких пищеварительных ферментов, как амилаза, протеаза, щелочная и кислая фосфатазы и др. (Куперман, 1988). Секреторные белки D. interrupta обладают протеазной, РНКазной и ДНКазной активностью. Предполагается, что данные секреторные белки могут принимать участие в катаболизме макромолекул хозяина перед поглощением их компонентов цестодами, а протеазы могут принимать участие и в защите паразита от иммунного ответа хозяина (Крылов и др., 1991). В секреторно-экскреторных продуктах метацестод T. solium также идентифицирован ряд белков с протеолитической/эндопептитазной активностью (Victor et al., 2012). Спектр белков сыворотки крови рыб представлен типичными группами – альбуминами и глобулинами. Низкомолекулярные фракции белков сыворотки крови рыб относятся к альбуминоподобным белкам и у разных видов рыб включают в себя от 4–5 до 10–13 фракций с ММ от 13 до 90 кДа (Андреева, 2008). У байкальского омуля низкомолекулярные белки состоят из 15 фракций с ММ от 15 до 75 кДа. Через 3, 12 и 24 ч после начала инкубации в культуральной среде, содержавшей сыворотку крови омуля, было отмечено резкое снижение содержания или полное исченовение низкомолекулярных фракций белков с ММ 57 и 42 кДа. Вполне вероятно, что это – результат действия белков D. dendriticum, обладающих протеазной активностью, и всасывания питательных веществ через поверхность тегумента плероцеркоидов. В организме байкальского омуля плероцеркоиды D. dendriticum обычно заключены в соединительно-тканную капсулу. Известно, что тканевые личинки гельминтов выделяют комплекс биологически активных веществ, индуцирующих формирование ими капсулы специфического строения, секрецию тучными клетками фактора роста сосудистого эндотелия. Капсула выполняет две основные функции: задерживает поступление специфических антител из крови хозяина к паразиту и функционирует как биологический барьер с избирательной проницаемостью, аналогичный гистогематическому барьеру (Березанцев, 1975; Березанцев и др., 1989).
Таким образом, плероцеркоиды D. dendriticum получают питательные вещества из кровотока своих хозяев. Вероятно, in vitro плероцеркоиды в инкубационной среде, содержащей сыворотку крови своих хозяев, также избирательно поглощали необходимые им питательные компоненты. Кроме того, секреторные белки паразитов, обладающие протеазной активностью, могут выполнять функцию иммунорегуляторов, расщепляя иммуноглобулины хозяина. Показано, что протеазы Schistosoma mansoni специфически расщепляют человеческий IgE, делая его неспособным связываться с FcεRII-рецепторами. При этом IgA1, IgA2 и IgG1 протеазами шистосомы не расщепляются (Pleass et al., 2000).
Авторы выражают благодарность А.В. Базову (Байкальский филиал Госрыбцентра) за помощь в сборе материала. Пробоподготовка, электрофорез и визуализация белков выполнены на базе ЦКП “Протеомный анализ” НИИМББ ФИЦ ФТМ.
Работа выполнена в рамках темы госзадания (№ госрегистрации АААА-А17-117011810039-4) и при финансовой поддержке РФФИ (грант 19-04-00666).
Список литературы
Андреева А.М. Структурно-функциональная организация белков крови и некоторых других внеклеточных жидкостей рыб: Автореф. дис. докт. биол. наук. М.: МГУ, 2008. 42 с.
Березанцев Ю.А. Подавление воспалительной клеточной реакции личинками гельминтов и специфичность их инкапсуляции в тканях хозяев // Докл. АН СССР. 1975. Т. 220. № 1. С. 227–229.
Березанцев Ю.А., Борщуков Д.В., Оксов И.В., Чеснокова М.В. Инкапсуляция личинок паразитических нематод и цестод в тканях позвоночных как форма взаимоотношения паразита и хозяина // Паразитологический сборник ЗИН АН СССР. Л.: Наука, 1989. № 36. С. 131–160.
Бисерова Н.М., Кутырев И.А. Особенности локализации простагландина E2, γ-аминомасляной кислоты и других потенциальных иммуномодуляторов у плероцеркоида Diphyllobothrium dendriticum (Cestoda) // Изв. РАН. Сер. биол. 2014. № 3. С. 271–280.
Бисерова Н.М., Кутырев И.А., Малахов В.В. Ленточный червь Diphyllobothrium dendriticum (Cestoda) продуцирует простагландин Е2 – регулятор иммунитета хозяина // Докл. РАН. 2011. Т. 441. № 1. С. 126–128.
Давыдов В.Г., Микряков В.Р. Адаптивные структуры покровов тела некоторых цестод, связанные с защитой паразитов от влияний организма хозяев // Иммунологические и биохимические аспекты взаимоотношений гельминта и хозяина. М.: Наука, 1988. С. 88–100.
Извекова Г.И., Корнева Ж.В. Локализация процессов симбионтного пищеварения на пищеварительно-транспортных структурах рыб и цестод // Успехи соврем. биологии. 2007. Т. 127. № 5. С. 502–513.
Информационный сборник статистических и аналитических материалов. Разд. 3.2. Заболеваемость протозоозами и гельминтозами населения Российской Федерации в 1996–2000 годах. М.: Федеральный центр Госсанэпиднадзора Минздрава России, 2001. 112 с.
Информационный сборник статистических и аналитических материалов. Разд. 3.2. Заболеваемость протозоозами и гельминтозами населения Российской Федерации в 2008–2009 гг. М.: Федеральный центр Госсанэпиднадзора Минздрава России, 2010. 81 с.
Информационный сборник статистических и аналитических материалов. Разд. 3.2. Заболеваемость протозоозами и гельминтозами населения Российской Федерации в 2012–2013 гг. М.: Федеральный центр Госсанэпиднадзора Минздрава России, 2014. 79 с.
Крылов Ю.М., Маленев А.Л., Соколов Е.Е., Краснощеков Г.П. Секреторные белки плероцеркоидов цестоды Digramma interrupta и их ферментативная активность // Паразитология. 1991. Т. 25. № 3. С. 278–280.
Куклина М.М., Куклин В.В. Паразитирование Diphyllobothrium dendriticum (Cestoda: Diphyllobothriidae) в кишечнике серебристой чайки Larus argentatus: особенности локализации и трофические аспекты // Изв. РАН. Сер. биол. 2016. № 4. С. 389–395.
Куперман Б.И. Функциональная морфология низших цестод: онтогенетический и эволюционный аспекты. Л.: Наука, 1988. 167 с.
Кутырев И.А. Морфофункциональные и иммунологические аспекты взаимоотношений в системе паразит–хозяин: цестоды–рыбы: Автореф. дис. докт. биол. наук. М.: ИПЭЭ РАН, 2017. 44 с.
Львова М.Н., Дужак Т.Г., Центалович Ю.П., Катохин А.В., Мордвинов В.А Секретом мариты печеночного сосальщика Opisthorchis felineus // Паразитология. 2014. Т. 48. № 3. С. 169–184.
Мазур О.Е., Толочко Л.В. Цитоморфологические и биохимические показатели байкальского омуля Coregonus migratorius при инвазии плероцеркоидами Diphyllobothrium dendriticum (Cestoda: Pseudophyllidae) // Изв. РАН. Сер. биол. 2015. № 2. С. 155–162.
Пронин Н.М., Пронина С.В., Кутырев И.А. Структура Байкальского природного очага дифиллоботриоза и взаимоотношения Diphyllobothrium dendriticum с дефинитивными хозяевами // Изв. ИГУ. Сер. Биология. Экология. 2009. № 1. С. 53–56.
Сердюков A.M. Дифиллоботрииды Западной Сибири. Новосибирск: Наука, 1979. 120 с.
Biserova N.M., Kutyrev I.A., Jensen K. GABA in the nervous system of the Cestodes Diphyllobothrium dendriticum (Diphyllobothriidea) and Caryophyllaeus laticeps (Caryophyllidea), with comparative analysis of muscle innervation // J. Parasitol. 2014. V. 100. № 4. P. 411–421.
Buck A.H., Coakley G., Simbari F., McSorley H.J., Quintana J.F., Le Bihan T., Kumar S., Abreu-Goodger C., Lear M., Harcus Y., Ceroni A., Babayan S.A., Blaxter M., Ivens A., Maizels R.M. Exosomes secreted by nematode parasites transfer small RNAs to mammalian cells and modulate innate immunity // Nat. Commun. 2014. V. 25. № 5. P. 54–88.
Bulgheresi S., Schabussova I., Chen T., Mullin N.P., Maizels R.M., Ott J.A. A new C-type lectin similar to the human immunoreceptor DC-SIGN mediates symbiont acquisition by a marine nematode // Appl. Environ. Microbiol. 2006. V. 72. P. 2950–2956.
Chiumiento L., Bruschi F. Enzymatic antioxidant systems in helminth parasites // Parasitol. Res. 2009. V. 105. P. 593–603.
Cho Y. Structural and functional characterization of a secreted hookworm Macrophage Migration Inhibitory Factor (MIF) that interacts with the human MIF receptor CD74 // J. Biol. Chem. 2007. V. 282. № 32. P. 23447–23456.
Coakley G., Buck A.H., Maizels R.M. Host parasite communications – Messages from helminths for the immune system: Parasite communication and cell-cell interactions // Mol. Biochem. Parasitol. 2016. V. 208. P. 33–40.
Coakley G., Maizels R.M., Buck A.H. Exosomes and other extracellular vesicles: The new communicators in parasite infections // Trends Parasitol. 2015. V. 31. P. 477–489.
Finlay C.M., Walsh K.P., Mills K.H. Induction of regulatory cells by helminth parasites: exploitation for the treatment of inflammatory diseases // Immunol. Rev. 2014. V. 259. № 1. P. 206–230.
Gregory W.F., Maizels R.M. Cystatins from filarial parasites: evolution, adaptation and function in the host–parasite relationship // Int. J. Biochem. Cell. Biol. 2008. V. 40. P. 1389–1398.
Harnett W., Harnett M.M. Therapeutic immunomodulators from nematode parasites // Expert. Rev. Mol. Med. 2008. V. 10. P. 7–18.
Hewitson J.P., Grainger J.R., Maizels R.M. Helminth immunoregulation: The role of parasite secreted proteins in modulating host immunity // Mol. Bioch. Par. 2009. V. 167. P. 1–11.
Jenkins S.J., Hewitson J.P., Jenkins G.R., Mountford A.P. Modulation of the host’s immune response by schistosome larvae // Par. Immunol. 2005. V. 27. P. 385–393.
Knopf K., Naser K., van der Heijden M.H.T., Taraschewski H. Humoral immune response of European eel Anguilla anguilla experimentally infected with Anguillicola crassus // Dis. Aquat. Org. 2000. V. 42. P. 61–69.
Kutyrev I.A., Biserova N.M., Olennikov D.N., Korneva J.V., Mazur O.E. Prostaglandins E2 and D2 – regulators of host immunity in the model parasite Diphyllobothrium dendriticum: an immunocytochemical and biochemical study // Mol. Biochem. Parasitol. 2017. V. 212. P. 33–45.
Kutyrev I.A., Franke F., Büscher J., Kurtz J., Scharsack J.P. In vitro effects of prostaglandin E2 on leucocytes from sticklebacks (Gasterosteus aculeatus) infected and not infected with the cestode Schistocephalus solidus // Fish Shellfish Immunol. 2014. V. 41. P. 473–481.
Li J., Shao J., Xiang L., Wen Y. Cloning, characterization and expression analysis of pufferfish interleukin-4 cDNA: The first evidence of Th2-type cytokine in fish // Mol. Immunol. 2007. V. 44. P. 2078–2086.
Lightowlers M.W., Rickard M.D. Excretory–secretory products of helminth parasites: effects on host immune responses // Parasitology. 1988. V. 96. Suppl. 1. P. S123–S166.
Maizels R.M., Balic A., Gomez-Escobar N., Nair M., Taylor M.D., Allen J.E. Helminth parasites – masters of regulation // Immun. Rev. 2004. V. 201. P. 89–116.
Marcilla A., Trelis M., Cortés A. Sotillo J., Cantalapiedra F., Minguez M.T., Valero M.L., Sánchez del Pino M.M., Muñoz-Antoli C., Toledo R., Bernal D. Extracellular vesicles from parasitic helminths contain specific excretory/secretory proteins and are internalized in intestinal host cells // PLoS One. 2012. V. 7. № 9. P. 459–474.
McSorley H.J., Maizels R.M. Helminth infections and host immune regulation // Clin. Microbiol. Rev. 2012. V. 25. № 4. P. 585–608.
Pleass R.J., Kusel J.R., Woof J.M. Cleavage of human IgE mediated by Schistosoma mansoni // Int. Arch. Allergy Immunol. 2000. V. 121. P. 194–204.
Poulin R., Morand S. The diversity of parasites // Quart. Rev. Biol. 2000. V. 75. P. 277–293.
Victor B., Kanobana K., Gabriël S., Polman K., Deckers N., Dorny P., Deelder A.M., Palmblad M. Proteomic analysis of Taenia solium metacestode excretion-secretion proteins // Proteomics. 2012. V. 11. P. 1860–1869.
Wang T., Husain M., Hong S., Holland J.W. Differential expression, modulation and bioactivity of distinct fish IL-12 isoforms: Implication towards the evolution of Th1-like immune responses // Eur. J. Immunol. 2014. V. 44. P. 1541–1551.
Wang T., Johansson P., Abós B. Holt A., Tafalla C., Jiang Y., Wang A., Xu Q., Qi Z., Huang W., Costa M.M., Diaz-Rosales P., Holland J.W., Secombes C.J. First in-depth analysis of the novel Th2-type cytokines in salmonid fish reveals distinct patterns of expression and modulation but overlapping bioactivities // Oncotarget. 2016. V. 10. P. 10917–10946.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


