Известия РАН. Серия биологическая, 2020, № 5, стр. 491-498
Филогения и дифференциация видов-двойников мышовок группы betulina (Rodentia, Dipodoidea, Sicista): результаты анализа изменчивости фрагмента гена IRBP ядерной ДНК
М. И. Баскевич 1, *, А. С. Богданов 2, Л. А. Хляп 1, В. М. Малыгин 3, М. Л. Опарин 1, С. Ф. Сапельников 4, Б. И. Шефтель 1
1 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
2 Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, 26, Россия
3 Московский государственный университет им. М.В. Ломоносова, биологический ф-т
119234 Москва, Ленинские горы, 1, Россия
4 Воронежский государственный заповедник
394080 пос. Краснолесный, Россия
* E-mail: mbaskevich@mail.ru
Поступила в редакцию 07.05.2019
После доработки 30.07.2019
Принята к публикации 21.08.2019
Аннотация
Показана по результатам анализа изменчивости гена IRBP (интерфоторецепторного ретиноидсвязывающего белка) ядерной ДНК у мышовок рода Sicista монофилия группы betulina и подтверждена существенная генетическая обособленность входящих в нее видов-двойников S. betulina и S. strandi. С использованием трехпараметрической модели Тамуры Т92 установлено, что средние генетические дистанции между S. betulina и S. strandi составляют 0.7%, что сопоставимо с межвидовыми генетическими дистанциями для видов-двойников мышовок других групп. Выявлена внутривидовая дифференциация видов-двойников группы, особенно выраженная у мышовки Штрандта. У S. strandi обнаружена сопоставимая с межвидовыми различиями дифференциация (D = 0.8%) между северными и южными популяциями вида, а у S. betulina – обособленность от других европейских и сибирской выборок (D = 0.2%) карпатского образца.
Ранее считалось, что политипический вид лесная мышовка S. betulina s. lato Pallas, 1779, широко распространенный от Скандинавии до Забайкалья и от Кавказа до устья Печоры (Pucek, 1982), морфологически однороден в пределах ареала (Виноградов, 1937; Огнев, 1948). Однако в 1989 г. была проведена ревизия (Соколов и др., 1989), итогом которой было повышение таксономического ранга одного из подвидов S. betulina s. lato – мышовки Штранда S. betulina strandi Formosov, 1931 – до видового. Самостоятельность видов-двойников S. strandi и S. betulina (последний далее будет рассматриваться в узком понимании) была доказана в первую очередь на основании кариотипических особенностей: в отличие от собственно лесной мышовки S. betulina s. str., кариотип которой включает в себя 32 хромосомы, мышовка Штранда характеризуется 44-хромосомным набором (Соколов и др., 1989). Степень кариотипических отличий (6 перестроек транслокационного типа и 5–6 перестроек типа изменения положения центромеры и перицентрических инверсий), по которым различаются кариотипы этих видов, указывает на то, что между ними сформировалась репродуктивная изоляция (Баскевич, Окулова, 2003; Kovalskaya et al., 2011). В настоящее время S. betulina s. str. и S. strandi наряду с серой мышовкой S. pseudonapaea Strautman, 1949 рассматриваются в составе группы betulina (Соколов, Ковальская, 1990).
Посредством кариологической диагностики было установлено, что S. betulina и S. strandi географически замещают друг друга (Соколов и др., 1989). Так, основная часть евразийского ареала S. betulina охватывает лесную зону севера Палеарктики, но этот вид встречается и в европейской лесотундре, не избегает лесистых гор и предгорий и обитает также в лесостепи Зауралья и Сибири. С севера на юг ареал S. betulina простирается от европейского севера до северной границы смешанных и широколиственных лесов, а с востока на запад – от Забайкалья до Карпат, Скандинавии и Ютландии (Соколов и др., 1989); для северо-западного участка ареала вида характерны изолированные популяции (Pucek, 1982). Мышовка Штранда имеет мозаичное распространение, которое приурочено к островным, байрачным и пойменным лесам юга Русской равнины и Предкавказья, а также к лесолугостепному и субальпийскому поясам северных склонов Главного Кавказского хребта (Соколов и др., 1989; Шенброт и др., 1995).
Позднее для диагностики видов группы betulina успешно использовались еще и молекулярно-генетические маркеры, краниометрические признаки (Баскевич и др., 2005б), а также предпринимались попытки выявить их внутривидовую изменчивость. Посредством кластерного анализа предварительных краниометрических данных была установлена дифференциация северных и южных популяций мышовки Штранда (Баскевич и др., 2005а), согласующаяся с результатами исследования строения glans penis самцов (Соколов и др., 1989, Баскевич, Опарин, 2000). Согласно дополненным краниометрическим материалам северная группировка представлена экземплярами S. strandi из Курской обл., а южная – выборками с Кавказа, из Предкавказья и Приазовья (Баскевич и др., 2018в). Анализ изменчивости гетерохроматина подтвердил краниометрические данные, дополнив северную популяционную группировку особями S. strandi из Саратовской обл. (Баскевич и др., 2005а) и продемонстрировав более сложную структуру этого узкоареального вида, чем предполагалось ранее (Громов, Ербаева, 1995). У S. betulina также была выявлена географическая изменчивость в особенностях локализации гетерохроматина: выборки с севера Валдайской возвышенности (Новгородская обл.), из центра европейской части России (Московская обл.) и с Карпат (Ивано-Франковская обл.) отчетливо различались по данному хромосомному признаку (Baskevich, 1996; Баскевич, Окулова, 2003). Кроме того, у лесной мышовки был обнаружен полиморфизм по морфологии второй пары аутосом, которые могут быть субмета-, субтело- или акроцентрическими. Изменчивость и гетероморфизм второй пары аутосом были отмечены у некоторых экземпляров S. betulina как в азиатской, так и европейской частях ареала (Соколов и др., 1989; Быстракова, 2000; Fedyk et al., 2011), однако природа данной хромосомной перестройки и характер ее распределения по ареалу еще не вполне ясны.
Анализ нуклеотидных последовательностей генов митохондриальной и ядерной ДНК с успехом использовался в диагностике видов мышовок и в исследовании их филогенетических связей (Zhang et al., 2013; Pisano et al., 2015; и др.), но главным образом в группах subtilis (Cserkesz et al., 2015, 2016), caucasica (Баскевич и др., 2015, 2018а; Rusin et al., 2018), tianshanica (Cserkesz et al., 2019). Он до сих пор ограниченно применялся в отношении группы betulina, и в частности филогеографии S. betulina и S. strandi. По фрагменту гена цитохрома b (cytb) митохондриальной ДНК было показано обособленное положение популяции лесной мышовки с севера Валдайской возвышенности относительно других выборок вида с Валдая и Московской обл. (Баскевич и др., 2018б). Другие гены для изучения группы betulina до сих пор не привлекались, а оценки филогенетических отношений, характера и уровня дифференциации составляющих ее видов были противоречивыми (Баскевич и др., 2018б; Rusin et al., 2018; Cserkesz et al., 2019).
Цель исследования – определение масштаба внутривидового полиморфизма у S. betulina и S. strandi, а также их межвидовых различий по фрагменту первого экзона гена IRBP (гена интерфоторецепторного ретиноидсвязывающего белка) ядерной ДНК.
МАТЕРИАЛЫ И МЕТОДЫ
Собственный материал, использованный в анализе фрагмента гена IRBP, включал в себя 12 кариологически диагностированных образцов Sicista группы betulina и три образца Sicista группы subtilis (табл. 1).
Таблица 1.
Использованный в сиквенс-анализе нуклеотидных последовательностей фрагмента (903 п.н.) гена IRBP ядерной ДНК материал по видам-двойникам Sicista группы betulina и другим представителям рода Sicista
| Вид | Код образца (GenBank Accession numbers) | 2n | Локалитет и его координаты (град. с.ш./град. в.д.) | Источник |
|---|---|---|---|---|
| S. betulina | 13-144 (MN175442), 11-84 (MN175441) |
32 | Россия, Новгородская обл., Валдайский р-н, оз. Кренье; (43.22/ 42.69) | Наши данные |
| То же | PTZ 13-60 (MN175437), 14-86(MN175438) |
32 | Московская обл., Серпуховской р-н, ПТЗ (43.52 /40.62) | То же |
| » | 09-28 (MN175440) | 32 | Московская обл., Одинцовский р-н, ЗБС МГУ; (42.78/43.90) | » |
| » | 01-11(MN175439) | 32 | Тверская обл., г. Ржев (56.26/34.33) | » |
| » | 193(MN175443), 369(MN175444) |
32 | Красноярский край, Туруханский р-н, пос. Мирный (62.31/89.02) | » |
| » | KF854241 | – | Румыния, Suseni (46.37/25.35) | (Cserkesz et al., 2015) |
| S. strandi | KF854242 | – | Украина, Луганск (48.12/39.8) | То же |
| То же | 11-23 (MN175447), 11-83 (MN175448) | 44 | Россия, Кабардино-Балкария, близ Экипцоко (43.68/43.08) | Наши данные |
| » | 03-11 (MN175445), 06-70 (MN175446) | 44 | Курская обл., Стрелецкий участок ЦЧЗ (51.58/36.08) | То же |
| S. caucasica | 07-49 (MN175453) | 32 | Краснодарский край, верховье р. Мзымта (43.52/40.62) | (Баскевич и др., 2018а) |
| S. kluchorica | 10-40 (MN175452) | 24 | Кабардино-Балкария, ущ. Адыл-Су (43.22/42.69) | То же |
| S. kazbegica | 10-89 (MN175454) | 40 | Северная Осетия, верховье р. Сказдон (42.78/43.90) | » |
| S. tianshanica | AF297288 | – | Не указаны | (DeBry, Sagel, 2001) |
| S. concolor | JF835089 | – | Китай, Ginghai | (Zhang et al., 2013) |
| S. subtilis nordmanni* | KF854236 | 26 | Румыния, Iasi (47.11/27.27) | (Cserkesz et al., 2015) |
| S. subtilis trizona* | KF854237 | – | Венгрия, Mezocsat (47.75/20.78) | То же |
| S. subtilis subtilis* | 03-216 (MN175450) | 24 | Россия, Саратовская обл., Заволжье, Александров Гай (50.14/48.57) | Наши данные |
| То же | 11-3 (MN175449) | 23 | Саратовская обл., Правобережье, Афанасьевка (51.87 /46.29) | То же |
| S. severtzovi* | 09-10 (MN175451) | 19 | Курская обл., ЦЧЗ, Баркаловка (51.56 /37.65) | » |
Тотальную ДНК выделяли методом фенолхлороформной депротеинизации с предварительной обработкой измельченных тканей протеиназой К по стандартной методике Самбрука и др. (Sambrook et al., 1989). Праймеры, использованные для амплификации и секвенирования фрагмента экзона 1 ядерного гена IRBP, представлены в табл. 2. Полимеразную цепную реакцию (ПЦР) проводили в смеси, содержавшей 25–30 нг ДНК, 2 мкл 10 × Taq-буфера, 1.6 мкл 2.5 мM раствора dNTP, 4 pM каждого праймера, единицу Taq-полимеразы и деионизированную воду до конечного объема 20 мкл. Амплификация была выполнена на приборе ТЕРЦИК (Россия) по следующей программе: предварительный прогрев при 94°С (3 мин), далее 35 циклов в последовательном режиме: 30 с – 94°С, 1 мин – 57°С, 1 мин – 72°С; в завершение реакции была проведена однократная финальная элонгация ПЦР-продуктов при 72°С (6 мин). Автоматическое секвенирование осуществлено с использованием кита ABI PRISM®BigDyeTM Terminator v. 3.1 (ABI, США) в ИБР РАН на генетическом анализаторе ABI 3500 (ABI, США).
Таблица 2.
Праймеры, использованные для амплификации и секвенирования участка (903 п.н.) экзона 1 гена IRBP мышовок
| Обозначение праймера | Нуклеотидная последовательность праймера (5'–3') |
|---|---|
| Прямые праймеры | |
| IRBP-F | AGCAGGCCATGAAGAGTCG |
| IRBP-F1int | AGCAGCTCATGGGCACTT |
| IRBP-F3int | CATTGTGGTGGGTGAGCGGACTG |
| Обратные праймеры | |
| IRBP-R | TCATTATCACGGAGGCATCAGC |
| IRBP-Rint | CAGATCTCCGTGGTGGTATT |
Помимо собственного материала мы включили в исследование ранее опубликованные и доступные в базе GenBank последовательности гена IRBP ряда других представителей рода Sicista (табл. 1), а также тушканчиков Allactaga sibirica (Jansa, Weksler, 2004; GenBank AY326076) и Cardiocranius paradoxus (Lebedev et al., 2013; GenBank JQ347926) в качестве аутгруппы. После выравнивания нуклеотидных последовательностей были получены и проанализированы фрагменты гена IRBP длиной 903 пары нуклеотидов (п.н.); их начало соответствует таковым последовательностей, опубликованных Черкезом с соавт. (Cserkész et al., 2015). Статистическая обработка данных была выполнена с помощью компьютерной программы Mega 6.06, разработанной Тамурой с соавт. (Tamura et al., 2013). Подходящую модель нуклеотидных замен выбирали по показателю BIC (bayesian information criterion); мы использовали модель T92+G (Tamura 3-parameter model with gamma distributed) при построении дендрограммы методом Maximum Likelihood (ML) и расчете генетических дистанций (D). Значения бутстреп-поддержки определяли по 1000 репликаций.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Расчет средних межвидовых генетических дистанций (табл. 3) и анализ топологии ML-древа, построенного по фрагменту первого экзона гена IRBP (рис. 1), позволяют выделить несколько уровней дифференциации в пределах надсемейства Dipodoidea: внутри групп видов Sicista (группы betulina, subtilis, caucasica) (<1%), между указанными группами и представителями других групп (>1.4%), между родами (11–12%). Как видно на дендрограмме, группа betulina монофилитичная с высоким уровнем бутстреп-поддержки. Это согласуется с результатами морфологических исследований, в соответствии с которыми glans penis самцов видов данной группы имеет единый тип строения, отличающий ее от других групп рода Sicista (Соколов и др., 1981, 1986а, 1986б, 1989; Соколов, Баскевич, 1988; Cserkesz et al., 2019), и с филогенетическими реконструкциями других авторов, включающих в состав группы betulina также алтайскую мышовку S. napaea (Pisano et al., 2015; Cserkesz et al., 2019).
Таблица 3.
Средние генетические дистанции между представителями рода Sicista и двумя видами тушканчиков Allactaga sibirica и Cardiocranius paradoxus, рассчитанные по фрагменту (903 п.н.) гена IRBP ядерной ДНК
| Виды/внутривидовые группировки |
S. betulina | S. strandi | S. subtilis | Ssev | Sklu | Scau | Skaz | Scon | Stian | Asib | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| I | II | B | I | II | S | I | II | III | S | |||||||||
| S. betulina | Россия (I) | ― | ||||||||||||||||
| Румыния (II) | 0.002 | ― | ||||||||||||||||
| Вид в целом (B) | ― | |||||||||||||||||
| S. strandi | Луганск-Экипцоко (I) | 0.008 | 0.006 | 0.008 | ― | |||||||||||||
| ЦЧЗ (II) | 0.007 | 0.004 | 0.006 | 0.008 | ― | |||||||||||||
| Вид в целом (S) | 0.007 | 0.005 | 0.007 | ― | ||||||||||||||
| S. subtilis | Саратовская обл. (I) | ― | ||||||||||||||||
| Венгрия (S. s. trizona) (II) | 0.004 | ― | ||||||||||||||||
| Румыния (S. s. nordmanni) (III) | 0.007 | 0.006 | ― | |||||||||||||||
| Вид в целом (S) | 0.014 | 0.015 | ― | |||||||||||||||
| S. severtzovi (Ssev) | 0.016 | 0.016 | 0.002 | 0.004 | 0.008 | 0.004 | ― | |||||||||||
| S. kluchorica (Sklu) | 0.022 | 0.023 | 0.024 | 0.025 | ― | |||||||||||||
| S. caucasica (Scau) | 0.022 | 0.023 | 0.024 | 0.025 | 0.004 | ― | ||||||||||||
| S. kazbegica (Skaz) | 0.024 | 0.024 | 0.025 | 0.026 | 0.007 | 0.007 | ― | |||||||||||
| S. concolor (Scon) | 0.029 | 0.030 | 0.028 | 0.030 | 0.020 | 0.020 | 0.023 | ― | ||||||||||
| S. tianshanica (Stian) | 0.031 | 0.030 | 0.032 | 0.033 | 0.022 | 0.022 | 0.024 | 0.019 | ― | |||||||||
| Allactaga sibirica (Asib) | 0.128 | 0.126 | 0.127 | 0.129 | 0.121 | 0.121 | 0.118 | 0.118 | 0.114 | ― | ||||||||
| Cardiocranius paradoxus | 0.120 | 0.123 | 0.127 | 0.129 | 0.111 | 0.114 | 0.114 | 0.111 | 0.109 | 0.092 | ||||||||
Рис. 1.
ML-дендрограмма, построенная при сравнении нуклеотидных последовательностей фрагмента (903 п.н.) экзона 1 ядерного гена IRBP Sicista группы betulina, ряда других представителей рода Sicista и двух видов тушканчиков. В узлах ветвления древа указаны значения бутстреп-поддержки, превышающие 70%.
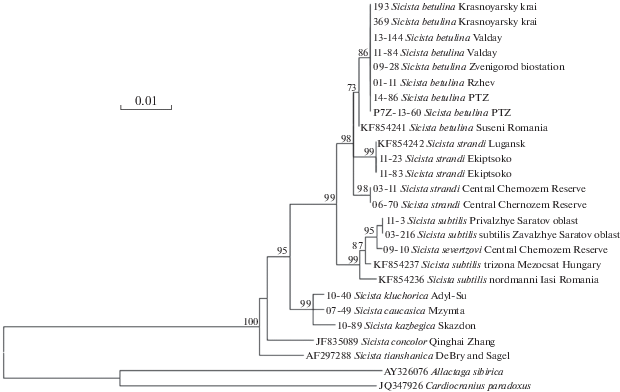
Результаты проведенного нами анализа фрагмента первого экзона гена IRBP ядерной ДНК по дифференциации видов-двойников Sicista группы betulina согласуются с полученными ранее хромосомными (Соколов и др., 1989) и молекулярно-генетическими (Баскевич и др., 2018б; Rusin et al., 2018) данными, т.е. демонстрируют распределение гаплотипов на дендрограмме в две группы в полном соответствии с кариотипическими особенностями видов мышовок. В состав первой группы входят гаплотипы лесных мышовок S. betulina (2n = 32, где n – число хромосом), а в состав второй группы – гаплотипы мышовок Штранда S. strandi (2n = 44). Следует отметить, что некоторыми другими исследователями (Cserkesz et al., 2019) были получены результаты, отличающиеся от наших, что, по-видимому, обусловлено использованием ими единичных представителей видов группы betulina с юга Европы. По нашим данным, генетические дистанции между видами-двойниками S. betulina и S. strandi достигают 0.7% (табл. 3). Это значение сопоставимо с межвидовыми генетическими дистанциями в других группах рода Sicista, в частности между видами S. kazbegica, S. caucasica и S. kluchorica группы caucasica (D = 0.4–0.7%) (Баскевич и др., 2018а).
В пределах кластера, объединяющего гаплотипы особей S. strandi, отчетливо видна подразделенность на два подкластера, которые соответствуют двум внутривидовым группировкам: северной и южной (рис. 1). Северная группировка представлена экземплярами из Центрального Черноземья (Курская обл.), а южная – особями с Северного Кавказа (Кабардино-Балкария) и из окрестностей Луганска. Интересно, что уровень различий между данными внутривидовыми группировками S. strandi (D = 0.8%) немного превышает максимальные межвидовые дистанции (D = 0.7%) в группах betulina, subtilis и caucasica (табл. 3). Объяснений может быть два: либо мы имеем дело с двумя генетически дифференцированными формами S. strandi (и, возможно, даже с отдельными криптическими видами), либо ген IRBP у S. strandi очень быстро эволюционирует. Для прояснения ситуации необходимо в дальнейшем вовлекать в анализ дополнительный материал по мышовке Штранда и расширить набор исследуемых генов.
Сравнение по фрагменту гена IRBP особей S. betulina из шести локалитетов (Карпаты, Валдай, два пункта Московской обл., Тверская обл., Красноярский край) показало высокое сходство гаплотипов лесных мышовок с территории России, как из европейской части страны, так и из азиатской (рис. 1). По ядерному маркеру нами не выявлено отличий северо-валдайской популяции S. betulina от прочих восточно-европейских популяций этого вида, что было установлено ранее при исследовании изменчивости у лесной мышовки митохондриального гена cytb (Баскевич и др., 2018б). Вероятнее всего, это обусловлено более низкой скоростью эволюции ядерных генов по сравнению с митохондриальными. Тем не менее анализ гена IRBP продемонстрировал обособленность карпатского экземпляра (D = 0.2%) от всех других исследованных лесных мышовок из Восточной Европы и Сибири (рис. 1, табл. 3). Напомним, что ранее было отмечено своеобразие по гетерохроматину хромосом популяции S. betulina Восточных Карпат при ее сопоставлении с выборками из центральной части Европейской России и Валдая (Баскевич, Окулова, 2003). Совокупность полученных молекулярных и хромосомных данных подтверждает значение Карпат как рефугиума, игравшего существенную значение в формообразовании лесной мышовки. Этот вывод согласуется с мнением польских исследователей, обосновавших с учетом многочисленных палеозоологических, палеоботанических и молекулярных сведений существенное значение рефугиумов в Карпатах, на Кавказе и Русской равнине, а также на Урале для формообразования и расселения ряда лесных видов фауны и флоры Европы (Jancewicz, Falkowska, 2017).
ML-дерево, построенное нами на основе фрагмента гена IRBP ядерной ДНК (рис. 1), не только указывает на возможную рефугиальную роль Карпат в формообразовании S. betulina, но и поддерживает гипотезу о существовании на Кавказе и Русской равнине рефугиумов, длительная изоляция в которых предковых популяций мышовки Штранда способствовала накоплению различий в кавказско-восточно-украинской части ареала вида, с одной стороны, и в популяциях Черноземного региона – с другой. В пользу последнего предположения свидетельствуют не только полученные нами молекулярные, но и известные ранее хромосомные и краниометрические (Баскевич и др., 2005а) данные, поддерживающие дифференциацию между северными и южными популяциями S. strandi.
Интересно также сопоставить, как полученные нами молекулярные результаты согласуются с представлениями о естественной системе Sicista группы betulina (Громов, Ербаева, 1995), хотя до проведения таксономической ревизии и описания видов-двойников (Соколов и др., 1989) выделение подвидов у S. betulina s. l. принималось не всеми исследователями (Виноградов, 1937; Огнев, 1948), а описание ряда форм (montana Mehely, 1913, tatricus Mehely, 1913, norvegica Chaworth-Musters, 1927) из Западной Европы сводилось в синонимы S. betulina s. l. Полученные нами данные по фрагменту гена IRBP на новом уровне подтверждают результаты таксономической ревизии S. betulina s. l., иллюстрируя видовой уровень отличий между былым подвидом S. betulina (=montana) strandi Formosov, 1931 и S. betulina s. str. (Соколов и др., 1989), в настоящее время рассматриваемых в рамках видов-двойников Sicista группы betulina: S. betulina и S. strandi (Cоколов, Ковальская, 1990).
Следует напомнить, что признаваемая некоторыми систематиками (Громов, Ербаева, 1995) политипическая структура S. betulina включает в себя только сибирские подвиды: S. betulina betulina Pallas, 1778 (населяет зауральские и западно-сибирские лесостепи) и S. betulina taigica Stroganov et Potapkina, 1950 (обитает в таежной части Западной Сибири), а S. strandi рассматривается этими авторами как монотипический вид. Полученные нами молекулярные данные выявили сложную филогеографическую структуру обоих видов-двойников в европейской части ареала группы, тогда как образцы S. betulina из Красноярского края не отличались по нуклеотидным последовательностям изученного фрагмента гена IRBP от других, за исключением карпатского, исследованных из ряда пунктов Европы образцов (рис. 1, табл. 3). Карпатский образец лесной мышовки был добыт в пределах ареала формы montana, ранее сведенной в синонимы S. betulina. Его обособленность по использованному нами молекулярному маркеру может указывать на возможность последующего выделения карпатской популяции вида в качестве особого подвида. Аналогичная, а возможно, и более сложная ситуация прослеживается для северной популяции S. strandi, в значительной степени обособленной от южных выборок (табл. 3).
Таким образом, полученные нами результаты подтвердили высокий уровень генетических различий между S. betulina и S. strandi, а также продемонстрировали их внутривидовую дифференциацию, особенно выраженную у второго вида.
Работа выполнена в рамках Государственных заданий 0108-2019-0007 и 0109-2018-0073.
Список литературы
Баскевич М.И., Окулова Н.М. Сравнительная кариология и краниология мышовок (Sicista, Dipodoidea, Rodentia) группы betulina // Зоол. журн. 2003. Т. 82. Вып. 8. С. 996–1009.
Баскевич М.И., Опарин М.Л. О новой находке мышовки Штранда Sicista strandi (Rodentia, Dipodoidea), уточняющей северо-восточную границу распространения вида // Зоол. журн. 2000. Т. 79. Вып. 7. С. 1133–1136.
Баскевич М.И., Богданов А.С., Хляп Л.А. Таксономия и филогения видов-двойников мышовок группы “caucasica” и их положение в составе рода Sicista (Rodentia, Dipodoidea) по данным секвенирования фрагмента гена IRBP ядерной ДНК // Изв. РАН. Сер. биол. 2018а. № 5. С. 476–481.
Баскевич М.И., Потапов С.Г., Миронова Т.А. Криптические виды грызунов Кавказа как модели в изучении проблем вида и видообразования // Журн. общ. биологии. 2015. Т. 75. № 4. С. 333–349.
Баскевич М.И., Окулова Н.М., Власов А.А., Опарин М.Л. Хромосомная и краниометрическая изменчивость у мышовки Штранда Sicista strandi (Rodentia, Dipodoidea) на Кавказе и Русской равнине // Млекопитающие горных территорий / Под ред. Рожнова В.В., Темботовой Ф.А. М.: КМК, 2005а. С. 18–23.
Баскевич М.И., Хляп Л.А., Потапов С.Г., Шварц Е.А., Дмитриев С.Г., Малыгин В.М. Эволюционные и экологические аспекты генетического разнообразия валдайских популяций лесной мышовки Sicista betulina Pallas, 1778 // Поволж. экол. журн. 2018б. № 2. С. 136–146.
Баскевич М.И., Богданов А.С., Потапов С.Г., Окулова Н.М., Опарин М.Л., Хляп Л.А., Власов А.А., Стахеев В.В. Хромосомные, молекулярные и краниометрические подходы в изучении популяционно-генетической структуры мышовки Штранда Sicista strandi (Rodentia, Dipodoidea) // Матер. XX междунар. конф. “Биологическое разнообразие Кавказа и юга России” (Махачкала, 7–9 ноября 2018 г.). Махачкала: Изд-во ИПЭ РД, 2018в. С. 365–367.
Баскевич М.И., Окулова Н.М., Потапов С.Г., Илларионова Н.А., Крысанов Е.Ю., Щипанов Н.А., Опарин М.Л., Власов А.А. К вопросу о диагностике и распространении видов-двойников мышовок (Rodentia, Dipodoidea, Sicista) на территории Русской равнины и Кавказа // Тр. Зоол. ин-та РАН. 2005б. Т. 360. С. 22–40.
Быстракова Н.В. Таксономическое и генетическое разнообразие мелких млекопитающих Среднего Поволжья: Автореф. дис. канд. биол. наук. 2000. М.: ИПЭЭ РАН, 2000. 24 с.
Виноградов Б.С. Тушканчики / Ред. Штакельберг А.А. Фауна СССР. Млекопитающие. М.; Л.: Изд-во АН СССР, 1937. Т. 3 (4). 298 с.
Громов И.М., Ербаева М.А. Млекопитающие фауны России и сопредельных территорий. Зайцеобразные и грызуны. СПб.: Изд-во РАН, 1995. 552 с.
Огнев С.И. Звери СССР и прилежащих стран. Грызуны. Т. 6. М.; Л.: Изд-во АН СССР, 1948. 559 с.
Соколов В.Е., Баскевич М.И. Новый вид одноцветных мышовок (Rodentia, Dipodoidea) с Малого Кавказа // Зоол. журн. 1988. Т. 67. Вып. 2. С. 300–304.
Соколов В.Е., Ковальская Ю.М. Система рода Sicista и хромосомные формы тяньшанской мышовки, S. tiancshanica Salensky, 1903 // Тез. докл. V Съезда Всесоюзного териологического об-ва (Москва, 29 янв.–2 февр. 1990 г.). М.: Изд-во АН СССР, 1990. Ч. 1. С. 99–100.
Соколов В.Е., Баскевич М.И., Ковальская Ю.М. Ревизия одноцветных мышовок Кавказа: виды-двойники Sicista caucasica Vinigradov, 1925 и S. kluchorica sp.n. (Rodentia, Dipodidae) // Зоол. журн. 1981. Т. 60. Вып. 9. С. 1386–1393.
Соколов В.Е., Баскевич М.И., Ковальская Ю.М. Sicista kazbegica sp.n. (Rodentia, Dipodidae) из бассейна верхнего течения реки Терек // Зоол. журн. 1986а. Т. 65. Вып. 6. С. 949–952.
Соколов В.Е., Баскевич М.И., Ковальская Ю.М. Изменчивость кариотипа степной мышовки, Sicista subtilis Pallas (1778) и обоснование видовой самостоятельности S. severtzovi Ognev, 1935 (Rodentia, Zapodidae) // Зоол. журн. 1986б. Т. 65. Вып. 8. С. 1684–1692.
Соколов В.Е., Ковальская Ю.М., Баскевич М.И. О видовой самостоятельности мышовки Штранда S. strandi Formosov (Rodentia, Dipodoidea) // Зоол. журн. 1989. Т. 68. Вып. 10. С. 95–106.
Шенброт Г.И., Соколов В.Е., Гептнер В.Г., Ковальская Ю.М. Тушканчикообразные // Млекопитающие России и сопредельных регионов / Под ред. Cоколова В.Е. М.: Наука, 1995. 573 с.
Baskevich M.I. About morphologically similar species in the genus Sicista // Bonn. Zool. Beitrage. 1996. V. 46. № 1–2. P. 133–140.
Cserkész T., Rusin M., Shramko G. An integrative systematic revision of the European Southern birch mice (Rodentia, Sminthidae, Sicista subtilis group) // Mamm. Rev. 2016. V. 46. P. 114–130.
Cserkész T., Aczél-Fridrich Z., Hegyeli Z., Sugár S., Czabán D., Horváth O., Sramkó G. Rediscovery of the Hungarian birch mouse (Sicista subtilis trizona) in Transylvania (Romania) with molecular characterisation of its phylogenetic affinities // Mammalia. 2015. V. 79. Iss. 2. P. 215–224.
Cserkész T., Fulop A., Almerekova Sh., Kondor T., Levente L., Shramko G. Phylogenetic and morphological analysis of birch mice (genus Sicista, family Smintidae, Rodentia) in the Kazak Gradle with description of a new species // J. Mamm. Evol. 2019. V. 26. Iss. 1. P. 147–163.
DeBry R.W., Sagel R.W. Phylogeny of Rodentia (Mammalia) inferred from the nuclar-encoded gene IRBP // Mol. Phyl. Evol. 2001. V. 19. P. 290–301.
Fedyk S., Chetnicki W., Ruprecht A.L., Cichocki J. Chromosome polymorphism in Polish populations of Nothern birch mouse Sicista betulina // Fol. Zool. 2011. V. 60. № 1. P. 31–36.
Jancewicz E., Falkowska E. Glacial refugia in Europe: what do we know about the history of contemporary plant and animal species // SYLWAN. 2017. V. 161. № 12. P. 982–990.
Jansa Sh.A., Weksler M. Phylogeny of muroid rodents: relationships within and among major lineages as determined by IRBP gene sequences // Mol. Phyl. Evol. 2004. V. 31. Iss. 1. P. 256–276.
Kovalskaya Y.M., Aniskin V.M., Bogomolov P.L., Surov A.V., Tikhonov I.A., Tikhonova G.N., Robinson T.J., Volobuev V.T. Karyotype Reorganization in the subtilis Group of Birch Mice (Rodentia, Dipodidae, Sicista): Unexpected Taxonomic Diversity within a Limited Distribution // Cytogenet. Genome Res. 2011. V. 132. № 4. P. 271–288.
Lebedev V.S., Bannikova A.A., Pages M., Pisano J., Michaux J.R., Shenbrot G.I. Molecular phylogeny and systematics of Dipodoidea: a test of morphology-based hypotheses // Zool. Scripta. 2013. V. 42. Iss. 3. P. 231–249.
Pisano J., Condamine F.I., Lebedev V., Bannikova A., Quere J.-P., Shenbrot G.I., Pages M., Michaux J.R. Out of Hymalaya: the impact of past Asian environmental changes on the evolutionary and biographical history of Dipodoidea (Rodentia) // J. Biogeogr. 2015. V. 42. Iss. 5. P. 856–870.
Pucek Zd. Family Zapodidae – Handbuch der Saugetiere Europas. Weisbaden: Acad. Verlag, 1982. Pt 2/1. S. 497–538.
Rusin M., Lebedev V., Matrosova V., Zemlemerova E., Lopatina N., Bannikova A. Hidden diversity in the Caucasian mountains: an example of birch mice (Rodentia, Sminthidae, Sicista) // Hystrix, Ital. J. Mamm. 2018. V. 29. P. 61–66.
Sambrook J., Fritsch E.F., Maniatis T. Molecular cloning: a laboratory manual. N.Y.: Cold Spring Harbor Lab. Press, 1989. 398 p.
Tamura K., Stecher G., Peterson D., Filipski A., Kumar S. MEGA6: Molecular Evolutionary Genetics Analysis version 6.0 // Mol. Biol. Evol. 2013. V. 30. Iss. 12. P. 2725–2729.
Zhang Q., Xia L., Kimura Y., Shenbrot G., Zhang Z., Ge D., Yang Q. Tracing the origin and diversification of Dipodoidea (Order: Rodentia): Evidence from fossil record and molecular phylogeny // Evol. Biol. 2013. V. 40. Iss. 1. P. 32–44.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


