Известия РАН. Серия биологическая, 2020, № 5, стр. 517-525
Изменение запаха мочи мышей в динамике формирования перевитой опухоли гепатокарциномы Н33
М. Ю. Кочевалина 1, В. Г. Трунов 1, О. В. Морозова 2, Г. А. Когунь 3, Е. И. Родионова 1, *
1 Институт проблем передачи информации им. А.А. Харкевича РАН
127051 Москва, Большой Каретный пер., 19, стр. 1, Россия
2 "Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина" Министерства здравоохранения Российской Федерации
115478 Москва, Каширское шоссе, 24, Россия
3 Отдел кинологического мониторинга Департамента управления авиационной безопасностью
ПАО “Аэрофлот – российские авиалинии”
119002 Москва, ул. Арбат, 10, Россия
* E-mail: A.Rodionova@gmail.com
Поступила в редакцию 16.01.2019
После доработки 04.02.2019
Принята к публикации 09.04.2019
Аннотация
Исследовано влияние стадии развития злокачественной опухоли на успешное выявление собаками мочи животных с онкологией. Показано, что успех собак в поиске больного организма среди здоровых хорошо согласуется с динамикой развития перевитой опухолевой ткани, т.е. собаки способны воспринимать как весь спектр летучих метаболитов, сопутствующих заболеванию, так и изменения этого спектра, связанные непосредственно с развитием опухоли. Установлено существование летучих органических соединений, связанных с ростом злокачественной опухоли.
Сегодня мы только начинаем понимать, как велик объем информации, которую животные извлекают из “химических сообщений” ‒ запаховых меток, оставленных другими организмами (Wells, Bekoff, 1981; Bekoff, 2001; Harrington et al., 2003). Передача химических сигналов ‒ одна из самых значительных форм социальной коммуникации, имеющая множество преимуществ перед другими способами взаимодействия. Химические сигналы играют особую роль, когда практически бесполезны другие органы чувств (например, в темноте или в шумной среде). Они могут переноситься на большие расстояния ветром или потоком воды, долго сохраняются, когда их “отправитель” уже далеко. Показано, что животные используют запахи не только для обнаружения источников пищи и токсинов, но и для получения информации о метаболическом статусе других индивидов, конспецификов и других окружающих организмов, выделяя родственников, “соседей”, жертв и хищников. Информация о возрасте (Osada et al., 2003, 2008), диете (Schellinck et al., 1992), генетических различиях индивидов (Schaefer et al., 2002; Keller et al., 2006a, b), стрессе (Novotny et al., 1985; Schaal et al., 2003) может быть закодирована в химических сигналах, состоящих из небольших молекул метаболитов – летучих органических соединений (ЛОС) (Johnston 2003; Brennan, Kendrick 2006; Kelliher, 2007). ЛОС представляют собой широкий спектр стабильных химических веществ, летучих при температуре окружающей среды, и обнаруживаются в выдыхаемом воздухе, моче, фекалиях и поте (Cicolella, 2008; Dummer et al., 2011). Состав и соотношение летучих метаболитов в выделениях людей и животных уникальны для каждого индивида и несут информацию о перечисленных выше факторах, а также о многом другом, например о состоянии здоровья (Penn, Potts, 1998; Yamazaki et al., 2002; Kavaliers et al., 2005a, b; Arakawa et al., 2010, 2011; Moser, McCulloch, 2010). Результаты исследований предпочтения запаха у грызунов продемонстрировали, что широкий спектр инфекций (от паразитарных до вирусных) влияет на запахи инфицированных индивидов и что самки предпочитают запах неинфицированных самцов (Willis, Poulin, 2000; Ehman, Scott, 2002; Kavaliers et al., 2005б).
Показано, что на состав ЛОС, выделяемых организмом человека, влияют аутоиммунные заболевания (Kang et al., 2015), диабет (Phillips et al., 2004; Novak et al., 2007), желудочно-кишечные и печеночные заболевания (Probert et al., 2009), болезни легких (Boots et al., 2012), инфекции (Phillips et al., 2007; Dummer et al., 2011; Chambers et al., 2012) и различные виды рака (Mazzone 2008; Horvath et al., 2009; Peng et al., 2010; Hakim et al., 2012). Эти запахи могут быть обнаружены другими животными и/или инструментальными методами, и поэтому летучие метаболиты привлекательны как биомаркеры не только для диагностики различных заболеваний (Risby, 2002; Dummer et al., 2011; Shirasu, Touhara, 2011), но и для разработки быстрого и недорогого скрининга. Наибольшее количество исследований летучих биомаркеров было проведено на образцах выдыхаемого воздуха (Miekisch et al., 2004; Phillips et al, 2004; Amann, 2012; Boots et al., 2012), хотя также были исследованы моча (Guernion et al., 2001) и фекалии (Garner et al., 2007). Немаловажно, что выделение этих биомаркеров ‒ неинвазивная процедура, а это очень существенно для тяжелобольных людей и маленьких детей.
С развитием новых эффективных методов лечения онкологических заболеваний их ранняя диагностика становится все более и более актуальной. По данным на 2008 г. основными причинами смерти людей были сердечно-сосудистые заболевания и опухоли (25 и 23% общего числа умерших за год соответственно) (Minino, Kochanek, 2011). Известно также, что если средняя пятилетняя выживаемость пациентов с диагностированными опухолями легкого (первое место по частоте встречаемости у мужчин и второе после рака молочной железы у женщин) составляет 18.6%, то при обнаружении новообразования на стадии локализованной опухоли – 56% выживаемости, а на стадии регионарных и отдаленных метастазов – 24 и 4% соответственно (American…, 2015). Результаты исследований показывают, что и для других видов злокачественных опухолей, например гепатокарциномы (ГК) – одного из наиболее распространенных онкологических заболеваний с высоким уровнем заболеваемости и смертности (El-Serag et al., 2008), ранняя диагностика имеет решающее значение для выживаемости пациентов и эффективного лечения (Trinchet et al., 2009).
Постоянно разрабатываемые новые методы, например такие, как компьютерная томография, магнитно-резонансная томография, позитронно-эмиссионная томография, позволяют с достаточно высокой точностью диагносцировать рак. Однако их высокая стоимость, большие затраты времени и некоторые риски для здоровья пациентов (например, увеличение риска развития рака при радиационном воздействии (Jett, 2005) и потенциальная опасность ненужных биопсий при доброкачественных поражениях (Zlotta, Nam, 2012)) обусловливают поиск новых способов ранней диагностики – дешевых, быстрых и неинвазивных. Химический анализ ЛОС, присутствующих в выделениях пациентов, – одно из перспективных направлений поиска ранних биомаркеров роста злокачественных образований. Поскольку метаболизм опухолевых клеток отличается от метаболизма нормальных, их метаболиты могут содержать специфические ЛОС (Strauch et al., 2014; Schmidt, Podmore, 2015).
Исследования ЛОС в выдыхаемом воздухе и моче с использованием газовой хроматографии и масс-спектрометрии показали, что метаболические изменения, связанные с развитием злокачественных опухолей, влияют на спектр высвобождаемых ЛОС (Ludwig, Weinstein, 2005; Peng et al., 2010; Lubes, Goodarzi, 2017), но существуют значительные трудности по выявлению конкретных маркеров. Показано также, что высокой чувствительностью к таким ЛОС обладают животные, мыши и собаки (Matsumura et al., 2010; Cornu et al., 2011; Ehmann et al., 2011; Родионова и др., 2015; Sato et al., 2017). Они с большой вероятностью способны отличать здоровых людей и животных от тех, в организме которых развивается опухоль. Однако следует отметить, что рак – сложное заболевание. Помимо прогрессии опухоли больной организм от здорового отличают и многие другие процессы. Возможно, собаки способны выделять именно комплекс веществ, непосредственно связанный с изменением метаболизма злокачественных клеток, но скорее всего они пользуются и другими сигналами, например метаболитами, образовавшимися в процессах, связанных с прогрессией опухоли, таких как воспаление, ангиогенез и некроз. Собаки воспринимают “обонятельный образ” больного организма аналогично тому, как мы, наблюдая бледность, потливость, воспаленные глаза у другого человека, понимаем, что он болен, хотя и не знаем, от какого конкретно заболевания он страдает. До сих пор нет четких доказательств того, что собаки способны выделять комплекс ЛОС, связанный именно с пролиферацией опухоли. Если некоторые комплексы ЛОС действительно связаны с ростом опухоли и отражают метаболизм злокачественных клеток, чувствительность собак к этим комплексам может зависеть, например, от стадии развития опухоли. Следовательно, можно предположить, что по мере развития злокачественной опухоли, увеличения внутриопухолевой гетерогенности клеток, их последующей эволюции и отбора спектр выделяемых веществ будет меняться и запах организма будет зависеть от стадии развития опухоли.
Цель работы – установить, влияет ли стадия развития опухоли на успех определения собаками больного организма, а также можно ли утверждать, что существуют ЛОС, связанные с пролиферацией опухоли, и собаки могут обнаруживать эти вещества в общем комплексе ЛОС.
МАТЕРИАЛЫ И МЕТОДЫ
Экспериментальной моделью онкологического заболевания служили самцы гибридных мышей BDF-f1 (DBA2 × C57Bl/6). 2–3-месячным гибридным самцам подкожно трансплантировали 100 мг измельченной опухолевой ткани в 0.5 мл 0.9%-ного физиологического раствора. Мы использовали штамм Н33 перевиваемой ГК мышей, полученный в НМИЦ онкологии им. Н.Н. Блохина МЗ РФ из опухолей, индуцированных ранее у таких же гибридных самцов мышей BDF-f1 однократным внутрибрюшинным введением 90 мг/кг диэтилнитрозамина (Lazarevich et al., 2004). Контролем служили самцы мышей той же линии, но после введения ткани здоровой печени. Инъекции опухолевой ткани и ткани здоровой печени делали подкожно в лопаточную область. Образцы мочи собирали с 1-х по 8-е сут после инъекции ткани, сразу замораживали при ‒23°С и размораживали непосредственно перед проведением эксперимента.
Для измерения массы и объема перевитой ткани с 1-х по 8-е сут после инъекции каждые 24 ч умерщвляли с помощью эфира по 10 самцов контрольной и экспериментальной групп. У животных извлекали перевитую ткань, которую взвешивали, после чего рассчитывали ее относительную массу (отношение массы перевитой ткани к массе мыши).
Все животные содержались в стандартных лабораторных условиях при световом режиме: 12 ч – световая фаза, 12 ч – темновая фаза. Температура варьировала от 20 до 22°C. Комбикорм для мышей (Лабораторкорм, Россия), смесь овса и семян подсолнечника, а также вода были в свободном доступе. На протяжении всего исследования животных содержали по 10 особей в стандартных полипропиленовых клетках.
Для сравнения образцов мочи были использованы специально обученные собаки (шакало-псовые гибриды) отдела кинологического мониторинга Департамента управления авиационной безопасностью ПАО “Аэрофлот – российские авиалинии”. В экспериментах участвовали 5 взрослых собак (3 кобеля и 2 суки) в возрасте от 5 до 10 лет. Экспериментом мы считали одно предъявление одной собаке одного набора контрольных и исследуемых проб мочи мышей. Эксперименты проводили с применением метода, используемого в криминалистической одорологии и научных исследованиях – “выбор по подобию” (Schoon, 1996; Крутова, 1997). Собаке предлагали запах мочи больного донора (стартовый образец), а затем давали выбрать из 12 образцов, среди которых присутствовал образец другого больного донора (тестовый образец). В экспериментальной комнате размером 4 × 4 м поддерживались температура 18–20°C и влажность не менее 35%. 40–60 мкл мочи мыши в открытой пластиковой пробирке помещали на дно чисто вымытой и выдержанной при 70°C стеклянной банки объемом 0.5 л так, чтобы собака, обнюхивая, не могла прикоснуться к источнику запаха. На полу комнаты на одинаковом расстоянии одна от другой (1 м) были нанесены краской 12 точек, образующих круг. Банки с образцами расставляли по точкам на полу. Кроме тестового образца ставили десять контрольных образцов и еще один образец, идентичный стартовому образцу, так называемый свидетель. Свидетель был поставлен в круг для того, чтобы можно было похвалить собаку, если она не находила тестовый образец. Стартовый образец предъявляли собаке в течение 30 с и затем ждали 1‒2 мин перед предъявлением ряда проб. Банки с пробами расставляли по точкам на полу случайным образом. Все образцы мочи в одном кругу были собраны от разных животных и предъявлялись только одной собаке. Эксперименты проводили двойным слепым методом, т.е. ни инструктор, ведущий собаку, ни наблюдатели, присутствующие в комнате, не знали расположения образцов. При нахождении искомой пробы собаки садились перед банкой и подавали голос. Мы считали, что собака сделала правильный выбор, если она нашла банку, содержавшую мочу больной мыши. Если собака садилась перед контрольной пробой, мы считали этот выбор как ошибочный. Если собака пронюхала все банки и не совершила ни одной посадки либо совершила от одной до трех ложных посадок, мы считали, что животное не обнаружило тестовой пробы. С пробами мочи, собранными в каждые сутки развития опухоли (с 1-х по 8-е), было проведено по 12‒15 экспериментов по выявлению собаками больных животных (всего 103 эксперимента). Каждый эксперимент был зафиксирован в бумажном протоколе и на видеозаписи.
Различия по группам рассчитывали с применением критерия Краскела‒Уоллиса. Все параметры экспериментов заносили в разработанную нами базу данных (Кочевалина, Трунов, 2016), что позволило провести многофакторный анализ.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
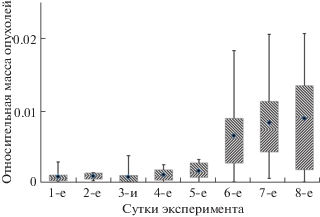
Относительная масса перевитой опухолевой ткани, как и относительная масса перевитой здоровой ткани печени, несколько уменьшается в первые 3 сут, а затем масса перевитой здоровой ткани меняется мало. Как видно на рис. 1 и из результатов статистической обработки, показанных на рис. 2, относительная масса опухолевой ткани уменьшается к 3-м сут, а на 4-е сут начинается ее рост и к 6-м сут относительная масса опухолевой ткани в несколько раз превышает изначальную массу ткани перевитой мыши.
Рис 1.
Изменение относительной массы перевитой ткани в зависимости от времени, прошедшего после перевивки. 1 ‒ опухолевая ткань, 2 ‒ ткань здоровой печени.
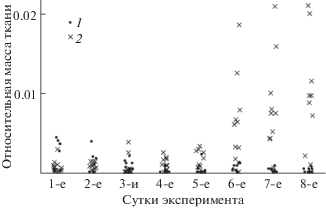
Рис. 2.
Box plot диаграмма относительной массы опухолевой ткани в зависимости от времени, прошедшего после перевивки. Границы прямоугольников обозначают нижний и верхний квартили, горизонтальная полоса в каждом прямоугольнике – медиана, а верхняя и нижняя границы “усов” – максимальное и минимальное значения относительной массы соответственно.
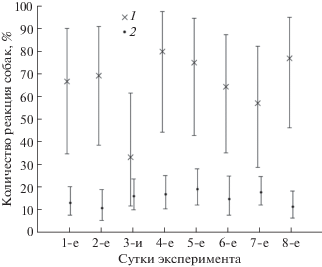
На рис. 3 приведены эмпирические оценки частоты реакций собак и 95%-ные доверительные интервалы этих оценок в зависимости от типа перевитой ткани и числа дней после операции. На 1-е и 2-е сут развития перевитой ткани ГК собаки успешно отличают больных мышей от здоровых по запаху мочи, однако на 3-и сут развития опухоли собаки испытывают существенные трудности с обнаружением больных животных. С четвертого дня развития опухолевой ткани обнаружение больных мышей не вызывает у собак трудностей, хотя успешность обнаружения не всегда одинакова.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Мы использовали ГК, так как это пятая по частоте встречаемости опухоль и третья среди причин смерти от онкологических заболеваний после рака легких и желудка (Parkin et al., 2001). На ранних стадиях развитие ГК проходит практически бессимптомно, а лечение на поздних стадиях не приводит к удовлетворительному лечебному эффекту (Hartke et al., 2017). Основные биомаркеры ГК ‒ альфа-фетопротеин и дез-гамма-карбоксипротромбин ‒ используются для раннего выявления ГК и в качестве маркеров рецидива заболевания при наблюдении за пациентами. Однако у ~30% пациентов с ГК этих маркеров не обнаружено (Masuda, Miyoshi, 2011). Так как основная причина рецидива опухоли и смерти пациента от рака печени – это метастазы от первичной опухоли, возникшие до операции, ранняя диагностика ГК, в том числе и выделение новых высокочувствительных и специфических ранних маркеров, имеет решающее значение для эффективного лечения и повышения выживаемости пациентов (Trinchet et al., 2009). В последние годы было показано, что линии различных опухолевых клеток, в том числе и ГК, выделяют специфические ЛОС in vitro (Filipiak et al., 2008; Amal et al., 2012). Более того, для ГК было получено первое свидетельство существования измеримых ЛОС-профилей метастатического потенциала опухоли (Amal et al., 2012). Но исследования in vitro игнорируют воздействие пролиферации опухоли на весь организм и лишены трудностей аналогичных исследований выделений целого организма – влияния на состав ЛОС возраста, пола, образа жизни индивида, употребления им лекарств, присутствия у него других заболеваний и т.д. Таким образом, результаты, основанные на исследованиях клеточных линий, можно рассматривать лишь как ориентировочные. Показано также, что ЛОС, выделенные из воздуха, выдыхаемого пациентами, могут быть полезны в качестве маркеров ГК (Qin et al., 2010).
В наших экспериментах успех собак в поиске больного организма среди здоровых хорошо согласуется с динамикой развития перевитой опухолевой ткани. Гистологические исследования развития опухолевой ткани и ткани здоровой печени (Кочевалина и др., 2014) показали, что в опухолевой ткани на 1-е–2-е сут наблюдается массовая гибель клеток. На 3-и сут небольшие группы опухолевых клеток присутствуют в месте введения в жировой и соединительной подкожной ткани, а на 4-е сут гибель клеток продолжается, но уже присутствуют митозы, в том числе патологические, и наблюдается прорастание в окружающие ткани. Клетки здоровой ткани печени гибнут на 3-и–4-е сут, и далее перевитая ткань представлена клеточным детритом. Похоже, что именно на 3-и сут процессы в эксперименте и контроле достигают наибольшего сходства – иммунная система губит чужеродные клетки, что и отражается на реакции собак. Активизация пролиферации клеток на 4-е сут после перевивки ткани совпадает с возрастанием чувствительности собак к запаху болезни. Можно заключить, что именно этот процесс – источник метаболитов, маркирующих больной организм на этом этапе развития опухоли.
Надо отметить, что не во всех случаях динамика развития опухолевой ткани одинакова. На рис. 1 видно, что у двух мышей на 3-и сут после перевивки масса опухолевой ткани значительно больше, чем у других. Это возможно по двум причинам: либо к 3-м сут осталось еще много перевитой ткани, либо, напротив, отбор новых опухолевых клеток и рост опухоли по каким-то причинам у этих мышей идут активнее, чем у других. На этом же рисунке видны большие различия в дальнейшем изменении массы опухоли у разных мышей. Это согласуется с известным фактом, что глобальные перестройки метаболических путей организма в случае развития каждой опухоли имеют индивидуальные особенности, так как ее пролиферация связана с повреждением некоторых генов и последующим эволюционным развитием, отбором злокачественных клеток (Rozhok, DeGregori, 2016). Исходя из того, что масса опухолевой ткани на 4-е сут после перевивки возрастает незначительно (рис. 1, 2), а число верных выборов собаками проб мочи больного организма в то же время вырастает более чем вдвое, мы считаем, что успешность узнавания собаками “больного” организма связана не с массой опухолевой ткани, а с активностью опухолевой пролиферации. Метаболиты, маркирующие процессы, специфические для роста опухоли, выделяются в мочу, и поскольку методика предъявления запаха гарантирует, что биосенсоры не имеют прямого контакта с источниками запаха, можно заключить, что это ЛОС, которые могут быть потенциальными маркерами начальных этапов развития опухоли.
Многие исследования показывают, что животные способны обнаруживать летучие сигналы, связанные с болезнью (Bijland et al., 2013; Kimball et al., 2013; 2014; Kimball, 2016в). Это подтверждается данными о высокоразвитой системе химической связи животных, которая позволяет им оценивать состояние здоровья конспецификов и менять собственное поведение в соответствии с полученной информацией, в том числе избегать больных (Arakawa et al., 2011).
Механизмы возникновения и выделения спектров ЛОС, “запаха болезни”, мало изучены. Для некоторых заболеваний механизм, лежащий в основе изменения запаха тела, очевиден и очень неспецифичен. Например, болезни, связанные с нарушениями функций кишечника, прежде всего, изменяют запах фекалий (Probert et al., 2009). ЛОС, выделяющиеся в случае микробного заражения организма, исследуются с начала ХIХ в. (Liddell, 1976). Микроорганизмы выделяют свои метаболиты в тело хозяина, и эти летучие вещества выделяются с дыханием, мочой, калом и потом. Клиницистам известны специфические для конкретных инфекций запахи, и профили ЛОС потенциально могут быть использованы в качестве биомаркеров инфекционных заболеваний (Pavlou, Turner, 2000). Например, фекалии больных холерой имеют характерный сладковатый запах. На основе анализа ЛОС в образцах фекалий больных холерой как кандидаты в биомаркеры были идентифицированы диметилдисульфид и терпинеол (Garner et al., 2009).
Один из потенциальных путей, вызывающих изменение запаха выделений во время болезней, это изменение работы иммунной системы. Известно, что вакцинация может вызвать значительное изменение запаха тела и летучие метаболиты могут возникать на разных этапах сложных процессов врожденного или приобретенного иммунитета (Kimball, 2014). В многолетних исследованиях показано, что главный комплекс гистосовместимости (major histocompatibility complex (MHC)) тесно связан с выделяемыми организмом ЛОС (Beauchamp et al., 1985; Beauchamp, Yamazaki, 2005). Исследователи пришли к выводу, что на летучие сигналы, обнаруживаемые обученными животными, могут влиять липазы, цитокины и комплексы комплементарных белков поодиночке или в комплексе. Накопленные данные свидетельствуют, что практически каждое возмущение в организме животного приводит к изменению спектра ЛОС. В экспериментах с животными были описаны изменения запаха мочи, связанные с иммунизацией (Kimball et al., 2014), инфекционными заболеваниями (Kimball et al., 2013), хроническим заболеванием (Kimball et al., 2016б) и повреждением головного мозга (Kimball et al., 2016в). В этих исследованиях есть свидетельства характерных изменений, связанных с различными метаболическими путями в организме, дающими надежду на то, что летучие метаболиты могут специфично маркировать многие заболевания.
Характерный для развития опухоли селективный рост клеток, их пролиферативное преимущество, перепрограммирование энергетического обмена, изменение реакции на стресс, благоприятствующее общей выживаемости клеток, васкуляризация опухоли, инвазия, метастазирование, специфическое опухолевое микроокружение или формирование преметастатических ниш, иммунная модуляция и другие процессы связаны со значительными перестройками метаболизма не только опухолевых клеток, но и клеток иммунной системы, микроокружения опухоли и т.д. (Hanahan, Weinberg, 2011; Fouad, Aanei, 2017). В основе этих процессов лежит нестабильность генома опухолевой клетки, генерирующая генетическое разнообразие клеток (Hanahan, Weinberg, 2011). Все эти особенности связаны с перестройкой метаболизма, что не может не отражаться на составе мочи, составе ее летучих компонентов и, следовательно, запахе (Yamazaki et al., 1999).
Огромное число перестроек метаболизма, сопутствующее даже не очень значительным клеточным событиям в организме, указывает не только на то, что число возможных комбинаций одорантов в моче огромно, но и на то, что вероятность существования уникального летучего вещества, связанного с пролиферацией опухоли, практически исключена. Уникальные ЛОС-маркеры, вероятно, характерны только для бактериальных инфекций. Более того, спектры ЛОС больных и здоровых (контрольных) организмов отличаются, скорее всего, не составом, а соотношениями одних и тех же веществ. Для исследования спектров ЛОС из выделений в настоящее время широко используются факторный анализ, машинное обучение, искусственные нейронные сети. Несмотря на широкие возможности этих методов, они пока не позволяют выявить биомаркеры онкологических заболеваний. Это предполагает, что анализируемые данные пока недостаточно надежны или обширны.
Полученные нами данные позволяют предположить, что собаки способны воспринимать как весь спектр ЛОС, сопутствующий болезни, так и незначительные изменения этого спектра при ее течении. Насколько детально собаки могут анализировать “запах болезни”, еще предстоит узнать, но очевидно, что обоняние животных – полезный инструмент в поиске биомаркеров онкологических заболеваний. Используя “модельных пациентов” – мышей, сопоставляя стадии развития болезни, реакцию собак, гистологический и физиологический анализ процессов, протекающих в организме со спектрами ЛОС, полученных с помощью современных аналитических методов, со временем можно будет предположить, какие метаболические пути ответственны за изменения запаха и диагностический потенциал спектров ЛОС.
Список литературы
Кочевалина М.Ю., Трунов В.Г. Принципы организации базы данных для поведенческих экспериментов с животными-макросматиками // Успехи соврем. науки. 2016. Т. 3. № 4. С. 130–133.
Кочевалина М.Ю., Родионова Е.И., Морозова О.В., Амбарян А.В., Бородков А.С. Исследование одорологического профиля мочи мышей, больных гепатокарциномой // Тр. конф. ИТиС 2014. http:// itas2014.iitp.ru/pdf/1569927987.pdf С. 570–574.
Крутова В.И., Сулимов К.Т., Зинкевич Э.П. Время появления индивидуального запаха в онтогенезе серых крыс (Rattus norvegicus) по данным кинологического анализа // Сенсорн. системы. 1997. Т. 11. № 3. С. 340–345.
Родионова, Е.И., Кочевалина М.Ю., Котенкова Е.В., Морозова О.В., Когунь Г.А., Батаева Е.Л., Амбарян А.В. Распознавание животными-макросматиками летучих органических веществ, связанных с развитием гепатокарциномы: подходы к поиску маркеров онкологических заболеваний // Изв. РАН. Сер. биол. 2015. № 3. С. 293‒301.
Amal H., Ding L., Liu B.B., Tisch U., Xu Z.Q., Shi D.Y., Zhao Y., Chen J., Sun R.X., Liu H., Ye S.L., Tang Z.Y., Haick H. The scent fingerprint of hepatocarcinoma: in-vitro metastasis prediction with volatile organic compounds (VOCs) // Int. J. Nanomedicine. 2012. V. 7. P. 4135‒4146.
Amann A. Breath Analysis for Clinical Diagnosis and Therapeutic Monitoring // Siriraj Med. J. 2012. V. 6. Suppl. 2. P. 18–19.
American Lung Association. Lung cancer fact sheet. American Lung Association http://www. lung. org/lung-health-and-diseases/lung-disease-lookup/lung-cancer/resource-library/lung-cancer-fact-sheet. html (accessed 22 March 2020). 2015.
Arakawa H., Arakawa K., Deak T. Sickness-related odor communication signals as determinants of social behavior in rat: a role for inflammatory processes // Horm. Behav. 2010. V. 57. № 3. P. 330‒341.
Arakawa H., Cruz S., Deak T. From models to mechanisms: odorant communication as a key determinant of social behavior in rodents during illness-associated states // Neurosci. Biobehav. Rev. 2011. V. 35. № 9. P. 1916‒1928.
Beauchamp G.K., Yamazaki K. Individual differences and the chemical senses // Chem. Senses. 2005. V. 30. (suppl.1). P. i6–i9.
Beauchamp G.K., Yamazaki K., Wysocki C.J., Slotnick B.M., Thomas L., Boyse E.A. Chemosensory recognition of mouse major histocompatibility types by another species // Proc. Natl Acad. Sci. USA. 1985. V. 82. P. 4186–4188.
Bekoff M. Observations of scent-marking and discriminating self from others by a domestic dog (Canis familiaris): tales of displaced yellow snow // Behav. Process. 2001. V. 55. № 2. P. 75–79.
Bijland L.R., Bomers M.K., Smulders Y.M. Smelling the diagnosis. A review on the use of scent in diagnosing // Neth. J. Med. 2013. V. 71. P. 300–307.
Boots A.W., van Berkel J.J.B.N., Dallinga J.W., Smolinska A., Wouters M.F.M., van Schooten F.J. The versatile use of exhaled volatile organic compounds in health and disease // J. Breath Res. 2012. V. 6. P. 027108.
Brennan P.A., Kendrick K.M. Mammalian social odours: attraction and individual recognition // Philos. Trans. R. Soc. Lond., B, Biol. Sci. 2006. V. 361. P. 2061–2078.
Chambers S.T., Scott-Thomas A., Epton M. Developments in novel breath tests for bacterial and fungal pulmonary infection // Curr. Opin. Pulm. Med. 2012. V. 18. P. 228–232.
Cicolella A. Volatile organic compounds (VOC): definition, classification and properties // Rev. Mal. Respir. 2008. V. 25. P. 155–163.
Cornu J.N., Cancal-Tassin G., Ondet V., Girardet C., Cussenot O. Olfactory detection of prostate cancer by dogs sniffing urine: A step forward to early diagnosis // Eur. Urol. 2011. V. 59. P. 197–201.
Dummer J., Storer Swanney M., McEwan M., Scott-Thomsad A., Bhandari S., Chambers S., Dweik R., Epton M. Analysis of biogenic volatile organic compounds in health and disease // Trends Anal. Chem. 2011. V. 30. P. 960–967.
Ehman K.D., Scott M.E. Female mice mate preferentially with non-parasitized males // Parasitology. 2002. V. 125. № 5. P. 461–466.
Ehmann R., Boedeker E., Friedrich U., Sagert J., Dippon J., Friedel G., Walles T. Canine scent detection in the diagnosis of lung cancer: revisiting a puzzling phenomenon // Eur. Resp. J. 2011. V. 39. P. 669–676.
El-Serag H.B., Marrero J.A., Rudolph L., Reddy K.R. Diagnosis and treatment of hepatocellular carcinoma // Gastroenterology. 2008. V. 134. P. 1752–1763.
Filipiak W., Sponring A., Mikoviny T., Ager C., Schubert J., Miekisch W., Amann A., Troppmair J. Release of volatile organic compounds (VOCs) from the lung cancer cell line CALU-1 in vitro // Cancer Cell Int. 2008. V. 8. № 1. P. 17–28.
Fouad Y.A., Aanei C. Revisiting the hallmarks of cancer // Am. J. Cancer Res. 2017. V. 7. № 5. P. 1016–1036.
Garner C.E., Smith S., Bardhan P.K., Ratcliffe N.M., Probert C.S. A pilot study of faecal volatile organic compounds in faeces from cholera patients in Bangladesh to determine their utility in disease diagnosis // Trans. R. Soc. Trop. Med. Hyg. 2009. V. 103. № 11. P. 1171–1173.
Garner C.E., Smith S., Costello B., White P., Spencer R., Prober C.S.J., Ratcliffe M. Volatile organic compounds from feces and their potential for diagnosis of gastrointestinal disease // The FASEB Journ. 2007. V. 21. № 8. P. 1675–1688.
Guernion N., Ratcliffe M., Spencer-Phillips P.T., Howe R.A. Identifying bacteria in human urine: current practice and the potential for rapid, near-patient diagnosis by sensing volatile organic compounds // Clin. Chem. Lab. Med. 2001. V. 39. P. 893–906.
Hakim M., Broza Y.Y., Barash O., Peled N., Phillips M., Amann A., Haick H. Volatile organic compounds of lung cancer and possible biochemical pathways // Chem. Rev. 2012. V. 112. P. 5949–5966.
Hanahan D., Weinberg R.A. Hallmarks of cancer: the next generation // Cell. 2011. V.144. № 5. P. 646–674.
Harrington F.H., Asa C.S., Mech L., Boitani L. Wolf communication // Wolves: Behavior, ecology, and conservation. Chicago: Univ. Chicago Press, 2003. V. 3. P. 66–103.
Hartke J., Johnson M., Ghabril M. The diagnosis and treatment of hepatocellular carcinoma // Semin. Diagn. Pathol. 2017. V. 34. P. 153–159.
Horvath I., Lazar Z., Gyulai N., Kollai M., Losonczy G. Exhaled biomarkers in lung cancer // Eur. Respir. J. 2009. V. 34. P. 261–275.
Jett J.R. Limitations of screening for lung cancer with low-dose spiral computed tomography // Clin. Cancer Res. 2005. V. 11. № 13. P. 4988s–4992s.
Johnston R.E. Chemical communication in rodents: from pheromones to individual recognition // J. Mamm. 2003. V. 84. P. 1141–1162.
Kang J., Zhu L., Lu J., Zhang X. Application of metabolomics in autoimmune diseases: insight into biomarkers and pathology // J. Neuroimmunol. 2015. V. 279. P. 25–32.
Kavaliers M., Choleris E., Pfaff D.W. Recognition and avoidance of the odors of parasitized conspecifics and predators: differential genomic correlates // Neurosci. Biobehav. Rev. 2005a. V 29. P. 1347–1359.
Kavaliers M., Choleris E., Agmo A., Muglia L.J., Ogawa S., Pfaff D.W. Involvement of the oxytocin gene in the recognition and avoidance of parasitized males by female mice // Anim. Behav. 2005б. V. 70. P. 693–702.
Keller M., Douhard Q., Baum M.J., Bakker J. Destruction of the main olfactory epithelium reduces female sexual behavior and olfactory investigation in female mice // Chem. Senses. 2006a. V. 31. P. 315–323.
Keller M., Pierman S., Douhard Q., Baum M.J., Bakker J. The vomeronasal organ is required for the expression of lordosis behaviour, but not sex discrimination in female mice // Eur. J. Neurosci. 2006b. V. 23. P. 521–530.
Kelliher KR. The combined role of the main olfactory and vomeronasal systems in social communication in mammals // Horm. Behav. 2007. V. 52. P. 561–570.
Kimball B.A. Volatile metabolome: problems and prospects // Bioanalysis. 2016a. V. 8. № 19. P. 1987–1991.
Kimball B.A., Wilson D.A., Wesson D.W. Alterations of the volatile metabolome in mouse models of Alzheimer’s disease // Sci. Rep. 2016б. V. 14. № 6. P. 19495.
Kimball B.A., Opiekun M., Yamazaki K., Beauchamp G.K. Immunization alters body odor // Physiol. Behav. 2014. V. 128. P. 80–85.
Kimball B.A., Yamazaki K., Kohler D., Bowen R.A., Muth J.P., Opiekun M., Beauchamp G.K. Avian influenza infection alters fecal odor in mallards // PLoS ONE. 2013. V. 8. № 10. P. e75411.
Kimball B.A., Cohen A.S., Gordon A.R., Opiekun M., Martin T., Elkind J., Lundström J.N., Beauchamp G.K. Brain injury alters volatile metabolome // Chem. Senses. 2016в. V. 41. № 5. P. 407– 414.
Lazarevich N.L., Cheremnova O.A., Varga E.V., Ovchinnikov D.A., Kudrjavtseva E.I., Morozova O.V., Fleishman D.I., Engelhardt N.V., Duncan S.A. Progression of HCC in mice is associated with a downregulation in the expression of hepatocyte nuclear factors // Hepatology. 2004. V. 39. P. 1038–1047.
Liddell K. Smell as a diagnostic marker // Postgrad. Med. J. 1976. V. 52. № 605. P. 136–138.
Lubes G., Goodarzi M. GC-MS based metabolomics used for the identifcation of cancer volatile organic compounds biomarkers // J. Pharm. Biomed. Anal. 2017. V. 147. P. 313–322.
Ludwig J.A., Weinstein J.N. Biomarkers in cancer staging, prognosis and treatment selection // Nat. Rev. Cancer. 2005. V. 5. № 11. P. 845–856.
Masuda T., Miyoshi E. Cancer biomarkers for hepatocellular carcinomas: from traditional markers to recent topics // Clin. Chem. Lab. Med. 2011. V. 49. № 6. P. 959–966.
Matsumura K., Opiekun M., Oka H., Vachani A., Albelda S.M., Yamazaki K., Beauchamp G.K. Urinary volatile compounds as biomarkers for lung cancer: a proof of principle study using odor signatures in mouse models of lung cancer // PLoS One. 2010. V. 5. № 1. P. e8819.
Mazzone P.J. Analysis of volatile organic compounds in the exhaled breath for the diagnosis of lung cancer // J. Thorac. Oncol. 2008. V. 3. P. 774– 780.
Miekisch W., Schubert J.K., Gabriele F.E., Noelge-Schomburg G.F.E. Diagnostic potential of breath analysis–focus on volatile organic compounds // Clin. Chim. Acta. 2004. V. 347. P. 25–39.
Minino A.M., Kochanek K.D. Deaths: Preliminary Data for 2008 // Natl Vital Stat Rep. 2010. V. 59. P. 1–72.
Moser E., McCulloch M. Canine scent detection of human cancers: a review of methods and accuracy // J. Vet. Behav. Clin. Appl. Res. 2010. V. 5. P. 145–152.
Novak B.J., Blake D.R., Meinardi S., Rowland F.S., Pontello A., Cooper D.M., Galassetti P.R. Exhaled methyl nitrate as a noninvasive marker of hyperglycemia in type 1 diabetes // Proc. Natl Acad. Sci. USA. 2007. V. 104. P. 15613–15618.
Novotny M., Harvey S., Jemiolo B., Alberts J. Synthetic pheromones that promote inter-male aggression in mice. // Proc. Natl Acad. Sci. USA. 1985. V. 82. P. 2059–2061.
Osada K., Tashiro T., Mori K., Izumi H. The identification of attractive volatiles in aged male mouse urine // Chem. Senses. 2008. V. 33. № 9. P. 815–823.
Osada K., Yamazaki K., Curran M., Bard J., Smith B.P., Beauchamp G.K. The scent of age // Proc. R. Soc. Lond. B. Biol. Sci. 2003. V. 270. № 1518. P. 929–933.
Parkin D.M., Bray F., Ferlay J., Pisani P. Estimating the world cancer burden: Globocan 2000 // Int. J. Cancer. 2001. V. 94. № 2. P. 153–156.
Pavlou A.K., Turner A.P. Sniffing out the truth: clinical diagnosis using the electronic nose // Clin. Chem. Lab. Med. 2000. V. 38. P. 99–112.
Peng G., Hakim M., Broza Y.Y., Billan S., Abdah-Bortnyak R., Kuten A., Tisch U., Haick H. Detection of lung, breast, colorectal, and prostate cancers from exhaled breath using a single array of nanosensors // Br. J. Cancer. 2010. V. 103. P. 542–551.
Penn D., Potts W.K. Chemical signals and parasite-mediated sexual selection // Trends Ecol. Evol. 1998. V. 13. P. 391–396.
Phillips M., Cataneo R.N., Cheema T., Greenberg J. Increased breath biomarkers of oxidative stress in diabetes mellitus // Clin. Chim. Acta. 2004. V. 344. P. 189–194.
Phillips M., Cataneo R.N., Condos R., Ring Erikson G.A., Greenberg J., La Bombardi V., Munawar M.I., Tietje O. Volatile biomarkers of pulmonary tuberculosis in the breath // Tuberculosis. 2007. V. 87. P. 44–52.
Probert C.S., Ahmed I., Khalid T., Johnson E., Smith S., Ratcliffe N. Volatile organic compounds as diagnostic biomarkers in gastrointestinal and liver diseases // J. Gastrointestin. Liver Dis. 2009. V. 18. № 3. P. 337–343.
Qin T., Liu H., Song Q., Song G., Wang H.Z., Pan Y.Y., Xiong F.X., Gu K.S., Sun G.P., Chen Z.D. The screening of volatile markers for hepatocellular carcinoma // Cancer Epidemiol. Biomark. Prev. 2010. V. 19. № 9. P. 2247–2253.
Rozhok A.I., DeGregori J. The evolution of lifespan and age-dependent cancer risk // Trends Cancer. 2016. V. 2. № 10. P. 552–560.
Sato T., Katsuoka Y., Yoneda K., Nonomura M., Uchimoto S., Kobayakawa R., Kobayakawa K., Mizutani Y. Sniffer mice discriminate urine odours of patients with bladder cancer: A proof-of-principle study for non-invasive diagnosis of cancer-induced odour // Sci. Rep. 2017. V. 7. № 1. P. 14628.
Schaal B., Coureaud G., Langlois D., Ginies C., Semon E., Perrier G. Chemical and behavioural characterization of the rabbit mammary pheromone // Nature. 2003. V. 424. P. 68–72.
Schaefer M.L., Yamazaki K., Osada K., Restrepo D., Beauchamp G.K. Olfactory fingerprints for major histocompatibility complex-determined body odors II: relationship among odor maps, genetics, odor composition, and behavior. // J. Neurosci. 2002. V. 22. P. 9513–9521.
Schellinck H.M., West A.M., Brown R.E. Rats can discriminate between the urine odors of genetically identical mice maintained on different diets // Physiol. Behav. 1992. V. 51. № 5. P. 1079–1082.
Schmidt K., Podmore I. Current challenges in volatile organic compounds analysis as potential biomarkers of cancer // J. Biomark. 2015. V. 2015. Art. ID 981458.
Schoon G.A.A. Scent identification lineups by dogs (Canis familiaris): experimental design and forensic application // Appl. Anim. Behav. Sci. 1996. V. 49. P. 257–267.
Shirasu M., Touhara K. The scent of disease: volatile organic compounds of the human body related to disease and disorders // J. Biochem. 2011. V. 150. P. 257–266.
Strauch M., Lüdke A., Münch D., Laudes T., Galizia C.G., Martinelli E., Lavra L., Paolesse R., Ulivieri A., Catini A., Capuano R. More than apples and oranges - detecting cancer with a fruit fly’s antenna // Sci. Rep. 2014. V. 4. P. 3576.
Syhre M., Manning L., Phuanukoonnon S., Harino P., Chambers S.T. The scent of Mycobacterium tuberculosis – part II breath // Tuberculosis. 2009. V. 89. № 4. P. 263–266.
Trinchet J.C., Alperovitch A., Bedossa P., Degos F., Hainaut P., Beers B.V. Epidemiology, prevention, screening and diagnosis of hepatocellular carcinoma // Bull. Cancer. 2009. V. 96. P. 35–43.
Wells M.C., Bekoff M. An observational study of scent-marking in coyotes, Canis latrans // Anim. Behav. 1981. V 29. № 2. P. 332–350.
Willis C., Poulin R. Preference of female rats for the odours of non-parasitised males: the smell of good genes? // Folia Parasitol. 2000. V. 47. № 1. P. 6–10.
Yamazaki K., Beauchamp G.K., Singer A., Bard J., Boyse E.A. Odortypes: their origin and composition // Proc. Natl Acad. Sci. USA. 1999. V. 96. P. 1522–1525.
Yamazaki K., Boyse E.A., Bard J., Curran M., Kim D., Ross S.R., Beauchamp G.K. Presence of mouse mammary tumor virus specifically alters the body odor of mice // Proc. Natl Acad. Sci. USA. 2002. V. 99. № 8. P. 5612–5615.
Zlotta A.R., Nam R.K. To biopsy or not to biopsy ‒ thou shall think twice // Eur. Urol. 2012. V. 61. № 6. P. 1115–1117.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая