Известия РАН. Серия биологическая, 2020, № 5, стр. 461-472
Миогенные потенции мезенхимных стромальных клеток и их влияние на регенерацию скелетных мышц
О. Н. Шевелева 1, О. В. Паюшина 2, *, Н. Н. Буторина 1, Е. И. Домарацкая 1
1 Институт биологии развития им. Н.К. Кольцова РАН
119134 Москва, ул. Вавилова, 26,Россия
2 Первый МГМУ им. И.М. Сеченова Минздрава России
119991 Москва, ул. Трубецкая, 8, стр. 1, Россия
* E-mail: payushina@mail.ru
Поступила в редакцию 20.09.2018
После доработки 26.04.2019
Принята к публикации 31.01.2020
Аннотация
Проанализировано участие мезенхимных стромальных клеток (МСК) в регенерации мышечной ткани. Показано, что МСК костного мозга крысы не проявляют потенций к миогенной дифференцировке in vitro под влиянием соответствующих индукторов и крайне редко сливаются с миобластами при совместном культивировании, однако выделяемые ими факторы стимулируют дифференцировку миогенных клеток. Отмечено, что in vivo при совместной трансплантации с измельченной мышечной тканью МСК усиливают миогенез и ангиогенез, а при введении в травмированную мышцу улучшают течение восстановительного процесса, как и кондиционированная ими среда. Установлен паракринный механизм влияния МСК на регенерацию скелетных мышц.
Мезенхимные стромальные клетки (МСК) как универсальные регуляторы тканевого гомеостаза представляют собой перспективный материал для регенеративной медицины, в частности для восстановления скелетных мышц после повреждения. Хотя восстановление скелетных мышц обеспечивается в основном клетками-сателлитами (покоящейся тканеспецифической популяцией клеток), в регенерации также участвуют МСК, как резидентные, так и выходящие из костного мозга в кровоток с последующей миграцией в поврежденную ткань под влиянием хемоаттрактантов (Ramírez et al., 2006; Granero-Moltó et al., 2009; Liu et al., 2009; Chen et al., 2010; Fong et al., 2011). Полученные в последние годы экспериментальные данные свидетельствуют о том, что стимуляция мышечной регенерации может быть достигнута с помощью введения МСК в область повреждения (Natsu et al., 2004; Winkler et al., 2012; Andrade et al., 2015).
В настоящее время рассматриваются три возможных механизма участия МСК в регенерации скелетных мышц: дифференцировка в миогенном направлении, слияние с миобластами и паракринное влияние на миогенез. При культивировании в присутствии некоторых индукторов, в частности 5-азацитидина (Krupnick et al., 2004), стероидных гормонов (Gang et al., 2004), галектина-1 (Chan et al., 2006), МСК могут приобретать признаки дифференцировки в скелетные мышцы – экспрессировать специфические маркеры MyoD (Abcam, Великобритания) и миогенин и сливаться в многоядерные миотубы, содержащие десмин и миозин. Впрочем, способность МСК к миогенной дифференцировке в ответ на те или иные индукторы подтверждается не всеми авторами и, видимо, неодинакова для клеток из разных органов и на разных стадиях онтогенеза (Liu et al., 2003; Gang et al., 2004; Balana et al., 2006; Chan et al., 2006). Результаты исследований возможного участия МСК в регенерации путем слияния с миогенными клетками также противоречивы (Shi et al., 2004; Sassoli et al., 2012; Kulesza et al., 2016). Вместе с тем положительное действие МСК на восстановление мышечной ткани может быть обусловлено их паракринной функцией – продукцией множества биологически активных факторов широкого спектра действия (Sassoli et al., 2012).
Цель работы – исследование возможности непосредственной дифференцировки МСК в миогенные клетки, а также их паракринного влияния на миогенез.
МАТЕРИАЛЫ И МЕТОДЫ
Были использованы половозрелые самцы и самки крыс Wistar массой 200–250 г, полученные из питомника лабораторных животных «Столбовая» (Московская обл.), а также их 20-суточные плоды и 9–10-суточные детеныши.
Выделение и культивирование МСК и фетальных фибробластов. МСК получали из костного мозга половозрелых крыс, который выделяли из бедренных и большеберцовых костей, промывая диафизы средой α‑MEM (HyClone, США). Фетальные фибробласты выделяли из кожи 20-суточных плодов путем обработки тканевых фрагментов 0.075%-ным раствором коллагеназы I типа (Sigma, США) в течение 30 мин при 37°С. Клетки костного мозга и фетальной кожи культивировали в пластиковых флаконах площадью 75 см2 (Greiner, Германия) при 37°С и 5% CO2 в среде α‑MEM с 10% фетальной телячьей сыворотки (ФТС) с добавлением L-глутамина, антибиотика-антимикотика, пенициллина и стрептомицина (HyClone). Пассирование проводили по достижении конфлюэнтного монослоя, снимая клетки 0.25%-ным раствором трипсина с этилендиаминтетраацетатом (HyClone) и пересевая их в соотношении 1 : 2.
Индукция миогенной дифференцировки МСК. Дифференцировку МСК костного мозга индуцировали на втором пассаже. В связи с отсутствием общепринятого протокола индукции миогенеза и неоднозначности имеющихся в литературе данных о способности МСК к дифференцировке в этом направлении (Liu et al., 2003; Gang et al., 2004; Balana et al., 2006; Chan et al., 2006) была оценена эффективность трех различных вариантов индукции. Клетки рассеивали в 12-луночные платы (Greiner) с плотностью 1 × 104 кл./мл в индукционные среды (три варианта).
Вариант I. Среда Игла, модифицированная Дульбекко (Dulbecco modified Eagle medium (DMEM)), + 20% ФТС + 10 мкМ 5-азацитидина (Sigma); контроль – DMEM + 20% ФТС. Спустя 2 сут среду сменяли на DMEM c 10% лошадиной сыворотки (HyClone), после чего продолжали культивирование с периодической сменой этой новой среды.
Вариант II. DMEM + 2% ФТС + 3 мкМ 5-азацитидина + 10 нг/мл эпидермального фактора роста (EGF) + 10 нг/мл основного фактора роста фибробластов (bFGF) + 1% добавки ITS + 1 + 50 мкг/мл 2‑фосфо-L-аскорбата натрия (Sigma); контроль – среда того же состава без 5-азацитидина. Спустя 4 сут как в опытной, так и в контрольной культурах среду заменяли той же без 5-азацитидина и продолжали культивирование с периодической сменой этой новой среды.
Вариант III. DMEM + 10% ФТС + 0.1 мкМ дексаметазона + 50 мкМ гидрокортизона (Sigma); контроль – DMEM с 10% ФТС. Спустя 4 сут в опытной культуре среду сменяли на DMEM + 5% лошадиной сыворотки + 0.1 мкМ дексаметазона + + 50 мкМ гидрокортизона, а в контрольной культуре – на DMEM с 5% лошадиной сыворотки. Дальнейшее культивирование проводили с периодической сменой этих новых сред.
Во всех вариантах культивирование продолжали в течение 14–28 сут со сменой среды дважды в неделю, после чего культуры фиксировали для морфологического и иммуноцитохимического исследования.
Трансфекция МСК геном зеленого флуоресцентного белка (GFP). Мечение МСК проводили путем аденовирусной инфекции на втором пассаже после образования клеточного монослоя. Вирусные частицы, несущие ген GFP, были сконструированы в лаборатории молекулярной иммунологии Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН на основе системы Ad.MAX (SignaGen Laboratories, США), включающей в себя шатл-вектор DC311, несущий ген GFP, и геномную плазмиду pBHGloxΔE13Cre. Культуру клеток 293 (эпителиальные клетки почки эмбриона человека) дважды заражали сконструированными вирусными частицами для наращивания их количества, после чего замораживали и размораживали для лизирования клеток. Вирусные частицы отделяли от клеточного детрита центрифугированием. Во флаконы с культурой МСК после удаления среды вносили 0.5 мл суспензии вируса и 1.5 мл α−МЕМ с 10% ФТС; спустя 2 ч добавляли свежую культуральную среду. Смену среды проводили через 1–3 сут. Эффективность трансфекции оценивали путем прижизненного наблюдения флуоресценции GFP в инвертированный микроскоп. В экспериментах использовали культуры, содержащие не менее 50% флуоресцирующих клеток, через 4–5 сут после трансфекции.
Совместное культивирование МСК с клетками мышц. Клетки из мышц 9–10-суточных детенышей крыс выделяли путем обработки 0.2%-ным раствором коллагеназы I типа в течение 30 мин при 37°С. Свежевыделенные клетки мышц сокультивировали с МСК костного мозга в 12-луночных платах в среде DMEM с 10% ФТС. Использовали три варианта совместного культивирования:
для оценки способности МСК к миогенной дифференцировке под влиянием факторов, продуцируемых миобластами, МСК после первого пассажа помещали на дно платы (1 × 104 клеток на лунку), а клетки мышц (1 × 105 клеток на лунку) – на поверхность мембранных вкладышей с размером пор 0.4 мкм (Becton Dickinson, США). Контролем служили МСК, культивируемые в отсутствие клеток мышц. Длительность культивирования составляла 21 сут;
для оценки паракринного влияния МСК на миогенез in vitro на дно платы, предварительно покрытое фибронектином из плазмы крови человека (Паюшина и др., 2010), помещали клетки мышц (1 × 105 клеток на лунку), на поверхность мембранного вкладыша – МСК, прошедшие 1 пассаж (1 × 104 клеток на лунку). Клетки мышц, культивируемые на фибронектиновом покрытии в отсутствие МСК, служили контролем. Длительность культивирования – 10 сут;
для оценки способности МСК к слиянию с миобластами в каждую лунку покрытой фибронектином платы помещали 1 × 104 меченных GFP клеток костного мозга и 1 × 105 клеток мышц и культивировали в течение 13 сут.
Подкожная трансплантация мышечной ткани. Для исследования влияния МСК на миогенез in vivo использовали экспериментальную модель эктопической трансплантации измельченных мышц, разработанную Студитским (Студитский, 1977). Мышечную ткань задних конечностей крысы измельчали и смешивали с суспензией МСК второго пассажа (меченных GFP или немеченых). На спине половозрелых крыс под хлоралгидратным наркозом формировали два подкожных кармана, в один из которых помещали мышечную ткань, смешанную с МСК (7 × 105–1.6 × 106 клеток на каждого реципиента), в другой – только мышечную ткань. На разрез кожи накладывали швы. Спустя 5 сут животных выводили из эксперимента. Было проанализировано пять животных с введением МСК, меченных GFP, и пять животных с введением немеченых МСК.
Введение клеток и кондиционированных сред в область мышечной травмы. Механическое повреждение наносили половозрелым крысам под хлоралгидратным наркозом путем глубокого поперечного разреза краниальной большеберцовой мышцы с последующим наложением швов на кожную рану. Для оценки регенеративного потенциала МСК на разных сроках раневого процесса одним группам животных инъецировали в область повреждения 1 × 106 МСК второго пассажа в 100 мкл среды DMEM непосредственно после операции, другим группам – спустя 4 сут после нее. Контролем служило введение 100 мкл среды DMEM без клеток либо 1 × 106 фетальных кожных фибробластов второго пассажа в 100 мкл DMEM. Аналогичным образом в мышцы непосредственно после их повреждения инъецировали 100 мкл среды, кондиционированной МСК второго пассажа. В качестве контроля в мышцы вводили тот же объем DMEM с 10% ФТС либо среды, кондиционированной фетальными кожными фибробластами второго пассажа. Часть экспериментальных животных получали четыре повторные инъекции 100 мкл кондиционированной МСК или контрольной среды через 3, 5, 7 и 10 сут после травмы. В ряде опытов кондиционированную МСК среду и контрольную среду (DMEM с 10% ФТС) перед введением в мышцы концентрировали путем лиофилизации с последующим разведением в 1/20 первоначального объема. Животных выводили из эксперимента через 5 или 14 сут после нанесения травмы. Каждая экспериментальная группа включала в себя по пять крыс.
Анализ результатов. Для морфологического исследования культуры клеток фиксировали 96%-ным этанолом и окрашивали азур-эозином. Иммуноцитохимическое окрашивание проводили на культурах, фиксированных 10%-ным формалином, непрямым методом с использованием моноклональных антител к мышечному маркеру MyoD (Abcam) и вторых антител с флуорохромом Alexa Fluor 488 (Invitrogen, США). Ядра клеток докрашивали Hoechst 33342 (Sigma). Регенерирующие мышцы и подкожные трансплантаты фиксировали 10%-ным формалином, предварительно выдержав 30 мин в физиологическом растворе, приготавливали парафиновые срезы и окрашивали их гематоксилин-эозином либо методом Маллори согласно протоколу производителя (Bio-Optica, Италия). Площадь областей воспаления и фиброза измеряли на микрофотографиях поперечных срезов исследуемой мышцы с помощью программы ImageJ и выражали в процентах общей площади среза. Эффективность ангиогенеза оценивали путем подсчета сосудов на 1 мм2 площади среза. Были проанализированы по три среза с каждой поврежденной мышцы и определены средние значения оцениваемых показателей. Количественные данные обрабатывали статистически с использованием таблиц Стрелкова (Стрелков, 1999); достоверность различий оценивали по критерию Манна–Уитни.
Этические стандарты. Перед проведением хирургических операций животных наркотизировали с помощью внутрибрюшинной инъекции хлоралгидрата в дозе 400 мг/кг. Выведение животных из эксперимента осуществляли путем передозировки хлороформа. Эксперименты осуществляли с соблюдением Правил проведения работ с использованием экспериментальных животных. Все протоколы и манипуляции с животными были одобрены комиссией по биоэтике ИБР РАН им. Н.К. Кольцова в соответствии с правилами лабораторной практики в Российской Федерации (Приказ МЗ РФ от 19.06.2003 г. № 267).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
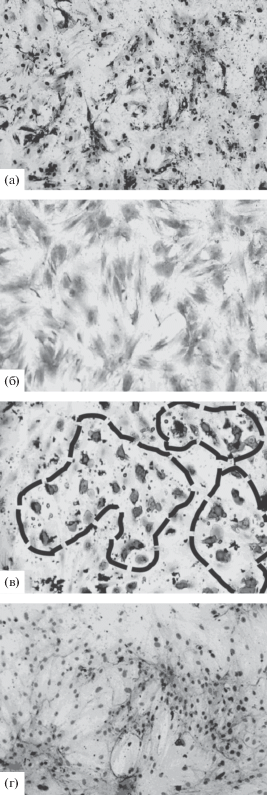
Миогенные потенции МСК и их способность к слиянию с миобластами in vitro. При культивировании МСК в присутствии веществ, известных как индукторы миогенеза (дексаметазона и 5-азацитидина), миогенный маркер MyoD в них не обнаруживался, а образования миотуб не происходило (рис. 1а, б). В отдельных случаях в среде с 5-азацитидином отмечалась дифференцировка МСК в адипогенном направлении (рис. 1в). Полученные нами данные согласуются с результатами других авторов, которым не удалось вызвать миогенную дифференцировку МСК с помощью 5-азацитидина (Liu et al., 2003; Martin-Rendon et al., 2008). Известно, что в качестве индукторов миогенеза могут выступать факторы, секретируемые в среду миобластами (Salvatori et al., 1995; Wise et al., 1996), причем в ряде случаев они вызывают миогенную дифференцировку МСК более эффективно, чем 5-азацитидин (Chan et al., 2006). Однако мы не обнаружили морфологических или иммуноцитохимических признаков дифференцировки МСК, сокультивируемых с клетками из мышц через полупроницаемую мембрану (рис. 1г). Полученные результаты свидетельствуют об отсутствии у МСК костного мозга крысы выраженных потенций к миогенезу.
Рис. 1.
МСК не дифференцируются in vitro в миогенном направлении. Культивирование МСК в присутствии 0.1 мкМ дексаметазона (а), 10 мкМ 5-азацитидина (б), 3 мкМ 5-азацитидина (штрихами обведены очаги адипогенеза) (в), клеток из мышц в системе непрямого сокультивирования (г). а, б, г – окраска гематоксилин-эозином, в – окраска жировым красным О, ядра докрашены гематоксилином. Ув.: об. ×20, ок. ×10.
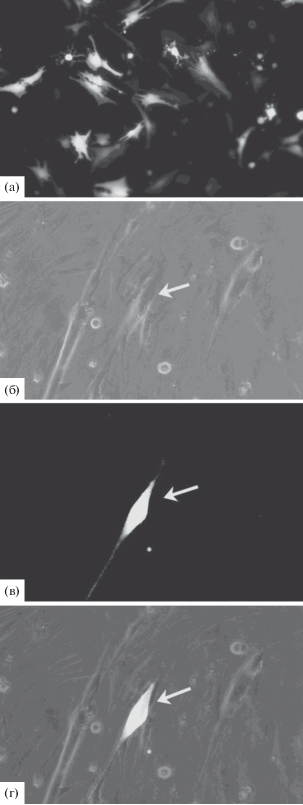
При прямом сокультивировании меченных GFP МСК с клетками, выделенными из мышц, лишь в одном случае мы наблюдали образование меченой миотубы в результате слияния МСК с миобластами (рис. 2). Отсутствие или малочисленность случаев слияния МСК с дифференцирующимися in vitro либо in vivo миогенными клетками отмечались и другими авторами (Natsu et al., 2004; Motohashi et al., 2008; Sassoli et al., 2012), хотя сообщалось также и о том, что при совместном культивировании меченных GFP МСК с миобластами линии C2C12 в присутствии индукторов миогенеза частота формирования гибридных миотуб составляла 38 случаев на 1000 клеток (Shi et al., 2004).
Рис. 2.
Совместное культивирование меченных GFP МСК и миобластов. а – культура МСК, меченных GFP; б–г – совместная культура миобластов и меченых МСК (гибридная миотуба отмечена стрелкой). а, в – флуоресцентная микроскопия, б – фазовый контраст, г – совмещение. Ув.: а – об. ×20, ок. ×10, б–г – об. ×10, ок. ×10.
Можно предположить, что низкая частота трансдифференцировки МСК или их слияния с клетками реципиента характерна для неповрежденной ткани. При повреждении скелетных мышц или при облучении, вызывающем гибель сателлитных клеток, МСК способны занимать нишу последних и вступать на путь миогенной дифференцировки (LaBarge, Blau, 2002; Dreyfus et al., 2004). Есть данные и о слиянии МСК с миогенными клетками в мышцах, регенерирующих после химического повреждения (Shi et al., 2004; de la Garza-Rodea et al., 2012). Таким образом, полученные нами данные не позволяют полностью исключить возможность участия МСК в регенерации мышечной ткани путем дифференцировки или слияния.
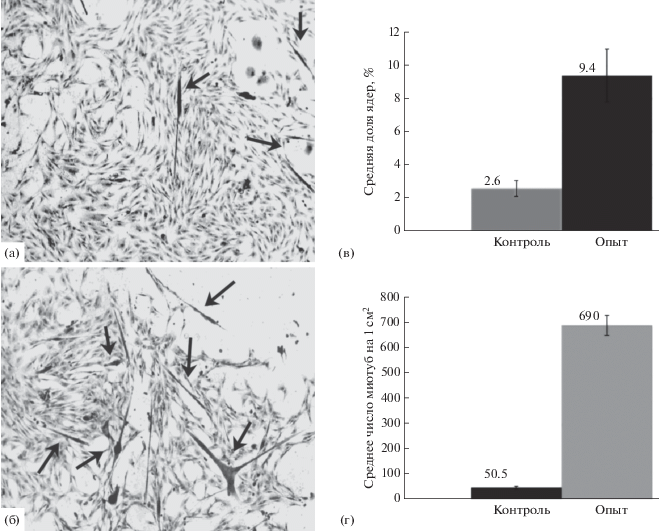
Регуляторное влияние МСК на миогенез in vitro. В системе непрямого сокультивирования, когда МСК были помещены на поверхность вкладышей, а эффекторными клетками оказывались мышечные, наблюдалась активация миогенеза, что выражалось в увеличении числа миотуб, а также отношения среднего числа ядер в их составе к общему числу ядер в поле зрения (рис. 3а–в). Многократное возрастание числа формирующихся миотуб было отмечено также при культивировании клеток из мышечной ткани в среде, кондиционированной МСК (рис. 3г). Поскольку в этих экспериментах мышечные клетки с МСК не контактировали, очевидно, что стимуляция образования миотуб происходила за счет секретируемых МСК факторов, т.е. посредством паракринного влияния МСК на дифференцировку и слияние мышечных клеток.
Рис. 3.
Влияние секреторных продуктов МСК на дифференцировку миобластов. а – культура клеток мышц в отсутствие МСК; б – клетки мышц при непрямом сокультивировании с МСК. Миотубы показаны стрелками. Окраска гематоксилин-эозином; ув.: об. ×10, ок. ×10; в – доля ядер миотуб в общем числе ядер при непрямом сокультивировании МСК с клетками мышц (контроль – культивирование без МСК, опыт – сокультивирование с МСК); г – число миотуб на 1 см2 при культивировании клеток мышц в среде, кондиционированной МСК (контроль – среда DMEM, опыт – кондиционированная среда).
Влияние МСК на миогенез in vivo при подкожной трансплантации мышечной ткани. Влияние МСК на ранние стадии миогенеза было исследовано на модели подкожного введения клеток из разрушенных мышц совместно с суспензией МСК. При трансплантации измельченной мышечной ткани и МСК, меченных GFP, спустя 5 сут после операции в трансплантате обнаруживались флуоресцирующие клетки, расположенные главным образом вблизи фрагментов мышечных волокон или прилежащих к их поверхности, но не сливающиеся с миобластами (рис. 4а, б). Добавление МСК к трансплантируемой ткани приводило к активации миогенеза, что выражалось в большем числе и размере вновь образованных миотуб по сравнению с контрольными образцами (трансплантация измельченных мышц без введения МСК) (рис. 4в, г) и в более раннем их образовании (на 2 сут раньше, чем в контроле). Процесс ангиогенеза также усиливался: числа кровеносных сосудов при введении МСК и в контроле составляли соответственно 6.3 ± 1.1 и 2.1 ± 0.2 на 1 мм2 площади (различия достоверны при p < 0.01). Таким образом, добавление МСК к трансплантируемым миогенным клеткам стимулировало ранние стадии восстановительного процесса.
Рис. 4.
Трансплантация измельченных мышц под кожу крыс через 5 сут после операции. а – меченные GFP МСК в трансплантате; б – то же поле зрения, ядра клеток, окрашенные Hoechst 33342; в – контроль (трансплантация измельченных мышц); г – опыт (трансплантация измельченных мышц с добавлением МСК). Миотубы показаны стрелками. а, б – флуоресцентная микроскопия, в, г – окраска методом Маллори. Ув.: а, б – об. ×20, ок. ×10; в, г – об. ×10, ок. ×10.

Влияние МСК на регенерацию механически поврежденных мышц. Для оценки влияния МСК на регенерацию скелетных мышц была также использована модель механического повреждения мышц путем глубокого разреза, позволяющая анализировать состояние ткани не только в ранние сроки после повреждения (5 сут), но и в более поздние (14 сут). МСК инъецировали в область травмы; контролем служило введение фибробластов фетальной кожи или культуральной среды. Гистологический анализ состояния мышц через 5 сут после повреждения показал, что МСК, введенные непосредственно после травмы, не влияли на раннюю стадию регенерации: как в контрольных, так и в опытных образцах наблюдались обширные зоны разрушения мышечной ткани и выраженное воспаление (рис. 5а, б).
Рис. 5.
Поврежденные мышцы после введения МСК. а – контроль (DMEM), 5 сут после травмы; б – МСК, 5 сут после травмы; в – контроль (DMEM), 14 сут после травмы; г – МСК, 14 сут после травмы; д – отложенное (через 4 сут) введение DMEM, 14 сут после травмы; е – отложенное (через 4 сут) введение МСК, 14 сут после травмы. Фиброзная ткань показана стрелками. Окраска гематоксилин-эозином. Ув.: а, б, г, д, е – об. ×10, ок. ×10; в – об. ×20, ок. ×10.
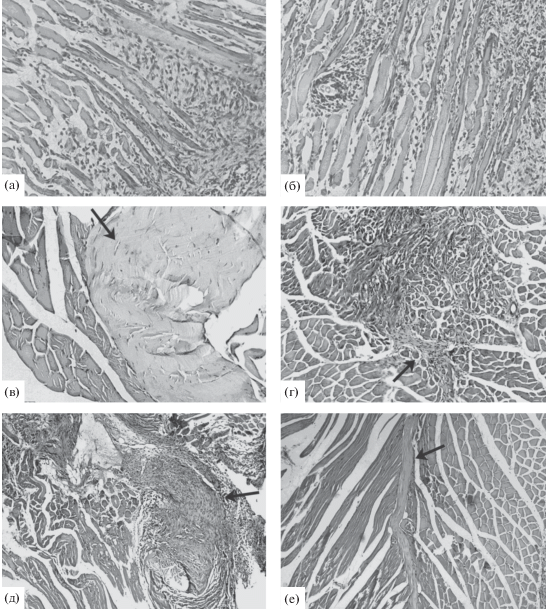
Через 14 сут после повреждения регенерация как в контроле (рис. 5в), так и в опыте (рис. 5г) была еще не завершена. При этом если при введении в мышцу культуральной среды или кожных фибробластов на месте повреждения в 80–100% случаев формировался соединительно-тканный рубец, то при введении МСК частота его образования составляла ~50%. В то же время площадь фиброзной ткани после введения МСК была сопоставима с таковой в контроле (табл. 1 ). Другие авторы, сообщавшие о существенном улучшении функциональной способности поврежденных мышц после введения МСК, связанном с увеличением численности и степени зрелости мышечных волокон, не обнаруживали при этом уменьшения признаков фиброгенеза (Natsu et al., 2004; Andrade et al., 2015). Введение МСК в наших экспериментах не приводило к существенному уменьшению площади зоны воспаления по сравнению с контролем (введение среды), хотя, как известно, МСК способны подавлять провоспалительные макрофаги М1 и активировать антивоспалительные макрофаги М2 (Le Blanc, Mougiakakos, 2012 ; Abumaree et al., 2013). При введении кожных фибробластов область воспаления увеличивалась по сравнению с контрольными мышцами, в которые была введена среда, и регенерация задерживалась на макрофагальной стадии. Не исключено, что это было обусловлено секрецией фибробластами провоспалительных цитокинов интерлейкина-6 и интерлейкина-8 (Vistejnova et al., 2014). Следует отметить, что при введении фибробластов большинство мышечных волокон оставались незрелыми, что свидетельствует о замедлении их формирования. Введение МСК, напротив, способствовало формированию более зрелых мышечных волокон и увеличению числа сосудов в регенерирующей ткани (рис. 6а).
Таблица 1.
Влияние МСК на регенерацию мышц после механического повреждения
| Срок введения | Введенные клетки | Площадь воспаления, % общей площади | Площадь фиброза, % общей площади |
|---|---|---|---|
| Непосредственно после травмы | Контроль (DMEM) | 5.16 ± 1.55 | 3.31 ± 0.84 |
| Фибробласты | 9.35 ± 1.70** | 1.61 ± 0.36** | |
| МСК | 3.89 ± 1.25 | 2.48 ± 1.04 | |
| Через 4 сут после травмы | Контроль (DMEM) | 7.92 ± 2.49 | 3.28 ± 1.28 |
| Фибробласты | 8.32 ± 2.30 | 2.42 ± 1.20 | |
| МСК | 0.70 ± 0.59* | 0.69 ± 0.56** |
Рис. 6.
Среднее число сосудов на 1 мм2 площади поврежденной мышцы через 14 сут после введения клеток (а) и кондиционированной среды (б). КСконтр – DMEM с 10% ФТС; КСопыт – среда, кондиционированная МСК; КСлиоф. контр и КСлиоф. опыт – соответственно контрольная и кондиционированная МСК среда, сконцентрированная лиофилизацией. Достоверность различий: * – p < 0.01, ** – p < 0.05.
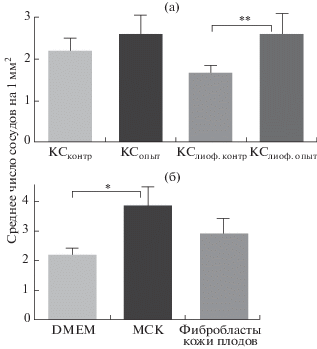
В случае когда МСК вводили в мышцу через 4 сут после повреждения, наблюдали уменьшение площади фиброзной ткани и зоны воспаления по сравнению с контролем (введение среды) (рис. 5д, е), тогда как инъекция кожных фибробластов эффекта не оказывала.
Однократное введение среды, кондиционированной МСК, не оказывало существенного влияния на регенерацию мышц, как и введение среды, кондиционированной кожными фибробластами. Однако при ее многократном введении площадь областей воспаления уменьшалась приблизительно в 3 раза по сравнению с контролем (табл. 2). Предварительные эксперименты по введению кондиционированной МСК среды, концентрация которой была повышена путем лиофилизации, показали, что оно приводит к более активному по сравнению с контролем образованию сосудов (рис. 6б). Полученные результаты свидетельствуют о том, что противовоспалительное и ангиогенное действие МСК в ходе регенерации связано с продуцируемыми ими регуляторными молекулами; в частности, стимуляция образования кровеносных сосудов может быть обусловлена присутствием в секретоме МСК фактора роста сосудистого эндотелия (VEGF) и ангиопоэтина-1 (Wu et al., 2007).
Таблица 2.
Влияние среды, кондиционированной МСК, на регенерацию мышц после механического повреждения
| Вариант | Источник кондиционированной среды | Площадь воспаления, % общей площади | Площадь фиброза, % общей площади |
|---|---|---|---|
| Однократное введение | Контроль (DMEM) | 6.62 ± 1.50 | 2.92 ± 1.02 |
| Фибробласты | 4.60 ± 1.01 | 3.40 ± 0.84 | |
| МСК | 3.46 ± 0.82 | 1.70 ± 0.39 | |
| Многократное введение | Контроль (DMEM) | 20.10 ± 8.75 | 1.74 ± 0.58 |
| Фибробласты | н/a | н/a | |
| МСК | 6.52 ± 1.35* | 0.80 ± 0.30 |
ЗАКЛЮЧЕНИЕ
Судя по результатам проведенных экспериментов, МСК из костного мозга крысы, по-видимому, не обладают потенциями к миогенной дифференцировке под влиянием индукторов и имеют слабую способность к слиянию с миобластами, однако стимулируют дифференцировку клеток мышечной ткани посредством паракринного влияния. При введении в поврежденную мышцу МСК положительно влияют на ход восстановительного процесса – способствуют уменьшению частоты фиброза (а иногда и его площади), образованию сосудов, формированию зрелых мышечных волокон и в ряде случаев уменьшают площадь зоны воспаления. Очевидно, что благотворное влияние МСК на регенерацию мышечной ткани связано с их паракринной функцией, так как многократное введение кондиционированной ими среды или введение ее после лиофилизации, повышающей концентрацию содержимого, оказывает положительный эффект.
Работа выполнена в рамках раздела Государственного задания ИБР РАН № 0108-2018-0004.
Список литературы
Паюшина О.В., Хныкова О.Н., Буторина Н.Н., Буеверова Э.И., Минин А.А., Старостин В.И. Влияние первичных адгезивных взаимодействий с фибронектином на клональный рост и остеогенные потенции мезенхимных стромальных клеток крысы // Цитология. 2010. Т. 52. № 4. С. 326–333.
Стрелков Р.Б. Таблицы Стрелкова и экспресс-метод статистической обработки данных. М.: ПАИМС, 1999. 96 с.
Студитский А.Н. Трансплантация мышц у животных. М.: Медицина, 1977. 248 с.
Abumaree M.H., Al Jumah M.A., Kalionis B., Jawdat D., Al Khaldi A., Abomaray F.M., Fatani A.S., Chamley L.W., Knawy B.A. Human placental mesenchymal stem cells (pMSCs) play a role as immune suppressive cells by shifting macrophage differentiation from inflammatory M1 to anti-inflammatory M2 macrophages // Stem Cell Rev. 2013. V. 9. № 5. P. 620–641.
Andrade B.M., Baldanza M.R., Ribeiro K.C., Porto A., Peçanha R., Fortes F.S., Zapata-Sudo G., Campos-de-Carvalho A.C., Goldenberg R.C., Werneck-de-Castro J.P. Bone marrow mesenchymal cells improve muscle function in a skeletal muscle re-injury model // PLoS One. 2015. V. 10. № 6. P. e0127561.
Balana A., Nicoletti C., Zahanich I., Graf E.M., Christ T., Boxberger S., Ravens U. 5-Azacytidine induces changes in electrophysiological properties of human mesenchymal stem cells // Cell Res. 2006. V. 16. № 12. P. 949–960.
Chan J., O’Donoghue K., Gavina M., Torrente Y., Kennea N., Mehmet H., Stewart H., Watt D.J., Morgan J.E., Fisk N.M. Galectin-1 induces skeletal muscle differentiation in human fetal mesenchymal stem cells and increases muscle regeneration // Stem Cells. 2006. V. 24. № 8. P. 1879–1891.
Chen Y., Xiang L.X., Shao J.Z., Pan R.L., Wang Y.X., Dong X.J., Zhang G.R. Recruitment of endogenous bone marrow mesenchymal stem cells towards injured liver // J. Cell. Mol. Med. 2010. V. 14. № 6B. P. 1494–1508.
Dreyfus P.A., Chretien F., Chazaud B., Kirova Y., Caramelle P., Garcia L., Butler-Browne G., Gherardi R.K. Adult bone marrow-derived stem cells in muscle connective tissue and satellite cell niches // Am. J. Pathol. 2004. V. 164. № 3. P. 773–779.
Fong E.L., Chan C.K., Goodman S.B. Stem cell homing in musculoskeletal injury // Biomaterials. 2011. V. 32. № 2. P. 395–409.
Gang E.J., Jeong J.A., Hong S.H., Hwang S.H., Kim S.W., Yang I.H., Ahn C., Han H., Kim H. Skeletal myogenic differentiation of mesenchymal stem cells isolated from human umbilical cord blood // Stem Cells. 2004. V. 22. № 4. P. 617–624.
de la Garza-Rodea A.S., van der Velde-van Dijke I., Boersma H., Gonçalves M.A., van Bekkum D.W., de Vries A.A., Knaän-Shanzer S. Myogenic properties of human mesenchymal stem cells derived from three different sources // Cell Transplant. 2012. V. 21. № 1. P. 153–173.
Granero-Moltó F., Weis J.A., Miga M.I., Landis B., Myers T.J., O’Rear L., Longobardi L., Jansen E.D., Mortlock D.P., Spagnoli A. Regenerative effects of transplanted mesenchymal stem cells in fracture healing // Stem Cells. 2009. V. 27. № 8. P. 1887–1898.
Krupnick A.S., Balsara K.R., Kreisel D., Riha M., Gelman A.E., Estives M.S., Amin K.M., Rosengard B.R., Flake A.W. Fetal liver as a source of autologous progenitor cells for perinatal tissue engineering // Tiss. Eng. 2004. V. 10. № 5–6. P. 723–735.
Kulesza A., Burdzinska A., Szczepanska I., Zarychta-Wisniewska W., Pajak B., Bojarczuk K., Dybowski B., Paczek L. The mutual interactions between mesenchymal stem cells and myoblasts in an autologous co-culture model // PLoS One. 2016. V. 11. № 8. P. e0161693.
LaBarge M.A., Blau H.M. Biological progression from adult bone marrow to mononucleate muscle stem cell to multinucleate muscle fiber in response to injury // Cell. 2002. V. 111. № 4. P. 589–601.
Le Blanc K., Mougiakakos D. Multipotent mesenchymal stromal cells and the innate immune system // Nat. Rev. Immunol. 2012. V. 12. № 5. P. 383–396.
Liu Y., Song J., Liu W., Wan Y., Chen X., Hu C. Growth and differentiation of rat bone marrow stromal cells: does 5-azacytidine trigger their cardiomyogenic differentiation? // Cardiovasc. Res. 2003. V. 58. № 2. P. 460–468.
Liu Z.-J., Zhuge Y., Velazquez O.C. Trafficking and differentiation of mesenchymal stem cells // J. Cell. Biochem. 2009. V. 106. № 6. P. 984–991.
Martin-Rendon E., Sweeney D., Lu F., Girdlestone J., Navarrete C., Watt S.M. 5-Azacytidine-treated human mesenchymal stem/progenitor cells derived from umbilical cord, cord blood and bone marrow do not generate cardiomyocytes in vitro at high frequencies // Vox Sang. 2008. V. 95. № 2. P. 137–148.
Motohashi N., Uezumi A., Yada E., Fukada S., Fukushima K., Imaizumi K., Miyagoe-Suzuki Y., Takeda S. Muscle CD31(-)CD45(-) side population cells promote muscle regeneration by stimulating proliferation and migration of myoblasts // Am. J. Pathol. 2008. V. 173. № 3. P. 781–791.
Natsu K., Ochi M., Mochizuki Y., Hachisuka H., Yanada S., Yasunaga Y. Allogeneic bone marrow-derived mesenchymal stromal cells promote the regeneration of injured skeletal muscle without differentiation into myofibers // Tissue Eng. 2004. V. 10. № 7–8. P. 1093–1112.
Ramírez M., Lucia A., Gómez-Gallego F., Esteve-Lanao J., Pérez-Martínez A., Foster C., Andreu A.L., Martin M.A., Madero L., Arenas J., García-Castro J. Mobilization of mesenchymal cells into blood in response to skeletal muscle injury // Br. J. Sports Med. 2006. V. 40. № 8. P. 719–722.
Salvatori G., Lattanzi L., Coletta M., Aguanno S., Vivarelli E., Kelly R., Ferrari G., Harris A.J., Mavilio F., Molinaro M. Myogenic conversion of mammalian fibroblasts induced by differentiating muscle cells // J. Cell Sci. 1995. V. 108. Pt 8. P. 2733–2739.
Sassoli C., Pini A., Chellini F., Mazzanti B., Nistri S., Nosi D., Saccardi R., Quercioli F., Zecchi-Orlandini S., Formigli L. Bone marrow mesenchymal stromal cells stimulate skeletal myoblast proliferation through the paracrine release of VEGF // PLoS One. 2012. V. 7. № 7. P. e37512.
Shi D., Reinecke H., Murry Ch.E., Torok-Storbi B. Myogenic fusion of human bone marrow stromal cells, but not hematopoietic cells // Blood. 2004. V. 104. № 1. P. 290–294.
Vistejnova L., Safrankova B., Nesporova K. Low molecular weight hyaluronan mediated CD44 dependent induction of IL-6 and chemokines in human dermal fibroblasts potentiates innate immune response // Cytokine. 2014. V. 70. № 2. P. 97–103.
Winkler T., von Roth P., Radojewski P., Urbanski A., Hahn S., Preininger B., Duda G.N., Perka C. Immediate and delayed transplantation of mesenchymal stem cells improve muscle force after skeletal muscle injury in rats // J. Tiss. Eng. Regen. Med. 2012. V. 6. Suppl. 3. P. 60–67.
Wise C.J., Watt D.J., Jones G.E. Conversion of dermal fibroblasts to a myogenic lineage is induced by a soluble factor derived from myoblasts // J. Cell. Biochem. 1996. V. 61. № 3. P. 363–374.
Wu Y., Chen L., Scott P.G., Tredget E.E. Mesenchymal stem cells enhance wound healing through differentiation and angiogenesis // Stem Cells. 2007. V. 25. № 10. P. 2648–2659.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


