Известия РАН. Серия биологическая, 2020, № 5, стр. 473-481
Нейропротекторное действие N-докозагексаеноилдофамина на дегенерирующие дофаминергические нейроны в культуре клеток среднего мозга
С. А. Сурков 1, *, Э. Р. Мингазов 1, В. Е. Блохин 1, А. И. Стурова 1, Н. М. Грецкая 2, Г. Н. Зинченко 2, В. В. Безуглов 2, М. В. Угрюмов 1
1 Институт биологии развития им. Н.К. Кольцова РАН
119334 Москва, ул. Вавилова, 26, Россия
2 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
* E-mail: surkov@eimb.ru
Поступила в редакцию 03.12.2018
После доработки 17.06.2019
Принята к публикации 17.10.2019
Аннотация
Исследованы нейропротекторные свойства N-докозагексаеноилдофамина (ДГК-ДА), эндогенного биоактивного липида семейства нейролипинов, на дофаминергические нейроны среднего мозга плодов мыши в культуре клеток после воздействия на них 1-метил-4-фенилпиридиния (МФП+) – специфического нейротоксина катехоламинергических нейронов. Оценено состояние нейронов в опыте (МФП+) и в контроле (0.9% NaCl) по числу выживших дофаминергических нейронов, длине нейритов и содержанию в нейронах дофамина. Отмечено, что ДГК-ДА оказывает дозозависимое нейропротекторное воздействие на дегенерирующие под влиянием МФП+ дофаминергические нейроны, а при концентрации 0.5 мкМ и ниже нейропротекторного действия не наблюдается. Установлено, что нейропротекторный эффект в виде предотвращения гибели дофаминергических нейронов и деградации нейритов проявляется при более высоких концентрациях ДГК-ДА (1.0 и 2.0 мкМ). Также обнаружено, что на фоне действия МФП+ ДГК-ДА существенно снижает потерю дофамина в клетках нейронов.
Изучение дегенерации нигростриатных дофаминергических нейронов (ДА-ергических нейронов) и ее предотвращение с помощью лекарственных средств имеет большое значение для углубленного познания патогенеза болезни Паркинсона (БП) и разработки нейропротекторной терапии. Действительно, БП – нейродегенеративное заболевание, характеризующееся прогрессирующей гибелью ДА-ергических нейронов нигростриатной системы мозга – ключевого звена регуляции двигательной функции. При снижении содержания дофамина в стриатуме у больных до порогового уровня (20–30% нормы) появляются нарушения двигательных функций в виде тремора, брадикинезии и ригидности (Agid, 1991). Традиционное лечение больных с использованием агонистов дофамина (ДА) способствует временной компенсации функциональной недостаточности нигростриатных ДА-ергических нейронов (Fahn, 2008), но не останавливает гибель этих нейронов.
Отсутствие эффективной нейропротекторной терапии делает особенно актуальным поиск новых лекарственных средств с нейропротекторными свойствами, способных если не остановить, то хотя бы замедлить гибель ДА-ергических нейронов, что особенно важно на ранней стадии нейродегенеративного заболевания. Наиболее перспективными считаются нейропротекторы эндогенного происхождения, к которым относятся вещества, обладающие способностью защищать клетки от действия вредных факторов. Этим свойством обладают биоактивные липиды из семейства нейролипинов (эндованилоиды/эндоканнабиноиды и родственные соединения). Нейролипины и их рецепторы участвуют во множестве физиологических реакций: модулируют синаптическую передачу, влияют на свойства К+, Ca2+-каналов и мембранных транспортеров, а также регулируют моторное поведение (Connor et al., 2010; Бобров и др., 2014; Freestone et al., 2014). Кроме того, показано, что каннабиноидные рецепторы и их агонисты, вовлеченные в патогенез БП, способствуют выживаемости ДА-ергических нейронов (Guzmán et al., 2001; Brotchie, 2003).
Среди нейролипинов один из наиболее перспективных кандидатов на роль нейропротектора – N‑докозагексаеноилдофамин (ДГК-ДА) – лиганд каннабиноидных рецепторов (Connor et al., 2010; Бобров и др., 2014). До сих пор нейропротекторные свойства ДГК-ДА были показаны только на культуре нейронов мозжечка крыс в условиях дефицита К+ или окислительного стресса (Bobrov et al., 2008; Генрихс и др., 2010; Бобров и др., 2014), а также нейронов, дифференцированных из индуцированных плюрипотентных стволовых клеток человека (Бобров и др., 2006; Новосадова и др., 2017). При этом оказалось, что ДГК-ДА обладает антиапоптотическим и антиоксидантным действием (Андрианова, 2009; Бобров и др., 2006). Однако до сих пор не было попыток оценить нейропротекторное влияние ДГК-ДА на нигростриатные ДА-ергические нейроны, хотя известно, что эти нейроны при БП погибают именно в результате оксидативного стресса и апоптоза (Dexter, Jenner, 2013; Dias et al., 2013).
Цель исследования – изучение в культуре клеток нейропротекторных действий ДГК-ДА на ДА-ергические нейроны, дегенерирующие под влиянием 1‑метил-4-фенилпииридиний йодида (МФП+) – специфического нейротоксина катехоламинергических нейронов.
МАТЕРИАЛЫ И МЕТОДЫ
Первичная культура ДА-ергических нейронов и воздействия на нее. В работе использованы эмбрионы мышей линии C57BL/6 на 13-е сут развития. Беременных самок наркотизировали изофлураном, извлекали матку и промывали ее охлажденным буфером Хенкса без Са2+ и Mg2+ (Gibco, США) с добавлением антибиотиков гентамицина и амфотерицина (Gibco). После декапитации эмбрионов извлекали мозг и в охлажденном стерильном буфере Хенкса без Са2+ и Mg2+ вырезали вентральную область среднего мозга – закладку черной субстанции. Выделенную ткань помещали в микропробирку со средой для суспендирования DMEM/F12, содержащей бессывороточную добавку B-27, 0.5 мМ L-глутамин и антибиотики (Gibco). Кусочки ткани механически диссоциировали пипетированием.
Полученную суспензию клеток фильтровали с помощью нейлонового фильтра (поры фильтра – 70 мкм) и центрифугировали 200 g, 5 мин при 4°С. Образовавшийся осадок ресуспендировали в нейробазальной среде (neurobasal medium), включающей в себя бессывороточную добавку B-27, 0.5 мМ L-глутамина, 100 нг/мл фактора роста нервов и 10 нг/мл мышиного фактора роста фибробластов с добавлением гентамицина (Gibco). Клеточную суспензию окрашивали трипановым синим, после чего подсчитывали живые клетки в камере Горяева. Выживаемость составляла 80–90%.
Затем клетки высаживали в предварительно обработанные поли-L-лизином 24-луночные планшеты (Corning, США) по 400 тыс. клеток в каждую лунку и культивировали в нейробазальной среде (1 мл/лунку), содержащей бессывороточную добавку B-27 (Gibco), 0.5 мМ L-глутамина и антибиотики, в атмосфере 5% CO2 при 37°C. Среду культивирования заменяли каждые 2-е сут. На 4-е сут в среду вводили 10 мкМ цитарабина (Sigma, США) на 24 ч для устранения глии. На 7-е сут в среду в различные лунки на 24 ч добавляли: в контроле 2 мкл 0.9% NaCl, а в эксперименте МФП+ (Sigma) в 2 мкл 0.9% NaCl (конечная концентрация МФП+ 10 мкМ) и ДГК-ДА (98%-ной чистоты, синтезирован в лаборатории оксилипинов ИБХ РАН) (Bezuglov et al., 2001) в конечной концентрации 0.5, 1 или 2 мкМ. Через 8 сут после начала культивирования проводили морфологический и биохимический анализ культуры.
Иммуноцитохимия. Во всех опытах с культурой клеток иммуноцитохимически выявляли нейроны, содержащие тирозингидроксилазу (ТГ). Для этого культуральную среду отмывали фосфатно-солевым буфером (ФСБ: NaCl – 137, KCl – 2.7, Na2HPO4 – 10, KH2PO4 – 1.76 мМ, pH 7.3) 10 мин при 4°С и клетки фиксировали 4%-ным параформальдегидом на 0.2 М фосфатном буфере (pH 7.2–7.4) в течение 1 ч при 4°С. Затем культуру клеток инкубировали поэтапно:
с 3%-ным бычьим сывороточным альбумином (БСА) (Sigma) и 0.3% Triton X-100 (Sigma) на ФСБ 30 мин при 20°С;
с кроличьими антителами к ТГ (1 : 5000) (предоставлены проф. Ж. Тибо, Франция) в ФСБ, содержащем 1%-ный БСА и 0.1%-ный Triton X-100, в течение 20 ч при 20°С;
с биотинилированными козьими антителами к антителам кролика (1 : 400) (VectorLaboratories, США) на ФСБ в течение 2 ч при 20°С;
с авидин-биотиновым комплексом, связанным с пероксидазой хрена (VectorLaboratories) на ФСБ в течение 1 ч при 20°С. После каждой инкубации лунки промывали ФСБ в течение 30 мин при 20°С. В контроле на втором этапе инкубации клеток из инкубационной среды исключали кроличьи антитела к ТГ. Пероксидазу авидин-биотинового комплекса выявляли в процессе инкубации с 0.05% 3,3'-диаминобензидинтетрогидрохлорида (Sigma) и 0.02% H2O2 на ФСБ при 20°С под визуальным контролем. Культуру клеток заключали в Mowiol 4-88 (Sigma).
После выявления ТГ-иммунореактивных (ТГ-ИР) нейронов лунки с культурой клеток сканировали с помощью микроскопа Zeiss Observer Z1 (Zeiss, Германия), оснащенного координатным столом и фотокамерой, при увеличении объектива ×20/NA 0.4 EC Plan-Neofluar (Zeiss). С помощью модуля MosaiX AxioVision (Zeiss) и программного обеспечения AxioVision 4.8 воссоздавали целостное изображение лунки. В каждой лунке с помощью программы Image J (Wayne Rasband – NIH, США) подсчитывали общее число ТГ-ИР-нейронов. Кроме того, в каждой лунке случайным образом выбирали по 100 ТГ-ИР-нейронов и определяли длину нейритов у каждого из них в соответствии с ранее описанной методикой (Rønn et al., 2000). Для этого с помощью программы Photoshop СS 5.1 на изображение ТГ-ИР-нейронов накладывали сеть параллельных линий с интервалом 20 мкм и подсчитывали число пересечений нейритов с этими линиями, определяя длину нейритов (L) по формуле
где I – число пересечений нейритов с параллельными линиями, d – расстояние (20 мкм) между параллельными линиями.Высокоэффективная жидкостная хроматография с электрохимической детекцией (ВЭЖХ-ЭД). Из гомогената клеточной культуры методом твердофазной экстракции на оксиде алюминия экстрагировали дофамин и его метаболиты, содержание которых определяли методом ВЭЖХ-ЭД. Разделение ДА и метаболитов осуществляли на обращенно-фазной колонке ReproSil-Pur, ODS-3, 4 × 100 мм с диаметром пор 3 мкм (Dr. Majsch GMBH, Германия) при температуре 30°С и скорости подвижной фазы 1 мл/мин, поддерживаемой жидкостным хроматографом LC-20ADsp (Shimadzu, Япония). Мобильная фаза с pH 2.5 включала в себя 0.1 М цитратно-фосфатный буфер, 0.3 мМ октансульфат натрия, 0.1 мМ ЭДТА и 9%-ный ацетонитрил (Sigma). Электрохимический детектор Decade II (AntecLeyden, Нидерланды) был укомплектован стеклоуглеродным рабочим электродом и хлорсеребряным электродом сравнения. Пики катехоламинов и метаболитов идентифицировали по времени их выхода в стандартном растворе (в качестве стандартов использовали адреналин, норадреналин, L-ДОФА, ДГБА, ДОФУК, ДА в концентрации 50 пкМ). Содержание ДА и метаболитов рассчитывали методом внутреннего стандарта как отношение площадей пиков стандартной смеси и в образце с помощью программного обеспечения LabSolutions (Shimadzu).
Статистическая обработка. Статистическую обработку данных выполняли с помощью комплекса программ статистического анализа GraphPad Prism Version 6.0 (GraphPad Software, США). Статистическую значимость результатов определяли с использованием двухфакторного дисперсионного анализа (1-way ANOVA) с последующим использованием теста Тьюки для множественного сравнения средних. Данные представлены как среднее арифметическое ± средняя ошибка.
Было проведено шесть экспериментов; в каждом эксперименте данные, полученные после воздействия на клетки МФП+ и ДГК-ДА, сравнивали с контролем. Результаты экспериментов в виде процентных отношений опыт/контроль приведены в табл. 1.
Таблица 1.
Сравнение полученных морфологических данных, выраженных в процентных отношениях средних значений по сравнению с контролем, принятым за 100%
| Параметр | 10 мкМ МФП+, % | 0.5 мкМ ДГК-ДА + + МФП+, % | 1.0 мкМ ДГК-ДА + + МФП+, % | 2.0 мкМ ДГК-ДА + + МФП+, % |
|---|---|---|---|---|
| Число ТГ-ИР нейронов | 41.78 | 50.47 | 77.91 | 44.19 |
| Содержание дофамина/лунку | 44.43 | 46.43 | 81.26 | 70.86 |
| Длина нейритов/клетку | 45.34 | 41.69 | 62.01 | 57.83 |
Примечание. БП – болезнь Паркинсона; ВЭЖХ-ЭД – высокоэффективная жидкостная хроматография с электрохимической детекцией; ДА – дофамин; ДА-ергические – дофаминергические; ДГК-ДА – N-докозагексаеноилдофамин; MФП+ – 1-метил-4-фенилпиридиний йодид; ФСБ – фосфатно-солевой буфер; ТГ-ИР – тирозингидроксилаза-иммунореактивный.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Характеристика ТГ-ИР-нейронов в первичной культуре среднего мозга. Через 8 сут культивирования клеток среднего мозга эмбрионов мыши с добавлением в последние 24 ч в среду 0.9% NaCl (контроль) были выявлены ТГ-ИР-нейроны с овальными или полигональными телами размером 8–10 мкм. Эти нейроны обладают 2–6 отростками (нейритами), ветвящимися по мере отдаления от тел (рис. 1а). Число ТГ-ИР-нейронов на лунку в первичной культуре составляло в среднем 215 ± 10 (рис. 2а), а общая длина нейритов на нейрон 505 ± 21 мкм (рис. 2б). В процессе иммуногистохимии в контроле при инкубации клеток без антител к ТГ специфическое иммунокорашивание отсутствует. Общее содержание ДА в первичной культуре ТГ-ИР-нейронов на лунку составляло 0.69 ± 0.06 пмоль на лунку (рис. 3).
Рис. 1.
Тирозингидроксилаза-иммунореактивные (ТГ-ИР) нейроны в 8-суточной диссоциированной культуре после 24 ч инкубации с 0.9% NaCl – контроль (а); МФП+ в концентрации 10 мкМ (б); МФП+ (10 мкМ) совместно с 1.0 мкМ ДГК-ДА (в). Масштаб: 50 мкм.
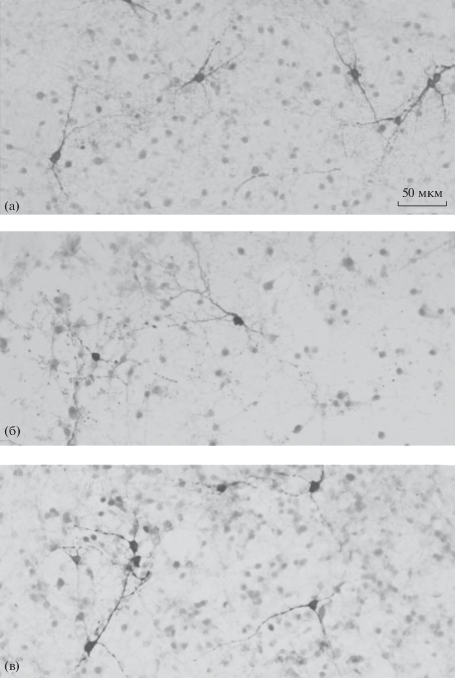
Рис. 2.
Число ТГ-ИР-нейронов (тел) на лунку (а) и общая длина отростков на нейрон (б) после 7 сут культивирования и 24 ч инкубации в присутствии 0.9% NaCl (контроль), 10 мкМ МФП+, 10 мкМ МФП+ и 0.5 мкМ ДГК-ДА, 10 мкМ МФП+ и 1 мкМ ДГК-ДА, 10 мкМ МФП+ и 2 мкМ ДГК-ДА. * – р < 0.05 по сравнению с контролем; ** – р < 0.05 по сравнению с выбранным параметром.
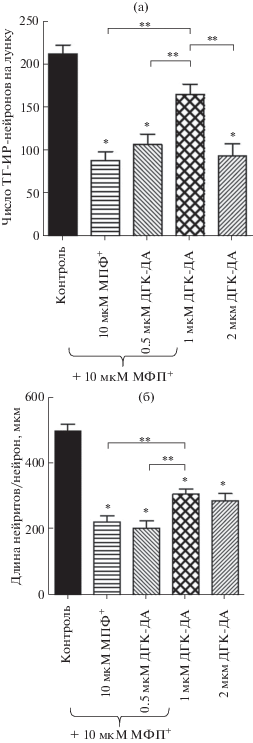
Рис. 3.
Содержание ДА в культуре ТГ-ИР-нейронов в контроле и через 24 ч после введения МФП+ (10 мкМ) или МФП+ одновременно с ДГК-ДА в различных концентрациях. * – р < 0.05 по сравнению с контролем; ** –р < 0.05 по сравнению с выбранным параметром.
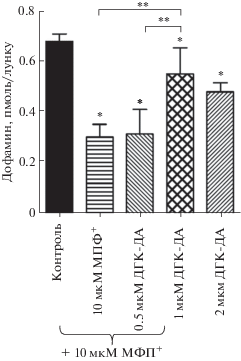
ТГ-ИР-нейроны после инкубации с МФП+. Введение через 7 сут после начала культивирования нейронов в культуральную среду МФП+ (10 мкМ) через 24 ч привело к снижению числа ТГ-ИР-нейронов на лунку на 58% по сравнению с контролем – после введения 0.9% NaCl вместо МФП+ (рис. 1б, 2а). При этом под влиянием МФП+ средняя длина нейритов на нейрон уменьшилась на 55% (рис. 2б), а общее содержание ДА в нейронах на лунку – на 56% по сравнению с контролем (рис. 3).
ТГ-ИР нейроны после инкубации с МФП+ и ДГК-ДА. Одновременное добавление в культуру клеток из среднего мозга эмбрионов мыши 10 мкМ МФП+ и 0.5 мкМ ДГК-ДА через 24 ч привело к уменьшению числа ТГ-ИР-нейронов на 49.5% и общей длины нейритов на нейрон на 58% по сравнению с контролем (введение в среду 0.9% NaCl) (рис. 2). При введении в культуральную среду 1 мкМ ДГК-ДА и 10 мкМ МФП+ число нейронов уменьшилось на 22%, а общая длина нейритов на нейрон – на 38% по сравнению с контролем (введение в среду 0.9% NaCl) (рис. 1в, 2). При этом общее содержание дофамина в нейронах было снижено на 19% по сравнению с контролем (0.9% NaCl) (рис. 3). При добавлении в культуральную среду 2 мкМ ДГК-ДА и 10 мкМ МФП+ число ТГ-ИР-нейронов на лунку уменьшилось на 56%, а общая длина нейритов на нейрон – на 42% по сравнению с контролем (введение в среду 0.9% NaCl) (рис. 2). В этом же опыте общее содержание дофамина на лунку уменьшилось на 29% по сравнению с контролем (введение в среду 0.9% NaCl) (рис. 3).
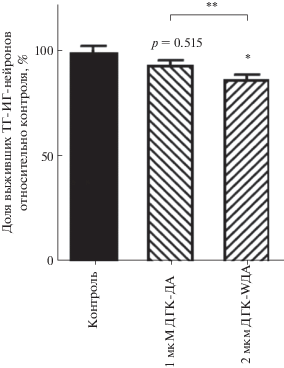
Цитотоксичность ДГК-ДА. Для оценки токсичности ДГК-ДА на ДА-нейроны была проведена 24-ч инкубация первичной культуры с ДГК-ДА в концентрациях без добавления МФП+. Оценка количества ТГ-ИР-нейронов показала, что в концентрации 1.0 мкМ наблюдалось незначительное (на 6–7%) уменьшение числа позитивных ТГ-ИР-нейронов по сравнению с контролем (p = 0.0515). В результате инкубации культуры с 2.0 мкМ ДГК-ДА на 13% статистически значимо уменьшилось число ТГ-ИР-нейронов относительно контроля. Между дозировками 1 и 2 мкМ ДГК-ДА также имеется различие (рис. 4).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В соответствии с общепринятой методологией скрининга кандидатов лекарственных средств исследования начинаются с тестирования физиологических эффектов in vitro, что позволяет доказать прямое действие на клеточную мишень и изучить молекулярные механизмы действия. С помощью этой методологии оценивали предполагаемое нейропротекторное действие ДГК-ДА на дегенерирующие ДА-ергические нейроны нигростриатной системы мозга, играющие в норме ключевую роль в центральной регуляции двигательной функции, а при дегенерации, являющиеся ключевым звеном патогенеза болезни Паркинсона.
В данной работе в качестве источника ДА-ергических нейронов использовали первичную культуру нейронов среднего мозга, полученную от эмбрионов мыши на 13-е сут развития. Дегенерацию ДА-ергических нейронов вызывали через 7 сут после начала культивирования путем добавления в среду МФП+ – специфического токсина катехоламинергических нейронов, вызывающего оксидативный стресс. Специфичность действия МФП+ на ДА-ергические нейроны обусловлена его захватом из среды в эти нейроны с помощью мембранного транспортера ДА (Javitch et al., 1985; Bezard et al., 1999; Choi et al., 2015). МФП+ – продукт дезаминирования в мозге протоксина – МФТП, который широко используется для моделирования БП in vivo, а его аналог (героин) вызывает паркинсонизм у людей (Langston et al., 1984; Javitch et al., 1985; D’Amato et al., 1986).
ДА-ергические нейроны в культуре идентифицировали по наличию ТГ – первого ключевого фермента синтеза катехоламинов, который является идеальным маркером, поскольку равномерно распределен по всему катехоламинергическому нейрону (от дендритов до терминалей аксонов). Использование этого маркера позволяет гарантированно выявить в эмбриональной закладке черной субстанции (в вентральной части среднего мозга) только ДА-ергические нейроны, поскольку в ней не содержатся другие катехоламинергические нейроны (Sawamoto et al., 2001). Более того, ранее было показано, что для количественной оценки дегенерации ДА-ергических нейронов может быть использован только количественный иммуноцитохимический анализ ТГ-ИР-нейронов. Так, было показано, что уменьшение числа ТГ-ИР-нейронов в черной субстанции под действием специфических нейротоксинов идентично числу дегенерировавших в этой области нейронов (Petroske et al., 2001; Turmel et al., 2001). Альтернативный подход к оценке дегенерации клеточной культуры с помощью подсчета апоптозных клеток с морфологически измененными ядрами после их окрашивания флуоресцентными красителями (Columbano, 1995; Choi et al., 2000; Бессмельцев и др., 2011) недостаточно точен, так как основан на субъективной оценке изменения морфологии ядра либо изменения интенсивности флуоресценции, а поэтому используется для качественной, а не для количественной характеристики нейродегенерации.
На первом этапе работы дана количественная оценка дегенерации ДА-ергических нейронов при добавлении в среду культивирования нейронов среднего мозга 10 мкМ МФП+. В качестве прямых показателей дегенерации нейронов использовали уменьшение числа ТГ-ИР-нейронов на лунку и укорочение нейритов на нейрон при действии МФП+ по сравнению с контролем (0.9% NaCl), а в качестве косвенного показателя – снижение общего содержания ДА в нейронах на лунку. По полученным данным эти показатели снизились в опыте по сравнению с контролем соответственно на 58.2, 54.7 и 55.6%.
В дальнейших экспериментах в среду добавляли одновременно 10 мкМ МФП+ и ДГК-ДА – тестируемый нейропротектор – в концентрациях 0.5, 1.0 и 2.0 мкМ. Добавление в культуральную среду 0.5 мкМ ДГК-ДА не повлияло на действие МФП+ ни по одному из оцениваемых показателей. Ярко выраженный нейропротекторный эффект ДГК-ДА проявился при добавлении в культуральную среду вместе с МФП+ ДГК-ДА в концентрации 1 мкМ. При этом число ТГ-ИР-нейронов, длина нейритов и содержание ДА хотя и уменьшились по сравнению с контролем (0.9% NaCl), но в гораздо меньшей степени, чем при действии только МФП+. В такой же степени были снижены деградация нейритов ТГ-ИР-нейронов и общее содержание дофамина в нейронах.
Несмотря на то что ДГК-ДА оказывает нейропротекторное влияние на дофаминергические нейроны и в более высокой дозе (2 мкМ), характер действия существенно отличается от такового в дозе 1 мкМ. Так, при культивировании нейронов в присутствии МФП+ и ДГК-ДА в дозе 2 мкМ деградации подвергается такое же число дофаминергических нейронов, как и при добавлении в среду только МФП+. Однако длина нейритов на ТГ-ИР-нейрон и общее содержание в выживших нейронах дофамина увеличены в такой же степени, как и при действии ДГК-ДА в дозе 1 мкМ, по сравнению с инкубацией культуры в присутствии только МФП+.
Из полученных данных следует, что нейропротекторное действие ДГК-ДА на дегенерирующие ДА-ергические нейроны меняется количественно и качественно в зависимости от концентрации нейропротектора. Так, при самой низкой из использованных концентраций (0.5 мкМ) ДГК-ДА нейропротекторное действие не наблюдается, тогда как при средней концентрации (1 мкМ) отмечено наиболее выраженное нейропротекторное воздействие, причем в этом случае ДГК-ДА в гораздо большей степени защищает тела нейронов от деградации, чем их отростки (нейриты). В самой высокой из использованных концентраций (2 мкМ) ДГК-ДА в меньшей степени защищает от гибели тела нейронов, но в гораздо большей степени защищает и/или стимулирует рост нейритов выживших нейронов. Важно отметить, что общее содержание ДА на лунку, являющееся важнейшим показателем нейротрансмиттерной функции нейронов, поддерживается на одном уровне независимо от характера нейропротекторных эффектов при дозах ДГК-ДА 1 и 2 мкМ.
Гетерогенный характер влияния ДГК-ДА в различных концентрациях на дегенерирующие ДА-ергические нейроны косвенно свидетельствует о различных дозозависимых механизмах действия этого нейропротектора. Вероятно, речь идет об антиоксидантных свойствах ДГК-ДА. С одной стороны, показано, что оксидативный стресс приводит к гибели ДА-ергических нейронов как при моделировании БП in vitro и in vivo, так и у больных при БП (Dexter, Jenner, 2013), а с другой стороны, продемонстрировано, что ДГК-ДА способствует выживанию гранулярных нейронов мозжечка крысы в условиях оксидативного стресса, вызванного H2O2 (Bobrov et al., 2008).
Помимо антиоксидантного ДГК-ДА демонстрирует также антиапоптотические свойства, снижая активность каспаз 3 и 9 (Генрихс и др., 2010; Бобров, 2014) – ферментов, запускающих апопотоз – основной путь дегенерации нейронов при хронических заболеваниях мозга, включая дегенерацию нигростриатных ДА-ергических нейронов при БП (Anglade et al., 1997; Olanow, Tatton, 1999; Hartmann et al., 2000). Кроме того, было показано, что ДГК-ДА обладает выраженными иммуномодулирующими свойствами (Wang et al., 2017).
Таким образом, на клеточной культуре нейронов получены доказательства нейропротекторного дозозависимого воздействия ДК-ДА на дегенерирующие ДА-ергические нейроны среднего мозга.
Работа выполнена при финансовой поддержке Программы Президиума РАН “Фундаментальные исследования для биомедицинских технологий”, проект № 0101-2018-0019.
Список литературы
Андрианова Е.Л. Про- и антиапоптотическое действие нейролипинов на нормальные и трансформированные клетки нервной системы: Автореф. дис. канд. хим. наук. М., 2009.
Бессмельцев С.С., Козлов А.В., Сясина Т.В., Удальева В.Ю. Сравнительная оценка методов определения апоптотической активности клеток костного мозга у больных хроническим миелолейкозом // Фундам. исследования. 2011. № 10 (1). С. 33–36.
Бобров М.Ю., Грецкая Н.М., Акимов М.Г., Безуглов В.В. Нейролипины – эндогенные нейропротекторы при ишемии мозга и основа для создания новых гибридных мультифункциональных препаратов // Нейродегенеративные заболевания: от генома до целостного организма. М.: Науч. мир, 2014. С. 726–762.
Бобров М.Ю., Лыжин А.А., Андрианова Е.Л., Грецкая Н.М., Зинченко Г.Н., Фрумкина Л.Е., Хаспеков Л.Г., Безуглов В.В. Антиоксидантные и нейропротекторные свойства N-докозагексаеноилдофамина // Бюл. эксперим. биологии и медицины. 2006. Т. 142. № 10. С. 406–408.
Генрихс Е.Е., Барсков И.В., Бобров М.Ю., Безуглов В.В. Нейропротекторные свойства модуляторов эндогенной каннабиноидной системы in vivo и in vitro. Современные направления исследований функциональной межполушарной асимметрии и пластичности мозга. Экспериментальные и теоретические аспекты нейропластичности. М.: Науч. мир, 2010. С. 338–342.
Новосадова Е.В., Арсеньева Е.Л., Мануилова Е.С., Хаспеков Л.Г., Бобров М.Ю., Безуглов В.В., Иллариошкин С.Н., Гривенников И.А. Исследование нейропротекторных свойств эндоканнабиноидов N-арахидоноилдофамина и N-докозагексаеноилдофамина на нейрональных предшественниках человека, полученных из индуцированных плюрипотентных стволовых клеток человека // Биохимия. 2017. Т. 82 (11). С. 1732–1739.
Agid Y. Parkinson’s disease: pathophysiology // Lancet. 1991. V. 337. № 8753. P. 1321–1324.
Anglade P., Vyas S., Hirsch E., Agid Y. Apoptosis in dopaminergic neurons of the human substantia nigra during normal aging // Histol Histopathol. 1997. V. 12. № 3. P. 603–610.
Bezard E., Gross C.E., Fournier M.C., Dovero S., Bloch B., Jaber M. Absence of MPTP-induced neuronal death in mice lacking the dopamine transporter // Exp. Neurol. 1999. V. 155. № 2. P. 268–273.
Bezuglov V., Bobrov M., Gretskaya N., Gonchar A., Zinchenko G., Melck D., Bisogno T., Di Marzo V., Kuklev D., Rossi J.C., Vidal J.P., Durand T. Synthesis and biological evaluation of novel amides of polyunsaturated fatty acids with dopamine // Bioorg. Med. Chem. 2001. V. 11. № 4. P. 447–449.
Bobrov M.Y., Lizhin A.A., Andrianova E.L., Gretskaya N.M., Frumkina L.E., Khaspekov L.G., Bezuglov, V.V. Antioxidant and neuroprotective properties of N-arachidonoyldopamine // Neurosci. Lett. 2008. V. 431. № 1. P. 6–11.
Brotchie J.M. CB1 cannabinoid receptor signalling in Parkinson’s disease // Curr. Opin. Pharmacol. 2003. V. 3. № 1. P. 54–61.
Choi K.H., Hama-Inaba H., Wang B., Haginoya K., Odaka T., Yamada T., Hayata I., Ohyama H. UVC-induced apoptosis in human epithelial tumor A431 cells: sequence of apoptotic changes and involvement of caspase (-8 and -3) cascade // J. Radiat. Res. 2000. V. 41. № 3. P. 243–258.
Choi S.J., Panhelainen A., Schmitz Y., Larsen K.E., Kanter E., Wu M., Sulzer D., Mosharov E.V. Changes in Neuronal Dopamine Homeostasis following 1-Methyl-4-phenylpyridinium (MPP+) Exposure // J. Biol. Chem. 2015. V. 290. № 11. P. 6799–6809.
Columbano A. Cell death: current difficulties in discriminating apoptosis from necrosis in the context of pathological processes in vivo // J. Cell Biochem. 1995. V. 58. № 2. P. 181–190.
Connor M., Vaughan C.W., Vandenberg R.J. N-acyl amino acids and N-acyl neurotransmitter conjugates: neuromodulators and probes for new drug targets // Br. J. Pharmacol. 2010. V. 160. № 8. P. 1857–1871.
D’Amato R.J., Lipman Z.P., Snyder S.H. Selectivity of the parkinsonian neurotoxin MPTP: toxic metabolite MPP+ binds to neuromelanin // Science. 1986. V. 231 (4741). P. 987–989.
Dexter D.T., Jenner P. Parkinson disease: from pathology to molecular disease mechanisms // Free Radic. Biol. Med. 2013. V. 62. P. 132–144.
Dias V., Junn E., Mouradian M.M. The role of oxidative stress in Parkinson’s disease // J. Parkinsons Dis. 2013. V. 3. № 4. P. 461–491.
Fahn S. The history of dopamine and levodopa in the treatment of Parkinson’s disease // Mov. Disord. 2008. V. 23. № 3. P. 497–508.
Freestone P.S., Guatteo E., Piscitelli F., di Marzo V., Lipski J., Mercuri N.B. Glutamate spillover drives endocannabinoid production and inhibits GABAergic transmission in the Substantia Nigra pars compacta // Neuropharmacol. 2014. V. 79. P. 467–475.
Guzmán M., Sánchez C., Galve-Roperh I. Control of the cell survival/death decision by cannabinoids // J. Mol. Med. 2001. V. 78. № 11. P. 613–625.
Hartmann A., Hunot S., Michel P.P., Muriel M.P., Vyas S., Faucheux B.A., Mouatt-Prigent A., Turmel H., Srinivasan A., Ruberg M., Evan G.I., Agid Y., Hirsch E.C. Caspase-3: A vulnerability factor and final effector in apoptotic death of dopaminergic neurons in Parkinson’s disease // Proc. Natl Acad. Sci. USA. 2000. V. 97. № 6. P. 2875–2880.
Javitch J.A., D’Amato R.J., Strittmatter S.M., Snyder S.H. Parkinsonism-inducing neurotoxin, N-methyl-4-phenyl-1,2,3,6-tetrahydropyridine: uptake of the metabolite N-methyl-4-phenylpyridine by dopamine neurons explains selective toxicity // Proc. Natl Acad. Sci. USA. 1985. V. 82. № 7. P. 2173–2177.
Langston J.W., Langston E.B., Irwin I. MPTP-induced parkinsonism in human and non-human primates – clinical and experimental aspects // Acta Neurol. Scand. Suppl. 1984. V. 70. № 100. P. 49–54.
Olanow C.W., Tatton W.G. Etiology and pathogenesis of Parkinson’s disease // Annu. Rev. Neurosci. 1999. V. 22. № 1. P. 123–144.
Petroske E., Meredith G.E., Callen S., Totterdell S., Lau Y.S. Mouse model of Parkinsonism: a comparison between subacute MPTP and chronic MPTP/probenecid treatment // Neuroscience. 2001. V. 106. № 3. P. 589–601.
Rønn L., Ralets I., Hartz B., Bech M., Berezin A., Berezin V., Møller A., Bock E. A simple procedure for quantification of neurite outgrowth based on stereological principles // J. Neurosci. Meth. 2000. V. 100. P. 25–32.
Sawamoto K., Nakao N., Kobayashi K., Matsushita N., Takahashi H., Kakishita K., Yamamoto A., Yoshizaki T., Terashima T., Murakami F., Itakura T., Okano H. Visualization, direct isolation, and transplantation of midbrain dopaminergic neurons // Proc. Natl Acad. Sci. USA. 2001. V. 98. № 11. P. 6423–6428.
Turmel H., Hartmann A., Parain K., Douhou A., Srinivasan A., Agid Y., Hirsch E.C. Caspase-3 activation in 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP)-treated mice // Movement Disord. 2001. V. 16. № 2. P. 185–189.
Wang Y., Plastina P., Vincken J.P., Jansen R., Balvers M., Ten Klooster J.P., Gruppen H., Witkamp R., Meijerink J. N-Docosahexaenoyl dopamine, an endocannabinoid-like conjugate of dopamine and the n-3 fatty acid docosahexaenoic acid, attenuates lipopolysaccharide-induced activation of microglia and macrophages via COX-2 // ACS Chem. Neurosci. 2017. V. 8 (3), P. 548–557.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая