Известия РАН. Серия биологическая, 2020, № 6, стр. 565-574
Биологическая активность и особенности фармакокинетики фенбендазола на основе супрамолекулярной системы адресной доставки с экстрактом солодки и натрия диоктилсульфосукцинатом
А. И. Варламова 1, *, С. О. Мовсесян 2, И. А. Архипов 1, С. С. Халиков 3, М. В. Арисов 1, П. П. Кочетков 1, В. Е. Абрамов 1, М. М. Ильин 3, Б. В. Локшин 3
1 Всероссийский научно-исследовательский институт фундаментальной и прикладной паразитологии животных и растений – филиал ФГБНУ “Федеральный научный центр – Всероссийский научно-исследовательский институт экспериментальной ветеринарии им. К.И. Скрябина и Я.Р. Коваленко РАН”
117218 Москва, ул. Большая Черемушкинская, 28, Россия
2 Центр паразитологии Института проблем экологии и эволюции им А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
3 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
119334 Москва, ул. Вавилова, 28, Россия
* E-mail: arsphoeb@mail.ru
Поступила в редакцию 19.02.2020
После доработки 23.03.2020
Принята к публикации 23.03.2020
Аннотация
Изучено влияние супрамолекулярного комплекса фенбендазола с экстрактом солодки и натрия диоктилсульфосукцинатом (далее “супрамолекулярный фенбендазол” (СФБЗ)), полученного по механохимической технологии, на метаболизм и антигельминтную активность в организме овец. Отмечено, что данными физико-химических исследований подтверждено повышение растворимости СФБЗ, уменьшение размеров его частиц. Установлено повышение уровня абсорбции и поступления в кровь фенбендазола (ФБЗ) и его метаболитов, повышение в 2.3–2.5 раза их максимальной концентрации в крови и времени достижения этой концентрации. Показано, что эффективность СФБЗ на лабораторной модели Trichinella spiralis составила 96.27% в дозе 1 мг/кг по действующему веществу (ДВ) по сравнению с 13.70%-ной эффективностью субстанции ФБЗ в этой же дозе. Высокая эффективность СФБЗ была получена в дозе 2.0 мг/кг по ДВ при однократном пероральном введении против нематод на спонтанно зараженных овцах по результатам копроовоскопических исследований, в то время как субстанция ФБЗ показала 95.97%-ную активность в дозе 5.0 мг/кг. Обнаружено, что СФБЗ оказался более активным за счет повышения растворимости и абсорбции в организме животных.
Паразитарные болезни, в том числе гельминтозы животных, повсеместно распространены в РФ и в мире. В некоторых регионах России от 40 до 90% овец и крупного рогатого скота инвазированы гельминтами (Радионов, Архипов, 2010; Шамхалов и др., 2015), что причиняет большой экономический ущерб вследствие значительного снижения роста и развития молодняка, уменьшения мясной, молочной, шерстной продуктивности и качества получаемой продукции. Установлено, что прирост массы тела телят, зараженных Dictyocaulus viviparus и желудочно-кишечными стронгилятами, снижается в среднем на 34–35 кг в год (Сафиуллин, 1997).
К наиболее часто применяемым средствам борьбы с гельминтозами животных относится фенбендазол (ФБЗ), который обладает широким спектром действия, безопасен в применении и нетоксичен для организма животных, за исключением редких случаев диареи и рвоты (Goosens et al., 2005; Архипов, 2009; Riviere, Papich, 2009; Tramboo et al., 2017; Bushra, 2019). Механизм действия препарата обусловлен изменением микротубул гельминтов и нарушением потребления глюкозы у нематод, что вызывает снижение запасов энергии и гибель гельминта. Известно, что ФБЗ обладает низкой растворимостью, а следовательно, слабой биодоступностью (Campbell, Rew, 1986; Душкин и др., 2013), и поэтому при терапии некоторых гельминтозов требуется повышение его дозировок. Так, для повышения водорастворимости современных препаратов используют различные методики модификации лекарственных субстанций с помощью циклодекстринов, полисахаридов, липосом, мицелл и наноразмерных неорганических частиц (Marchessault et al., 2006; Krishnaian, 2010; Yanghuan et al., 2015). Повышение фармакологического эффекта достигается за счет увеличения растворимости, мембранной проницаемости и лучшей доставки молекул препарата к месту их действия (Loftsson et al., 2007; Kong et al., 2017). Кроме того, могут быть использованы различные физико-химические методы для повышения растворимости препаратов: изменение и уменьшение размеров частиц, изменение кристаллической структуры, приготовление твердых дисперсий субстанций с полимерами и др. (Boldyrev, 2004; Vemula et al., 2010; Wagh, Wagh, 2015).
Большой интерес к повышению эффективности действия ФБЗ вызван использованием механохимической технологии для улучшения показателей растворимости, абсорбции и биодоступности (Душкин и др., 2013). В предыдущие годы нами была определена активность супрамолекулярного фенбендазола (СФБЗ) с арабиногалактаном и поливинилпирролидоном при нематодозах овец и крупного рогатого скота (Варламова, 2017; Arkhipov et al., 2019).
В наших исследованиях использовался новый полимерный компонент – экстракт солодки (ЭС), который содержит до 25% глицирризиновой кислоты (ГК). Ранее было установлено, что производные ГК могут встраиваться в клеточные мембраны, обеспечивая подвижность липидов (Селютина и др., 2015). Благодаря амфифильным свойствам ГК способна к образованию мицелл с гидрофобными веществами и их переносу через биологические мембраны (Dushkin et al., 2012; Graebin, 2016; Selutina et al., 2016). Кроме того, нами был установлен тот факт, что добавление известного эмульгатора – натрия диоктилсульфосукцината (НДОСС) (Hetenyi et al., 2017), использующегося в пищевой промышленности, – увеличивает антигельминтную активность действующего вещества (ДВ) (Варламова и др., 2019).
Цель работы – изучение физико-химических свойств и биологической активности СФБЗ, полученного по механохимической технологии при гельминтозах.
МАТЕРИАЛЫ И МЕТОДЫ
СФБЗ получали при совместной механообработке компонентов, взятых в весовом соотношении 1 : 8.9 : 0.1 в металлическом барабане (объем 800 мл) валковой шаровой мельницы типа LE-101 (Венгрия) при скорости вращения барабана 60 об./мин и модуле процесса 1 : 16 в среде с металлическими шарами (диаметр 23 мм). Полученные при варьировании времени активации (от 1 до 24 ч) образцы композиций представляли собой твердые дисперсии (ТД) в виде легкосыпучих порошков. Эти ТД в среде растворителей образовывали супрамолекулярные комплексы.
В работе были использованы:
ФБЗ, который в химическом отношении представляет собой 5-(фенилтио)-2-бензимидазолкарбамат (99.0%) производства Changzhou Yabang Pharmaceuticals Co. Ltd (Цзянсу, Китай);
ЭС – сухой мелкодисперсный порошок от светло- до темно-коричневого цвета с содержанием 24.9% ГК производства ООО “Вистерра”, Алтайский край (Декларация соответствия TCN RU Д–RU.AF96.B.00958);
НДОСС с содержанием основного вещества 96% (Acras Organics, Нью-Джерси, США) – мелкодисперсный, гигроскопичный порошок со слегка горьким, мыльным вкусом и запахом октанола. В РФ разрешено его использование в качестве эмульгатора и детергента.
Физико-химические свойства исходных компонентов и их изменения в полученных ТД изучали методами ИК-спектроскопии и рентгенофазового анализа (РФА). Основной параметр, определяющий образование комплексов из их ТД, – изменение растворимости ФБЗ. Для определения концентрации ФБЗ в анализируемых образцах использовали метод высокоэффективной жидкостной хроматографии (ВЭЖХ). Анализ проводили на жидкостном хроматографе Agilent 1100 (Германия) с диодной матрицей с использованием аналитической колонки Hypersil C18 (5 мкм, 150 × 4.6 мм). Элюент состава ацетонитрил–ацетатный буфер, рН 3.4, в соотношении 1 : 1 подавали в изократическом режиме со скоростью 1 мл/мин. Температура термостата колонки была 30°С, УФ-детектирование проводили при длине волны 290 нм. Объем вводимой пробы – 1 мкл. Прием и обработку данных осуществляли с помощью программно-аппаратного комплекса Chemstation.
При рентгенофазовом анализе дифрактограммы регистрировали при вращении образца методом съемки “на просвет” в диапазоне углов рассеяния 20:5–100° на дифрактометре Brucker D8 (Advance, Германия) с фокусирующим германиевым кристаллом-монохроматором на первичном пучке (CuKa-излучение, длина волны 0.1542 нм). Первичную обработку дифрактограмм проводили методом Aлександера с учетом собственного рассеяния кюветы, внесением поправки на поглощение и поляризацию излучения (Alexander, 1969). Для определения степени кристалличности образцов, подвергнутых механообработке с различным временем воздействия, использовали метод Руланда, отличительная особенность которого – возможность одновременного учета влияния искажений в кристаллической решетке ФБЗ при вычислении степени его кристалличности (Ruland, 1961; Могилевская и др., 2006).
ИК-спектры измеряли методом нарушенного полного внутреннего отражения (НПВО) на инфракрасном фурье-спектрометре VERTEX 70v (Bruker Optik GmbH, Германия) с использованием приставки НПВО GladyATR 50 (PIKE, США) с алмазным рабочим элементом в области 4000–400 см–1 со спектральным разрешением 4 см–1. Измеренные спектры НПВО корректировали с использованием входящей в состав программного обеспечения OPUS 7 программы для учета зависимости глубины проникновения излучения в образец от длины волны (Khalikov et al., 2019).
Исследование антигельминтной активности проводили в соответствии с Руководством по экспериментальному изучению новых фармакологических веществ субстанций (Хабриев, 2005), Правилами, адаптированными Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных научных целей (Страсбург, 1986), и Правилами надлежащей клинической практики РФ (Приказ МЗ РФ № 199н от 01.04.2016 г.).
Особенности фармакокинетики СФБЗ изучали в организме овец методом ВЭЖХ. В опытах использовали две группы овец (по пять голов в каждой), которым давали СФБЗ и субстанцию ФБЗ в дозе 2 мг/кг однократно перорально. Пробы крови брали до и через 1, 2, 4, 6, 8, 12, 24, 33, 48, 72 и 144 ч после введения супрамолекулярного и базового препаратов. Для определения наличия ФБЗ и его метаболитов (сульфоксида и сульфона) в сыворотке крови овец применяли методику, описанную нами ранее (Кочетков и др., 2016; ГОСТ 32834-2014). В работе использовали жидкостной хроматограф высокого давления Agilent 1290 с масс-спектрометрическим детектором Agilent 6430 (QQQ), управляемым с помощью программы Mass Hunter Workstation Software LC/MS Data Acquisition Triple Quadrupole Version B.06.00. Хроматографическое разделение проводили на колонке Kromasil Eternity XT-2.5-C18 (Швеция) длиной 100 мм, с внутренним диаметром 2.1 мм, с размером зерна сорбента 2.5 мкм и предколонке Kromasil Eternity 2.1 × 10 мм. Детектирование аналитов и внутреннего стандарта осуществляли с помощью метода тандемной масс-спектрометрии (МС/МС) в режиме записи сигналов выбранных ионных реакций (MRM) для отрицательно заряженных ионов при температуре ионизации 350°C, потоке газа 10 л/мин и давлении небулайзера 40 psi.
Изучение эффективности действия СФБЗ против Trichinella spiralis на лабораторной модели проводили на 70 инбредных белых мышах BALB/c (генотип – b, c, H-2d) обоих полов (16–18 г) возраста 1.5–2 мес., полученных из питомника “Столбовая” (ФГБУН НЦБМТ ФМБА России). Мыши находились на карантине в течение 7 сут до опыта в условиях свободного доступа к корму и воде в соответствии с ежедневными нормами кормления РФ (Приказ МЗ СССР № 1179 от 10.10.1983 г. “Об утверждении нормативов затрат кормов для лабораторных животных в учреждениях здравоохранения”). Мышей содержали в виварии при 22оС и влажности 60–70% с естественным и искусственным освещением. Животных распределяли на группы случайным образом с одинаковой массой тела.
Инвазионные личинки T. spiralis были выделены методом переваривания мышечной ткани крыс. Пробы выдерживали в переваривающей жидкости (20 мл концентрированной HCl, 1000 мл физиологического раствора и 20 г пепсина) при 37°С в течение 12 ч в условиях постоянного встряхивания в механическом встряхивателе. Затем после двойной седиментации при 1000 об./2 мин при добавлении 1.5% желатина в физиологический раствор получили суспензию личинок. Для подсчета числа выделенных личинок использовали хемоцитометр. После 12-часового голодания мышам в желудок вводили с помощью атравматического зонда 200 личинок T. spiralis на мышь (Астафьев и др., 1989). На 3-и сут после заражения животных разделили на группы (6 экспериментальных и одну контрольную) по 10 мышей в каждой. Животным 1, 2 и 3-й группы вводили СФБЗ в дозах соответственно 3.0, 2.0 и 1.0 мг/кг по ДВ в крахмальном геле. Мыши 4-й и 5-й групп получали субстанцию ФБЗ (без механохимической обработки) в дозах 5 и 1.0 мг/кг в крахмальном геле соответственно. Физическую смесь того же состава (ФБЗ/ ЭС/НДОСС в соотношении 1.0 : 8.9 : 0.1) назначали животным 6-й группы в дозе 1.0 мг/кг. Мыши контрольной группы получали 1%-ный крахмальный гель в соответствующем объеме. На 3-и сут после введения препаратов провели декапитацию мышей всех групп.
Гельминтологическое вскрытие тонкого кишечника мышей проводили на 3-и сут после введения препаратов. Тонкий кишечник мышей вскрывали ножницами по всей длине, помещали в физиологическом растворе в аппарат Бермана, затем термостатировали при 37–39оС в течение 2 ч, после чего исследовали седимент под бинокулярной лупой и подсчитывали число обнаруженных T. spiralis (Астафьев и др., 1989; Архипов и др., 2019).
Антигельминтную эффективность СФБЗ изучали в овцеводческой ферме в Самарской обл. (ООО “Измайлов”). Опыты проводили в период максимального подъема зараженности в 2019 г. Всего в опыте были использованы 284 головы молодняка овец различных пород с массой тела от 16 до 37 кг, включая спонтанно зараженных Nematodirus spp. (60 овец) и другими видами желудочно-кишечных стронгилят (55 овец). Овец содержали в станках (без выпаса), и кормили согласно соответствующим нормам, обеспечивали водой вдоволь и распределяли на группы с равным числом яиц в 1 г фекалий на основании количественного учета яиц гельминтов методом McMaster (MAFF, 1986). В расчетах использовали среднее геометрическое число яиц гельминтов в 1 г фекалий (Wood et al., 1995). По результатам исследований проб фекалий овец разделили на 6 равных групп по 7–10 голов в каждой (MAFF, 1986). Животные 1, 2 и 3-й групп получали СФБЗ в форме 10%-ного порошка однократно в дозах 1.0, 2.0 и 3.0 мг/кг по ДВ соответственно. Животным 4-й и 5-й групп назначали субстанцию ФБЗ в дозах 1.0 и 5.0 мг/кг соответственно. Овцы контрольной группы препарат не получали. Эффективность применения СФБЗ при нематодозах овец определяли по результатам исследования проб фекалий методом McMaster до и через 15–18 сут после лечения. Идентификацию нематод проводили на основании их морфологии в фекалиях. Эффективность препаратов подсчитывали по снижению среднего геометрического числа яиц нематод до и после лечения (MAFF, 1986; Wood et al., 1995).
Статистическую обработку полученных данных проводили с помощью компьютерной программы SAS №9.4 SoftwareforWindows. Microsoft Excel PK Solver 2.0 использовали для обсчета данных фармакокинетических кривых с использованием однокамерной модели (Zhang et al., 2010). Математический анализ проводили по среднему числу гельминтов с помощью параметрического t-теста для сравнения разницы между лечеными и контрольными группами (Р ≤ 0.05).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Метод механохимической модификации ФБЗ с ЭС и НДОСС использовали для получения СФБЗ. Подтверждением образования комплекса служит повышение растворимости, что подтверждено данными ВЭЖХ-анализа. При этом в количественном выражении данные растворимости представлены в табл. 1, из которой видно повышение растворимости до 27 раз. При этом растворимость физической смеси (без механохимической обработки) повысилась незначительно, в 2.6 раза.
Таблица 1.
Растворимость субстанции фенбендазола (ФБЗ) и его твердой дисперсии с экстрактом солодки (ЭС) и натрия диоктилсульфосукцинатом (НДОСС)
| Название образца и соотношение компонентов | Время механообработки, мин | Растворимость | |
|---|---|---|---|
| абсолютная, мг/л | увеличение, раз | ||
| ФБЗ – исходный образец | – | 1.0 | – |
| ФБЗ : ЭС : НДОСС – 1 : 8.9 : 0.1 | 30 | 7.4 | 7 |
| То же | 150 | 14.8 | 15 |
| » | 240 | 25.3 | 25 |
| » | 420 | 26.9 | 27 |
| ФБЗ : ЭС : НДОСС – 1 : 8.9 : 0.1 – физическая смесь | – | 2.6 | 3 |
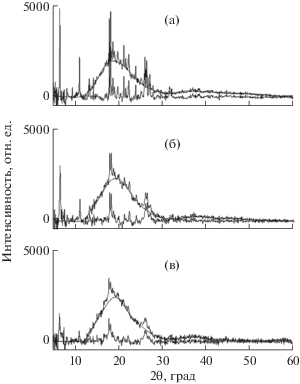
РФА использовали для выявления разницы в композициях ФБЗ и ЭС, при этом наличие НДОСС не учитывали из-за его незначительного содержания в твердой дисперсии (не более 1%). Сопоставление дифрактограмм исходного ФБЗ и его измельченной композиции (2 ч механообработки LE-101 при модуле 1 : 25) указывает на то, что при такой механообработке кристалличность исходного ФБЗ не изменяется (рис. 1), несмотря на снижение интенсивности рефлексов, что наглядно отображается на рис. 1б. Сделан вывод лишь о микронизации образца ФБЗ с сохранением исходной кристалличности. Однако добавление к кристаллическому ФБЗ аморфно-кристаллического образца полимера ЭС (кристалличность 20% из-за наличия в ЭС до 25% ГК) и проведение совместной механообработки позволили снизить кристалличность ФБЗ до 20% (рис. 2).
Рис. 1.
Рефлексы отражения исходного (1) и измельченного (2) образцов фенбендазола. а – общий вид дифрактограммы; б – увеличенный размер фрагмента дифрактограммы.
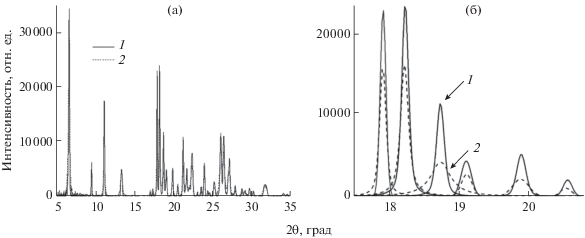
Рис. 2.
Рефлексы отражения твердой дисперсии состава ФБЗ : ЭС (1 : 9) в виде физической смеси (а) и после механообработки: 120 (б) и 420 мин (в).
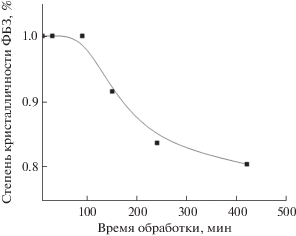
Обработка результатов РФА показывает, что степень аморфизации ФБЗ в ТД состава ФБЗ : ЭС (1 : 9) достигает оптимального значения (10%) уже при механообработке в течение 150 мин и дальнейшая обработка (вплоть до 420 мин) не позволяет существенно снизить кристалличность ФБЗ (рис. 3).
Рис. 3.
Влияние времени механообработки на снижение степени кристалличности фенбендазола (ФБЗ) в твердой дисперсии после механообработки до 420 мин.
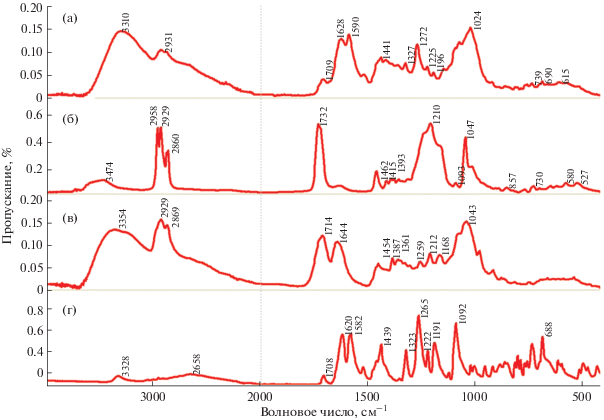
При анализе ИК-спектров (рис. 4) было установлено, что в процессе совместной механообработки субстанции ФБЗ с ЭС и НДОСС не происходит механодеструкции лекарственного вещества. Кроме этого в твердой дисперсии содержатся частоты поглощения исходного ФБЗ с незначительным смещением в область повышения частот на 1–7 см–1. И лишь полосы 3310 и 1092 см–1, характерные для исходного ФБЗ, смещаются в область снижения частот до 8 см–1. Эти данные позволяют предполагать образование межмолекулярного комплекса ФБЗ с компонентами твердой дисперсии. Сравнение ИК-спектров СФБЗ с ИК-спектром ГК (действующего вещества ЭС) показывает, что чаще всего наблюдается смещение основных характеристичных полос ГК в область повышения частот 5–19 см–1, что свидетельствует об участии групп ГК в образовании комплексов включения и было отмечено ранее (Khalikov et al., 2019).
Рис. 4.
ИК-спектры твердой дисперсии фенбендазола (ФБЗ) с экстрактом солодки (ЭС) и натрия диоктилсульфосукцинатом (НДОСС) (а), ИК-спектры НДОСС (б), ЭС (в) и ФБЗ (г).
При изучении физико-химических свойств было установлено, что повышается растворимость СФБЗ, уменьшаются размеры частиц ФБЗ, происходят потеря кристалличности ФБЗ и его аморфизация, однако деструктивных изменений молекулы ФБЗ в условиях механообработки отмечено не было. Вероятно, ФБЗ локализуется на поверхности и в порах молекул ЭС и НДОСС, что изменяет особенности и свойства действующего вещества, и носители транспортируют его через клеточные мембраны.
Результаты исследований, полученные нами при изучении особенностей фармакокинетики ФБЗ и его метаболитов в организме овец, показали существенную разницу в метаболизме ФБЗ после введения базового препарата и супрамолекулярного комплекса в равной дозе (по 2.0 мг/кг по ДВ). ФБЗ и его метаболиты (сульфоксид и сульфон) начали обнаруживать в сыворотке крови овец через 2 ч после однократного перорального введения супрамолекулярной формы и только через 5–6 ч после применения базового препарата – ФБЗ. Максимальное содержание ФБЗ и его метаболитов было отмечено в сыворотке крови овец через 28–42 ч после введения СФБЗ и составило соответственно 50.2, 41.2 и 43.2 против 19.1, 16.4 и 18.8 нг/мл после применения базового ФБЗ, что почти в 2.5 раза ниже показателей СФБЗ.
Фармакокинетические параметры ФБЗ и его метаболитов, представленные в табл. 2, свидетельствуют о значительном повышении скорости абсорбции и времени поступления их в кровь. Так, скорость абсорбции ФБЗ после введения базового препарата составила 0.032 ч–1, а после введения супрамолекулярной формы – 0.060 ч–1. Время всасывания в кровь половины введенной дозы было равно соответственно 25.60 и 13.88 ч, т.е. ФБЗ в супрамолекулярной форме всасывается почти в 2 раза быстрее. Отмечали значительную разницу в показателях клиренса базового и супрамолекулярного фенбендазола. Максимальная концентрация ФБЗ в сыворотке крови овец составила после введения супрамолекулярной формы 50.62 нг/мл, что в 2.5 раза выше максимальной концентрации базового препарата (19.84 нг/мл). Значительное повышение было отмечено и в концентрации метаболитов в крови овец, которым вводили супрамолекулярную форму. Период полувыведения ФБЗ был в 3.5 раза больше после применения СФБЗ. Время удерживания ФБЗ в системном кровотоке овец составило 61.60 и 364.22 ч соответственно после введения базового и СФБЗ.
Таблица 2.
Фармакокинетические параметры фенбендазола и его метаболитов в организме овец после введения базового и супрамолекулярного фенбендазола в дозе 2.0 мг/кг по действующему веществу
| Показатель | Фенбендазол | Сульфоксид | Сульфон | |||
|---|---|---|---|---|---|---|
| М | RSD | М | RSD | М | RSD | |
| Базовый фенбендазол | ||||||
| ka, ч–1 | 0.032 | 6.6 | 0.038 | 1.6 | 0.031 | 3.0 |
| t1/2ka, ч | 25.60 | 6.4 | 18.30 | 1.7 | 19.10 | 3.0 |
| CL, л/ч | 0.94 | 6.4 | 1.58 | 3.0 | 1.34 | 3.2 |
| Cmax, нг/мл | 19.84 | 1.8 | 16.70 | 1.6 | 18.20 | 1.8 |
| Tmax, ч | 40.42 | 6.0 | 27.60 | 2.2 | 27.82 | 2.8 |
| T1/2, ч | 28.82 | 6.4 | 20.10 | 2.8 | 21.56 | 3.0 |
| AUC0 – t, нг/(мл ч) | 1154.16 | 6.8 | 928.12 | 2.4 | 1014.12 | 3.4 |
| МRТ, ч | 61.60 | 7.44 | 54.18 | 2.6 | 55.36 | 3.0 |
| Супрамолекулярный фенбендазол | ||||||
| ka, ч–1 | 0.060 | 5.4 | 0.034 | 2.0 | 0.028 | 4.0 |
| t1/2ka, ч | 13.88 | 8.2 | 21.50 | 1.8 | 26.42 | 4.2 |
| CL, л/ч | 0.22 | 7.0 | 0.50 | 5.2 | 0.40 | 6.2 |
| Cmax, нг/мл | 50.62 | 4.0 | 41.74 | 4.4 | 42.14 | 4.6 |
| Tmax, ч | 42.82 | 9.0 | 31.68 | 2.6 | 40.18 | 4.0 |
| T1/2, ч | 102.22 | 11.2 | 24.58 | 3.4 | 28.60 | 3.4 |
| AUC0 – t, нг/(мл ч) | 3044.68 | 3.8 | 2482.64 | 4.2 | 2466.20 | 4.8 |
| МRТ, ч | 364.22 | 9.4 | 69.08 | 2.6 | 88.40 | 4.0 |
Примечание. M – среднее значение показателя, RSD – относительное стандартное отклонение, ka – константа скорости абсорбции, t1/2ka – время всасывания в кровь 1/2 введенной дозы, CL – клиренс, Cmax – максимальная концентрация, Tmax – время достижения максимальной концентрации, T1/2 – период полувыведения, AUC0 – t– площадь под кривой “концентрация действующего вещества–время” в интервале времени от 0 до момента t отбора последней пробы биоматериала, МRТ – время удержания в кровотоке.
Значения показателей фармакокинетики ФБЗ и его метаболитов в организме овец значительно различаются при применении базового и супрамолекулярного фенбендазола в равной дозе 2 мг/кг по ДВ и свидетельствуют о большем уровне абсорбции СФБЗ, что может приводить к изменению его биологической активности.
Испытания СФБЗ на белых мышах, зараженных T. spiralis, показали его высокую нематодоцидную активность (табл. 3). В ходе проведенных опытов было установлено, что СФБЗ в дозах 3.0, 2.0 и 1.0 мг/кг по ДВ показал соответственно 100, 99.73 и 96.27%-ную эффективность. При этом в тонком кишечнике животных обнаруживали соответственно 0, 0.230 и 3.163 экз. T. spiralis. Субстанция ФБЗ (базовый препарат) показала в дозе 5 мг/кг 95.97%-ный эффект, а в дозе 1 мг/кг – 13.7%-ную эффективность против T. spiralis. Физическая смесь ФБЗ : ЭС : ДССН в соотношении 1 : 8.9 : 0.1 показала в дозе 2 мг/кг по ДВ 24.17%-ную антигельминтную активность. У животных контрольной группы обнаруживали в среднем по 84.726 экз. T. spiralis.
Таблица 3.
Эффективность использования супрамолекулярного фенбендазола (СФБЗ) против Trichinella spiralis
| Группа мышей | Препарат | Доза, мг/кг по ДВ | Геометрическое среднее число нематод, экз. | Эффективность*, % |
|---|---|---|---|---|
| Контроль | Плацебо | – | 84.72 | – |
| Опытная | СФБЗ | 3.0 | 0 | 100** |
| » | » | 2.0 | 0.230 | 99.73** |
| » | » | 1.0 | 3.163 | 96.27** |
| » | ФБЗ-субстанция | 5.0 | 3.417 | 95.97** |
| » | » | 1.0 | 73.125 | 13.70 |
| » | ФБЗ : ЭС : НДОСС физическая смесь | 2.0 | 64.247 | 24.17 |
Полученные результаты испытания СФБЗ при гельминтозах овец показали различную степень эффективности использования препарата в разных дозах (табл. 4). СФБЗ продемонстрировал в дозах 3.0, 2.0 и 1.0 мг/кг по ДВ соответственно 100, 98.21 и 95.64%-ную эффективность против Nematodirus spp. по результатам копроовоскопических исследований методом McMaster. После введения комплекса в дозе 2.0 мг/кг по ДВ 8 из 10 леченых овец освободились от гельминтов, и число яиц нематодирусов снизилось на 98.21%. Эффективность введения комплекса в дозе 1 мг/кг составила 95.64%, и 6 из 10 животных освободились от инвазии. Значения эффективности введения базового препарата – субстанции ФБЗ в дозах 5 и 1 мг/кг по ДВ – составили соответственно 95.58 и 16.22%.
Таблица 4.
Эффективность супрамолекулярного фенбендазола (СФБЗ) при желудочно-кишечных стронгилятозах овец
| Препарат | Доза по ДВ, мг/кг | Число овец в группе | Число овец, освободившихся от инвазии | Среднее число яиц гельминтов в 1 г фекалий | Снижение числа яиц гельминтов в фекалиях, % | |
|---|---|---|---|---|---|---|
| до лечения | после лечения | |||||
| Нематодироз | ||||||
| СФБЗ | 3.0 | 10 | 10 | 174.5 ± 7.1 | 0 | 100* |
| » | 2.0 | 10 | 8 | 178.6 ± 6.8 | 3.2 | 98.21* |
| » | 1.0 | 10 | 6 | 180.2 ± 7.2 | 7.8 ± 1.2 | 95.64* |
| ФБЗ | 1.0 | 10 | 0 | 177.0 ± 6.9 | 149.8 ± 5.7 | 16.22 |
| » | 5.0 | 10 | 5 | 171.6 ± 6,8 | 7.9 ± 1.2 | 95.58* |
| Контроль | – | 10 | 0 | 173.7 ± 6.9 | 178.8 ± 7.7 | – |
| Другие стронгилятозы пищеварительного тракта | ||||||
| СФБЗ | 3.0 | 10 | 10 | 193.4 ± 7.2 | 0 | 100* |
| » | 2.0 | 9 | 7 | 191.6 ± 6.9 | 4.1 ± 1.0 | 97.94* |
| » | 1.0 | 9 | 4 | 198.2 ± 7.0 | 9.0 ± 1.2 | 95.47* |
| ФБЗ | 1.0 | 9 | 0 | 189.6 ± 7.1 | 158.4 ± 5.6 | 20.25 |
| » | 5.0 | 9 | 5 | 195.3 ± 7.2 | 8.6 ± 1.4 | 95.67* |
| Контроль | – | 9 | 0 | 192.6 ± 7.3 | 198.6 ± 7.4 | – |
СФБЗ показал 100, 97.94 и 95.47%-ную эффективность против других желудочно-кишечных стронгилят овец в дозах соответственно 3.0, 2.0 и 1.0 мг/кг по ДВ. Субстанция ФБЗ в дозах 5 и 1 мг/кг по ДВ проявила 95.67 и 20.25%-ную антигельминтную активность при обнаружении в 1 г фекалий овец контрольной группы 192.6 ± 7.3 и 198.6 ± 7.4 экз. до и в конце опыта. Следовательно, эффективность введения СФБЗ была в 4.7–5.8 раза выше эффективности введения субстанции ФБЗ.
Повышение антигельминтной эффективности комплекса, по нашему мнению, обусловлено ролью механохимической технологии и применением для адресной доставки НДОСС и ЭС, что позволило увеличить растворимость препарата в воде. Значительное повышение биологической активности СФБЗ связано также с повышением биодоступности и изменением метаболизма ФБЗ в форме супрамолекулярного комплекса.
Таким образом, проведенные исследования подтвердили повышение биологической активности СФБЗ, полученного по механохимической технологии с добавлением ЭС и НДОСС в опытах на лабораторной модели трихинеллеза белых мышей и на овцах, спонтанно инвазированных стронгилятами пищеварительного тракта в дозе, которая была в 2.5 раза меньше дозы базового препарата ФБЗ, рекомендованной согласно инструкции. Увеличение антигельминтного действия, по нашему мнению, связано с уменьшением размеров частиц ФБЗ, потерей его кристалличности и аморфизации, включением его молекул на поверхность и в поры ЭС и НДОСС и, как следствие, повышением растворимости и проницаемости через биологические мембраны.
Авторы выражают благодарность А.Н. Озерину (ИСПМ РАН) за помощь при изучении дифрактограмм образцов СМКФ и их анализа, а также К.М. Садову и специалистам овцеводческих хозяйств за помощь в проведении полевых опытов.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования РФ.
Список литературы
Архипов И.А. Антигельминтики: фармакология и применение. М.: РАСХН, 2009. 406 с.
Архипов И.А., Варламова А.И., Одоевская И.М. Методические рекомендации по испытанию и оценке эффективности препаратов при трихинеллезе и гименолепидозе на лабораторной модели // Рос. паразитол. журн. 2019. № 13. С. 58–63.
Астафьев Б.А., Яроцкий Л.С., Лебедева М.Н. Экспериментальные модели паразитозов в биологии и медицине. М.: Наука, 1989. 278 с.
Варламова А.И. Спектр антигельминтной активности супрамолекулярного комплекса фенбендазола с арабиногалактаном // Рос. паразитол. журн. 2017. № 1. С. 78–83.
Варламова А.И., Архипов И.А., Халиков С.С., Садов К.М. Эффективность фенбендазола на основе наноразмерной супрамолекулярной системы доставки с поливинилпирролидоном и диоктилсульфосукцинатом натрия при гельминтозах // Рос. паразитол. журн. 2019. № 1. С. 56–63.
ГОСТ 32834-2014. Продукты пищевые, продовольственное сырье. Метод определения остаточного содержания антгельминтиков с помощью высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектором. Дата введения 01.01.2016. М.: Стандартинформ, 2015. 20 с.
Душкин А.В., Сунцова Л.П., Халиков С.С. Механохимическая технология для повышения растворимости лекарственных веществ // Фармацевт. исследования. 2013. № 1. С. 448–457.
Кочетков П.П., Варламова А.И., Абрамов В.Е., Мисюра И.А., Абрамова Е.В., Абрамов С.В., Кошеваров Н.И., Архипов И.А. Определение фенбендазола и его метаболитов в молоке коров методом жидкостной хроматографии с масс-спектрометрическим детектированием // Рос. паразитол. журн. 2016. № 4. С. 554–562.
Могилевская Е.Л., Акопова Т.А., Зеленецкий А.Н., Озерин А.Н. О кристаллической структуре хитина и хитозана // Высокомолек. соединения. 2006. №2. С. 216–226.
Радионов А.В., Архипов И.А. Распространение нематодозов крупного рогатого скота при разной технологии содержания в России // Рос. паразитол. журн. 2010. № 4. С. 89–93.
Сафиуллин Р.Т. Распространение и экономический ущерб от основных гельминтозов жвачных // Ветеринария. 1997. № 6. С. 28–32.
Селютина О.Ю., Апанасенко И.Е., Поляков Н.Э. Исследование мембраномодифицирующей активности глицирризиновой кислоты // Изв. РАН. Сер. хим. 2015. № 7. С. 1555–1559.
Хабриев Р.У. Руководство по экспериментальному (доклиническому) изучению новых фармакологических субстанций. М.: Медицина, 2005. 832 с.
Шамхалов В.М., Магомедов О.А., Шамхалов М.В., Гюльахмедова Н.Х., Бакриева Р.М. Распространение кишечных гельминтозов овец в Дагестане // Рос. паразитол. журн. 2015. № 2. С. 61–64.
Alexander L.E. X-ray diffraction methods in polymer science. N.Y.: Intersci.-John Wiley, 1969. 119 p.
Arkhipov I.A., Khalikov S.S., Sadov K.M., Dushkin A.V., Meteleva E.S., Varlamova A.I., Odoevskaya I.M., Danilevskaya N.V. Influence of mechanochemical technology on anthelmintic efficacy of the supramolecular complex of fenbendazole with polyvinylpyrrolidone // J. Adv. Vet. Anim. Res. 2019. V. 6(1). P. 133–141.
Boldyrev V.V. Mechanochemical modification and synthesis of drugs // J. Mater. Sci. 2004. V. 39. P. 5117–5120.
Bushra M., Shahardar R.A., Allaie I.M., Wani Z.A. Efficacy of closantel, fenbendazole and ivermectin against GI helminths of cattle in central Kashmir // J. Parasit. Dis. 2019, V. 43(2). P. 289–293.
Campbell W.C., Rew R.S. Chemotherapy of parasitic diseases. New York; London: Plenum Press, 1986. 655 p.
Dushkin A.V., Tolstikova T.G., Khvostov M.V., Tolstikov G.A. Complexes of polysaccharides and glycyrrhizic acid with drug molecules. Mechanochemical synthesis and pharmacological activity / Ed. Karunaratn D.N. // The complex world of polysaccharides. Croatia: InTech, 2012. P. 573–602.
Goossens E., Dorny P., Vercammen F., Vercruysse J. Field evaluation of the efficacy of fenbendazole in captive wild ruminants // Vet. Rec. 2005. V. 157(19). P. 582–586.
Graebin C.S. The pharmacological activities of glycyrrhizinic acid (“Glycyrrhizin”) and glycyrrhetinic Acid / Eds Merillon J.M., Ramawat K. Sweeteners. Reference Series in Phytochemistry. Cham.: Springer, 2016.
Hetenyi G., Griesser J., Moser M., Demarne F., Jannin V., Bernkop-Schnurch A. Comparison of the protective effect of self-emulsifying peptide drug delivery systems towards intestinal proteases and glutathione // Inter. J. Pharm. 2017. V. 523 (1). P. 357–365.
Khalikov S.S., Lokshin B.V., Ilyin M.M., Varlamova A.I., Musaev M.B., Arkhipov I.A. Methods for obtaining solid dispersions of drugs and their properties // Russ. Chem. Bull. 2019. V. 68. P. 1924–1932.
Kong R., Zhu X., Meteleva E.S., Chistyachenko Y.S., Suntsova L.P., Polyakov N.E., Khvostov M.V., Baev D.S., Tolstikova T.G., Yu J., Dushkin A.V., Su W. Enhanced solubility and bioavailability of simvastatin by mechanochemically obtained complexes // Inter. J. Pharm. 2017. V. 534. P. 108–118.
Krishnaian Y.S. Pharmaceutical technologies for enhancing oral bioavailability of poorly soluble drugs // J. Bioequival. Bioavailab. 2010. V. 2(2). P. 28–36.
Loftsson T., Vogensen S., Brewster M.E., Konraosdottir F. Effects of cyclodextrins on drug delivery through biological membranes // J. Pharm. Sci. 2007. V. 10. P. 2532–2546.
Marchessault R.H., Ravenelle F., Zhu X.X. Polysaccharides for drug delivery and pharmaceutical applications. Washington D.C.: Am. Chem. Soc., 2006. 365 p.
Ministry of Agriculture Fisheries and Food. Manual of veterinary parasitological laboratory techniques. Reference Book 418. London: Her Majesty’s Stationery Office, 1986. 160 p.
Riviere J.E., Papich M.G. Veterinary pharmacology & therapeutics. 9thed. Hoboken: Willey-Blackwell, 2009. 1541 p.
Ruland W. X-ray determination of crystallinity and diffuse disorder scattering // Acta Cryst. 1961. V. 14. P. 1180–1185.
Selutina O.Yu., Polyakov N.E., Korneev D.V., Zaitsev B.N. Influence of glycyrrhizin on permeability and elasticity of cell membrane: perspectives for drugs delivery // Drug Deliv. 2016. V. 23 (3). P. 848–855.
Tramboo S.R., Shahardar R.A., Allaie I.M., Wani Z.A., Abbas M. Efficacy of ivermectin, closantel and fenbendazole against gastrointestinal nematodes of sheep in Kashmir valley // J. Parasit. Dis. 2017. V. 41. P. 380.
Vemula V.R., Lagishetty V., Lingala S. Solubility enhancement techniques // Inter. J. Pharm. Sci. Rev. Res. 2010. V. 5(1). P. 41–51.
Wagh V.T., Wagh R.D. Solid dispersion techniques for enhancement of solubilization and biovailability of poorly water soluble drugs – a review // Inter. J. Pharm. Technol. 2015. V. 6 (4). P. 3027–3045.
Wood I.B., Amaral N.K., Bairden K., Dunkan J.L., Kassai T., Malone J.B., Pancavich J.A., Reinecke R.K., Slocombe O., Taylor S.M., Vercruysse J. World Association for the Advancement of Veterinary Parasitology (WAAVP) second edition of guidelines for evaluating the effectiveness of anthelmintics in ruminants (bovine, ovine, caprine) // Vet. Parasitol. 1995. V. 58. P. 181–213.
Yanghuan Ye., Zhang X., Zhang T., Wang H., Wu B. Design and evaluation of injectable niclosamide nanocrystals prepared by wet media milling technique // J. Drug Dev. Ind. Pharm. 2015. V. 41 (9). P. 1416–1424.
Zhang Y., Huo M., Zhou J., Xie S. PK Solver: An add-in program for pharmacokinetic and pharmacodynamic data analysis in Microsoft Excel // Comp. Meth. Programs Biomed. 2010. V. 99(3). P. 306–314.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


