Известия РАН. Серия биологическая, 2020, № 6, стр. 604-615
Регуляция накопления фенольных соединений в каллусной культуре чайного растения при раздельном и совместном действии света и ионов кадмия
М. Ю. Зубова 1, *, Т. Л. Нечаева 1, А. В. Карташов 1, Н. В. Загоскина 1
1 Институт физиологии растений им. К.А. Тимирязева РАН
127276 Москва, ул. Ботаническая, 35, Россия
* E-mail: mariaz1809@gmail.com
Поступила в редакцию 22.06.2020
После доработки 25.06.2020
Принята к публикации 25.06.2020
Аннотация
Исследовано влияние света и ионов кадмия (Cd) на морфофизиологические характеристики и накопление низкомолекулярных антиоксидантов фенольной природы в каллусной культуре чайного растения Camellia sinensis L. при раздельном и совместном их действии. Установлено, что световое воздействие и поступление Cd по отдельности приводили к изменению морфофизиологических характеристик культуры, снижению ее ростовой активности и активизации работы антиоксидантной системы. Отмечено, что это проявлялось в повышении суммарного содержания фенольных соединений, флаванов и в меньшей степени проантоцианидинов и не зависело от активности ключевого фермента фенольного метаболизма L-фенилаланинаммиаклиазы. Обнаружено, что при действии Cd ответ клеток был выражен в большей степени, чем при действии света, а в ряде случаев эти показатели коррелировали с уровнем перекисного окисления липидов в каллусных культурах. Показано, что при совместном действии света и Cd все изменения были выражены в большей степени.
Характерная особенность высших растений – способность к образованию различных вторичных метаболитов (Носов, 2005; Chezem, Clay, 2016). К ним относятся фенольные соединения (ФС) или полифенолы, присутствующие во всех растительных клетках и тканях (Запрометов, 1993; Bidel et al., 2010). Известно участие ФС в процессах роста и развития растений, фотосинтезе, дыхании, а также защите от различных стрессовых воздействий (Cheynier et al., 2013; Kubalt, 2016; Baskar et al., 2018).
ФС относятся к низкомолекулярным компонентам антиоксидантной системы защиты растительных клеток (Agati et al., 2012). Так как в их структуре имеются свободные гидроксильные группы, ФС вступают в реакции с активными формами кислорода (АФК), тем самым снижая их токсическое действие и препятствуя развитию окислительного стресса. ФС сохраняют свою биологическую активность и в организме человека (Тараховский и др., 2013). Известны их антиоксидантное, антитоксическое, антиканцерогенное, противовоспалительное, антибактериальное действия, благодаря чему они успешно используются в фармакологии и медицине для лечения и профилактики многих заболеваний (Nile et al., 2018; Durazzo et al., 2019).
Накоплению ФС в растительных тканях могут способствовать различные биотические и абиотические воздействия (Li et al., 2020), в частности свет, активирующий многие ферменты фенольного метаболизма, что приводит к повышению образования полифенолов (Hong et al., 2014). Кроме того, световое воздействие способствует образованию хлоропластов, которые относятся к основным местам биосинтеза этих вторичных метаболитов (Загоскина и др., 2000; Hong et al., 2014). В то же время при определенных условиях свет может быть и стрессовым фактором для растительных клеток, приводящим к подавлению синтеза ФС (Mukhopadhyay, 2016). Все это свидетельствует о “неоднозначности” светового воздействия на накопление полифенолов в растениях.
В условиях современной действительности влияние на метаболический потенциал растений могут оказывать не только природные факторы, но и различные антропогенные стрессоры, в частности поллютанты. К наиболее агрессивным их представителям относятся тяжелые металлы, которые в значительных концентрациях могут накапливаться в почве и затем поступать в растения, нарушая при этом естественное протекание в них метаболических процессов (Asati et al., 2016; Song et al., 2017). Один из опасных их представителей – кадмий (Сd) (Huang et al., 2017). Этот элемент относится к тем представителям тяжелых металлов, которые не участвуют в клеточном метаболизме и токсичны даже в низких концентрациях. Поступление Сd в растения сопровождается нарушением транспорта веществ, ингибированием фотосинтеза, изменением водного и гормонального статусов, а также ряда других физиолого-биохимических процессов (Серегин, Иванов, 2001; Ismael et al., 2019). Кроме того, Сd инициирует развитие окислительного стресса в растительных клетках, обусловленное нарушением баланса между генерацией и удалением АФК (Zaid et al., 2020). В восстановлении этого баланса важную роль играют и ФС как компоненты антиоксидантной системы защиты (Foti, Amorati, 2016; Baskar et al., 2018).
При изучении ответных реакций растительных клеток на действие различных факторов удачным объектом могут служить культивируемые в условиях in vitro клетки и ткани растений (Nosov, 2012; Espinosa-Leal et al., 2018). Их преимущества – рост в строго контролируемых условиях, более простая внутриклеточная и внутритканевая организация, а также сохранение специфики метаболизма интактного растения (Бутенко, 1999; Matkowski, 2008). Именно на клеточных культурах растений были исследованы пути биосинтеза ФС, возможности регуляции их накопления гормоноподобными соединениями, углеводами и другими воздействиями (Dias et al., 2016). Однако до сих пор практически нет сведений о “первичном” влиянии света на образование ФС в культурах in vitro, в том числе в присутствии Cd, что аналогично процессу деэтиоляции растений в нормальных условиях и при действии техногенных факторов.
Перспективными объектами для изучения регуляции образования ФС и оценки их роли в устойчивости растительных клеток могут быть каллусные культуры растений чая, для которых характерен специализированный метаболизм, направленный на биосинтез различных классов ФС (Загоскина и др., 2003; Sutini et al., 2016). Показано, что они сохраняют способность к образованию флаванов – веществ с Р-витаминной капилляроукрепляющей активностью (Загоскина и др., 2000; Hong et al., 2014).
Цель работы – изучение роста и накопления низкомолекулярных антиоксидантов фенольной природы у in vitro культур чайного растения при раздельном и совместном действии света и Cd.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали каллусные культуры стебля чайного растения C. sinensis L., выращиваемые в темноте (темновая культура, ТК) на основной питательной среде Хеллера, содержащей 2,4-дихлорфеноксиуксусную кислоту (5 мг/л), глюкозу (25 г/л), агар (7 г/л). При проведении опытов часть каллусных культур переносили в световые условия (световая культура, СК) и выращивали при 16-часовом фотопериоде (интенсивность 5000 лк). При изучении действия Сd к основной среде для культивирования ТК и СК добавляли Cd(NO3)2 в концентрации 25 мг/л, которая не вызывала гибели клеток и была подобрана в предварительных экспериментах.
Как контрольный, так и опытные варианты каллусной ткани чая выращивали в факторостатной камере при 26°С и относительной влажности воздуха 70%. Длительность пассажа составляла 6 нед. Анализировали культуры 20-, 30- и 40-сут возраста (соответственно середина и конец линейной, начало стационарной фаз роста). Для биохимических исследований материал фиксировали жидким азотом и хранили при –70°С до проведения определений.
Прирост каллусной ткани определяли стандартным методом, учитывая сырую массу каллусов в начале и в конце эксперимента (Носов, 2011). Содержание воды определяли после высушивания каллусов до постоянной массы при 70°С (Рогожин, Рогожина, 2013).
Содержание Cd в каллусной ткани определяли по стандартной методике (Ivanov et al., 2016). Для этого материал высушивали до постоянной массы при 60°С, заливали смесью концентрированных кислот HNO3 : HClO4 (2 : 1) и оставляли на 24 ч при комнатной температуре. Далее пробы инкубировали последовательно при 150°C (1.5 ч) и 180°C (2 ч) в термостате TDB-A-400 (BioSan, Латвия). Полученный раствор охлаждали, добавляли 5–6 капель 37%-ной H2O2 и доводили дистиллированной водой до объема 5 мл. Количество Cd в пробе определяли на атомно-абсорбционном спектрофотометре Формула ФМ400 (ЛабИст, Россия) с применением ламп с полым катодом (Hamamatsu Photonics, Япония). Прибор калибровали растворами Сd(NO3)2 в различной концентрации, приготовленными из стандартного раствора кадмия ГСО 7874-2000. Содержание Cd выражали в мг/г сухой массы.
Цитохимическое исследование локализации Cd в клетках каллусов чая проводили с помощью метода, основанного на способности дитизона образовывать окрашенные комплексы с этим металлом (Серегин и др., 2004). Небольшие кусочки каллусной ткани помещали в камеру микротома-криостата (Россия), замораживали в течение 58 мин при –18°С и получали срезы толщиной 25 мкм. Их помещали на предметное стекло в раствор дитизона (0.5 мг/мл) в смеси ацетон : дистиллированная вода (3 : 1), к 6 мл которого добавляли 1–2 капли ледяной уксусной кислоты для повышения чувствительности реакции. Препараты просматривали и фотографировали с помощью светового микроскопа (Ergaval, Германия).
Уровень перекисного окисления липидов (ПОЛ) в каллусных тканях определяли по содержанию малонового диальдегида (МДА), используя для этого реакцию с тиобарбитуровой кислотой (ТБК). Для этого навеску замороженного растительного материала (200 мг) гомогенизировали в 5 мл 0.1 М трис-HCl-буфера (рН 7.5), содержащего 0.35 М NaCl. К полученному гомогенату добавляли 1 мл 0.5%-ного раствора ТБК в 20%-ном водном растворе трихлоруксусной (ТХУ) кислоты. Реакционную смесь инкубировали на кипящей водяной бане в течение 30 мин и измеряли оптическую плотность раствора при 532 нм. Для расчета содержания МДА (мкмоль/г сухой массы) использовали коэффициент молярной экстинкции, равный 1.56 × 10–5 см–1 · М–1 (Hodges et al., 1999).
ФС извлекали из замороженного материала 96%-ным этанолом при 45°С в течение 40 мин (Олениченко, Загоскина, 2005), гомогенат центрифугировали (16 000 об./мин, 10 мин), а в надосадочной жидкости спектрофотометрическим методом определяли суммарное содержание растворимых ФС с реактивом Фолина–Дениса (поглощение при 725 нм), флаванов с ванилиновым реактивом (поглощение при 500 нм) и растворимых проантоцианидинов с бутанольным реактивом (поглощение при 550 нм) (Запрометов, 1971). Содержание суммы растворимых ФС и флаванов выражали в мг-экв. эпикатехина/г сухой массы, а содержание проантоцианидинов – в мг-экв. цианидина/г сухой массы.
Для определения активности L-фенилаланинаммиаклиазы (ФАЛ) замороженный материал гомогенизировали в 0.1 М Na-боратном буфере (рН 8.8), содержавшем 0.5 мМ ЭДТА и 3 мМ дитиотреитола, с добавлением водонерастворимого поливинилпирролидона (Олениченко, Загоскина, 2005). Гомогенат фильтровали, центрифугировали (25 000 об./мин, 20 мин), и надосадочную фракцию использовали в качестве “грубого” ферментного препарата для определения активности фермента. Все операции проводили на холоде при 4°C. Активность ФАЛ определяли спектрофотометрически по образованию из L-фенилаланина продукта реакции – транс-коричной кислоты (поглощение при 290 нм) в смеси, содержавшей 0.1 М Na-боратный буфер (рН 8.8), 0.01 М L-фенилаланин и “грубый” ферментный препарат (60 мкг белка/мл) в общем объеме 2 мл. Активность ФАЛ выражали в мкг транс-коричной кислоты/мг белка. Содержание белка определяли методом Брэдфорд (Bradford, 1976).
Опыт проводили в двух аналитических и трех биологических повторностях. Полученные результаты статистически обрабатывали с использованием программ SigmaPlot 12.3. и Microsoft Excel. На рисунках представлены средние арифметические значения определений и их стандартные ошибки (±SEM). Достоверность различий средних значений определяли по t-критерию Стьюдента при P ≤ 0.05 и обозначали ее разными латинскими буквами.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Морфофизиологические характеристики и рост культур. ТК представляла собой плотный каллус светло-бежевого цвета. К концу пассажа он приобретал более темный оттенок. Для ТК характерно постепенное увеличение свежей массы каллусов в течение всего пассажа (рис. 1). К концу пассажа ее прирост достигал 216%.
Рис. 1.
Прирост биомассы каллусных культур чайного растения, выращиваемых в темноте (ТК) или на свету (СК) на основной питательной среде (ТК, СК) или на среде с Cd (ТК + Cd, СК + Cd). Достоверные различия средних значений при P ≤ 0.05 отмечены разными латинскими буквами над барами; для рис. 1–5.
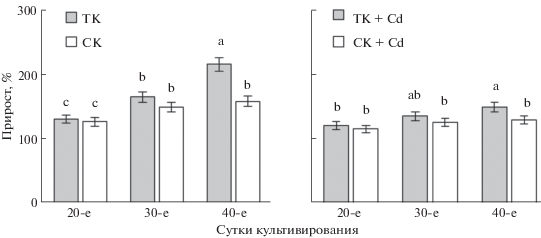
Перенесение каллусов чая в световые условия не вызывало значительных изменений в их морфофизиологических характеристиках. При этом к концу выращивания на поверхности СК отмечалось формирование небольших участков желто-зеленого цвета и отсутствовал темный оттенок, характерный для ТК. Следует также отметить, что в условиях светового воздействия происходило снижение прироста каллусной ткани: на 20-, 30- и 40-е сут он был на 3, 10 и 27% ниже такового у ТК соответственно (рис. 1). За весь период выращивания прирост свежей массы СК составил 158%.
Выращивание культур на питательной среде, содержащей поллютант, сопровождалось изменением их морфофизиологических характеристик по сравнению с культурами, растущими на основной среде. Каллусы становились менее плотными, приобретали светло-коричневый оттенок к 20-м сут роста, а к 40-м на их поверхности формировались участки темно-коричневого цвета. Оценивая рост каллусных тканей чая в присутствии поллютанта, можно отметить его снижение у ТК и СК соответственно на 31 и 18% ниже, чем в вариантах без Cd (рис. 1).
Важный показатель при оценке состояния клеток растений – их оводненность, приобретающая особое значение при действии стрессовых факторов (Brodersen, McElrone, 2013). В нашем случае у обеих культур чая в течение всего пассажа она была достаточно высокой и практически равной (94% у ТК и 93% у СК). При выращивании каллусов на среде с Cd содержание воды в клетках варьировало в тех же пределах, хотя можно отметить тенденцию к его снижению (92–93% у ТК и 92% у СК).
Содержание и локализация Cd. Для понимания воздействия Cd на рост и метаболизм in vitro культур чая было определено его содержание в каллусах в течение цикла выращивания (рис. 2а). У ТК количество этого металла постепенно повышалось по мере роста: минимальные значения были у 20-сут культуры, к 30-м сут содержание повышалось на 30%, а к 40-м еще на 19%. У СК содержание Cd уже на 20-е сут роста почти на 30% превышало таковое у ТК и сохранялось практически одинаковым до конца пассажа.
Рис. 2.
Содержание Cd (а) в каллусных культурах чайного растения различного возраста, выращиваемых на среде с Cd в темноте (ТК) или на свету (СК), и его локализация (б) в клетках (реакция с дитизоном).
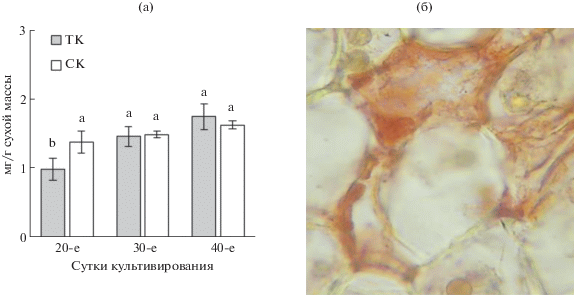
Определение внутриклеточной локализации Cd гистохимическим методом (по реакции с дитизоном) в ТК и СК показало его наличие в микровакуолях и вакуолярном пространстве (рис. 2б). Отмечено также его присутствие в клеточных стенках и межклетниках, которое не зависело от условий выращивания культур (свет, темнота).
Содержание МДА. Важный показатель состояния клеток растений – уровень ПОЛ, характеризующий баланс между образованием и утилизацией АФК, о котором судят по содержанию МДА (Agati et al., 2012). В каллусах ТК оно было низким на 20-е сут роста, к 30-м сут возрастало (на 59%), а к 40-м снижалось (на 34%), но превышало таковое начального этапа роста (рис. 3). Для СК тенденция изменения в содержании МДА была аналогичной, но с меньшими различиями на разных этапах роста. Наименьшие значения МДА были у 20-сут культуры, они были равны таковым у ТК этого возраста. К 30-м сут содержание МДА повышалось (на 44%), а к 40-м снижалось (на 25%). В целом уровень ПОЛ у СК был выше такового у ТК, а его изменения по мере роста культуры проявлялись в меньшей степени.
Рис. 3.
Содержание малонового диальдегида в каллусных культурах чайного растения различного возраста, выращиваемых в темноте (ТК) или на свету (СК) на основной питательной среде (ТК, СК) или на среде с Cd (ТК + Cd, СК + Cd).
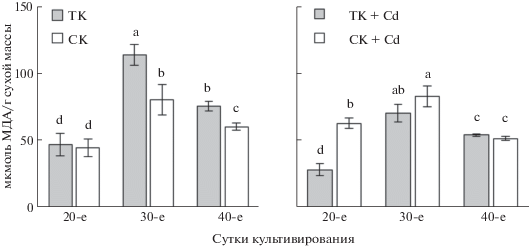
Судя по литературным данным, при воздействии Cd на клетки растений в большинстве случаев количество АФК в них повышалось, что часто сопровождалось увеличением уровня ПОЛ (Zaid et al., 2020). В нашем случае аналогичная тенденция отмечалась только у 20-сут СК, у которой содержание МДА на 30% превышало таковое в каллусе, культивируемом на среде без поллютанта (рис. 3). В остальных случаях оно было ниже или равно контрольному. При этом во всех вариантах наименьшее содержание МДА отмечено у 20-сут каллусов, более высокое – у 30-сут, которое снижалось к концу пассажа. Следует также отметить, что в условиях действия Cd более высокий уровень ПОЛ характерен для СК по сравнению с ТК, что противоположно его значениям у культур, растущих на основной среде.
Содержание суммы ФС. Основной показатель оценки уровня низкомолекулярных антиоксидантов фенольной природы – суммарное содержание ФС в растительной ткани (Загоскина и др., 2003). Определение этого параметра показало, что у обеих культур, выращиваемых на основной питательной среде, оно было наибольшим на 20-е сут роста, а затем снижалось в течение пассажа, что в большей степени было выражено у ТК (рис. 4а). У ТК суммарное содержание ФС к концу пассажа было в 2.7 раза ниже по сравнению с таковым на начальных этапах роста. У СК также отмечалось снижение этого показателя, но только до 30-х сут роста, а к концу пассажа оно было ниже, чем у 20-сут каллуса в 1.4 раза.
Рис. 4.
Содержание суммы фенольных соединений (а), флаванов (б) и проантоцианидинов (в) в каллусных культурах чайного растения различного возраста, выращиваемых в темноте (ТК) или на свету (СК) на основной питательной среде (ТК, СК) или на среде с Cd (ТК + Cd, СК + Cd).
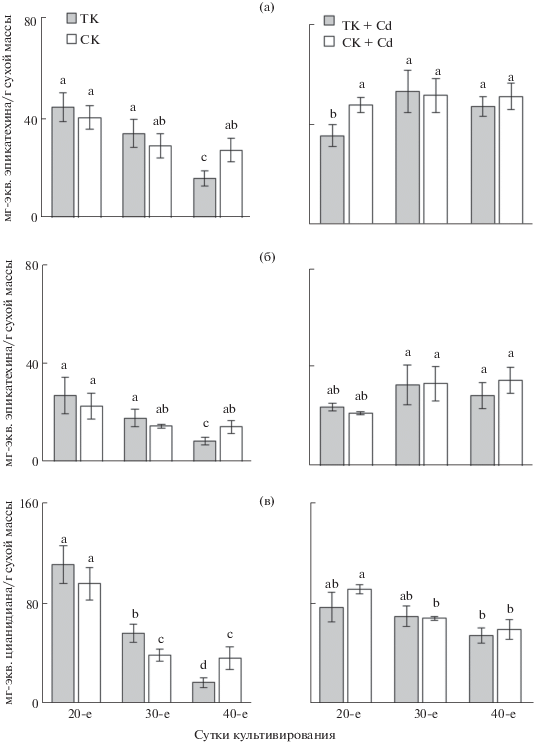
Иная тенденция отмечалась при выращивании культур чая на средах с Cd (рис. 4а). В этом случае у ТК на начальных этапах роста отмечалось наименьшее содержание суммы ФС в отличие от такового в контроле. К середине пассажа оно повышалось (на 33%) и статистически достоверно сохранялось таким до завершения цикла культивирования, хотя можно отметить незначительную тенденцию к его снижению. Следовательно, присутствие Cd в питательной среде приводило к накоплению ФС у ТК, которое в конце пассажа почти в 3 раза превышало таковое в контроле. Суммарное содержание ФС у СК, выращиваемой на среде с Cd, во-первых, на всех этапах роста превышало таковое в контрольном варианте, а во-вторых, практически не изменялось. Все это привело к тому, что в конце пассажа его уровень почти в 1.8 раза превышал этот показатель в контрольном варианте.
Содержание флаванов. К основным компонентам фенольного комплекса каллусных культур чайного растения относятся представители класса флавоноидов – флаваны (Запрометов, 1993). Для них характерна антиоксидантная активность, обусловленная наличием большого количества фенольных оксигрупп в структуре (Agati et al., 2012; Hong, 2014). Как следует из представленных на рис. 4б данных, тенденция накопления этих соединений у культур чая, выращиваемых на основной среде или на среде с Cd, была в значительной степени аналогична тенденции накопления суммы ФС в этих вариантах. На основной среде содержание флаванов у ТК было несколько выше, чем у СК, и в обоих случаях снижалось по мере их роста. У культур, выращиваемых на среде с Cd, в начале роста их содержание было практически равным таковому у контрольных, к 30-м сут оно повышалось (на 35%), а к 40-м незначительно снижалось у ТК и сохранялось без изменений у СК. В конце пассажа содержание флаванов у ТК и СК, выращиваемых на среде с поллютантом, соответственно на 70 и 60% превышало этот показатель у культур, растущих на основной среде.
Поскольку флаваны относятся к основным компонентам фенольного комплекса как чайного растения, так и инициированных из него каллусных культур, то мы проанализировали их вклад в суммарное содержание ФС. Так, у ТК, выращиваемой на основной среде, доля флаванов уменьшалась с 61 до 52% к концу цикла культивирования. У СК она составляла в среднем 53% и незначительно изменялась в течение пассажа. При выращивании культур на среде с Cd (рис. 4б) у ТК доля флаванов в суммарном содержании ФС была выше, но, как и в контрольном варианте, уменьшалась с 68 до 61% к концу пассажа. У СК, напротив, отмечалось увеличение доли флаванов в комплексе фенольных соединений: с 46 до 68% (начало и конец пассажа соответственно).
Содержание проантоцианидинов. Для каллусных культур чайного растения характерно образование еще одной группы соединений, обладающих антиоксидантными свойствами – проантоцианидинов, представляющих собой олигомерные и полимерные соединения на основе флаван-3-олов (Запрометов, 1993; Fraser et al., 2012; Jiang et al., 2015).
Для ТК, выращиваемой на основной питательной среде, наибольшее содержание проантоцианидинов отмечалось на 20-е сут роста (рис. 4в). К 30-м сут оно снижалось в 2 раза, а к концу пассажа было уже в 6.5 раза ниже, чем на начальных этапах роста. У СК также наблюдали значительное снижение содержания проантоцианидинов с 20-х по 30-е сут выращивания (в 2.5 раза), которое затем не изменялось до конца пассажа.
При выращивании культур на среде с Cd тенденция была иной (рис. 4в). Так, для ТК отмечено более низкое содержание проантоцианидинов в начале пассажа по сравнению с контролем (на 31%). По мере дальнейшего роста каллусов оно, хотя и несколько снижалось, но всегда превышало их содержание в контрольном варианте (на 19 и 69% на 30-е и 40-е сут роста соответственно). У СК, выращиваемой на среде с Cd, на начальных этапах роста содержание проантоцианидинов было высоким и аналогичным таковому в контрольном варианте. В дальнейшем оно снижалось: на 30-е и 40-е сут роста на 25 и 13% относительно 20-х сут роста соответственно, т.е. не столь стремительно, как это было в контрольном варианте.
Активность ФАЛ. ФАЛ – ключевой фермент в биосинтезе фенольных соединений, участвующий в образовании первого продукта фенольного метаболизма – транс-коричной кислоты, которая в дальнейшем служит предшественником многих полифенолов и, судя по опубликованным ранее данным, может свидетельствовать о его интенсивности (Klejdus et al., 2013). У ТК, выращиваемой в контрольных условиях, уровень активности ФАЛ оставался стабильным до 30-х сут культивирования, а концу пассажа возрастал (на 26%) (рис. 5). У СК в начале пассажа (20-е сут) активность фермента была на 25% выше, чем у ТК, и в течение всего пассажа практически не изменялась.
Рис. 5.
Активность L-фенилаланинаммиаклиазы в каллусных культурах чайного растения различного возраста, выращиваемых в темноте (ТК) или на свету (СК) на основной питательной среде (ТК, СК) или на среде с Cd (ТК + Cd, СК + Cd).
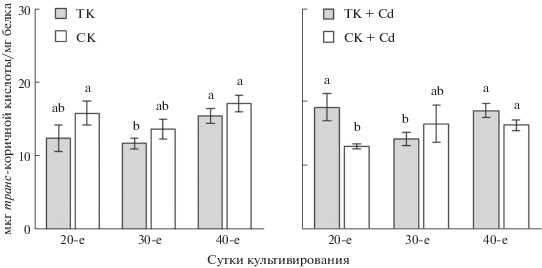
У культур, выращиваемых на среде с Cd, изменения активности ФАЛ имели другие тенденции (рис. 5). У ТК уже в начале пассажа она была на 26% выше, чем в контроле. К середине пассажа активность ФАЛ снижалась на 27%, достигая значений контрольного варианта, а к концу пассажа вновь незначительно возрастала до значений, характерных для начала цикла культивирования. В культурах, выращиваемых на среде с Cd, у СК активность ФАЛ в начале пассажа была ниже таковой у ТК на 33%. К 30-м сут она повышалась (на 29%), а затем не изменялась, но так и не достигала значений, характерных для контрольных каллусов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Важные первичные показатели реакции растительных клеток на изменение условий окружающей среды или действие стрессовых факторов – их морфофизиологические характеристики и ростовая активность (Shanying et al., 2017).
При выращивании ТК на основной питательной среде к концу пассажа отмечалось ее потемнение, что, вероятно, было следствием старения клеток. Для нее характерен равномерный и незначительный прирост: за весь цикл культивирования масса каллусов увеличилась лишь в 2 раза (рис. 1). Такой характер роста, возможно, обусловлен высокой способностью каллусов чая к биосинтезу фенольных соединений, в том числе флаванов, которые подавляют процессы пролиферации клеток, необходимые для формирования каллусной ткани (Matkowski, 2008).
Для изучения первичного действия света гетеротрофные каллусы чая помещали в условия 16-часового фотопериода, что аналогично начальным этапам деэтиоляции клеток растений (Cortleven et al., 2016). Появление на их поверхности желто-зеленых участков к концу пассажа свидетельствовало о начальных этапах формирования в клетках хлоропластов, что отмечалось нами ранее, но после более длительного светового воздействия (Зубова и др., 2019). Следует также отметить замедление прироста каллусной массы у СК по сравнению с ТК (рис. 1). Это может быть следствием стрессовой реакции в клетках каллусных культур чая, вызванной как действием света, так и переходом от гетеротрофного к смешанному (фотомиксотрофному) типу питания (Загоскина и др., 2000; Hong et al., 2014).
К числу наиболее опасных представителей тяжелых металлов, которые, накапливаясь в растениях, могут оказывать на них сильное токсическое действие, относится Cd, что в первую очередь проявляется в изменении их ростовых и морфофизиологических параметров (Серегин, Иванов, 2001; Shanying et al., 2017; Ismael et al., 2019). О том, что присутствие Cd в питательной среде влияет на морфофизиологические характеристики культивируемых в условиях in vitro клеток и тканей высших растений, сообщалось ранее (Lux et al., 2010; Гончарук, Загоскина, 2017). Потемнение каллусов чая на среде с Cd уже в начале пассажа и постепенное формирование на их поверхности темно-коричневых участков, содержащих предположительно некротизированные клетки, явные тому доказательства. Токсическое действие этого поллютанта подтверждается также снижением интенсивности их роста, что в большей степени проявлялось у ТК (рис. 1). Таким образом, несмотря на снижение прироста биомассы на среде с Cd, каллус чая в условиях освещения оказался более устойчив к действию поллютанта по сравнению с выращиваемым в темноте. Следовательно, при совместном действии этих двух факторов токсическое действие Cd снижается.
Содержание воды в клетках растений свидетельствует о степени их растяжения и вакуолизации (Brodersen, McElrone, 2013). Отмеченная нами тенденция к незначительному снижению этого показателя в опытных вариантах позволяет предположить, что присутствие Cd в среде культивирования подавляло эти процессы в каллусах чая, что сказывалось и на приросте ткани.
Все вышеизложенное позволяет заключить, что присутствие Cd в питательной среде влияло на морфофизиологические характеристики и рост каллусных культур чая, выращиваемых в темноте и перенесенных в световые условия, что выражалось в изменении их окраски, снижении прироста и оводненности клеток (в большей степени у ТК). Следовательно, на культивируемых в условиях in vitro клетках чайного растения четко прослеживалось токсическое действие Cd, о чем сообщалось и другими авторами (Гончарук, Загоскина, 2017; Zaid et al., 2020). Однако в световых условиях оно было менее выражено, что может быть следствием активации метаболических процессов, защищающих клетки от его токсического действия, в том числе наличия антиоксидантов или “ограничения” поступления этого поллютанта (Загоскина и др., 2000; Hong et al., 2014).
Проведенные нами исследования показали наличие Cd в каллусных клетках как ТК, так и СК уже на начальных стадиях роста (рис. 2а). Такое быстрое поступление, вероятно, объясняется высокой степенью подвижности ионов данного металла и более простой структурной организацией самой каллусной ткани по сравнению с таковой у интактных растений. Примечательно, что более высокое накопление Cd в этот период характерно для СК, т.е. условия освещения активируют этот процесс на начальном этапе роста культур. В дальнейшем таких ярко выраженных различий между каллусами, растущими в темноте или на свету, не наблюдалось. Локализация Cd, судя по данным гистохимической реакции с дитизоном, была приурочена к вакуолярным компартментам клеток каллусов чайного растения, а также к клеточным стенкам и межклетникам (риc. 2б). Все это свидетельствует о традиционном его распределении в клетках и тканях растений (Гончарук, Загоскина, 2017).
Одна из наиболее распространенных неспецифических реакций растительных клеток на действие стрессовых факторов – индукция ПОЛ, обусловленная действием АФК и определяемая по содержанию МДА (Foti, Amorati, 2016). Важно отметить и тот факт, что они накапливаются и в нормальных условиях, поскольку необходимы для поддержания жизнедеятельности клеток (Agati et al., 2012; Zaid et al., 2020). В первую очередь необходимо отметить, что по мере роста каллусных культур чая содержание в них МДА изменялось: в начале роста оно было наименьшим, затем повышалось и к концу пассажа снижалось (рис. 3). Все это обусловлено изменением баланса про/антиоксидантов в их клетках (Baskar et al., 2018). При сравнении уровня ПОЛ в каллусных культурах чая, выращиваемых на основной среде, можно отметить в большинстве случаев более низкие его значения и меньшие изменения в условиях светового воздействия. Следовательно, свет “нормализовал” работу антиоксидантной системы каллусов чая, что может быть связано и с образованием в них ФС – важных низкомолекулярных антиоксидантов растительного происхождения (Запрометов, 1993; Bidel et al., 2010).
При выращивании каллусных культур чая на средах с Cd наблюдалась тенденция снижения ПОЛ, что в большей степени проявлялось у ТК (рис. 3). Примечателен факт повышения содержания МДА на начальных этапах роста СК на среде с Cd, что противоположно реакции ТК, где оно снижалось по сравнению с контролем (среда без Cd). Исходя из этого можно предположить, что в данный период происходит более выраженная стрессовая реакция у культуры чайного растения при совместном действии этих двух факторов, что не отмечалось в других случаях.
Важная характеристика работы антиоксидантной системы – накопление тех или иных антиоксидантов, в нашем случае различных ФС (Bidel et al., 2010). Отмеченное нами высокое их суммарное содержание на начальных этапах роста каллусов чая на основной питательной среде и низкое в конце пассажа может быть обусловлено характером их образования в течение пассажа, высокой способностью к накоплению в молодых активно растущих клетках, гетерогенностью, присущей каллусным культурам, а также их функциональной ролью на различных этапах роста и дифференциации (Запрометов, 1993; Sutini et al., 2016).
Известно, что свет – один из важнейших абиотических факторов, регулирующих рост и развитие растений, и в том числе активно влияющих на образование ФС в клетках растений, в большинстве случаев способствуя увеличению их содержания, что было показано и для in vitro культур чайного растения (Загоскина и др., 2000; Pérez-López et al., 2018). Это можно объяснить и тем, что многие ферменты фенольного метаболизма светозависимы, а также тем, что в этих условиях в клетках начинают формироваться хлоропласты – одни из центров синтеза ФС (Загоскина и др., 2000; Hong et al., 2014). Тем не менее в нашем случае первичное действие света практически не влияло на содержание ФС в культуре чая, за исключением завершающих этапов ее роста, когда отмечали стабилизацию в накоплении этих веществ, тогда как у ТК оно продолжало снижаться (рис. 4). Здесь могут иметь значение длительность и интенсивность светового воздействия, о чем не раз сообщалось и другими авторами (Mukhopadhyay, 2016).
В вариантах каллусных культур чая, выращиваемых на средах с Cd, наблюдалась иная картина. В клетках ТК происходила постепенная активация биосинтеза полифенолов, что четко проявлялось на завершающих этапах их роста. Это свидетельствует о постепенном (медленном) ответе культур чая на стрессовое воздействие. О том, что реакция клеток высших растений на действие тяжелых металлов зависит от их концентрации и длительности воздействия, сообщалось ранее (Серегин, Иванов, 2001; Гончарук, Загоскина, 2017).
В случае с СК наблюдали быстрый ответ клеток на стрессовое воздействие. Уже на начальных этапах роста (20-е сут) суммарное содержание ФС было высоким и сохранялось таким до конца пассажа (рис. 4а). Следовательно, можно предположить, что совместное действие двух исследуемых факторов (Cd и свет) оказывало синергический эффект и, следовательно, активизировало накопление ФС в каллусных культурах чая.
Флаваны – основные компоненты фенольного комплекса растений чая, а также инициированных из них in vitro культур, доля которых в общем содержании ФС обычно составляет >50% (Запрометов, 1993; Wang, Li, 2018). Показано, что для флаванов преимущественно характерна аналогичная накоплению суммы ФС тенденция в процессе культивирования как ТК, так и СК (рис. 4б). Вместе с тем имеющиеся небольшие различия в их содержании позволяют предполагать изменение доли этих соединений в общем содержании полифенолов, поскольку в процессе роста и дифференциации клеток пути биосинтеза различных классов ФС могут изменяться (Запрометов, 1993). В нашем случае у ТК доля флаванов в общем количестве ФС к концу пассажа снижалась, уступая место так называемым нефлавановым компонентам, например фенилпропаноидам (Зубова и др., 2019). У СК эти изменения в течение пассажа были незначительны, хотя аналогичная тенденция прослеживалась.
В условиях действия Cd доля флаванов у ТК была в целом на 7–10% выше, чем у каллусов, растущих на основной питательной среде, но в течение пассажа она снижалась по аналогии с контролем. У СК в этих условиях наблюдали противоположную тенденцию – увеличение доли “флаванового” компонента более чем на 20% к концу пассажа. Таким образом, можно заключить, что совместное действие света и Cd приводило к увеличению доли флаванов в клетках культуры чая.
Флаваны в растениях представлены как мономерными формами (флаван-3-олами или катехинами), так и их олигомерными и даже полимерными производными. К последним относятся проантоцианидины – соединения, также обладающие антиоксидантной активностью (Fraser et al., 2012). Динамика их накопления в процессе роста каллусных тканей чая может быть в определенной степени аналогична динамике флаванов, поскольку проантоцианидины составляют часть их комплекса (Зубова и др., 2019). У каллусов, растущих на основной среде, так и происходило (рис. 4в). У ТК отмечали снижение содержания проантоцианидинов в течение всего пассажа, тогда как у СК их количество уменьшалось до середины пассажа, после чего стабилизировалось до завершения цикла культивирования. Однако это снижение было значительно более резким, чем у флаванов и тем более у суммы ФС.
Примечательно, что при выращивании ТК и СК на среде с Cd также отмечали тенденцию к снижению содержания проантоцианидинов к концу пассажа, что прямо противоположно накоплению флаванов в опытном варианте, причем у СК это снижение было более выраженным. Подобное снижение накопления проантоцианидинов в процессе роста каллусов чая отмечалось и в более ранних работах (Зубова и др., 2019). Оно может быть связано с перераспределением этих соединений внутри клетки из-за смены их функциональной роли. Дело в том, что проантоцианидины могут находиться как в свободном (растворимом), так и в связанном с клеточными стенками (нерастворимом) состоянии. Мы оценивали содержание в каллусных культурах чая только растворимых их форм. Однако в процессе их роста (или старения) часть этих соединений может прочно связываться с клеточными стенками, тем самым снижая пул растворимых форм (Ossipova et al., 2001). Встраиваясь в клеточную стенку, проантоцианидины становятся аналогами лигнина – полимера фенольной природы, выполняющего опорную и “барьерную” функцию, в том числе и при проникновении в клетки ионов металлов (Серегин, Иванов, 2001). Можно предположить, что в условиях поступления Cd в каллусные культуры чая часть проантоцианидинов встраивалась в клеточную стенку, в результате чего наблюдалось снижение содержания их растворимых форм. Важно отметить, что это снижение происходило на фоне увеличения содержания флаванов. Следовательно, можно предположить, что в условиях стрессового действия Cd в каллусных культурах чая в большей степени повышалось накопление именно катехинов (мономерных форм) и в меньшей – проантоцианидинов. Несмотря на эту тенденцию, снижение таких соединений в контроле у обеих культур происходило резче. Так, к концу пассажа содержание проантоцианидинов в культуре, выращенной на среде с Cd, превышало таковое в культуре, выращенной на основной среде, в 3 раза в случае ТК и в 1.5 раза в случае СК. Исходя из этого можно предположить, что проантоцианидины также принимают участие в защите клеток культур чая от действия стрессовых факторов, хотя и в меньшей степени. О менее выраженной антиоксидантной защите этих соединений по сравнению с их мономерными предшественниками упоминалось ранее (Min et al., 2012).
Биосинтез ФС в значительной степени зависит от активности основного фермента фенольного метаболизма – ФАЛ (Klejdus et al., 2013). В то же время в литературе встречаются противоречивые данные о взаимосвязи активности ФАЛ и содержания ФС, в том числе флаванов. В одних работах сообщалось о наличии прямой корреляции между ними (Pina, Errea, 2008), в других – об отсутствии взаимосвязи между этими показателями (Олениченко, Загоскина, 2005). Анализируя полученные данные, можно сделать вывод, что в процессе роста каллусных культур чайного растения на основной питательной среде и среде с Сd активность ФАЛ изменялась. Однако эти различия были незначительны и в целом ее уровень изменялся в одних и тех же пределах. Следовательно, прямой взаимосвязи между активностью ФАЛ и накоплением ФС, в частности флаванов и проантоцианидинов, в каллусных культурах чайного растения как при раздельном, так и при совместном действии света и Cd не прослеживалось.
ЗАКЛЮЧЕНИЕ
Все вышеизложенное позволяет заключить, что световое воздействие, а также поступление ионов Cd в клетки каллусных культур чайного растения, выращиваемых в темноте или перенесенных в световые условия, приводили к изменению их морфофизиологических характеристик, снижению ростовой активности и к активизации работы антиоксидантной системы на уровне накопления ее низкомолекулярных компонентов фенольной природы, а именно суммарного содержания фенольных соединений, флаванов и в меньшей степени проантоцианидинов. В ряде случаев эти изменения коррелировали с уровнем ПОЛ в клетках, но не зависели от активности ключевого фермента фенольного метаболизма ФАЛ. Важно, что при совместном действии света и Cd часто отмечался синергизм их действия. Полученные данные еще раз подтверждают, что ФС играют существенную роль в функционировании системы антиоксидантной защиты клеток, что можно считать важным механизмом, участвующим в адаптации растительных клеток в период их деэтиоляции или в стрессовых условиях, в частности в присутствии поллютанта (Cd).
Работа выполнена при финансовой поддержке Минобрнауки РФ в рамках темы государственного задания Института физиологии растений им. К.А. Тимирязева Российской академии наук № АААА-А-19-11904189005-8.
Список литературы
Бутенко Р.Г. Биология клеток высших растений in vitro и биотехнологии на их основе. М.: ФБК-ПРЕСС, 1999. 160 с.
Гончарук Е.А., Загоскина Н.В. Тяжелые металлы: поступление, токсичность и защитные механизмы растений (на примере ионов кадмия) // Вісн. Харків. нац. аграрн. ун-ту. Сер.: Біологія. 2017. № 1. С. 35–49.
Загоскина Н.В., Дубравина Г.А., Запрометов М.Н. Особенности формирования хлоропластов и накопления фенольных соединений в фотомиксотрофных каллусных культурах чайного растения // Физиология растений. 2000. Т. 47. № 4. С. 537–543.
Загоскина Н.В., Дубравина Г.А., Алявина А.К., Гончарук Е.А. Влияние ультрафиолетовой (УФ-Б) радиации на образование и локализацию фенольных соединений в каллусных культурах чайного растения // Физиология растений. 2003. Т. 50. № 2. С. 302–308.
Запрометов М.Н. Фенольные соединения и методы их исследования // Биохимические методы в физиологии растений. М.: Наука, 1971. С. 185–197.
Запрометов М.Н. Фенольные соединения. Распространение, метаболизм и функции в растениях. М.: Наука, 1993. 272 с.
Зубова М.Ю., Нечаева Т.Л., Загоскина Н.В. Образование и компартментализация проантоцианидинов в in vitro культурах чайного растения // Вестн. биотехнологии. 2019. Т. 15. № 4. С. 5–10.
Носов А.М. Вторичный метаболизм // Физиология растений / Под. ред. Ермакова И.П. М.: Академия, 2005. С. 588–620.
Носов А.М. Методы оценки и характеристики роста культур клеток высших растений // Молекулярно-генетические и биохимические методы в современной биологии растений. М.: БИНОМ, 2011. С. 386–403.
Олениченко Н.А., Загоскина Н.В. Ответная реакция озимой пшеницы на действие низких температур: образование фенольных соединений и активность L-фенилаланин-аммиак-лиазы // Прикл. биохимия и микробиология. 2005. Т. 41. № 6. С. 681–685.
Рогожин В.В., Рогожина Т.В. Практикум по физиологии и биохимии растений. СПб.: ГИОРД, 2013. 352 с.
Серегин И.В., Иванов В.Б. Физиологические аспекты токсического действия кадмия и свинца на высшие растения // Физиология растений. 2001. Т. 48. № 4. С. 606–630.
Серегин И.В., Шпигун Л.К., Иванов В.Б. Распределение и токсическое действие кадмия и свинца на корни кукурузы // Физиология растений. 2004. Т. 51. № 4. С. 582–591.
Тараховский Ю.С., Ким Ю.А., Абдрасилов Б.С., Музафаров, Е.Н. Флавоноиды: биохимия, биофизика, медицина. Пущино: Sуnchrobook, 2013. 310 с.
Agati G., Azzarello E., Pollastri S., Tattini M. Flavonoids as antioxidants in plants: location and functional significance // Plant Sci. 2012. V. 196. P. 67–76.
Asati A., Pichhode M., Nikhil K. Effect of heavy metals on plants: an overview // Int. J. Appl. Innov. Eng. Manage. 2016. V. 5. P. 2319–4847.
Baskar V., Venkatesh R., Ramalingam S. Flavonoids (antioxidants systems) in higher plants and their response to stresses // Antioxidants and antioxidant enzymes in higher plants. Cham: Springer, 2018. P. 253–268.
Bidel L.P., Coumans M., Baissac Y., Doumas P., Jay-Allemand C. Biological activity of phenolics in plant cells // Rec. Adv. Polyphenol Res. 2010. V. 2. P. 163–205.
Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding // Anal. Biochem. 1976. V. 72. № 1–2. P. 248–254.
Brodersen C., McElrone A. Maintenance of xylem network transport capacity: a review of embolism repair in vascular plants // Front. Plant Sci. 2013. V. 4. P. 108.
Cheynier V., Comte G., Davies K.M., Lattanzio V., Martens S. Plant phenolics: recent advances on their biosynthesis, genetics and ecophysiology // Plant Physiol. Biochem. 2013. V. 72. P. 1–20.
Chezem W.R., Clay N.K. Regulation of plant secondary metabolism and associated specialized cell development by MYBs and bHLHs // Phytochemistry. 2016. V. 131. P. 26–43.
Cortleven A., Marg I., Yamburenko M.V., Schlicke H., Hill K., Grimm B., Schaller G.E., Schmülling T. Cytokinin regulates etioplast-chloroplast transition through activation of chloroplast – related genes // Plant Physiol. 2016. V. 172. P. 464.
Dias M.I., Sousa M.J., Alves R.C., Ferreira I.C. Exploring plant tissue culture to improve the production of phenolic compounds: A review // Ind. Crops Prod. 2016. V. 82. P. 9–22.
Durazzo A., Lucarini M., Souto E.B., Cicala C., Caiazzo E., Izzo A.A., Novellino E., Santini A. Polyphenols: A concise overview on the chemistry, occurrence, and human health // Phytotherapy Res. 2019. V. 33. № 9. P. 2221–2243.
Espinosa-Leal C.A., Puente-Garza C.A., García-Lara S. In vitro plant tissue culture: means for production of biological active compounds // Planta. 2018. V. 248. № 1. P. 1–18.
Foti M.C., Amorati R. ROS and phenolic compounds. Reactive Oxygen Species in Biology and Human Health. Boca Raton; London; New York: CRC Press, 2016. P. 49–65.
Fraser K., Harrison S.J., Lane G.A., Otter D.E., Hemar Y., Quek S.Y., Rasmussen S. HPLC-MS/MS profiling of proanthocyanidins in teas: a comparative study // J. Food Composit. Anal. 2012. V. 26. № 1–2. P. 43–51.
Hodges D.M., DeLong J.M., Forney C.F., Prange R.K. Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds // Planta. 1999. V. 207. № 4. P. 604–611.
Hong G., Wang J., Zhang Y., Hochstetter D., Zhang S., Pan Y., Shi Y., Xu P., Wang Y. Biosynthesis of catechin components is differentially regulated in dark-treated tea (Camellia sinensis L.) // Plant Physiol. Biochem. 2014. V. 78. P. 49–52.
Huang D., Gong X., Liu Y., Zeng G., Lai C., Bashir H., Zhou L., Wang D., Xu P., Cheng M., Wan J. Effects of calcium at toxic concentrations of cadmium in plants // Planta. 2017. V. 245. № 5. P. 863–873.
Ismael M.A., Elyamine A.M., Moussa M.G., Cai M., Zhao X., Hu C. Cadmium in plants: uptake, toxicity, and its interactions with selenium fertilizers // Metallomics. 2019. V. 11. № 2. P. 255–277.
Ivanov Y.V., Kartashov A.V., Ivanova A.I., Savochkin Y.V., Kuznetsov, V.V. Effects of zinc on Scots pine (Pinus sylvestris L.) seedlings grown in hydroculture // Plant Physiol. Biochem. 2016. V. 102. P. 1–9.
Jiang X., Liu Y., Wu Y., Tan H., Meng F., sheng Wang Y., Li M., Zhao L., Liu L., Qian Y., Gao L. Analysis of accumulation patterns and preliminary study on the condensation mechanism of proanthocyanidins in the tea plant [Camellia sinensis] // Sci. Rep. 2015. V. 5. P. 8742.
Klejdus B., Kovacik J., Babula P. PAL inhibitor evokes different responses in two hypericum species // Plant Physiol. Biochem. 2013. V. 63. P. 82–88.
Kubalt K. The role of phenolic compounds in plant resistance // Biotechnol. Food Sci. 2016. V. 80. № 2. P. 97–108.
Li Y., Kong D., Fu Y., Sussman M.R., Wu H. The effect of developmental and environmental factors on secondary metabolites in medicinal plants // Plant Physiol. Biochem. 2020. V. 148. P. 80–89.
Lux A., Martinka M., Vaculík M., White P.J. Root responses to cadmium in the rhizosphere: a review // J. Exp. Bot. 2011. V. 62. № 1. P. 21–37.
Matkowski A. Plant in vitro culture for the production of antioxidants–a review // Biotechnol. Adv. 2008. V. 26. № 6. P. 548–560.
Min B., Gu L., McClung A.M., Bergman C.J., Chen M.H. Free and bound total phenolic concentrations, antioxidant capacities, and profiles of proanthocyanidins and anthocyanins in whole grain rice (Oryza sativa L.) of different bran colours // Food Chem. 2012. V. 133. № 3. P. 715–722.
Mukhopadhyay M., Mondal T.K., Chand P.K. Biotechnological advances in tea (Camellia sinensis [L.] O. Kuntze): a review // Plant Cell Rep. 2016. V. 35. № 2. P. 255–287.
Nile S.H., Keum Y.S., Nile A.S., Jalde S.S., Patel R.V. Antioxidant, anti-inflammatory, and enzyme inhibitory activity of natural plant flavonoids and their synthesized derivatives // J. Biochem. Mol. Toxicol. 2018. V. 32. № 1. P. e22002.
Nosov A.M. Application of cell technologies for production of plant-derived bioactive substances of plant origin // Appl. Biochem. Microbiol. 2012. V. 48. № 7. P. 609–624.
Ossipova S., Ossipov V., Haukioja E., Loponen J., Pihlaja K. Proanthocyanidins of mountain birch leaves: quantification and properties // Phytochem. Anal.: Inter. J. Plant Chem. Biochem. Techn. 2001. V. 12. № 2. P. 128–133.
Pérez-López U., Sgherri C., Miranda-Apodaca J., Micaelli F., Lacuesta M., Mena-Petite A., Quartacci M., Muñoz-Rueda, A. Concentration of phenolic compounds is increased in lettuce grown under high light intensity and elevated CO2 // Plant Physiol. Biochem. 2018. V. 123. P. 233–241.
Pina A., Errea P. Differential induction of phenylalanine ammonia-lyase gene expression in response to in vitro callus unions of Prunus spp // J. Plant Physiol. 2008. V. 165. № 7. P. 705–714.
Shanying H.E., Xiaoe Y.A.N.G., Zhenli H.E., Baligar V.C. Morphological and physiological responses of plants to cadmium toxicity: a review // Pedosphere. 2017. V. 27. № 3. P. 421–438.
Song Y., Jin L., Wang X. Cadmium absorption and transportation pathways in plants // Inter. J. Phytoremed. 2017. V. 19. № 2. P. 133–141.
Sutini S., Susilowati S., Indra R., Djoko A.P. Growth and accumulation of flavan-3-ol in Camellia sinensis through callus culture and suspension culture method // J. Biol. Res. 2016. V. 22. P. 27–31.
Wang T., Li Q., Bi K. Bioactive flavonoids in medicinal plants: Structure, activity and biological fate // Asian J. Pharm. Sci. 2018. V. 13. № 1. P. 12–23.
Zaid A., Mohammad F., Fariduddin Q. Plant growth regulators improve growth, photosynthesis, mineral nutrient and antioxidant system under cadmium stress in menthol mint (Mentha arvensis L.) // Physiol. Mol. Biol. Plants. 2020. V. 26. № 1. P. 25–39.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


