Известия РАН. Серия биологическая, 2021, № 1, стр. 55-64
Фотосинтетическая активность Fucus vesiculosus Linnaeus, 1753 (Phaeophyta: Fucales) Баренцева моря в период приливно-отливного цикла
И. В. Рыжик 1, 2, *, А. А. Кособрюхов 3, Е. Ф. Марковская 4, М. В. Макаров 1
1 Мурманский морской биологический институт Российской академии наук
183010 Мурманск, Владимирская, 17, Россия
2 Мурманский арктический государственный университет
183038 Мурманск, ул. Капитана Егорова, 15, Россия
3 Институт фундаментальных проблем биологии РАН
142290 Московская обл., г. Пущино, ул. Институтская, 2, Россия
4 Петрозаводский государственный университет
185910 Республика Карелия, Петрозаводск, просп. Ленина, 33, Россия
* E-mail: alaria@yandex.ru
Поступила в редакцию 15.03.2019
После доработки 15.06.2020
Принята к публикации 15.06.2020
Аннотация
Отмечено, что в течение приливно-отливного цикла у Fucus vesiculosus L. происходит потеря влаги растениями (до 30% сырой массы) и наблюдаются синусоидальные изменения фотосинтетической активности. Выявлены три пика увеличения интенсивности фотосинтеза в начале и середине отлива и начале прилива. Установлено, что структурных изменений фотосинтетического аппарата не происходит. С помощью анализа углекислотных кривых СО2-газообмена обнаружено лимитирование процессов фотосинтеза растений в воздушной среде активностью световых и темновых реакций. Показано, что увеличение содержания продуктов перекисного окисления липидов, активности каталазы и накопление пролина в талломах F. vesiculosus свидетельствует о наличии обратимого окислительного стресса во время отлива.
Произрастание водорослей в литоральной зоне тесно связано с приливно-отливными циклами, влияющими на резкие смены условий существования 4 раза в сутки. Во время отлива, когда водная среда сменяется на воздушную, водоросли подвергаются осушению, изменяются температура среды, освещение, соленость и т.д. В это время у макроводорослей может снижаться содержание влаги в талломе (Камнев, 1989; Bisson, Kirst, 1995; Schagerl, Moоstl, 2011), скорость фотосинтетического и дыхательного газообмена (Quadir et al., 1979; Dring, Brown, 1982; Андреев и др., 2012). Приспособление водорослей к периодическому осушению в основном связывают с накоплением веществ, удерживающих влагу (Wiltens et al., 1978; Quadir et al., 1979; Камнев, 1989; Davison, Pearson, 1996; Кузнецов и др., 2006), и изменением активности физиологических процессов на уровне световых реакций фотосинтеза (Андреев и др., 2012).
Представители рода Fucus широко распространены по всему миру. На мурманском побережье основная зона обитания F. vesiculosus Linnaeus, 1753 (Phaeophyta: Fucales) – верхний горизонт литорали, в других регионах вид может произрастать как в литоральной зоне, так и в сублиторали (Zaneveld, 1937; Russell et al., 1998; Gylle et al., 2009, 2011; Малавенда, 2014). Предполагается, что одна из причин отсутствия F. vesiculosus на больших глубинах в Баренцевом море – его конкуренция с другими видами. Ранее при экспериментальном выращивании F. vesiculosus на разных глубинах было показано, что с увеличением глубины произрастания снижается физиологическая активность клеток, на талломах увеличивается количество эпифитов и в итоге происходит гибель организма (Макаров и др., 2010). Возможно, F. vesiculosus относится к видам, которым для функциональной активности необходимо периодическое осушение, так как без этого они, в частности верхнелиторальный вид Pelvetia canaliculata, погибают (Thomas, 2002).
Цель работы – анализ физиологического состояния F. vesiculosus в период приливно-отливного цикла в естественных условиях, а также выявление механизмов его адаптации к периодическому осушению.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводили в июле–августе 2013 и 2014 гг. на базе Дальнезеленецкой сезонной биостанции ММБИ РАН in situ в литоральной зоне губы Зеленецкая (69°07′ с.ш., 36°04′ в.д.).
Изучались одновозрастные растения (4–5 дихотомических ветвлений) фукуса пузырчатого F. vesiculosus, произрастающие в верхнем горизонте литорали. В период проведения экспериментов длительность осушения (время отлива) в зоне произрастания F. vesiculosus составляла 6 ч.
Талломы фукусовых водорослей сильноразветвленные, произрастают скученно, с проективным покрытием субстрата до 100%. В период отлива на литорали образуется слой водорослей толщиной до 20 см. При этом отдельные части талломов или целые талломы могут оказаться на поверхности и в значительной степени высохнуть или внутри слоя, где они не подвергаются интенсивному осушению.
Для исследований интенсивности процессов фотосинтеза использовали апикальные участки талломов. Определение проводили в естественных условиях в течение дневного приливно-отливного цикла (интенсивность освещения 650–800 мкмоль Е/(м2 с), температуры воздуха и воды 20–25 и 7–8°С соответственно). Сначала исследовали талломы, находившиеся под водой >6 ч, затем по мере отступления воды во время отлива каждые 30–60 мин исследовали талломы, оказавшиеся на поверхности слоя водорослей и подверженные интенсивному высыханию. После наступления прилива, когда водоросли снова оказывались погруженными в воду, талломы анализировали каждые 10–15 мин в течение 2 ч. Периодичность отбора определялась возможностями прибора и скоростью первичной обработки проб. В опыте для определения влияния содержания влаги в талломах на интенсивность фотосинтеза (ИФ)образцы были взяты как с поверхности слоя водорослей (обсохшие), так и из его толщи (влажные).
ИФ определяли с помощью переносного инфракрасного газоанализатора LCPro+ (ADC BioScientific Ltd, Великобритания). В ассимиляционную листовую камеру газоанализатора помещали апикальную часть таллома, и при установлении стационарных значений определяли скорость СО2-газообмена в условиях атмосферной СО2, к которой более высокое сродство имеет рибулозобифосфаткарбоксилаза (РБФ-карбоксилаза). Углекислотные зависимости скорости фотосинтеза определяли с учетом изменения концентрации СО2 в воздухе, подаваемом в ассимиляционную камеру газоанализатора (0–1600 мкмоль СО2/(м2 с)), при насыщающей интенсивности света. Уровни концентрации СО2, подаваемой в листовую камеру, задавали с помощью микропроцессора газоанализатора и изменяли последовательно (50, 100, 200, 400, 800, 1200, 1600 мкмольСО2 /(м2 с)). Анализ углекислотных кривых СО2-газообмена проводили по модели Фаркюхара (Farquhar et al., 1980) с модификациями (Caemmerer, Farquhar, 1982; Harley, Sharkey, 1991) с использованием программы Photosyn Assistant Ver. 1.1.2 (Parsons, Ogston, 1999). В соответствии с уравнениями авторов модель позволяет определить максимальную скорость карбоксилирования (Vc max), скорость электронного транспорта при световом насыщении (Jmax), скорость утилизации триозофосфатов и ряд других параметров.
Содержание фотосинтетических пигментов определяли спектрофотометрически (спектрофотометр JENWAY 6305 UV/VIS): каротиноиды (β-каротин, виолаксантин, фукоксантин) предварительно разделяли методом бумажной хроматографии, хлорофиллы (А и С (С1 + С2)) определяли в растворе. Качественный и количественный состав пигментов исследовали по модифицированным методикам (Пигменты…, 1964; Ли, 1978; Маслова и др., 1986).
Содержание влаги в талломах рассчитывали по соотношению сырой и сухой масс высечек таллома (N = 20). Массу высечек определяли на весах (ВЛТЭ-210, Россия) с точностью до 0.001 г: сырую – после удаления с поверхности высечек капельно-жидкой влаги фильтровальной бумагой, сухую – после высушивания в сушильном шкафу (Т = 105°С) в течение 24 ч.
Активность каталазы (АК), уровень перекисного окисления липидов (ПОЛ) и концентрацию аминокислоты пролин определяли в течение нескольких периодов отлива. Для анализа использовали апикальную вегетативную часть таллома длиной до 0.5 см.
Уровень ПОЛ оценивали по накоплению активных продуктов тиобарбитуровой кислоты (ТБКап) (Esterbauer, Cheesman, 1990; Олениченко и др., 2008). Для этого 100 мг водорослей гомогенизировали в 1.2–1.5 мл дистиллированной воды в фарфоровой ступке. К полученному гомогенату добавляли 1.2–1.5 мл 10%-ной трихлоруксусной кислоты, полученный раствор центрифугировали при 8000 об./мин в течение 15 мин. Далее к 0.5 мл супернатанта добавляли 0.5 мл 0.67%-ного раствора тиобарбитуровой кислоты (ТБК). Полученный раствор выдерживали на кипящей водяной бане в течение 10 мин, затем охлаждали до комнатной температуры, разводили до конечного объема 2 мл. Измерение проводили при длине волны 540 нм.
Активность фермента каталазы определяли с использованием модифицированного спектрофотометрического метода (Королюк и др., 1988), основанного на способности перекиси водорода образовывать стойкий окрашенный комплекс с солями молибдена. Навеску водорослей 100 мг растирали на холоду с фосфатным буфером, затем центрифугировали при 8000 об./мин в течение 15 мин. К 0.1 мл надосадочной жидкости добавляли 2 мл перекиси водорода, смесь инкубировали в течение 10 мин при 18°С. Для остановки реакции в смесь добавляли 1 мл 4%-ного молибдата аммония. Измерения проводили на спектрофотометре при длине волны 410 нм.
Содержание свободного пролина в клетках водорослей определяли методом Бейтса с соавт. (Bates et al., 1973) по реакции с нингидрином. Для анализа брали навеску массой 500 мг, гомогенизировали в 3%-ном водном растворе сульфосалициловой кислоты, центрифугировали при 8000 об./мин в течение 15 мин. В пробирки добавляли по 2 мл вытяжки, 2 мл кислого нингидрина и 2 мл ледяной уксусной кислоты. Смесь инкубировали на водяной бане в течение 1 ч, реакцию останавливали на льду. После охлаждения в пробирки добавляли по 4 мл толуола, интенсивно встряхивали в течение 15–20 с. Верхний окрашенный слой толуола отделяли от водной фазы и нагревали до 18°С, измерения проводили при длине волны 520 нм. Концентрацию пролина определяли по калибровочной кривой и рассчитывали по формуле Бейтса (Bates et al., 1973). Измерения проводили на спектрофотометре JENWAY 6305 UV/VIS.
Все определения проводили в трех биологических и трех аналитических повторностях. Для статистической обработки данных использовали программы Statistica 6.0 и MS Excel 2007. Достоверность результатов оценивали с помощью t‑критерия Стьюдента при P = 0.95. На графиках представлены значения средних и доверительный интервал.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В период прилива, когда водоросли находились в погруженном состоянии, содержание влаги в талломах F. vesiculosus составляло ~80%. В период отлива в зависимости от продолжительности осушения, облачности, скорости ветра, температуры и влажности воздуха содержание влаги в талломах снижалось до 40%. При наступлении следующего прилива содержание влаги восстанавливалось до исходного в течение 30 мин независимо от степени осушения (рис. 1).
Рис. 1.
Содержание влаги (1) и интенсивность фотосинтеза талломов (2) Fucus vesiculosus в течение приливно-отливного цикла.
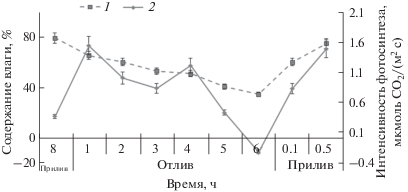
Во время приливно-отливного цикла (конец прилива–отлив–начало прилива) ИФ F. vesiculosus представляет собой трехвершинную кривую с двумя пиками в период отлива и одним пиком в начале прилива (рис. 1). В период приливно-отливного цикла достоверных изменений содержания фотосинтетических пигментов, соотношения хлорофиллов и каротиноидов, а также размеров светособирающего комплекса (ксантосомы), оцениваемого по соотношению Хл А и суммы Хл С + фукоксантин (Makarov, 2012), также не было выявлено (рис. 2, табл. 1).
Рис. 2.
Содержание фотосинтетических (ФС) пигментов в клетках водорослей Fucus vesiculosus в течение прилива (1) и отлива (2).

Таблица 1.
Соотношение хлорофиллов и каротиноидов, а также относительных размеров ксантосом у Fucus vesiculosus в период прилива и отлива
| Соотношение | Прилив | Отлив |
|---|---|---|
| Хл А/каротиноиды | 1.92 ± 0.18 | 2.02 ± 0.19 |
| Хл А/Хл С + фукоксантин | 4.03 ± 0.35 | 3.98 ± 0.37 |
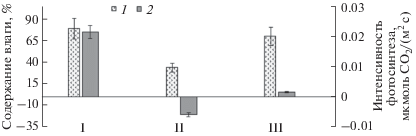
Для определения зависимости ИФ от содержания влаги в талломе были исследованы растения, находившиеся во время отлива как на поверхности, так и в толще слоя водорослей и, соответственно, имеющие разную степень высыхания. За время отлива у талломов, оказавшихся на поверхности слоя, содержание влаги снижалось до 40%, а у растений внутри слоя не изменялось: различия между растениями, находившимися внутри слоя и погруженными в воду, были недостоверны. В этот период ИФ растений независимо от их степени осушения снижалась: у талломов с поверхности до отрицательных значений (дыхание превалировало), у талломов, находившихся в толще слоя водорослей, до низких, но положительных (рис. 3).
Рис. 3.
Содержание влаги (1) и интенсивность фотосинтеза (2) Fucus vesiculosus в зависимости от расположения растений во время отлива. I – прилив, растения в воде; II – отлив 5 ч, растения на поверхности слоя водорослей; III – отлив 5 ч, растения в толще слоя водорослей.
Сравнительный анализ углекислотных кривых показал сходные максимально возможные значения ИФ водорослей, длительное время находившихся как при отливе (осушенные), так и во время прилива (покрытые водой) (табл. 2). Однако значение данного показателя оказались значительно выше реальных, когда на отливе наблюдался отрицательный газообмен, а на приливе ИФ была в 3 раза ниже. Расчет соотношения световых и темновых реакций фотосинтеза (Jmax/Vc max) показал, что у растений, длительно находящихся на воздухе (во время отлива) и в воде
Таблица 2.
Параметры аппроксимации углекислотных кривых СО2-газообмена Fucus vesiculosus, рассчитанные с использованием модели Фаркьюхара
| Параметр, мкмоль СО2 /(м2 с) | Условия* | |||
|---|---|---|---|---|
| 1 | 2 | 3 | 4 | |
| Максимальная скорость поглощения СО2 | 2.2 ± 0.28 | 4.07 ± 0.11 | 4.67 ± 0.94 | 1.78 ± 0.46 |
| Скорость темнового выделения СО2 | 0.23 ± 0.03 | 0.24 ± 0.04 | 0.49 ± 0.08 | 0.67 ± 0.16 |
| Максимальная скорость карбоксилирования РБФ | 0.81 ± 0.1 | 4.65 ± 0.35 | 3.57 ± 0.95 | 3.07 ± 0.74 |
| Эффективность карбоксилирования, мкмоль СО2/(м2 с Пa) | 0.022 ± 0.012 | 0.032 ± 0.016 | 0.050 ± 0.013 | 0.064 ± 0.013 |
| Скорость электронного транспорта при световом насыщении | 2.1 ± 0.4 | 13.1 ± 1.1 | 16.6 ± 1.5 | 7.73 ± 2.6 |
| Скорость утилизации триозофосфатов | 0.93 ± 0.12 | 1.19 ± 0.11 | 1.46 ± 0.14 | 0.80 ± 0.20 |
| Углекислотный компенсационный пункт | 177 ± 5 | 204 ±4 | 114 ± 12 | 217 ± 14 |
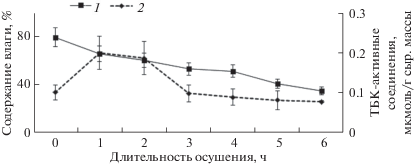
Резкое изменение условий окружающей среды в процессе отлива, влекущее за собой изменение содержания влаги и ИФ у F. vesiculosus, дает основание предполагать наличие окислительного стресса в клетках водорослей. Анализ содержания в тканях ТБКап, свидетельствующих о наличии процессов ПОЛ, показал достоверное, почти 3-кратное увеличение этих соединений в первые 2 ч осушения. Однако уже через 3 ч их содержание снижалось до исходного, которое поддерживалось до наступления прилива (рис. 4).
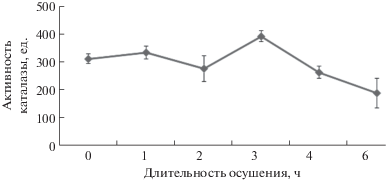
Эти данные свидетельствуют о наличии окислительного стресса в первые часы отлива и нарушении мембранных структур. Вследствие работы антиоксидантной и репарационной систем после второго часа осушения наблюдается процесс восстановления. Снижению содержания активных форм кислорода (АФК) способствует фермент каталаза, активность которого отмечается в течение всего периода нахождения растений при отливе, а максимум – на 4-й час (рис. 5).
Определение активности каталазы в течение нескольких приливно-отливных циклов показало, что во всех случаях характер кривой оставался одинаковым. Некоторый сдвиг пика активности фермента в ту или другую сторону зависел от погодных условий (температуры, облачности, скорости ветра, влажности): в более жаркие дни периоды снижения и повышения активности фермента наступали раньше.
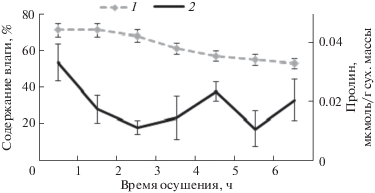
Мониторинг содержания пролина в тканях F. vesiculosus в течение нескольких приливно-отливных циклов показал, что в первые часы отлива происходит уменьшение концентрации аминокислоты, после 3–4 ч осушения отмечается резкое ее увеличение, в дальнейшем концентрация снижается (рис. 6).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На побережье Баренцева моря в районе биологической станции ММБИ (губа Зеленецкая) в течение приливно-отливного цикла продолжительность осушения верхней литорали составляет – 8 ч, нижней – 2–3 ч. F. vesiculosus уникальный вид, который благодаря своим высоким адаптивным возможностям способен произрастать в верхней литорали и опускаться в сублитораль.
Анализ фотосинтетической активности вида показал, что в течение приливно-отливного цикла у водорослей выявляется трехвершинная кривая с двумя максимумами в период отлива и одним в начале прилива. В конце отлива (6 ч осушения) ИФ снижалась до отрицательных значений газообмена. Значения ИФ в начале прилива оказались существенно выше, чем в конце. Отрицательные значения газообмена свидетельствуют о существенном ингибировании процессов фотосинтеза в период осушения.
В процессе приливно-отливного цикла изменения содержания и соотношения фотосинтетических пигментов, а также размеров светособирающего комплекса не наблюдались. Полученные данные свидетельствуют о том, что изменения ИФ происходят за счет изменения скорости световых реакций и связаны с функциональными, а не со структурными перестройками фотосинтетического аппарата.
Дальнейшие расчеты, основанные на полученных данных, показали, что скорость электронного транспорта, максимальная скорость и эффективность карбоксилирования и скорость темнового выделения СО2 у F. vesiculosus во время прилива были в 3–4 раза выше таковых во время отлива. Для таких показателей, как скорость утилизации триозофосфатов и углекислотный компенсационный пункт, в периоды прилива и отлива различий не отмечалось. Почти в 2 раза выше были значения ИФ при переходе в водную среду в начале прилива. Этот переход сопровождался быстрым увеличением максимальной скорости карбоксилирования и электронного транспорта, а через 30 мин активизировались и другие процессы (возрастали скорости утилизации триозофосфатов и темнового дыхания). Полученные данные свидетельствуют о том, что с переходом в водную среду подключаются другие механизмы карбоксилирования, которые не фиксируются используемым методом определения ИФ.
В работе использован метод, который учитывает поглощение только атмосферного углерода в форме СО2, который карбоксилируется с участием рибулозобисфосфат карбоксилазы/оксигеназы (РБФК/О). Однако в водной среде содержание СО2 мало и основной источник углерода для водорослей – бикарбонат, который переводится в доступную форму с помощью фермента карбоксилазы. Возможность переключения механизмов карбоксилирования и способность литоральных водорослей в качестве источника неорганического углерода использовать для фотосинтеза СО2 воздуха вместо бикарбоната была обнаружена еще в середине ХХ в. пионером в области этих исследований Бидвеллом (Bidwell, 1958). В некоторых работах указывается на снижение фотосинтеза литоральных водорослей в период отлива (Bidwell, Craigie, 1963; Williams, Dethier, 2005), что может быть связано с исследованием именно длительного нахождения водорослей в воздушной среде. В нашей работе выявлено увеличение ИФ литоральных водорослей в первую фазу отлива, при краткосрочном осушении, что подтверждается результатами аналогичных исследований (Quadir et al., 1979; Gao et al., 1999). Увеличение достигается, в частности, способностью F. vesiculosus аккумулировать углерод в тканях, подобно растениям с метаболизмом, аналогичным таковому у толстянковых, осуществляя тем самым процессы фотосинтеза какое-то время без внешнего источника углерода (Kawamitsu, Boyer, 1999).
Можно предположить, что устойчивость данного вида к осушению определяется его способностью к использованию атмосферной СО2. Однако в большинстве работ, касающихся адаптации фукусов к осушению, анализировались изменения содержания влаги в талломах. Так, известно, что F. vesiculosus способен выдерживать длительное осушение и быстро восстанавливать потерянную влагу: растения способны терять до 91% воды (Kanwisher, 1957) и до 32 ч находиться в воздушной среде без потери жизнеспособности (Kawamitsu et al., 2000; Андреев и др., 2012). Наши исследования показали, что во влажной среде F. vesiculosus может находиться ~1 мес. и быстро восстанавливать свою фотосинтетическую активность при попадании в воду. На беломорских фукоидах также отмечено, что литоральные виды медленнее теряют влагу, чем сублиторальные (Андреев и др., 2012).
Описано несколько механизмов, которые предотвращают обезвоживание водорослей во время отлива: выделение на поверхность таллома веществ полисахаридной природы, например фукоидана (Lobban et al., 1985), накопление в клетках веществ, обладающих осмотическими свойствами, например гидриноподобных белков (Wiltens et al., 1978; Quadir et al., 1979; Li et al., 1998), изменение концентраций ионов внутри клеток (Bisson, Kirst, 1995). Однако исследования, проведенные на различных видах водорослей, показали, что высота их произрастания на литорали не зависит от механизмов, регулирующих скорость потери влаги талломом (Dorgelo, 1976; Schonbeck, Norton, 1979; Ji, Tanaka, 2002). Это может означать, что все перечисленные механизмы обеспечивают прежде всего условия для поддержания углекислотного метаболизма в водной среде и при осушении.
У водорослей, длительное время находившихся в воздушной среде во время отлива, функциональные показатели фотосинтетической активности, рассчитанные по модели, были ниже, чем у талломов, находившихся в водной среде. В то же время при длительном нахождении водорослей под водой отмечались увеличение темнового дыхания, высокая скорость и эффективность процесса карбоксилирования, высокая активность транспорта электронов и даже повышение показателя углекислотного компенсационного пункта.
При переходе водорослей в водную среду в начале прилива ИФ увеличивалась почти в 2 раза и этот процесс сопровождался повышением скорости электронного транспорта в ЭТЦ хлоропластов, а значит, и скорости регенерации акцептора СО2 – рибулозобисфосфата. Скорость электронного транспорта в течение первых 30 мин увеличилась в 6–8 раз. Максимальная скорость карбоксилирования (активность РБФК/О) увеличивалась также почти в 6 раз, что оказалось сопоставимо с повышением скорости электронного транспорта. Однако значительное повышение скорости данных реакций не приводило к аналогичному повышению ИФ. Показатель Jmax/Vc max в начальный период прилива у растений, находящихся в воде 30 мин, увеличивался до 4.6, что свидетельствует о возможном лимитировании ИФ активностью РБФК/О. В результате в начале прилива активность РБФК/О хотя и повышается по сравнению с условиями отлива, но вследствие перехода на другой источник углерода (бикарбонат) не реализуется в соответствующем увеличении ИФ.
Результаты определения фотосинтетической активности световой и темновой фаз фотосинтеза у F. vesiculosus свидетельствовали об обратимых изменениях в работе фотосинтетического аппарата (ФА) в период отлива, что могло быть вызвано повышением освещенности и температуры и развивающимся окислительным стрессом.
Было показано увеличение ИФ у водорослей в первые часы отлива, когда растения начинали подвергаться воздействию высокой освещенности, которая увеличивалась в 5 раз и более, поскольку в прибрежной зоне Баренцева моря >80% фотосинтетически активной радиации (ФАР) задерживается верхним метровым слоем воды (Макаров и др., 2010). Однако ИФ различных видов литоральных водорослей в первые часы может значительно увеличиваться и снижаться и, как считают исследователи, маловероятно, что данный эффект может быть связан только с увеличением интенсивности освещения (Johnson et al., 1974; Wiltens et al., 1978; Quadir et al., 1979; Oquist, Fork, 1982; Hanelt, 1998; Ganlin et al., 2008).
Изменение ИФ может быть связано с увеличением скорости электронного транспорта и повышением содержания АФК, а также с последующей активизацией защитных реакций на уровне фотохимической стадии фотосинтеза (повышение тепловой диссипации, флуоресценции и т.д.) (Collén, Davison, 1999; Yoshinobu et al., 2000; Колупаев, 2007; Хебер и др., 2007). Об увеличении АФК свидетельствуют полученные нами данные о накоплении продуктов ПОЛ в начальный период осушения. Последующее снижение ПОЛ связано с активизацией антиоксидантных систем, активное функционирование которых может обеспечивать и поддержание второго пика фотосинтетической активности. Повышение содержания каталазы и/или повышение активности данного фермента в период первого пика объясняется накоплением АФК, а дальнейшее снижение активности связано как с уменьшением их концентрации (Радюкина, 2015), так и с подключением других систем антиоксидантной защиты. Мы также предполагаем, что в поддержании физиологической активности и в защите от окислительного стресса может участвовать и свободная аминокислота пролин. Анализ особенностей накопления пролина показал значительное увеличение концентрации через 3–4 ч осушения, что соответствует середине отлива. Ранее было отмечено, что пролин в клетках растений выполняет много функций, в том числе может выступать как сигнальная молекула для активизации систем организма, ответственных за восстановление растений после стресса (Bates et al., 1973; Szabados, Savouré, 2010). В некоторых работах была определена его роль как антиоксиданта, способного снижать концентрацию АФК и активировать альтернативные пути их детоксикации (Matysik et al., 2002). Вполне возможно, что он участвует в обезвреживании АФК, которые образуются в результате фотосинтетической деятельности в клетках фукоидов в начальный период осушения, а также участвует в активизации синтеза каталазы.
Снижение ИФ у F. vesiculosus до отрицательных значений при длительном нахождении талломов в воздушной среде может свидетельствовать либо об ограниченных возможностях фиксации СО2 атмосферы, либо об ограниченном потенциале антиоксидантных систем, которые обеспечивают активность фотосинтетического аппарата. Первое предположение поддерживается полученными нами данными о возможности быстрого восстановления ФА водорослей после начала прилива и о сохранении его активности при длительном обезвоживании растений, а также ранее опубликованными данными (Bidwell, Craigie, 1963; Quadir et al., 1979; Williams, Dethier, 2005; Schagerl, Moоstl, 2011).
Один из механизмов устойчивости F. vesiculosus к осушению – его гидролабильность, т.е. способность к потере значительного количества влаги в период отлива и быстрое его восстановление при наступлении прилива. Кроме того, приспособление к условиям местообитания, по-видимому, связано с активизацией защитных антиоксидантных систем и механизмов карбоксилирования. Их эффективность и продолжительность работы, по-видимому, соотносятся со средней продолжительностью периода осушения во время отлива в локальных условиях произрастания вида (Flores-Molina et al., 2014). При этом 3–4 ч осушения (именно такая продолжительность нахождения водорослей данного вида в воздушной среде наблюдалась во время квадратурных приливно-отливных циклов) – переходный период, когда происходила перестройка функциональных систем (переход на замедление фотосинтетических процессов и активизация защитных механизмов). По-видимому, в формировании защитных механизмов принимает участие и аминокислота пролин.
Длительное периодическое нахождение литоральных водорослей в воздушной среде во время отлива имеет и положительную сторону. Многие морские организмы, как животные, так и растения, не способны выдерживать столь продолжительное осушение. И хотя условия обитания для фукусовых водорослей там далеко не оптимальные, произрастание в литоральной зоне дает им дополнительное конкурентное преимущество, защищая от эпифитов и растительноядных животных.
Проведенное исследование показало, что адаптация макроводорослей, обитающих в литоральной зоне, к условиям периодического осушения связана со свойством гидролабильности, с активизацией защитных антиоксидантных систем, включения факультативных механизмов карбоксилирования. Длительность эффективной работы всех защитных механизмов, по-видимому, соотносится со средней продолжительностью периода осушения во время отлива в горизонте произрастания вида и обусловливает его дополнительное конкурентное преимущество.
Список литературы
Андреев В.П., Маслов Ю.И., Сороколетова Е.Ф. Функциональные особенности фотосинтетического аппарата трех видов Fucus в условиях Белого моря. Влияние обезвоживания // Физиология растений. 2012. Т. 59. № 2. С. 244–250.
амнев А.Н. Структура и функции бурых водорослей. М.: Изд-во МГУ, 1989. 200 с
Колупаев Ю.Е. Активные формы кислорода в растениях при действии стрессоров: образование и возможные функции // Вісн. Харківськ. нац. аграрн. унів. Сер. Біол. 2007. Вип. 3 (12). С. 6–26.
Королюк М.А., Иванова Л.И., Майорова И.Г., Токарев В.Е. Метод определения активности каталазы // Лаб. дело. 1988. № 1. С. 16–19.
Кузнецов В.В., Радюкина Н.Л., Шевякова Н.И. Полиамины при стрессе: биологическая роль, метаболизм и регуляция // Физиология растений. 2006. Т. 53. № 5. С. 658–683.
Ли Б.Д. Экологические аспекты фотосинтеза морских растений. Владивосток: Изд-во ДВНЦ АН СССР, 1978. С. 38–54.
Малавенда С.В. Особенности макрофитобентоса Грен-фьорда архипелага Шпицберген // Комплексные исследования природы Шпицбергена и прилегающего шельфа: Матер. Междунар. науч. конф. / Под общ. ред. Матишева Г.Г., Тарасова Г.А. М.: ГЕОС, 2014. С. 190–196.
Макаров М.В., Рыжик И.В., Воскобойников Г.М., Матишов Г.Г. Влияние глубины произрастания на морфофизиологические показатели Fucus vesiculosus L. Баренцева моря // Докл. РАН. 2010. Т. 430. № 3. C. 427–429.
Маслова Т.Г., Попова И.А., Попова О.Ф. Критическая оценка спектрофотометрического метода количественного определения каротиноидов // Физиология растений. 1986. Т. 33. № 3. С. 615–619.
Олениченко Н.А., Городкова Е.С., Загоскина Н.В. Влияние экзогенных фенольных соединений на перекисное окисление липидов у растений пшеницы // С.-х. биология. 2008. № 3. С. 58–61.
Пигменты пластид зеленых растений и методика их исследований / Под ред. Сапожникова Д.И. М.; Л.: Наука, 1964. 120 с.
Радюкина Н.Л. Функционирование антиоксидантной системы дикорастущих видов растений при кратковременном действии стрессоров: Атореф. дис. докт. биол. наук. М.: Ин-т физиологии растений им. К.А. Тимирязева РАН, 2015. 48 с.
Хебер У., Ланге О.Л., Шувалов В.А. Запасание и диссипация энергии света растениями как комплементарные процессы, участвующие в поддержании жизни растений // Проблемы регуляции в биологических системах / Под общ. ред. Рубина А.Б. Москва; Ижевск: НИЦ “Регулярная и хаотическая динамика”, 2007. 480 с.
Bates L.S., Waldren S.P., Teare I.D. Rapid determination of proline for water-stressed studies // Plant Soil. 1973. V. 39. P. 205–207.
Bidwell R.G.S. Photosynthesis and metabolism of marine algae. II. A survey of rates and products of photosynthesis in C14O2 // Can. J. Bot. 1958. V. 36. P. 337–349.
Bidwell R.G.S., Craigie J.S. A note on the greatly reduced ability of Fucus vesiculosus to absorb or evolve CO2 when not submerged // Can. J. Bot. 1963. V. 41. № 2. P. 179–182.
Bisson M.A., Kirst G.O. Osmotic acclimation and turgor pressure regulation in algae // Naturwissenschaften. 1995. V. 82. P. 461–471.
Caemmerer S., Farquhar G.D. Some relationships between the biochemistry of photosynthesis and the gas exchange rates of leaves // Planta. 1982. V. 153. P. 376–387.
Collén J., Davison I.R. Stress tolerance and reactive oxygen metabolism in the intertidal red seaweeds Mastocarpus stellatus and Chondrus crispus // Plant, Cell & Environ. 1999. V. 22. P. 1143–1151.
Davison I.R., Pearson G.A. Stress tolerance in intertidal seaweeds // J. Phycol. 1996. V. 32. P. 197–211.
Dorgelo J. Intertidal fucoid zonation and desiccation // Hydrobiol. 1976. V. 10. № 2. P. 115–122.
Dring M.J., Brown F.A. Photosynthesis of intertidal brown algae during and after periods of emersion: a renewed search for physiological causes of zonation // Mar. Ecol. Prog. Ser. 1982. V. 8. P. 301–308.
Esterbauer H., Cheesman U. Determination of aldehydic lipid peroxidation products: malonaldehyde and 4-hydroxymalonaldehyde // Meth. Enzymol. San Diego. 1990. V. 186. P. 302–310.
Farquhar G.D., Caemmerer S., Berry J.A. A biochemical model of photosynthetic CO2 assimilation in leaves of C3 plants // Planta. 1980. V. 149. № 1. P. 78–90.
Flores-Molina M.R., Thomas D., Lovazzano C., Nunez A., Zapata J., Kumar M., J.A. Correa, Contreras-Porcia A.C. Desiccation stress in intertidal seaweeds: Effects on morphology, antioxidant responses and photosynthetic performance // Aquat. Bot. 2014. V. 113. P. 90–99.
Guo G., Dong S. Effects of desiccation on the growth and photosynthetic rate of four intertidal macroalgae from different vertical locations // Transact. Oceanol. Limnol. 2008. V. 4. P. 78–84.
Gao K., Ji Y., Aruga Y. Relationship of CO2 concentrations to photosynthesis of intertidal macroalgae during emersion // Sixteenth Inter. Seaweed Sympos. Springer Netherlands, 1999. P. 355–359.
Gylle A.M., Nygard C.A., Ekelund N.G.A. Desiccation and salinity effects on marine and brackish Fucus vesiculosus L. (Phaeophyceae) // Phycologia. 2009. V. 48. № 3. P. 156–164.
Gylle A.M., Rantamaki S., Ekelund N.G.A., Tyystjarvi E. Fluorescence emission spectra of marine and brackish-water ecotypes of Fucus vesiculosus and Fucus radicans (Phaeophyceae) reveal differences in light-harvesting apparatus // J. Phycol. 2011. V. 47. P. 98–105.
Hanelt D. Capability of dynamic photoinhibition in Arctic macroalgae is related to their depth distribution // Mar. Biol. 1998. V. 131. P. 361–369.
Harley P.C., Sharkey T.D. An improved model of C3 photosynthesis at high CO2: Reversed O2 sensitivity explained by lack of glycerate re-entry into the chloroplast // Photosynth. Res. 1991. V. 27. P. 169–178.
Ji Y., Tanaka J. Effect of desiccation on the photosynthesis of seaweeds from the intertidal zone in Honshu // Jap. Phycol. Res. 2002. V. 50. P. 145–153.
Johnson W.S., Gigon A., Gulmon S.L., Mooney H.A. Comparative photosynthetic capacities of intertidal algae under exposed and submerged conditions // Ecol. Soc. Am. 1974. V. 55. №. 2. P. 450–453.
Kanwisher J. Freezing and drying in intertidal algae // Biol. Bull. 1957. V. 113. № 2. P. 275–285.
Kawamitsu Y., Boyer J.S. Photosynthesis and carbon storage between tides in a brown alga, Fucus vesiculosus // Mar. Biol. 1999. V. 133. № 2. P. 361–369.
Kawamitsu Y., Driscoll T., Boye J.S. Photosynthesis during desiccation in an intertidal alga and a land plant // Plant Cell Physiol. 2000. V. 41. № 3. P. 344–353.
Li R., Brawley S.H., Close T.J. Proteins immunologically related to dehydrins in fucoid algae // J. Phycol. 1998. V. 34. P. 642–650.
Lobban C.S., Harrison P.J., Duncan M.J. The physiological ecology of seaweeds. Cambridge: Cambr. Univ. Press, 1985. 242 p.
Makarov M.V. Adaptation of the light-harvesting complex of the Barents Sea brown seaweed Fucus vesiculosus L. to light conditions // Dokl. Biol. Sci. 2012. V. 442. № 1. P. 58–61.
Matysik J., Alia Bhalu B., Mohanty P. Molecular mechanisms of quenching of reactive oxygen species by proline under stress in plants // Curr. Sci. 2002. V. 82. № 5. P. 525–532.
Oquist G., Fork D.C. Effects of desiccation on the excitation energy distribution from phycoerythrin to the two photosystems in the red alga Porphyra perforate // Physiol. Plant. 1982. V. 56. P. 56–62.
Parsons R., Ogston S. Photosyn Assistant Ver 1.1.2. Dundee: Dundee Scientific, 1999.
Quadir P., Harrison J., DeWreede R.E. The effects of emergence and submergence on the photosynthesis and respiration of marine macrophytes // Phycologia. 1979. V. 18. № 1. P. 83–88.
Russell G., Ruuskanen A., Kiirikki M. Sunlight, shade and tidal night: photoadaptation in Fucus vesiculosus L. // Sarsia. 1998. V. 83. P. 381–386.
Schagerl M., Moostl M. Drought stress, rain and recovery of the intertidal seaweed Fucus spiralis // Mar. Biol. 2011. V. 158. P. 2471–2479. https://doi.org/10.1007/s00227-011-1748-x
Schonbeck M.W., Norton T.A. An investigation of drought avoidance in intertidal fucoid seaweeds // Bot. Mar. 1979. V. 22. P. 133–144.
Szabados L., Savouré A. Proline: a multifunctional amino acid // Trends Plant Sci. 2010. V. 15. № 2. P. 89–97.
Thomas D. Seaweeds. Life Series. London: Nat. History Museum, 2002. 253 p.
Williams S.N., Dethier M.N. High and dry: variation in net photosynthesis of the intertidal seaweed Fucus gardneri // Ecology. 2005. V. 86. P. 2373–2379.
Wiltens J., Schreiber U., Vidaver W. Chlorophyll fluorescence induction: an indicator of photosynthetic activity in marine algae undergoing desiccation // Can. J. Bot. 1978. V. 56. P. 2787–2794.
Yoshinobu K., Driscoll T., Boyer J.S. Photosynthesis during desiccation in an intertidal alga and a land plant // Plant Cell Physiol. 2000. V. 41. № 3. P. 344–353.
Zaneveld J.S. The littoral zonation of some Fucaceae in relation to desiccation // J. Ecol. 1937. V. 25. № 2. P. 431–468.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая