Известия РАН. Серия биологическая, 2021, № 1, стр. 83-92
Грибовидные тела палочников (Phasmatodea: Insecta): структура и источники формирования
А. А. Панов *
Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
* E-mail: tortrix@yandex.ru
Поступила в редакцию 29.11.2018
После доработки 24.04.2019
Принята к публикации 24.04.2019
Аннотация
Установлено, что грибовидные тела палочников формируются клетками Кеньона, собранными в многочисленные группы, причем отростки клеток Кеньона первоначально формируют индивидуальные пучки, следующие в чашечку. Найдено, что большинство таких пучков теряют обособленность уже в клеточном слое, поэтому в чашечку обычно входят сложные пучки. Обнаружено, что слияние пучков прогрессирует внутри чашечки, однако даже ножка сохраняет пучковое строение, а классическую концентрическую структуру имеют только доли. Показано, что у эмбрионов грибовидные тела образуются двумя пролиферативными центрами с одним нейробластом в каждом. Предположено, что эти нейробласты относятся к нейробластам II типа, а прародители групп клеток Кеньона – промежуточные нейральные прогениторы.
Палочники, или привидениевые, – относительно небольшой отряд насекомых. Современная фауна палочников насчитывает ~3000 видов, населяющих преимущественно субтропики и тропики (Grimaldi, Engel, 2005). Все палочники растительноядны, с ночной активностью и характеризуются длительными сроками эмбрионального и постэмбрионального развития. Большая часть современных палочников бескрыла. Форма их тела имитирует различные части растений: сучки, веточки или листья. Многим палочникам свойствен кататрепсис. Простота содержания палочников некоторых видов в домашних условиях уже давно сделала их “домашними любимцами” и объектами экспериментальных исследований (Bedford, 1978).
Мозг палочников, включая грибовидные тела, один из важнейших нервных центров мозга насекомых, был впервые описан у Carausius morosus (Kühnle, 1913). В каждой половине мозга был обнаружен только один “глобулус” (совокупность тел собственных нейронов грибовидного тела), а “шапочка” (современная чашечка) была описана как массивный полушар, выпуклой стороной направленный от мозга. Было указано существование многочисленных входов мощных пучков волокон в чашечку со стороны слоя глобулярных клеток. Однако Кюнле не нашел какого-либо порядка в их расположении. Позже Ганстрем исследовал грибовидные тела у листовидки Phyllium pulchrifolium (Hanström, 1930) и более подробно описал их у C. morosus и Diapheromera femorata (Hanström, 1940). У всех трех видов чашечка выглядела как единая нейропилярная структура, пронизанная пучками волокон глобулярных клеток, которые, сходясь, формировали ножку. Ножка затем делилась на двураздельную балку (бета-долю), возвратный стебелек (альфа-долю) и так называемый нижний стебелек, идущий сбоку от центрального тела и описанный еще Кюнле как “нижний корешок”.
Особняком стоит находка, сделанная Гольмгреном (Holmgren, 1916), который у не определенного им южно-американского тропического крылатого (следовательно, по мнению Гольмгрена, более древнего) палочника обнаружил двураздельную чашечку и две обособленные группы глобулярных клеток. На этом основании он считал, что единая чашечка, найденная до этого у Dixippus (Carausius), образовалась вторично.
Генезис грибовидных тел исследовался лишь однажды у C. morosus, причем только у эмбрионов (Malzacher, 1968). Автор обнаружил, что у этого палочника, как и у американского таракана, каждое грибовидное тело возникает из двух скоплений нейробластов. К моменту выхода личинки у Carausius двойная природа грибовидных тел исчезает благодаря слиянию зачатков и окончанию деятельности нейробластов.
Цель работы – подробное исследование структуры слоя клеток Кеньона и нейропилярных отделов грибовидных тел у имаго, а также изучение их генезиса у эмбрионов и нимф.
МАТЕРИАЛЫ И МЕТОДЫ
Были исследованы: C. morosus Sinety – самки неизвестного возраста (8 экз.), Extatosoma tiaratum Macleay – самки неизвестного возраста (6 экз.), Medauroidea extradentata Brunner – самцы и самки неизвестного возраста (8 экз.), Phasma gigas L. – эмбрионы стадий VII2–VII7 (15 экз.) и Sungaya inexpectata Zompro – самцы неизвестного возраста (6 экз.), нимфы разных возрастов (11 экз.), эмбрионы стадий III¾–VII7 (68 экз.). Эмбриональные стадии определяли по описаниям и рисункам Фурнье (Fournier, 1967). У наркотизированных имаго и нимф для облегчения доступа фиксатора внутрь головы срезали глаза и отрезанную по шее голову фиксировали в течение 3–4 сут в жидкости Буэна. Яйца вплавляли в дно восковой ванночки, которую заполняли забуференным рингером PBS (Phosphate Buffered Saline). Осторожно вскрывали хорион и далее разрезали оболочки, окружающие желток. Яйца палочников крайне богаты желтком, и эмбрионы ранних стадий находятся на его поверхности у заднего полюса яйца. Эмбрионы с желтком выдавливали из оболочек, затем эмбрионы отмывали от излишков плохо режущегося желтка и переносили на несколько суток в жидкость Буэна. У эмбрионов поздних стадий на голове прорезали собственную кутикулу эмбрионов. Вычлененные мозги имаго и эмбрионов заливали в парапласт, а 6- и 10-микронные срезы окрашивали железным гематоксилином по Гейденгайну (Ромейс 1953) или паральдегид-тионином с флоксином (ПТФ) (Panov, 1980). Цифровые изображения были получены с помощью микроскопа Leica DMR (Германия), снабженного камерой JVCKYF55B (Япония), и обработаны с помощью программы Adobe Photoshop CS2. Морфологические структуры измеряли вручную на растянутых цифровых отпечатках с помощью измерительной линейки с масштабом 0.35 мкм в 1 мм.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Грибовидное тело имаго. На обычных гистологических препаратах в грибовидных телах палочников можно различить два морфологических типа глобулярных клеток (клеток Кеньона). Клетки Кеньона 1-го типа характеризуются относительно крупными размерами и особенно тем, что содержимое их ядер собрано в единую округлую глыбку, окруженную светлым двориком (рис. 1а). Только при сильной дифференцировке железного гематоксилина или при окраске ПТФ в глыбке удается различить мелкие ядрышки и участки хроматина. Именно такого типа клетки Кеньона можно видеть на рисунках и фотографиях, приведенных в цитированных выше работах (Kühnle, 1913; Hanström, 1930, 1940). Клетки Кеньона 2-го типа идентифицируются только по их ядрам, которые мелки, и хроматин в них распределен по всему ядру (рис. 1б). Слой цитоплазмы у этих клеток настолько тонок, что не различается при средних увеличениях светового микроскопа.
Рис. 1.
Грибовидные тела имаго и эмбрионов палочников. а – Medauroidea extradentata, чашечка с двумя входами пучков отростков клеток Кеньона 1-го типа; б – то же, чашечка с одним пучком отростков клеток Кеньона 1-го типа и одним пучком отростков клеток Кеньона 2-го типа; в – Sungaya inexpectata, чашечка с поперечно перерезанными пучками отростков клеток Кеньона; г – Medauroidea extradentata, поперечно перерезанное основание большой группы клеток Кеньона 2-го типа (головками стрелок указаны основания индивидуальных колонок клеток Кеньона); д – Extatosoma tiaratum, поперечный разрез чашечки; е – Sungaya inexpectata, слой клеток Кеньона и чашечка (а–д – имаго, е – эмбрион стадии VII7). BL – β-доля. Cal – чашечка, INP? – ядра предполагаемых промежуточных нейральных прогениторов, Kc – клетки Кеньона, Kc1 – клетки Кеньона 1-го типа, Kc2- клетки Кеньона 2-го типа. LL – нижняя доля, lM – большой митоз, MBNb – нейробласт грибовидного тела, P – ножка, sM – малый митоз, sNb – одиночный нейробласт, sNbA – одиночный нейробласт в анафазе митоза, sNbM – одиночный нейробласт в метафазе митоза; для рис. 1–3. Масштаб: 20 (а, б, г–е) и 50 (в) мкм.
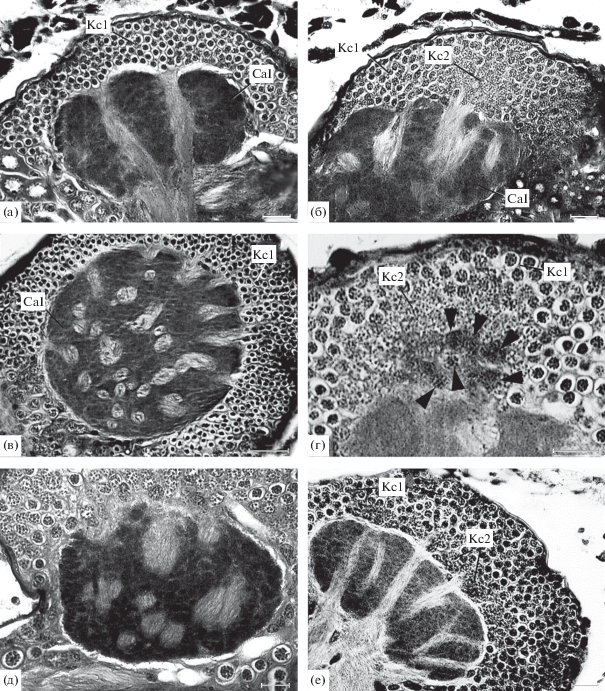
Встречаемость этих типов клеток Кеньона и их распределение в слое тел клеток грибовидных тел очень сильно различаются у исследованных видов палочников. Так, у C. morosus большинство особей имело только клетки Кеньона 1-го типа. Напротив, у исследованных экземпляров E. tiatarum клетки Кеньона большей частью имели ядра с равномерно распределенным хроматином, т.е. они могли быть отнесены ко 2-му типу. У некоторых особей были встречены и клетки Кеньона 1-го типа с содержимым ядра, собранным в компактную, сильно окрашивающуюся массу. Но их было немного, они лежали преимущественно на периферии, ближе к оболочке мозга, где были перемешаны с клетками Кеньона 2-го типа.
У имаго S. inexpectata и M. extradentata имелись клетки Кеньона обоих типов, но их распределение в клеточном слое было различным. У Sungaya клетки 2-го типа, особенно на ранних стадиях развития, небольшими группами концентрировались около чашечки (рис. 1е), а у Medauroidea они были собраны в две большие группы, по высоте занимавшие всю толщину клеточного слоя грибовидных тел (рис. 1б). У имаго исследованных видов тела клеток Кеньона образуют обычно единую массу, в которой нельзя выделить какие-либо клеточные группировки.
Как отмечено выше, уже Кюнле (Kühnle, 1913) обнаружил, что из слоя тел глобулярных клеток в нейропиль чашечки входит множество пучков отростков клеток, которые затем сходятся в ножку. Подсчет числа этих пучков обнаружил сильные видовые различия (табл. 1). Пучки отростков сильно различаются по толщине и составу волокон. На гистологических препаратах, окрашенных железным гематоксилином, у самых тонких пучков имеется только один темноокрашенный центр, а у толстых пучков таких центров несколько (рис. 1в). Поскольку отростки клеток Кеньона собираются в пучки, можно утверждать, что сами клетки Кеньона имеют первичную организацию в виде групп (кластеров), простых или сложных. Сложность крупных групп была подтверждена полицентричностью пучков их отростков и результатами анализа структуры больших групп клеток 2-го типа у M. extradentata (рис. 1г). В этих группах самые мелкие ядра клеток 2-го типа, лежащие рядом с чашечкой, окрашиваются сильнее других, более удаленных от чашечки. На рис. 1г видно, что самые мелкие и темнее окрашенные ядра расположены не равномерным слоем, а собраны в несколько первичных групп, имеющих общий вход в чашечку. Было установлено, что чем меньшее число пучков пересекает чашечку, тем более толстыми и сложными по составу они являются. Это хорошо демонстрируется сравнением структуры чашечки у S. inexectata и E. tiaratum (рис. 1в и д).
Таблица 1.
Число пучков отростков клеток Кеньона, входящих в нейропиль чашечки
| Вид | Стадия развития | Серия | Число пучков на правой/левой сторонах мозга |
|---|---|---|---|
| Carausius morosus | Самка | 88-52-1 | 40/40 |
| То же | » | 88-52-3 | 43/41* |
| » | » | 88-52-9 | 39/48 |
| Extatosoma tiaratum | » | 88-56-2 | 23(4)/18(4)** |
| Medauroidea extradentata | » | 88-54-1 | 15/19 |
| То же | » | 88-54-2 | 18/17 |
| Sungaya inexpectata | Самец | 18-21-1 | 56/56 |
| То же | » | 18-24-1 | 67/64 |
| » | Нимфа 1-го возр. | 18-18-1 | 39/36 |
| » | То же | 18-18-2 | 37/44 |
Составы клеток Кеньона, связанные с определенным пучком, могут различаться. Это могут быть клетки только 1-го типа, только 2-го типа либо обоих типов. В последнем случае клетки разных типов располагаются полярно: ближе к поверхности мозга располагаются клетки 1-го типа, а рядом с чашечкой – клетки 2-го типа. Такая поэтажность расположения разных типов клеток Кеньона четко выступает на ранних стадиях развития (рис. 1е).
Проходя через нейропиль чашечки, пучки отростков клеток Кеньона постепенно сливаются друг с другом, и поэтому чашечку покидает значительно меньшее число пучков, чем входит в нее. Большим своеобразием структуры характеризуется ножка грибовидного тела палочников. На всем ее протяжении сохраняется пучковая организация (рис. 2а). Только в месте перехода ножки в доли происходит реорганизация структуры, в результате которой доли становятся типично концентрически организованными структурами (рис. 2б).
Рис. 2.
Грибовидные тела имаго и эмбрионов палочников (продолжение). а – Carausius morosus, чашечка и начало ножки; б – то же, сечения ножки и долей рядом с местом трифуркации ножки; в – Sungaya inexpectata, одиночный нейробласт с колонкой клеток-потомков; г – то же, одиночный нейробласт в метафазе митоза и ганглиозная материнская клетка в поздней анафазе; д – то же, асимметричное деление одиночного нейробласта; е – S. inexpectata, два пролиферативных центра грибовидного тела (а, б – имаго, в–д – эмбрион стадии V5, е – эмбрион стадии VI2). Масштаб: 10 (в–е), 20 (б) и 50 (а) мкм.
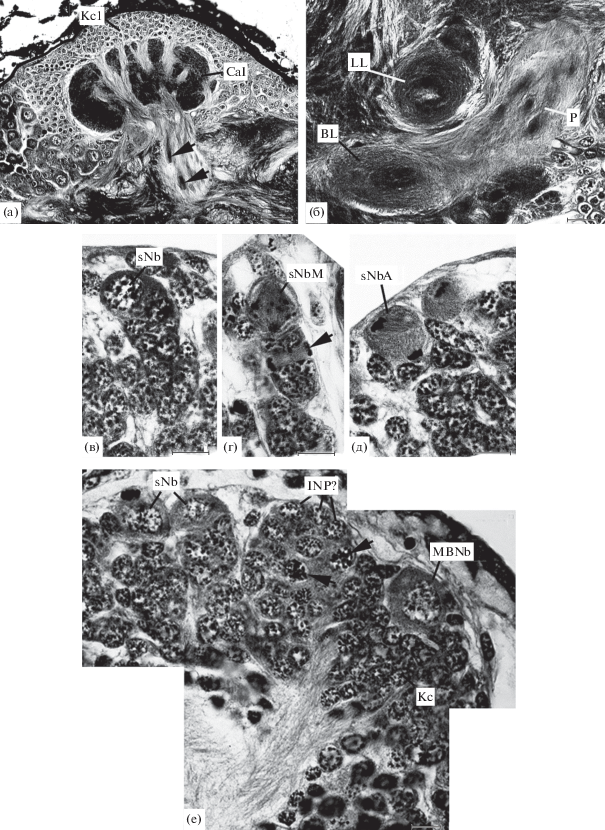
Грибовидные тела эмбрионов. Исследование развития грибовидных тел у S. inexpectata было начато со стадии V5, на которой нейропиль центрального мозга был образован только комиссуральными волокнами. В клеточной коре имелись многочисленные одиночные нейробласты, возглавлявшие колонки клеток-потомков (рис. 2в). Нейробласты типично делились асимметрично, а рядом с ними были встречены симметричные деления ганглиозных материнских клеток (рис. 2г, д).
Первые отчетливые следы начала формирования грибовидных тел были обнаружены на эмбриональной стадии VI2 (~37% эмбриогенеза). К этому времени на дорсокаудальной поверхности нейропиля каждой протоцеребральной доли образуется небольшой бугорок, сформированный отростками уже образовавшихся немногочисленных клеток Кеньона (рис. 2е). Ножка и доли еще отсутствуют.
К началу стадии VII (46–54% эмбриогенеза) чашечка значительно увеличивается и на фронтальных срезах имеет вид перевернутой трапеции, основанием обращенной к клеточному слою. Отростки клеток Кеньона, входящие в основание трапеции, сконцентрированы преимущественно по ее краям. На этой стадии внутри чашечки появляются участки “синаптического” нейропиля, разделяющего проходящие пучки отростков клеток Кеньона. Хорошо сформированы не только ножка, но и доли. Таким образом, к стадии завершения обрастания желтка зародышем происходит формирование основных отделов грибовидных тел.
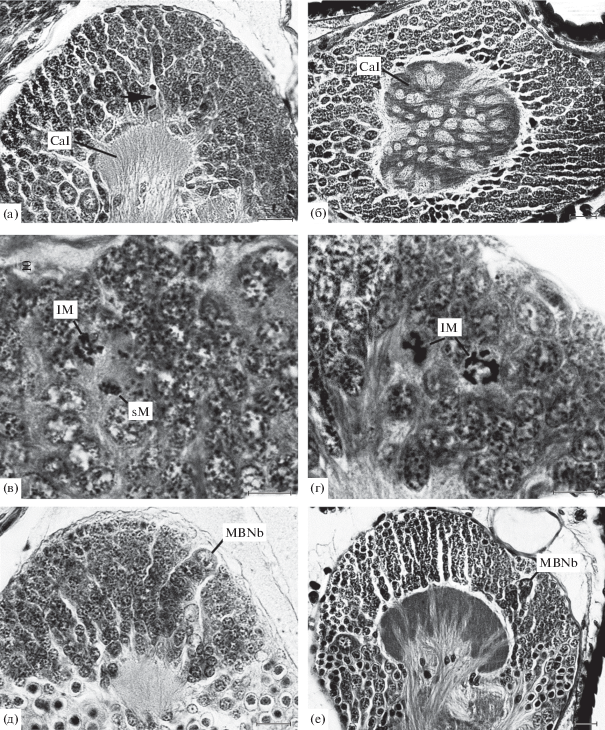
К стадии VII2 в чашечке сильно возрастает доля синаптического нейропиля и чашечка приобретает вид толстой двояковыпуклой линзы (рис. 3а). На протяжении позднего эмбриогенеза завершается формирование основных черт организации нейропилярных структур грибовидных тел, которые приобретают характеристики, свойственные имагинальным грибовидным телам. В чашечке, однако, синаптического нейропиля еще значительно меньше, чем у нимф и имаго, поэтому пучки отростков клеток Кеньона тесно сближены (рис. 3б).
Рис. 3.
Развитие грибовидных тел у эмбрионов Sungaya inexpectata. а – клетки Кеньона и чашечка (стрелкой указан митоз ганглиозной материнской клетки в анафазе); б – поперечное сечение чашечки; в – два типа митозов в пролиферативном центре; г – крупные митозы в пролиферативном центре; д – один из двух пролиферативных центров грибовидного тела; е – грибовидное тело с колонками клеток Кеньона и дегенерирующим пролиферативным центром (эмбриональные стадии: а – VII2, б – VII7, в – VI4, г – VII1, д – VII3 и е – VII7). Масштаб: 10 (в, г) и 20 (а, б, д–е) мкм.
Тела клеток Кеньона у молодых эмбрионов невозможно отличить от тел соседних нейронов, и единственный способ их идентификации – прослеживать вход их отростков в будущую чашечку (рис. 2е). Только к стадиям VI5 и VI6 они начинают четко отличаться меньшими размерами их ядер от соседних нейронов клеточной коры. Становится видно, что пучки волокон, входящие в чашечку, формируются определенными группами клеток Кеньона. В одних случаях эти группы клеток имеют классическую колонковидную форму, в других – группы гроздевидные, а отходящие от них пучки более толстые. Все клетки Кеньона выглядят одинаковыми. Ни на этой стадии, ни позже мы не обнаружили каких-либо особых клеток, которые были бы связаны с колонками клеток Кеньона.
На стадиях VII3 и VII4 основную массу клеток Кеньона образуют клетки того же типа, которые встречались на предыдущих стадиях развития. Клетки крайне бедны цитоплазмой, их ядра невелики, а глыбки хроматина равномерно заполняют ядро. По своей структуре они соответствуют клеткам Кеньона 2-го типа, найденным у имаго.
У Sungaya мы смогли уверенно идентифицировать нейробласты, связанные с грибовидными телами, только начиная со стадии VI2 эмбриогенеза (рис. 2е). До этой стадии одиночные нейробласты, располагавшиеся в дорсолатеральном протоцеребруме между зачатками центрального комплекса и зрительных долей, ничем не отличались друг от друга. Поэтому нельзя было определить, какие из них – нейробласты грибовидных тел. Но у эмбрионов стадии VI2, как отмечено выше, уже формируется некоторое число клеток Кеньона, отростки которых формируют зачаток чашечки. Именно вхождение отростков клеток в зачаток чашечки позволяет точно идентифицировать источник их образования. Было установлено, что у Sungaya на этой стадии развития в составе каждого грибовидного тела имеются только два нейробласта, которые вместе со своим потомством образуют два пролиферативных центра (рис. 2е). В противоположность клеткам других типов, нейробласты богаты цитоплазмой. Поперечник нейробластов равен ~20, а их ядер ~14 мкм. Как и одиночные нейробласты клеточной коры, нейробласты грибовидных тел располагаются недалеко от перинейриума. Проксимальнее нейробласта обычно находится группа клеток с зернистыми ядрами поперечником ~8 мкм и крайне тонким слоем цитоплазмы. Некоторые из этих ядер находились в профазе митоза. Клетки Кеньона располагались вокруг каждого пролиферативного центра и имели ядра поперечником ~6 мкм.
Приблизительно такое же общее строение клеточный слой грибовидного тела сохраняет и на стадии VI4. К этому времени число клеток Кеньона значительно возрастает и пролиферативные центры отодвигаются один от другого. Поэтому веер волокон, входящих в чашечку, становится более широким. На этой стадии во всем объеме клеточного слоя грибовидных тел были встречены митозы, у которых поперечник экваториальной пластинки был равен ~8 мкм. В дополнение к ним у эмбрионов стадий VI4 – VI7 в слое клеток, и особенно рядом с входом пучков отростков в чашечку, имелись более мелкие митозы поперечником ~5 мкм. От митозов первого типа их отличало также более плотное расположение хромосом в экваториальной пластинке (рис. 3в).
У эмбрионов стадии VII1, когда завершается обрастание желтка эмбрионом, в каждом грибовидном теле продолжают хорошо идентифицироваться два пролиферативных центра, в которых нейробласты находятся рядом с перинейриумом. Как и на предшествующих стадиях развития, рядом с ними лежат относительно крупные клетки с зернистыми ядрами. В клеточном слое грибовидных тел по-прежнему встречаются митозы двух типов: более мелкие располагаются рядом с чашечкой, а более крупные – по всему клеточному слою и рядом с нейробластом (рис. 3г). Деление самих нейробластов было встречено только однажды на стадии метафазы. Поэтому мы не можем полно их охарактеризовать. В клеточной коре остаются многочисленные одиночные нейробласты, сопровождаемые небольшими группами их потомков. На этой и на более поздних стадиях развития деления одиночных нейробластов встречались очень редко. У некоторых эмбрионов стадии VII3 еще сохранялось поверхностное положение нейробластов грибовидных тел (рис. 3д), но позднее происходило их смещение в глубину клеточного слоя. Еще сильнее выступает колонковидное расположение клеток Кеньона. К концу эмбрионального развития пролиферативные центры сохраняются, но они становятся менее заметными среди многочисленных клеток Кеньона (рис. 3е).
Данные о ходе нейрогенеза у S. inexpectata получили полное подтверждение при исследовании поздних эмбрионов P. gigas, которыe уже обросли желток (стадия VII). На стадии VII1 клеточная кора местами была образована из колонок клеток с расположенными на их вершине одиночными нейробластами. Четко выделялись группы пролиферировавших клеток, формировавших центральный комплекс. В коре дорсального протоцеребрума с каждой стороны были хорошо видны два пролиферативных центра грибовидных тел во главе с двумя нейробластами, которые отличались от одиночных нейробластов значительно более крупными группами клеток-потомков. Клетки Кеньона были немногочисленны, и их тела не отличались морфологически от таковых у соседних нейронов. Как и у Sungaya, на ранних стадиях формирования грибовидных тел клетки Кеньона идентифицировались только благодаря вхождению их отростков в зачаток чашечки.
У эмбрионов стадии VII1 нейробласты грибовидных тел лежали под самым перинейриумом, но в конце эмбриогенеза они погружались в массу клеток Кеньона. На всех имевшихся стадиях эмбрионального развития были встречены митозы двух размеров: более крупные были найдены преимущественно недалеко от нейробластов, более мелкие – рядом с чашечкой. Уже со стадии VII2 клетки Кеньона подразделялись на две категории, которые у Sungaya мы обозначили как клетки Кеньона 1-го и 2-го типов.
Грибовидные тела нимф. Развитие грибовидных тел в ходе нимфального развития было прослежено на примере S. inexpectata. Новорожденные нимфы имели грибовидные тела в целом имагинального типа. Однако у имевшихся в нашем распоряжении нимф все клетки Кеньона относились ко 2-му типу и число пучков их отростков было значительно меньше, чем у имаго (табл. 1). Нейробласты грибовидных тел достоверно обнаружены не были. Отсутствовали крупные митозы в слое клеток Кеньона, но были многочисленны мелкие митозы рядом с нейропилем чашечки. У нимф средних и старших возрастов происходит дифференциация клеток Кеньона на два типа, 1-й и 2-й, причем клетки 2-го типа располагаются слоем у наружной поверхности чашечки. Исследование единичных препаратов нимфального мозга M. extradetata подтвердило наступление дифференциации клеток Кеньона в ходе нимфального развития и концентрацию клеток 2-го типа у поверхности чашечки.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Исследование показало, что при кажущейся простоте грибовидные тела палочников обладают сложной и весьма своеобразной организацией. Хотя у взрослого насекомого явно выступает унитарность структуры грибовидного тела, его развитие отчетливо свидетельствует об исходной бинарности грибовидных тел палочников. Это впервые было предположено Гольмгреном (Holmgren, 1916), который на заре изучения нервной системы насекомых вообще считал, что исходное число глобулусов у Pterygota – два. Бинарность закладки грибовидных тел у Carausius была продемонстрирована Мальцахером (Malzacher, 1968) и подтверждена в данной работе. Это значит, что по общему характеру организации грибовидных тел палочники гораздо ближе к предполагаемому исходному типу, широко распространенному среди гемиметаболических насекомых (Farris, 2005), чем родственные им прямокрылые, у которых генезис грибовидных тел существенно отличается от предполагаемого исходного типа (Панов, 2019).
Вторая характерная особенность грибовидных тел палочников – объединение клеток Кеньона в отдельные группы. Отростки клеток группы формируют единый пучок, который обособленно, или сливаясь с себе подобными, входит в нейропиль чашечки. Эти группы нейронов очень напоминают так называемые линиджи (lineages), которые формируют клеточную кору центральной нервной системы насекомых и представляют собой совокупности клеток, последовательно происходящих от одного родоначальника. Их отростки объединяются в общий пучок, имеющий единый вход в нейропиль и единую зону концевых ветвлений в нейропиле (Lovick et al., 2013; Wong et al., 2013). Эти группы клеток формируются непосредственно нейробластами типа I или в случае нейробластов типа II – промежуточными нейральными прогениторами.
У палочников каждой чашечке соответствуют только два нейробласта и несколько десятков пучков отростков клеток Кеньона. Так как пучки в основном сложные, число линиджей клеток Кеньона в каждом грибовидном теле может быть значительным. Следовательно, можно предположить, что нейробласты грибовидных тел палочников – нейробласты II типа, при делении которых образуются не ганглиозные материнские клетки, а промежуточные нейральные прогениторы (Bello et al., 2008; Boone, Doe, 2008). Предположительно именно их крупные митозы наблюдались у эмбрионов стадий VI и VII Sungaya почти во всем объеме клеточного слоя грибовидного тела. К сожалению, мы не смогли идентифицировать этот тип пролиферируюших клеток, но состав клеток Кеньона позволяет предположить значительную продолжительность их образования нейробластами и длительность их митотической активности. Поэтому можно думать, что клетки Кеньона 1-го типа являются наиболее “старыми” глобулярными нейронами, внучатыми потомками наиболее рано образовавшихся промежуточных нейральных прогениторов и дочерними клетками более ранних ганглиозных материнских клеток.
Клетки Кеньона 2-го типа, соответственно, являются наиболее “молодыми” глобулярными нейронами. Полярность расположения этих двух типов клеток в линиджах и концентрация более мелких митозов около поверхности чашечки позволяют предположить, что в ходе нейрогенеза клеток Кеньона ганглиозные материнские клетки смещаются в основание группы, там делятся, и вновь образованные нейроны отодвигают более старые ближе к поверхности мозга. Это хорошо иллюстрируется строением клеточной коры грибовидных тел преимущественно на преимагинальных стадиях и у некоторых имаго. В итоге возникщие в разное время предполагаемые промежуточные нейрональные прогениторы образуют линиджи разного возраста. Поэтому у нимф последних возрастов и имаго часть (или большинство) пучков волокон, входящих в нейропиль чашечки, образуются “старыми” клетками Кеньона, для которых характерно объединение содержимого ядра в единую глыбку. Линиджи среднего возраста включают в себя как “старые” клетки Кеньона, лежащие дальше от чашечки, так и “молодые”, для которых характерно диспергированное состояние содержимого ядра и “отсутствие” цитоплазмы, не видимой при средних увеличениях светового микроскопа. Наконец, могут встречаться пучки отростков, образованные только “молодыми” клетками Кеньона – потомками наиболее поздно сформированных промежуточных нейральных прогениторов и ганглиозных материнских клеток.
Насколько уникальным делает нейрогенез грибовидных тел палочников предполагаемая природа нейробластов грибовидных тел как нейробластов II типа? Впервые такие нейробласты были обнаружены при изучении нейрогенеза в центральном отделе мозга личинки дрозофилы (Bello et al., 2008; Boone, Doe, 2008). Было найдено, что в каждой половине мозга у личинки дрозофилы имеются 8 нейробластов II типа, потомки которых участвуют в построении имагинального центрального комплекса (Riebli et al., 2013). Эти нейробласты последовательно обнаруживаются уже у эмбрионов дрозофилы, начиная со стадии 11, и уже у эмбрионов продуцируют промежуточные нейральные прогениторы, ганглиозные материнские клетки и нейроны, участвующие в построении имагинального центрального комплекса (Walsh, Doe, 2017; Alvarez, Diaz-Benjumea, 2018).
До сих пор остается неизвестным, имеются ли у дрозофилы нейробласты типа II в других отделах мозга или в туловищных ганглиях. Функциональная задача нейробластов II типа – производство большого числа нейронов. Такая задача может стоять перед нейробластами грибовидных тел, нервного центра, характеризующегося у многих насекомых многочисленными собственными нейронами. Действительно, у Cybister lateralimarginalis, одного из жуков-плавунцов, обладающего мощно развитыми грибовидными телами, в них был найден такой набор пролиферирующих клеток, который позволил предположить, что у этого насекомого нейробласты грибовидных тел относятся ко II типу (Панов, 2014). Совокупность приведенных выше фактов позволяет предполагать, что нейробласты, обнаруженные в грибовидных телах палочников, также могут быть II типа.
Автор благодарит Т.В. Компанцеву (Московский зоопарк) за предоставление яиц, нимф и взрослых особей S. inexpectata, нимф M. extradentata и яиц P. gigas.
Список литературы
Панов А.А. Новый, необычный (по крайней мере для жуков) способ продуцирования клеток Кеньона, найденный у жука-плавунца Cybister lateralimarginalis Deg. (Coleoptera: Dytiscidae) // Изв. РАН. Сер. биол. 2014. № 2. С. 150−154.
Панов А.А. Пролиферация и дифференцировка: два последовательных этапа активности пролиферативных центров в грибовидных телах эмбрионов сверчков Gryllus bimaculatus и Acheta domesticus и пустынной саранчи Schistocerca gregaria (Insecta: Orthoptera) // Изв. РАН. Сер. биол. 2019. № 3. С. 273−283.
Ромейс Б. Микроскопическая техника. М.: Изд-во иностр. лит., 1953. 718 с.
Alvarez J.-A., Diaz-Benjumea F.J. Origin and specification of type II neuroblasts in the Drosophila embryo // Development. 2018. V. 145. Iss. 7. P. 1−10. dev. 158394. doi:10:1242/dev.158394.
Bedford G.O. Biology and ecology of the Phasmatodea // Ann. Rev. Entomol. 1978. V. 23. P. 125−149.
Bello B.C., Izergina N., Caussinus E., Reichert H. Amplification of neural stem cell proliferation by intermediate progenitor cell in Drosophila brain development // Neural Dev. 2008. V. 3. Iss. 5. P. 1−17.
Boone J.Q., Doe C.Q. Identification of Drosohila type II neuroblast lineages containing transit amplifying ganglion mother cells // Dev. Neurobiol. 2008. V. 68. P. 1185−1195.
Farris S.M. Evolution of insect mushroom bodies: old clues, new insights // Arthr. Str. Dev. 2005. V. 34. Iss. 3. P. 211−234.
Fournier B. Échelle résumée des stades du developpement embryonnaire du phasme Carausius morosus Br. // Act. Soc. Linn. Bordeaux. 1967. Sér. A. V. 104. P. 1−30.
Grimaldi D.A., Engel M.S. Evolution of the Insects. Cambridge: Cambr. Univ. Press, 2005. 755 p.
Hanström B. Über das Gehirn von Termops nevadensis und Phyllum pulchrifolium, nebst Beiträgen zur Phylogenie der Corpora pedunculata der Arthropoden // Z. Morphol. Ökol. Tiere. 1930. Bd 19. S. 732−773.
Hanström B. Inkretorische Organe, Sinnesorgane und Nervensystem des Kopfes einiger niederer Insektenordnungen // Kungl. Svenska Vet. Akad. Handl. 1940. Ser. 3. Bd 18. H. 8. S. 1−266.
Holmgren N. Zur vergleichenden Anatomie des Gehirns von Polychäten, Onychophoren, Xyphosuren, Arachniden, Crustaceen, Myriapoden und Insekten // Kungl. Svenska Vet. Akad. Handl. 1916. Bd 56. H. 1. S. 1−303.
Kühnle K.F. Vergleichende Untersuchungen über das Gehirn, die Kopfnerven und die Kopfdrüsen des gemeinen Ohrwurms (Forficula auricularia) // Jen. Z. Naturwiss. 1913. Bd 50. S. 147−246.
Lovick J.K., Ngo K.T., Omoto J.J., Wong D.C., Nguyen J.D., Hartenstein V. Postembryonic lineages of the Drosophila brain: I. Development of the lineage-associated fiber tracts // Dev. Biol. 2013. V. 384. P. 228−257.
Malzacher P. Die Embryogenese des Gehirns paurometaboler Insekten. Untersuchungen an Carausius morosus und Periplaneta americana // Z. Morphol. Ökol. Tiere. 1968. Bd 62. H. 2. S. 103−161.
Panov A.A. Demonstration of neurosecretory cells in the insect central nervous system // Neuroanatomical Techniques / Eds Strausfeld N.J., Miller T.A. New York; Heidelberg; Berlin: Springer Verlag, 1980. P. 25−50.
Riebli N., Viktorin G., Reichert H. Early-born neurons in type II neuroblast lineages establish a larval primordium and integrate into adult circuitry during central complex development in Drosophila // Neural Dev. 2013. V. 8. Iss. 6. P. 1−17.
Walsh K.T., Doe C.Q. Drosophila embryonic type II neuroblasts: origin, temporal pattering, and contribution to the adult central complex // Development. 2017. V. 144. P. 4552−4562.
Wong D.C., Lovick J.K., Ngo K.T., Borisuthirattana W., Omoto J.J., Hartenstein V. Postembryonic lineages of the Drosophila brain: II. Identification of the lineage projection patterns based on MARCM clones // Dev. Biol. 2013. V. 384. P. 258−289.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


