Известия РАН. Серия биологическая, 2021, № 1, стр. 73-82
Структура и формирование капсулы вокруг скребня Corynosoma strumosum (Rudolphi, 1802) Lühe, 1904 в естественном паратеническом хозяине – рыбе Hadropareia middendorffii Schmidt, 1904. Ч. 1. Структура капсулы из рыб, инвазированных естественным образом
Е. М. Скоробрехова 1, В. П. Никишин 1, 2, *
1 Институт биологических проблем Севера ДВО РАН
685000 Магадан, ул. Портовая, 18, Россия
2 Северо-Восточный государственный университет
685000 Магадан, ул. Портовая, 13, Россия
* E-mail: nikishin@ibpn.ru
Поступила в редакцию 02.05.2019
После доработки 02.07.2019
Принята к публикации 21.08.2019
Аннотация
Изучена ультраструктура поверхностной части тегумента скребня Corynosoma strumosum и окружающей его капсулы в толстощеке Миддендорфа Hadropareia middendorffii. На поверхности тегумента скребня обнаружен толстый слой гликокаликса, предположительно защищающий его от клеточной реакции хозяина. Отмечено, что основные клеточные элементы капсулы – лейкоциты и фибробласты, позволяющие отнести ее к лейкоцитарному типу. Не установлено существенных различий в строении капсул, располагающихся на разных органах толстощеков.
Паратенический паразитизм является особенностью жизненных циклов многих паразитов (преимущественно, гельминтов), по общепринятому мнению, облегчающeй передачу инвазии от промежуточного хозяина к дефинитивному. Несмотря на столь важное экологическое значение, сведения о разных его аспектах в большинстве случаев фрагментарны, систематические же исследования носят единичный характер, вследствие чего эта форма паразитизма относится к числу наименее исследованных. Детальный анализ развития концепции паратенического паразитизма был проведен ранее (Шарпило, Саламатин, 2005). Авторы монографии подчеркивают, что имеющиеся данные позволяют усомниться в ряде существующих представлений об этом явлении, в частности о том, что паразит в паратеническом хозяине не претерпевает никакого развития, а также об отсутствии элементов специфичности в отношениях паразита и паратенического хозяина (Шарпило, Саламатин, 2005).
Наиболее широко эта форма паразитизма представлена в типе Acanthocephala (Шарпило и др., 1996). Известно, что в паратеническом хозяине скребни окружаются капсулами из клеток хозяина и их производных (Петроченко, 1956). В то же время имеющиеся сведения о структуре этих капсул носят либо фрагментарный, либо тезисный характер (Bogitsh, 1961; Amin et al., 1995, 1996), а механизм их формирования остается практически не изученным (Taraschewski, 2000).
Скребень Corynosoma strumosum (Rudolphi, 1802) Lühe, 1904 – широко распространенный паразит морских млекопитающих и рыбоядных птиц. В качестве промежуточных хозяев он использует морских ракообразных рода Pontoporeia, а к паратеническим хозяевам относятся морские, проходные и пресноводные рыбы множества видов (Петроченко, 1958). Ранее нами было показано, что капсула, окружающая коринозом в организме паратенического хозяина, зависит от его видовой принадлежности (Никишин, Скоробрехова, 2007; Skorobrechova, Nikishin, 2011; Скоробрехова, Никишин, 2013). Были выделены три формы капсул: фибробластические, состоящие преимущественно или исключительно из фибробластов; лейкоцитарные, в составе которых преобладают лейкоциты и макрофаги; промежуточные, образованные фибробластами с включением умеренного количества лейкоцитов (Скоробрехова, Никишин, 2013). Мы предположили, что такие различия могут быть обусловлены разной степенью сбалансированности взаимоотношений коринозом с хозяевами и соответствовать разным стратегиям этих отношений (Никишин, Скоробрехова, 2018). Кроме того, полученные ранее результаты позволили предположить, что капсулы, окружающие коринозом на разных внутренних органах паратенического хозяина, также могут несколько различаться по своему строению (Скоробрехова, Никишин, 2013).
Цель работы – проверка вышеизложенных предположений, а также изучение структуры и механизма формирования капсулы в естественном паратеническом хозяине на примере скребня C. strumosum в толстощеке Миддендорфа Hadropareia middendorffii Schmidt, 1904.
МАТЕРИАЛЫ И МЕТОДЫ
Толстощек Миддендорфа H. middendorffii – эндемичный вид эндемичного рода, распространенный в северо-западной части Тихого океана (Черешнев и др., 2001). Он обитает в литоральной зоне и на глубинах до 30 м, достигает в длину 25 см. Биология этой рыбы не изучена.
Толстощеков отлавливали в прибрежной зоне Охотского моря в окрестностях г. Магадана. Пойманных рыб подвергали парциальному вскрытию, обнаруженных скребней вместе с фрагментами окружающих тканей фиксировали в том или ином фиксаторе, причем период между вскрытием животного и фиксацией был минимальным, что позволяло сохранить живыми клетки, формирующие капсулу.
Светомикроскопические исследования. Образцы фиксировали в 70%-ном этаноле или жидкости Буэна, обезвоживали в спиртах восходящей концентрации (70, 80, 90, 96 и 100%) по 3 ч и заключали в парафин. Срезы толщиной 5–7 мкм изготавливали на санном микротоме, окрашивали в соответствии с задачами исследования и заключали в канадский бальзам.
Для выявления коллагеновых волокон срезы окрашивали методом Маллори, а для выявления эозинофилов – гематоксилин-эозином и азур-II-эозином. Препараты просматривали в световых микроскопах Биомед-2 и Olympus СХ41 и фотографировали с использованием цифровых фотокамер Olympus Е-420 и Canon Powershot А95.
Светомикроскопические исследования были частично проведены на полутонких срезах, полученных с препаратов, подготовленных к электронной микроскопии. Всего светомикроскопическими методами было исследовано 35 инкапсулированных скребней.
Электронно-микроскопические исследования. Для электронной микроскопии скребней отбирали случайным образом и фиксировали в течение 2 сут при 4°С в 2%-ном глутаровом альдегиде на 0.1 М фосфатном буфере. Для лучшей пропитки эпоксидными смолами гельминтов в процессе фиксации разрезали пополам. Постфиксацию проводили в 1%-ном растворе тетраоксида осмия на 0.2 М фосфатном буфере в течение 2 ч при комнатной температуре. Затем образцы обезвоживали в спиртах возрастающей концентрации, в процессе обезвоживания контрастировали в течение ночи в 1%-ном растворе уранилацетата на 70%-ном спирте и заключали в смесь эпона и аралдита.
Полутонкие срезы толщиной 1–2 мкм, полученные на ультрамикротомах LKB IV и PT-PC, монтировали на предметных стеклах, окрашивали метиленовым синим (Morgenstern, 1969) или смесью кристаллического фиолетового и метиленового синего, просматривали в световых микроскопах и фотографировали. Ультратонкие срезы монтировали на медные сеточки (300–1000 меш) без подложки или на бленды с подложкой из пиолоформа и контрастировали цитратом свинца (Reynolds, 1963). Препараты просматривали и фотографировали с помощью электронных микроскопов JEM-7, JEM-1011, JEM-1400PLUS и ZEISS LIBRA-120. Электронно-микроскопически были изучены три инкапсулированных скребня.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Интенсивность инвазии исследованных рыб составила 1–19 скребней. Всего в 12 вскрытых рыбах обнаружили 62 скребня: 57 из них локализовались на брыжейке кишечника, 3 – на селезенке и 2 – на печени (табл. 1). У двух рыб на брыжейке были обнаружены крупные капсулы: в одной было 6 скребней, во второй – 2.
Таблица 1.
Число и локализация обнаруженных (в скобках – исследованных) скребней Corynosoma strumosum из толстощека Миддендорфа Hadropareia middendorffii
| Длина, см, и пол рыбы | Локализация и число (экз.) скребней | |||
|---|---|---|---|---|
| брыжейка кишечника | печень | селезенка | всего | |
| 16.0 ♀ | 1 (1) | – | – | 1 (1) |
| 13.5 ♀ | 1 (1) | – | – | 1 (1) |
| 13.3 ♀ | 1 (1) | – | – | 1 (1) |
| 13.8 ♂ | 1 (1) | – | – | 1 (1) |
| 15.8 ♀ | 2 (2) | – | – | 2 (2) |
| 11.0 ♀ | 8 (6) | – | 3 (1) | 11 (7) |
| 17.0 ♂ | 3 (1) | – | – | 3 (1) |
| 16.2 ♀ | 7 (3) | – | – | 7 (3) |
| 14.2 ♀ | 6 (2) | – | – | 6 (2) |
| 17.0 ♂ | 6 (6) | 1 (1) | – | 7 (7) |
| 18.0 ♂ | 18 (7) | 1 | – | 19 (7) |
| 14.1 ♂ | 3 (2) | – | – | 3 (2) |
| Всего | 57 (33) | 2 (1) | 3 (1) | 62 (35) |
Скребни на брыжейке кишечника. Из 57 скребней, найденных на брыжейке кишечника, исследовали 33. Обычно скребни были заключены в капсулу и имели инвагинированный хоботок, однако в одном случае скребень, также с инвагинированным хоботком, не был инкапсулирован. Капсулы располагались на брыжейке кишечника относительно свободно, связываясь с ней немногочисленными тяжами соединительной ткани.
Толщина капсулы у исследованных скребней варьировала от 31 до 45 мкм (рис. 1а). В ее составе выделялись три слоя: внутренний, средний и наружный. Внутренний слой капсулы толщиной 4–14 мкм на полутонких срезах окрашивался наиболее интенсивно и состоял из дегенерирующих клеток. Средний и наружный слои капсулы окрашивались слабо, но различались особенностями организации составляющих их элементов. Средний слой толщиной 15–18 мкм характеризовался плотно расположенными клетками с небольшими или отсутствующими межклеточными пространствами. Наружный слой толщиной 11–19 мкм отличался рыхлым расположением клеток с более или менее выраженными межклеточными пространствами.
Рис. 1.
Общий вид капсул, окружающих скребня Corynosoma strumosum на брыжейке кишечника (а), печени (б) и селезенке (в) толстощека Миддендорфа Hadropareia middendorffii. ВСК – внутренний слой капсулы, НСК – наружный слой капсулы, ССК – средний слой капсулы, Т – тегумент скребня, стрелками показаны эозинофилы, звездочка – кровеносный сосуд. Масштаб: 20 мкм.
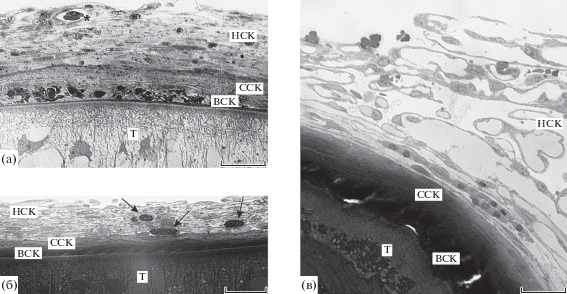
В составе капсулы были обнаружены фибробласты, лейкоциты и эритроциты, более или менее равномерно распределенные по всей ее толще. В наружном слое капсулы наблюдались еще и фиброциты, кровеносные сосуды, а иногда небольшие группы клеток поджелудочной железы и/или пигментных клеток.
Электронно-микроскопически на поверхности скребня был обнаружен слой гликокаликса (рис. 2а) толщиной 0.6–2.4 мкм, образованный плотно расположенными филаментами умеренной электронной плотности, среди которых были рассеяны мелкие плотные гранулы. Узкий внутренний слой гликокаликса прерывистый или с волнистой поверхностью, имеет повышенную электронную плотность (рис. 2а). С гликокаликсом в большинстве случаев контактируют клетки капсулы. В некоторых случаях между гликокаликсом и капсулой наблюдалось более или менее выраженное “пустое” пространство, образовавшееся, вероятно, в результате препарирования.
Рис. 2.
Макрофаги капсулы, окружающей скребня Corynosoma strumosum на брыжейке кишечника толстощека Миддендорфа Hadropareia middendorffii. а – толстый слой гликокаликса на поверхности скребня и деструктурированные клетки внутреннего слоя капсулы; б, в – макрофаги наружного (б) и среднего (в) слоев капсулы. Г – гликокаликс, Т – тегумент скребня, Ф – фагосомы, Я – ядра. Масштаб: 2 мкм.
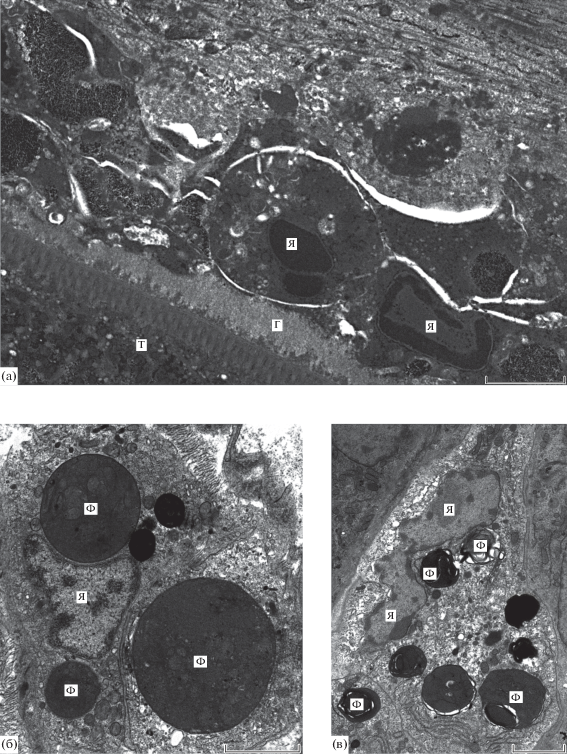
Внутренний слой капсулы образован 1–2 сплошными или прерывистыми рядами дегенерирующих клеток высокой электронной плотности, границы которых определяются не во всех случаях (рис. 2а). Клетки размерами 4.4–5.9 × 2.0–3.7 мкм имеют разнообразную форму с крупными отростками и располагаются довольно свободно, так что между ними видны узкие межклеточные пространства. Их ядра отличаются плотной кариоплазмой, в которой гетерохроматин концентрируется вдоль ядерной оболочки. Цитоплазма электронно-плотная со светлыми везикулярными образованиями, структуру которых, а также состав и строение цитоплазматических органелл определить не удалось. Отростки клеток иногда пронизывали гликокаликс и контактировали с тегументом скребня. Организация хроматина в ядре и наличие крупных отростков свидетельствуют о возможной их принадлежности к лейкоцитам.
Лейкоциты капсулы представлены макрофагами, эозинофилами, нейтрофилами и лимфоцитами. Размеры макрофагов 8.7–12.0 × 6.6–8.4 мкм (рис. 2б, в). Их ядра отличаются разнообразной формой и содержат умеренно-плотную кариоплазму, одно или два ядрышка и немногие скопления гетерохроматина вдоль ядерной оболочки. В цитоплазме выявляются канальцы гранулярной эндоплазматической сети (ГЭС), митохондрии сферической или вытянутой формы, хорошо развитый комплекс Гольджи, мелкие лизосомоподобные гранулы с гомогенным электронно-плотным содержимым и фагосомы, максимальные размеры которых (до 4.8 мкм) могут превышать размеры ядра (рис. 2б). Имеются также многочисленные остаточные тельца и “пустые” вакуоли.
Эозинофилы имеют типичную для этого типа клеток внешность (рис. 3а, б). Их форма неправильно-округлая, с крупными инвагинатами, а также с короткими и широкими цитоплазматическими отростками (размеры 10.0–13.3 × 4.0–9.5 мкм). Ядра смещены к периферии клеток и характеризуются удлиненно-неправильной формой; плотность кариоплазмы умеренная и равна плотности цитоплазмы; крупные скопления гетерохроматина многочисленны и располагаются вдоль ядерной оболочки. Из органоидов имеются комплекс Гольджи, представленный системой цистерн и мелких везикул, короткие канальцы ГЭС и митохондрии. Однако наиболее многочисленны в цитоплазме гранулы, заполненные гомогенным, электронно-плотным содержимым. Они имеют овальную, округлую или миндалевидную формы, а их диаметр колеблется от 0.3 до 1.0 мкм. Это позволяет легко наблюдать их в световой микроскоп на полутонких и парафиновых срезах (рис. 3а).
Рис. 3.
Лейкоциты капсулы, окружающей скребня Corynosoma strumosum на брыжейке кишечника толстощека Миддендорфа Hadropareia middendorffii. а – эозинофилы (стрелки) в наружном и среднем слоях капсулы, б – ультраструктура эозинофила из наружного слоя капсулы, в – ультраструктура нейтрофила из среднего слоя капсулы. Г – гранулы, НСК – наружный слой капсулы, ССК – средний слой капсулы, Т – тегумент скребня, Я – ядра.
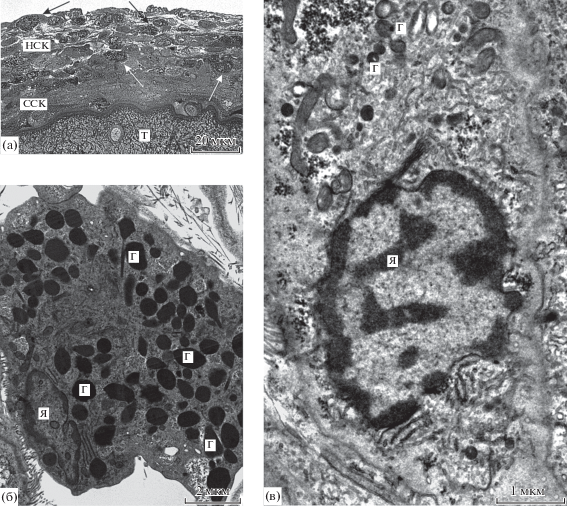
Нейтрофилы характеризуются несколько меньшими размерами (7.2–13.0 × 3.0–5.6 мкм), неправильной формой с немногими отростками и нечетким разделением цитоплазмы на эндоплазму и эктоплазму (рис. 3в). Ядра неправильной формы, часто с неглубокими инвагинатами, эксцентричные или занимают центральное положение и включают в себя ядрышко и крупные скопления хроматина, частично рассеянные в кариоплазме. Цитоплазма содержит многочисленные овальные или удлиненные гранулы размерами 0.3–0.9 × 0.1–0.2 мкм с содержимым, электронно-плотным на периферии гранул и менее плотным в их центральной части, канальцы ГЭС, митохондрии и скопления мелких плотных зерен неясной природы.
Лимфоциты (4.3–7.6 × 1.9–3.7 мкм) отличаются высоким ядерно-плазменным отношением и относительно высокой общей электронной плотностью (рис. 4а). Их ядра с глубокими инвагинатами, часто сегментированные, отличаются обилием гетерохроматина в виде сплошного периферического “пояска” и грубых скоплений, не связанных с ядерной оболочкой. Набор органоидов и включений минимален по разнообразию и количеству и состоит из митохондрий, коротких канальцев ГЭС и мелких вакуолей со светлым содержимым.
Рис. 4.
Клетки капсулы, окружающей скребня Corynosoma strumosum на брыжейке кишечника толстощека Миддендорфа Hadropareia middendorffii. а – лимфоциты в наружном слое капсулы, б – фибробласты в среднем слое капсулы, в – фиброциты в наружном слое капсулы. ВСК – внутренний слой капсулы, Я – ядра. Десмосомы – белые стрелки, коллагеновые волокна – черные стрелки. Масштаб: 2 мкм.
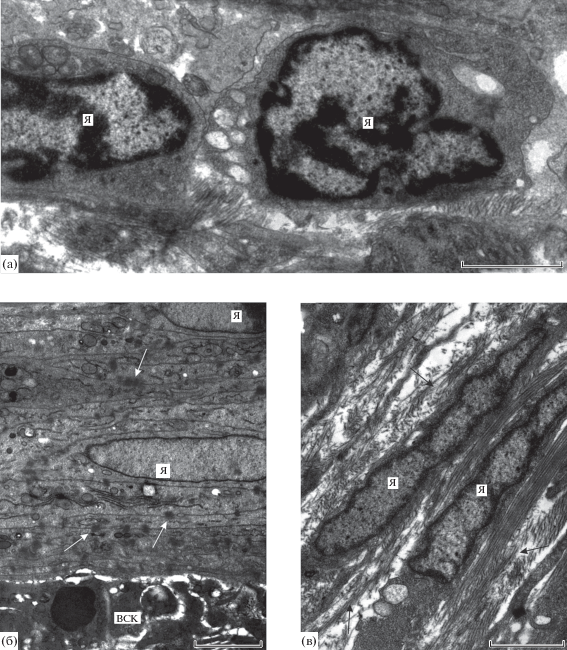
Фибробласты имеют вытянутую форму с длинными отростками, ориентированными параллельно поверхности скребня (рис. 4б, в). В среднем слое капсулы фибробласты и их отростки располагаются вплотную и связаны между собой многочисленными десмосомами (рис. 4б), однако пучки коллагеновых волокон в этом слое немногочисленны. Ядра фибробластов содержат светлую кариоплазму, нечеткое ядрышко и немногие мелкие скопления гетерохроматина, тогда как для цитоплазмы характерны длинные, часто извитые канальцы ГЭС, немногочисленные мелкие митохондрии и редкие зоны Гольджи (рис. 4б). Фиброциты и их отростки располагаются рыхло в наружном слое капсулы, уплощены в еще большей степени, а протяженные пространства между ними включают в себя многочисленные пучки коллагеновых волокон (рис. 4в).
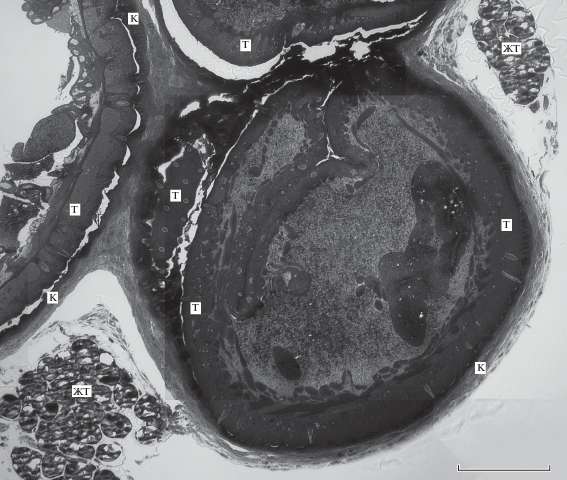
В двух исследованных случаях, как уже отмечалось, капсула содержала более одного скребня. Эта капсула тонкая (ее толщина <40 мкм), представляет собой непрерывное образование и также организована из трех слоев (рис. 5). Однако если наружный слой капсулы “общий” для всех скребней, заключенных в нее, то внутренний и средний слои у каждого паразита собственные, и только в редких случаях наблюдается слияние этих слоев с такими слоями у соседнего скребня.
Рис. 5.
Несколько скребней Corynosoma strumosum в одной общей капсуле на брыжейке кишечника толстощека Миддендорфа Hadropareia middendorffii. ЖT – жировая ткань, К – капсула, T – тегумент скребней. Масштаб: 100 мкм.
Скребни на печени. Из двух найденных на печени скребней светомикроскопически исследован один. Паразит расположен на печени, слегка вдавливаясь в ткань органа. Как и в предыдущих случаях, капсула, окружающая его, имеет трехслойное строение (рис. 1б). Ее толщина варьирует и в некоторых участках достигает 153 мкм. Внутренний слой представлен погибшими клетками и на всем его протяжении имеет примерно одинаковую толщину (12–15 мкм). Толщина среднего слоя также относительно постоянна и составляет 15–19 мкм. Этот слой отличается настолько плотным расположением клеток, что их границы едва заметны. Ядра этих клеток округлые светлые, а цитоплазма более темная и иногда содержит мелкие плотные гранулы. Клеточные элементы наружного слоя капсулы располагаются рыхло, разделены широкими пространствами, размеры которых уменьшаются по направлению к паразиту. Клетки слоя уплощены, имеют длинные и тонкие отростки и по форме напоминают фибробласты. Границы клеток выражены четко, их светлые овальные ядра включают в себя плотное ядрышко. Содержание волокнистых структур (предположительно коллагеновых волокон) между этими клетками незначительное. На границе наружного и среднего слоев иногда наблюдаются небольшие группы (из 4–10 на одном срезе) эритроцитов. В наружном слое кроме фибробластов встречаются гранулоциты и макрофаги. Гранулоциты легко выявляются благодаря обилию в их цитоплазме плотных гранул; размеры этих клеток составляют 7.3–10.5 × 5.7–6.6 мкм. Макрофаги (8.7–11.4 × 6.5–6.6 мкм) характеризуются бобовидным эксцентричным ядром и гранулярной цитоплазмой.
Скребни на селезенке. На селезенке обнаружены три скребня, светомикроскопически исследован один. Капсула подразделяется на три отчетливых слоя: тонкий и плотный внутренний, примерно одинаковой толщины средний и наиболее толстый наружный (рис. 1в). Общая толщина капсулы составляет 25–30 мкм. Ее внутренний слой плотно прилежит к поверхности скребня и представляет собой зону некроза; его структура не определяется. Основу среднего слоя составляют уплощенные, плотно организованные фибробласты. Наружный слой также образован фибробластами, которые, однако, располагаются менее плотно и разделены узкими межклеточными пространствами. Кроме того, в этом слое выявляются лейкоциты, среди которых определяются эозинофилы.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Особенность тегумента исследованных скребней – толстый слой гликокаликса на его поверхности. По своей толщине, а также по характеру образующего его материала этот гликокаликс сходен с гликокаликсом, который покрывает полностью сформированных цистакантов скребней других видов, а также цистицеркоидов цестод (Никишин, 2016, 2018). Именно это сходство не позволяет согласиться с интерпретацией его как стенки цисты (Marchand, Grita-Timoulali, 1992).
Ранее мы обнаруживали такой же мощный слой гликокаликса у коринозом, инвазирующих естественных паратенических хозяев многих видов вне зависимости от того, какой капсулой эти скребни были окружены (Никишин, Скоробрехова, 2007; Skorobrechova, Nikishin, 2011; Скоробрехова, Никишин 2013). В то же время у коринозом из камбаловых рыб гликокаликс был значительно тоньше; при этом скребни в этих рыбах были окружены только лейкоцитарными капсулами (Skorobrechova, Nikishin, 2011; Скоробрехова, Никишин, 2017). Не образовывался вокруг коринозом толстый слой гликокаликса и в неестественных паратенических хозяевах, зараженных экспериментально (Скоробрехова, Никишин, 2012; Skorobrechova et al., 2012). Анализ этих и смежных фактов привел к предположению о существовании как минимум двух стратегий взаимоотношений скребней с паратеническими хозяевами, различающихся рядом морфологических признаков (Никишин, Скоробрехова, 2018). Взаимоотношения коринозом с толстощеком Миддендорфа вписываются в рамки первой стратегии, один из характерных признаков которой – формирование на поверхности скребня толстого слоя гликокаликса. Есть основания предполагать, что столь толстый гликокаликс обеспечивает защиту паразита от клеточной реакции хозяина (Никишин, 2018).
Полученные результаты свидетельствуют, что все исследованные скребни C. strumosum в обычном паратеническом хозяине толстощеке Миддендорфа, инвазированном естественным образом, заключены в капсулы, состоящие из лейкоцитов и элементов фибробластического ряда. Похожие капсулы окружают коринозом в желтоперой камбале Limanda aspera (Pallas, [1814]) и керчаке Стеллера Myoxocephalus stelleri (Pallas, [1814]), а также в восточной бельдюге Zoarces elongatus Kner, 1868 и тихоокеанском белокором палтусе Hippoglossus stenolepis Schmidt, 1904 (Skorobrechova, Nikishin, 2011; Скоробрехова, Никишин, 2013, 2017). Такие капсулы мы назвали лейкоцитарными, поскольку в их составе лейкоциты численно либо преобладают, либо составляют значительную долю всех клеток. В отличие от них капсулы из зубастой Osmerus mordax dentex Steindachner et Kner, 1870 и малоротой Hypomesus olidus (Pallas, [1814]) корюшек и тихоокеанской наваги Eleginus gracilis (Tilesius, 1810) – фибробластические, поскольку состоят исключительно или преимущественно из фибробластов (Skorobrechova, Nikishin, 2011; Скоробрехова, Никишин, 2013). Промежуточные капсулы из пятнистого терпуга образованы преимущественно фибробластами с включением небольшого количества лейкоцитов (Скоробрехова, Никишин, 2013).
Различия в строении капсул, окружающих гельминтов в случаях тканевого паразитизма, могут рассматриваться как выражение степени сбалансированности отношений паразита с хозяином (Пронина, Пронин, 1988). Можно предполагать, что преобладание в составе капсул лейкоцитов свидетельствует об относительно менее сбалансированной паразитарной системе, а преобладание элементов фибробластического ряда – об относительно более сбалансированной (Никишин, Скоробрехова, 2018). Таким образом, наличие вокруг скребня C. strumosum лейкоцитарной капсулы можно рассматривать как свидетельство относительно более конфликтных взаимоотношений между паразитом и хозяином, тогда как фибробластическая капсула, например, в зубастой корюшке может отражать относительно менее конфликтные взаимоотношения. Надо подчеркнуть, что наличие лейкоцитарной капсулы не свидетельствует о нежизнеспособности паразита. Для экспериментальных исследований процесса инкапсуляции коринозом в толстощеке мы использовали паразитов, извлеченных, в том числе, и из толстощеков, зараженных естественным образом, и многие из этих скребней успешно приживались в экспериментальных рыбах.
Особенность всех исследованных капсул – внутренний слой, состоящий из остатков разрушенных клеток, которые, по всей видимости, поглощаются макрофагами среднего слоя капсулы. Другая особенность – определенное различие в составе среднего и наружного слоев капсулы. Основу среднего слоя составляют фибробласты с небольшим количеством коллагеновых волокон между ними, тогда как в наружном слое визуально преобладают лейкоциты и наблюдаются основная масса коллагеновых волокон и фиброциты. Эти результаты позволяют предполагать, что процесс образования капсулы в толстощеке происходит в несколько этапов. На первом этапе сразу после проникновения скребней в полость тела хозяина они окружаются клетками, скорее всего макрофагами и/или лейкоцитами, которые достаточно быстро погибают, а их остатки сохраняются в виде плотного внутреннего слоя капсулы. На втором этапе формирования капсулы в нее мигрируют фибробласты и в относительно меньшей степени лейкоциты. Эти клетки формируют второй слой капсулы, при этом, однако, фибробласты продуцируют небольшое количество коллагеновых волокон. На третьем этапе продолжается миграция в состав капсулы лейкоцитов и фибробластов, трансформируемых в фиброциты, и синтез коллагеновых волокон достигает своего максимума.
Существенных качественных различий в строении капсул, располагающихся на разных органах исследованных рыб, не обнаружено.
ЗАКЛЮЧЕНИЕ
Полученные результаты свидетельствуют, что взаимоотношения скребня C. strumosum с толстощеком Миддендорфа сходны с взаимоотношениями этого паразита с керчаком Стеллера и восточной бельдюгой. Во всех случаях гельминт окружается лейкоцитарной капсулой, состоящей из трех слоев лейкоцитов и фибробластов, а на его поверхности формируется толстый слой гликокаликса. Эти признаки характеризуют первую стратегию взаимоотношений скребней с паратеническими хозяевами. Наличие внутреннего слоя капсулы из разрушенных клеток может рассматриваться как аргумент в пользу участия гликокаликса в защите паразита от клеточной реакции организма хозяина на инвазию на начальном этапе образования капсулы.
Лейкоцитарная капсула в противоположность фибробластической вследствие преобладания в ее составе лейкоцитов может свидетельствовать об относительно меньшей сбалансированности системы скребень–паратенический хозяин. При этом скребень сохраняет свою жизнеспособность и инвазивен для дефинитивного хозяина. Возможно, срок жизни червя в этом случае может быть менее продолжительным, однако исследования в этом направлении не проводили.
Анализ клеточного состава слоев капсулы позволяет предположить трехэтапную схему ее формирования. На первом этапе к паразиту мигрируют макрофаги и лейкоциты, часть которых погибает, на втором в миграцию включаются фибробласты, на третьем синтез коллагеновых волокон фибробластами и фиброцитами достигает своего максимума. Для проверки этого предположения проведено экспериментальное исследование процесса формирования капсулы вокруг коринозом в толстощеке, результаты которого изложены в следующем сообщении.
Исследования проведены в ходе выполнения государственного задания по теме “Таксономическое, морфологическое и экологическое разнообразие гельминтов позвоночных животных Северной Азии” № ААА-А17-117012710031-6.
Список литературы
Никишин В.П. Морфофункциональное разнообразие гликокаликса у ленточных червей // Успехи соврем. биологии. 2016. Т. 136. № 5. С. 506–526.
Никишин В.П. Модификации гликокаликса скребней // Изв. РАН. Сер. биол. 2018. № 1. С. 42–54. https://doi.org/10/7868/S000233291801006X
Никишин В.П., Скоробрехова Е.М. Инкапсуляция скребней Corynosoma sp. в резервуарных хозяевах двух видов // Докл. РАН. 2007. Т. 417. № 4. С. 566–569.
Никишин В.П., Скоробрехова Е.М. Две стратегии взаимоотношений скребней с паратеническими хозяевами // Зоол. журн. 2018. Т. 97. № 9. С. 1100–1109. https://doi.org/10.1134/S0044513418090106
Петроченко В.И. Акантоцефалы домашних и диких животных. Т. 1. М.: Изд-во АН СССР, 1956. 436 с.
Петроченко В.И. Акантоцефалы домашних и диких животных. Т. 2. М.: Изд-во АН СССР, 1958. 458 с.
Пронина С.В., Пронин Н.М. Взаимоотношения в системах гельминты–рыбы (на тканевом, органном и организменном уровнях). М.: Наука, 1988. 176 с.
Скоробрехова Е.М., Никишин В.П. Инкапсуляция скребня Corynosoma strumosum в рыбе Hemichromis bimaculatus: предварительное экспериментальное изучение // Вестн. СВНЦ ДВО РАН. 2012. № 3. С. 52–58.
Скоробрехова Е.М., Никишин В.П. Зависимость строения капсулы, окружающей скребня Corynosoma strumosum от видовой принадлежности естественного паратенического хозяина // Изв. РАН. Сер. биол. 2013. № 6. С. 696–712. https://doi.org/10.7868/S0002332913050160
Скоробрехова Е.М., Никишин В.П. Морфологические особенности скребня Corynosoma strumosum (Polymorphidae) в паратенических хозяевах бельдюге Zoarces elongatus (Kner, 1868) (Zoarcidae) и палтусе Hippoglossus stenolepis (Schmidt, 1904) (Pleuronectidae) // Биология моря. 2017. № 1. С. 39–46.
Черешнев И.А., Волобуев В.В., Хованский И.Е., Шестаков А.В. Прибрежные рыбы северной части Охотского моря. Владивосток: Дальнаука, 2001. 197 с.
Шарпило В.П., Саламатин Р.В. Паратенический паразитизм: становление и развитие концепции. Киев: ЛОГОС, 2005. 240 с.
Шарпило В.П., Сонин М.Д., Лисицына О.И. Паратенический паразитизм: распространение и закономерности проявления // Вестн. зоологии. 1996. № 6. С. 3–10.
Amin O.M., Heckmann R.A., Inchausti V., Vasquez R. Immature Polyacanthorhynchus rhopalorhynchus (Acanthocephala: Polyacanthorhynchidae) in venton, Hoplias malabaricus (Pisces) from Moca Vie River, Bolivia, with notes on its apical organ and histopathology // J. Helmintholog. 1996. V. 63. № 1. P. 115–119.
Amin O.M., Heckmann R.A., Mesa R., Mesa E. Description and host relationships of cystacanths of Polymorphus spindlatus (Acanthocephala: Polymorphidae) from their paratenic fish hosts in Peru // J. Helmintholog. 1995. V. 62. № 2. P. 249–253.
Bogitsh B.J. Histological and histochemical observations on the nature of the cyst of Neoechinorhynchus cylindratus in Lepomis sp. // Proc. Helmintholog. Soc. Washington. 1961. V. 28. № 1. P. 75–81.
Marchand B., Grita-Timoulali Z. Comparative ultrastructural study of the cuticle of larvae and adults of Centrorhynchus milvus Ward, 1956 (Acanthocephala, Centrorhynchidae) // J. Parasitol. 1992. V. 78. № 2. P. 355–359.
Morgenstern E. Vergleichende lichtoptische Untersuchungen im Rahmen elektronenmikroskopischer Arbeiten an ultradünnen Schnitten. II. Färbemethoden // Mikroskopie. 1969. Bd 25. S. 250–260.
Reynolds E.S. The use of lead citrate at high pH as an electronopaque stain in electron microscopy // J. Cell Biol. 1963. V. 17. № 1. P. 208–212.
Skorobrechova E., Nikishin V. Structure of capsule surrounding acanthocephalans Corynosoma strumosum in paratenic hosts of three species // Parasitol. Res. 2011. V. 108. № 2. P. 467–475. https://doi.org/10.1007/s00436-010-2088-3
Skorobrechova E., Nikishin V., Lisitsyna O. Structure of capsule around acanthocephalan Corynosoma strumosum from uncommon paratenic hosts – lizards of two species // Parasitol. Res. 2012. V. 110. № 1. P. 459–467. https://doi.org/10.1007/s00436-011-2512-3
Taraschewski H. Host-parasite interactions in Acanthocephala: a morphological approach // Adv. Parasitol. 2000. V. 46. P. 1–179.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


