Известия РАН. Серия биологическая, 2021, № 2, стр. 168-176
Морфометрическая изменчивость верхних коренных зубов и митохондриальная филогеография сони-полчка Glis glis L. (Gliridae) Восточной Европы и Кавказа
Ю. В. Попова 1, О. О. Григорьева 1, *, Д. М. Кривоногов 3, А. В. Щегольков 2, В. В. Стахеев 3, В. Б. Сычева 1, В. Н. Орлов 1
1 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
2 Национальный исследовательский Нижегородский государственный университет им. Н.И. Лобачевского (Арзамасский филиал)
607220 Арзамас, ул. Карла Маркса, 36, Россия
3 Федеральный исследовательский центр Южный научный центр РАН
344006 Ростов-на-Дону, просп. Чехова, 41, Россия
* E-mail: grig@sevin.ru
Поступила в редакцию 18.03.2019
После доработки 25.07.2019
Принята к публикации 25.07.2019
Аннотация
С использованием одного из методов геометрической морфометрии впервые показаны достоверные различия формы верхних коренных зубов полчка Glis glis L. Восточной Европы и Кавказа. Показано сходство этих длительно изолированных популяций по митохондриальному гену цитохрома b (cytb). Предположено, что более быстрые темпы изменений морфологических структур по сравнению со случайными заменами в последовательностях гена cytb можно объяснять экологическими особенностями вида.
Современный ареал полчка охватывает Западную Европу и небольшие участки сохранившихся широколиственных лесов Восточной Европы (на востоке до Волги) (Россолимо и др., 2001) и отделен от ареала полчка в лесном поясе Большого Кавказа широкой зоной степей. Балканский участок ареала полчка соединялся в голоцене с кавказским узкой полосой вдоль южного берега Черного моря, а современный разрыв ареала вызван антропогенным сведением широколиственных лесов (Helvaci et al., 2012).
Популяции полчка характеризуются настолько низкой изменчивостью митохондриального гена cytb, что географически удаленные популяции Западной Европы, Поволжья (Жигули) и Восточной Турции имеют только один гаплотип Hap02 (Hürner et al., 2010). Поэтому можно предположить. что ареал полчка сформировался относительно недавно, в последние 10 тыс. лет голоцена, и замены пар нуклеотидов гена cytb не успели накопиться.
Оказалось, что такому предположению противоречат обнаруженные диагностические различия форм коренных зубов полчков Южных Балкан и Восточной Турции. Зона вторичного контакта этих морфологических форм восточнее прол. Босфор указывает на существование кавказского плейстоценового рефугиума полчка в последнее ледниковье (Helvaci et al., 2012). Очевидно, некоторые морфологические структуры у этого вида изменяются быстрее, чем накапливаются случайные замены нуклеотидов гена cytb.
В таком случае можно ожидать и морфологических различий между географически изолированными полчками Кавказа и Восточной Европы. Но каких-либо различий полчков Восточной Европы и Кавказа до сих пор не было известно. С.И. Огнев отмечал удивительное сходство размеров и окраски географически далеких полчков Русской равнины и некоторых регионов Кавказа, в частности “западной и центральной части Северного Кавказа, а также Южной Осетии”, которых относил к номинативному подвиду Словении (Огнев, 1947).
Цель работы – реконструкция сложной истории формирования современных популяций полчка на основе результатов сопоставления морфометрических особенностей коренных зубов и последовательностей митохондриального гена cytb полчков Восточной Европы и Кавказа.
МАТЕРИАЛЫ И МЕТОДЫ
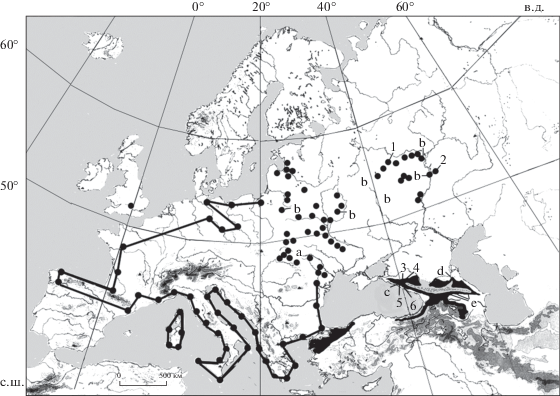
Были исследованы коренные зубы 92 экземпляров полчка из коллекции Зоологического музея МГУ пяти выборок: 1) Карпаты (Закарпатская и Черновицкая области Украины) n = 20 (9 самцов и 11 самок); 2) Восточно-Европейская равнина (Киевская обл. Украины, Беловежская Пуща Белоруссии, Брянская, Московская, Тамбовская и Самарская области, Республика Татарстан, n = 13 (7 самцов и 6 самок); 3) Западный Кавказ, Краснодарский край, Кавказский государственный природный биосферный заповедник, n = 19 (11 самцов и 8 самок); 4) Восточный Кавказ, Дагестан, Хасавюртовский р-н, n = 20 (9 самцов и 11 самок); 5) Закавказье, Кубинский и Закатальский районы Азербайджана, Южная Осетия, n = 20 (12 самцов и 8 самок) (табл. 1, рис. 1).
Таблица 1.
Характеристика оригинального материала и нуклеотидных последовательностей гена cytb полчка Glis glis и использованных для сравнения данных из GenBank
| Географический локалитет (номер на рис. 1) |
Гаплотип | Код образца |
№ в GenBank | Замены | |
|---|---|---|---|---|---|
| 390 | 504 | ||||
| Оригинальные образцы | |||||
| Нижегородская обл., Старая Пустынь (55°39.504′ с.ш., 43°36.366′ в.д.) (1) | HapA HapA HapA HapA HapA |
GG A8
GG A9 GG A10 GG A11 GG A12 |
MK335777 MK335777 MK335777 MK335777 MK335777 |
C C C C C |
T T T T T |
| Краснодарский край, Адыгея, Даховская (44°10.58′ с.ш., 40° 08.48′ в.д.) (3) | HapC | GG19 | KF699242 | T | C |
| Hap02 | GG20 | KF699243 | T | C | |
| Hap02 | GG21 | KF699243 | T | C | |
| Карачаево-Черкессия, Новая Теберда (43°42.567′ с.ш., 41°54.209′ в.д.) (4) | Hap02 | GG51 | KF699243 | T | C |
| Краснодарский край, Шаумян (44°17.773′ с.ш., 39°18.636′ в.д.) (5) | Hap02 | GG53 | KF699243 | T | C |
| Краснодарский край, Б. Псеушхо (44°04.968′ с.ш., 39°19.711′ в.д.) (6) | Hap02 Hap02 |
GG55, GG56 |
KF699243 KF699243 |
T T |
C C |
| Образцы из GenBank | |||||
| Самарская обл., Жигули (Hürner et al., 2010) (2) | Hap02 | GgR | Нет образцов | T | C |
| Польша (Moska, 2016) | Hap02 | GG1 | KM061382 | T | C |
| Польша (Moska, 2016) | GG2 | GG2 | KM061383 | T | C |
| Англия (Hürner et al., 2010) | Hap16 | GgT | FM160665 | T | C |
| Франция (Hürner et al., 2010) | Hap04 | GgF | FM160654 | T | C |
| Испания, Турция (Hürner et al., 2010) | Hap02 | EBD | FM160652 | T | C |
| Испания (Hürner et al., 2010) | Hap03 | GgE | FM160653 | T | C |
| Италия, Сицилия (Hürner et al., 2010) | Hap13 | GgI | FM160661 | С | C |
| Италия, Сицилия (Hürner et al., 2010) |
Hap14 | GgI | FM160662 | С | C |
| Иран (Naderi et al., 2010) | HapPel1 | Pel1 | KF931110 | T | C |
| Иран (Naderi et al., 2010) | HapNour1 | Nour1 | KF931111 | T | C |
| Иран (Naderi et al., 2010) | HapNour2 | Nour2 | KF931112 | T | C |
Рис. 1.
Границы ареала полчка в Западной Европе (Storch, 1978), распространение в Восточной Европе во второй половине ХХ в. (Лихачев, 1976), на Кавказе (Шидловский, 1976) и в Малой Азии (Helvaci et al., 2012). Буквами показаны места происхождения выборок коллекционных экземпляров: а – Карпаты, b – Восточно-Европейская равнина, c – Западный Кавказ, d – Восточный Кавказ, e – Закавказье; 1–6 – места происхождения молекулярных образцов из Поволжья и Западного Кавказа (табл. 1).
Учитывалась степень стертости зубов и принимались во внимание данные о времени (месяце) отлова. Для анализа были выбраны черепа приблизительно одновозрастных животных первого года жизни, добытых в июле–августе, с точечными обнажениями дентина на вершинах гребней моляров. Приблизительно равное соотношение самцов и самок в каждой выборке нивелировало возможный половой диморфизм.
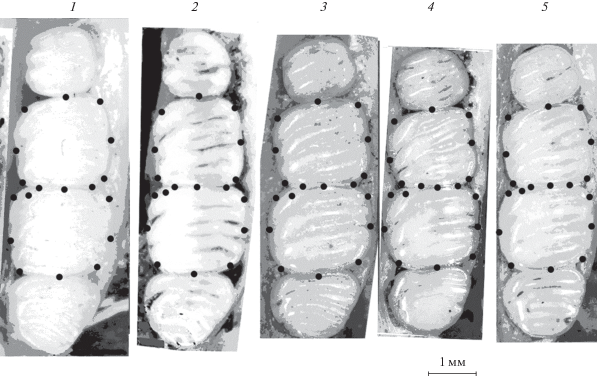
В качестве переменных использовали линейные промеры длины (L) и ширины (Br) снашивающихся поверхностей М1 и М2 и индекс LМ1/LМ2, а также центроидный размер (CS). Промеры длины и ширины коронок зубов взяты под микроскопом Keyence VHX-1000 на верхних молярах левого ряда с вентральной стороны черепа, как это принято в палеонтологических работах по соням (Daams, 1981). Череп располагали под окуляром микроскопа так, чтобы поверхность зубов была параллельна фокальной плоскости окуляра микроскопа. С помощью экранного дигитайзера TPSDig размещали 18 меток (Landmarks) на окружностях снашивающихся поверхностей М1 и М2 (рис. 2). Линейные дистанции между метками определяли в программе VHX-1000 Software с точностью до 1 мк. Для уменьшения ошибки расстановки меток на объектах процедуру описания формы проводили 2 раза с перерывом между повторами и использовали среднее значение двух повторов.
Выравнивание объектов относительно усредненной (консенсусной) конфигурации выполняли прокрустовым анализом General Procrustes Analysis (GPA). В результате для каждого объекта (черепа) были получены стандартизованные размеры (CS), которые представляют собой дистанции (D2) между каждой меткой объекта и меткой усредненной конфигурации, являющейся средним значением выборки (Rohlf, Slice, 1990; Павлинов, Микешина, 2002; Klingenberg, 2011), которое рассчитывали стандартными методами с использованием программы MorphoJ (Klingenberg, 2011).
Рис. 2.
Верхние коренные зубы полчков. 1 – Карпаты, Украина (S-67625); 2 – Беловежская Пуща, Белоруссия (S‑25778); 3 – Кавказский гос. природный биосферный заповедник, Западный Кавказ (S-93570); 4 – Бассейн Терека, Дагестан, Восточный Кавказ (S-25757); 5 – Закавказье (S-82787). Точками обозначены метки (Landmarks).
В связи с тем что музейные выборки могли быть неоднородны по составу, так как содержали черепа животных, отловленных в разные годы и в разных локалитетах, мы протестировали каждую выборку на соответствие модели нормального распределения методом Шапиро–Уилка (W). Тест Шапиро–Уилка выявил для всех пяти выборок нормальное распределение по длине и ширине М1 и М2 (W = 0.628–0.987, p < 0.05) и CS (W = = 0.590–0.968, p < 0.05).
Для анализа мтДНК использовали луковицы волос и кусочки уха 12 полчков из 9 географических локалитетов. Для сравнения были взяты также 8 последовательностей гена cytb этого вида из GenBank (табл. 1, рис. 1). Тотальную ДНК выделяли по стандартной методике путем лизиса ткани печени протеиназой К в присутствии додецилсульфата натрия (SDS) с последующей депротеинизацией смесью фенол-хлороформа и осаждением ДНК. Для амплификации были использованы универсальные праймеры cytb H15915 (5'-AACTGCAGTCATCTCCGGTTTACAAGAC-3'), L14724 (5'-CGAAGCTTGATATGAAAAACCATCGTTG-3') (Kocher et al., 1989) и специфичные для полчка FGLIS1 (5'-CAGCTTGATGAAACTTTGG-3'), RGLIS1 (5'-CCAATTCATGTGAGGGTG-3') (Hürner et al., 2010). Апмплификация проводилась на оборудовании “Терцик” (ДНК-Технология, Россия) с испольованием следующего протокола: начальная денатурация 3 мин при 94°C, следующие 35 циклов – 30 с при 94°C, 30 с при 50°C, 60 с при 72°C, в завершение – финальная элонгация 5 мин при 72°C. Длина исследованных последовательностей гена cytb составила 691 пар нуклеотидов (п.н.). Полученные последовательности были депонированы в GenBank, а также сравнивались с образцами из GenBank.
Филогенетический анализ основывался на методе максимального сходства (ML) при использовании трехпараметрической модели Тамуры (T3P) и 1000 бутстрэп-выборок. Для обработки данных использовали программы MEGA, PHYML, JMODELTEST (выбрана модель HKY+I, p-inv = = 0.512), FIGTREE. Медианная сеть гаплотипов гена цитохрома b была построена с использованием программного обеспечения POPART v. 1.7. Вычисление p-дистанций проводили с помощью программного обеспечения MEGA на основании метода Distance Estimation (при числе бутстрэп-реплик 1000). В качестве внешней группы на филогенетическом дереве была использована последовательность гена cytb Mus musculus (LC325154). Нумерацию нуклеотидов проводили относительно полной длины гена.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Полчки Восточно-Европейской равнины и Карпат сходны с полчками Западного Кавказа и характеризуются более крупными коренными зубами (по длине и ширине снашивающей коронки) в отличие от полчков Восточного Кавказа и Закавказья (табл. 2, рис. 3). Полчки Западного Кавказа достоверно отличаются от полчков Восточной Европы только по длине коронки М1, а от полчков Восточного Кавказа – по всем 6 промерам коренных и по 4 промерам из 6 от полчков Закавказья. Полчки Восточного Кавказа и Закавказья отличаются только по одному промеру (табл. 3).
Таблица 2.
Промеры (мм) и индексы коронок М1 и М2 выборок полчка
| Промеры, ндексы |
Карпаты | Восточно-Европейская равнина |
Западный Кавказ |
Восточный Кавказ |
Закавказье | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| N | M ± m | N | M ± m | N | M ± m (lim) | N | M ± m (lim) | n | M ± m (lim) | |
| LМ1 | 20 | 1.92 ± 0.02 | 13 | 1.88 ± 0.03 | 19 | 1.78 ± 0.04 | 20 | 1.60 ± 0.01 | 20 | 1.63 ± 0.02 |
| BrМ1 | 20 | 1.92 ± 0.02 | 13 | 1.87 ± 0.04 | 19 | 1.95 ± 0.05 | 20 | 1.77 ± 0.01 | 20 | 1.84 ± 0.02 |
| LМ2 | 20 | 1.92 ± 0.02 | 13 | 1.91 ± 0.04 | 19 | 1.86 ± 0.05 | 20 | 1.66 ± 0.01 | 20 | 1.71 ± 0.02 |
| BrМ2 | 20 | 2.11 ± 0.03 | 13 | 2.06 ± 0.04 | 19 | 2.10 ± 0.06 | 20 | 1.93 ± 0.02 | 20 | 2.01 ± 0.03 |
| LМ1/LМ2 | 20 | 1.00 ± 0.01 | 13 | 0.99 ± 0.01 | 19 | 0.96 ± 0.01 | 20 | 0.96 ± 0.01 | 20 | 0.95 ± 0.01 |
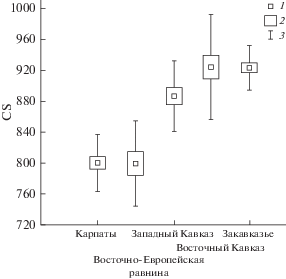
| CS | 20 | 800 ± 8 | 13 | 799 ± 15 | 19 | 886 ± 10 | 20 | 924 ± 15 | 20 | 924 ± 6 |
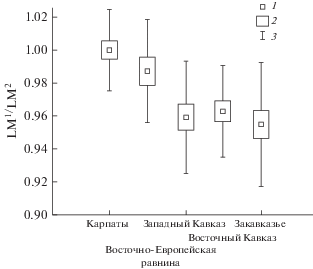
Рис. 3.
Различия выборок полчка по длине М1. Диаграммы сравнения средних (mean) значений и диапазоны SE и SD. 1 – Mean, 2 – Mean ± SE, 3 – Mean ± SD; для рис. 3–5.

Таблица 3.
Достоверность различий (t) абсолютных значений и индексов коронок М1 и М2 сравниваемых выборок полчка
| Промеры, индексы |
Карпаты и Восточно- Европейская равнина–Западный Кавказ |
Западный Кавказ– Восточный Кавказ |
Западный Кавказ–Закавказье | Восточный Кавказ–Закавказье |
|---|---|---|---|---|
| LМ1 | 2.88218* | 3.96675* | 2.75846* | –1.02287 |
| BrМ1 | –0.97544 | 3.39199* | 1.86531 | –1.84898 |
| LМ2 | 0.97909 | 3.82647* | 2.60779* | –1.53433 |
| BrМ2 | –0.09371 | 3.01068* | 1.43060 | –2.06071* |
| SМ1 | 0.67997 | 3.68997* | 2.33588* | –1.48756 |
| SМ2 | 0.23376 | 3.43329* | 2.08709* | –1.81736 |
| LМ1/LМ2 | 4.70320* | –0.32564 | 0.38031 | 0.71007 |
| SМ1/SМ2 | 1.18075 | 0.55730 | 1.05372 | 0.69064 |
| СS | –6.64236* | –2.02948* | –3.08937* | 0.19241 |
По форме снашивающейся поверхности верхних коренных зубов исследованные выборки достаточно хорошо распределяются на две группы: полчков Восточной Европы (включая Карпаты) и Кавказа. Для полчков Восточной Европы и Карпат характерна равная длина коронок М1 и М2, но М2 шире М1. В выборках Кавказа коронка М2 не только шире, но и длиннее М1 (табл. 2). Это различие заметно по соотношению длин коронок М1 и М2 (LМ1/LМ2) в выборках Кавказа и Восточной Европы (табл. 2, рис. 4).
Отмеченные различия формы снашивающейся поверхности коронок коренных зубов у полчков Восточной Европы и Кавказа отражает показатель СS. По этому показателю выборки с Восточно-Европейской равнины и Карпат достоверно отличаются от трех выборок Кавказа (табл. 1, рис. 5). Очевидно, более крупные размеры коронок полчков Западного Кавказа не влияют на характеристики формы снашивающихся коронок. Несовпадение линейных размеров коренных зубов и CS, скорее всего, связано с особенностями последней переменной, которая представляет собой размер объекта в целом, а не отдельные линейные показатели, и поэтому характеризует форму объекта (Павлинов, Микешина, 2002). CS коррелирует с линейными размерами объекта только при больших различиях последних. Эти вопросы обсуждались ранее (Zelditch et al., 2004).
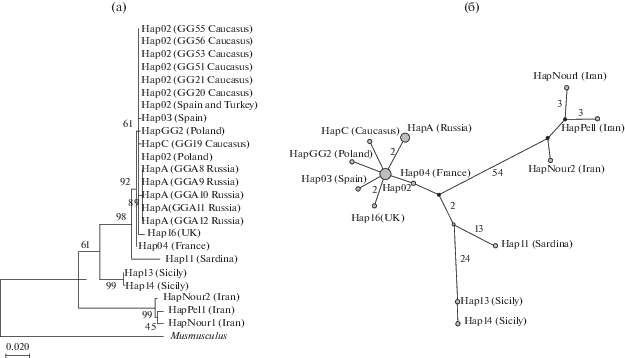
Филогеографические данные показали, что полчки Кавказа и Восточной Европы не имеют значительных отличий в гене cytb и кластеризуются в ранее обозначенной европейской кладе вместе с полчками из Германии, Франции, Бельгии, Испании, Италии, Швейцарии, Польши, Турции (Hürner et al., 2010; Moska et al., 2016). Стоит обратить внимание на то, что данная филогруппа достаточно гомогенна (внутригрупповые p-дистанции 0.23 ± 0.08%) по сравнению, например, с группой подвидового c ранга из Южной Италии (2.40 ± 0.8%) (Hürner et al., 2010).
Различия сонь Восточной Европы и Кавказа оказались незначительными (p-dist = 0.3 ± 0.2%); полчки Кавказа характеризуются преимущественно распространенным европейским гаплотипом Hap02. Однако мы обнаружили две фиксированные синонимичные замены, отличающие сонь Нижегородской обл. (в том числе и от полчков Самарского региона, Жигули) в позициях 390 (замена C/T) и 504 (T/C). Данные замены не отмечены у других представителей вида (табл. 1, рис. 6).
Рис. 6.
а – ML-филогенетическое древо полчка Glis glis (691 п.н.). Поддержки ветвей указаны в углах деревьев (1000 реплик для каждого анализа, показаны значения ≥20). б – Медианная сеть митохондриальных гаплотипов исследованных образцов (N = 24). Размеры кругов пропорциональны числу гаплотипов, цифрами указано число замен между гаплотипами (если оно ≥2).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные нами данные указывают на достоверные различия форм снашивающихся поверхностей коренных зубов (М1 и М2) полчков Восточной Европы и всех трех исследованных выборок Кавказа. При этом полчки Западного Кавказа, близкие по размерам коренных зубов к полчкам Восточной Европы, по форме коренных зубов сходны с более мелкими полчками Восточного Кавказа и Закавказья.
Морфологические различия полчков Восточной Европы и Кавказа могли быть следствием их длительной изоляции и существования на Кавказе плейстоценового рефугиума. Современное распространение полчка на Русской равнине дает слабое представление о его возможном историческом ареале в голоцене из-за почти полного уничтожения на Русской равнине первичных липово-дубовых лесов. Судя по восстановленному ареалу таких лесов на Русской равнине (Национальный …, 2011), южный край ареала полчка мог проходить южнее верховий Оки, далее в верховьях Дона (по 53° с.ш.), а восточнее охватывал бассейны Цны, Мокши и Суры (на юг до 50° с.ш.). Следовательно, в голоцене широкая зона степей отделяла ареал полчка на Русской равнине от лесного пояса Кавказа. Встречающиеся иногда в литературе упоминания о том, что в теплые периоды голоцена широколиственные леса доходили до Черного моря, относятся к западному побережью, устьям Дуная и Южного Буга (Кожаринов, 2006).
Степная фауна мелких млекопитающих была характерна для юга Русской равнины (50–52° с.ш.) и в предыдущее теплое Микулинское межледниковье (Riss–Wurm, Eems, 70–100 тыс. л. н.) (Маркова, 1985). Поэтому с уверенностью можно утверждать, что между полчками Русской равнины и Кавказа не могло быть контактов как в голоцене, так и в последнем теплом периоде плейстоцена. В то же время возникновение рефугиума полчка на Кавказе в последнее ледниковье могло быть следствием расселения полчка с Балкан по южному берегу Черного моря в последний теплый период плейстоцена (микулинский).
О длительной изоляции лесных экосистем Восточной Европы и Кавказа свидетельствуют значительные генетические различия многих лесных видов, в том числе лесной сони Dryomys nitedula Pall. Средняя продолжительность диверсификации географически изолированных популяций лесной сони Восточной Европы и Западного Кавказа была определена равной 7.7 ± 3.9 млн лет, т.е. как минимум с плиоцена (Григорьева и др., 2014).
Среди европейских млекопитающих полчок отличается крайне низкой генетической изменчивостью. Большинство популяций имеют только один, редко два гаплотипа гена cytb, в то время как у других европейских видов число гаплотипов этого гена в одной популяции может достигать многих десятков. В Западной Европе в популяциях полчка широко распространен гаплотип Hap02, в отдельных популяциях встречаются или фиксированы еще 6 гаплотипов, отличающихся 1–3 заменами. Следовательно, гаплотип HapA из Нижегородского региона – седьмой в “европейской группе гаплотипов”. Кроме того, на юге Италии и Балканах известно еще 9 гаплотипов, отличающихся 8, 17 и бóльшим числом перестроек (Hürner et al., 2010). Часть из них показана на филогенетическом дереве (рис. 6). Вероятность возникновения нового гаплотипа нижегородской популяции в голоцене (последние 10 тыс. лет) мала, судя по темпам накопления замен в последовательностях митохондриальных генов у видов семейства сонь Gliridae (Nunome et al., 2007) и крайне низкой генетической изменчивости полчка. Вероятнее всего на Русской равнине могли расселяться разные популяции полчков из Центральной Европы. Нельзя исключить и существование в Поволжье плейстоценового рефугиума полчка, поскольку известно расселение на Русской равнине в послеледниковье дуба и липы не только из Центральной Европы, но и из Поволжья (Кожаринов, 2006).
Низкую генетическую изменчивость популяций полчка можно объяснить его экологическими особенностями. Среди европейских лесных видов полчок оказывается единственным обитателем сомкнутых крон I и II ярусов широколиственных деревьев. Полчок редко спускается на землю, и его слабые возможности преодоления просек и дорог, нескольких десятков метров открытого пространства или разреженных (парковых) лесов отмечали многие авторы (Bieber, 1995; Negro et al., 2011; Worschech, 2012). Большие лесные массивы с сомкнутой кроной характерны для тропических лесов, а даже в первичных неморальных лесах представлены отдельными островными участками, соответственно, изолированы и небольшие популяции полчка. В малых популяциях повышается вероятность фиксации или утраты аллелей как следствие генетического дрейфа.
Напротив, эволюционные изменения морфологических структур могут даже ускоряться в малых изолированных популяциях. Непрерывное распределение любого морфологического количественного признака, приближается к колоколообразному, или нормальному, и, вероятнее всего, определяется некоторым числом генов (полигенно). В ограниченное число основателей малой популяции могут попасть крайние варианты распределения признака в исходной большой популяции, что ускорит эволюционные изменения среднего значения признака. При этом наследуемость признака в узком смысле, или реализованная наследуемость (realized heritability), должна отличаться от нуля (Hedrick, 2011). Судя по достоверным различиям структуры коренных зубов между полчками Балкан и Восточной Турции (Helvaci et al., 2012), а также Восточной Европы и Кавказа (наши данные), темпы изменений морфологических структур в популяциях полчка были выше по сравнению со случайными заменами в последовательностях гена cytb.
Список литературы
Григорьева О.О., Балакирев А.Е., Сычева В.Б., Стахеев В.В., Кривоногов Д.М., Андрейчев А.В., Опарин М.Л., Орлов В.Н. Митохондриальная филогеография и таксономия лесной сони Dryomys nitedula (Pallas, 1778) (Gliridae, Rodentia) Западного Кавказа с описанием нового подвида D. п. heptneri subsp. nov. // Охрана биоты в государственном природном заповеднике “Утриш”. Науч. тр. Майкоп: Полиграф-ЮГ, 2014. Т. 3. С. 332–344.
Лихачев Г.Н. Распространение сонь в Европейской части СССР // Фауна и экология грызунов. 1972. Вып. 11. С. 71–114.
Кожаринов А.В. Динамика неморальных широколиственных лесов Восточной Европы в позднеледниковье–голоцене // Чтения памяти академика В.Н. Сукачева. XXI. Закономерности вековой динамики биогеоценозов. М.: КМК, 2006. С. 66–125.
Маркова А.К. Микротериофауна микулинского межледниковья (по материалам Русской равнины) // Докл. АН СССР. 1985. Т. 284. № 3. С. 718–721.
Национальный атлас почв Российской Федерации / Глав. ред. Шоба С.А. М.: Астрель, 2011. 632 с.
Огнев С.И. Звери СССР и прилежащих стран. Т. 5. М.; Л.: Изд-во АН СССР, 1947. 809 с.
Павлинов И.Я., Микешина Н.Г. Принципы и методы геометрической морфометрии // Журн. общ. биологии. 2002. Т. 63. № 6. С. 473–493.
Россолимо О.Л., Потапова Е.Г., Павлинов И.Я., Крускоп С.В., Волчиц О.В. Сони (Myoxidae) мировой фауны. М.: МГУ, 2001. 229 с.
Шидловский М.В. Определитель грызунов Закавказья. Тбилиси: Мецниереба, 1976. 255 с.
Bieber C. Dispersal behaviour of the edible dormouse (Myoxus glis L.) in a fragmented landscape in central Germany // Hystrix. 1995. V. 6 (n. s.). P. 257–263.
Daams R. The dental pattern of the dormice Dryomys, Myomimus, Microdyromys and Peridyromys // Utrecht Micropaleontol. Bull. Special publ. 3. Hoogeveen: Loonzetterij Abé, 1981. 115 p.
Hedrick P.W. Genetics of populations. Boston: Jones and Bartlett Publ., 2011. 675 p.
Helvaci Z., Renaud S., Ledevin R. Adriaens D., Michaux J., Çolak R., Kankliç T., Kandemir I., Yiğit N., Çolak E. Morphometric and genetic structure of the edible dormouse (Glis glis): a consequence of forest fragmentation in Turkey // Biol. J. Linn. Soc. 2012. V. 107. Iss. 3. P. 611–623.
Hürner H., Krystufek B., Sarà M., Ribas A., Ruch T., Sommer R., Ivashkina V., Michaux J.R. Mitochondrial Phylogeography of the Edible Dormouse (Glis glis) in the Western Palearctic Region // J. Mamm. 2010. V. 91. № 1. P. 233–242.
Klingenberg C.P. MorphoJ: an integrated software package for geometric morphometrics // Mol. Ecol. Res. 2011. V. 11. P. 353–357.
Kocher T.O., Thomas W.K., Meyer A. Dynamics of mitochondrial DNA evolution in animals: Amplification and sequencing with conserved primers // Proc. Natl Acad. Sci. USA. 1989. V. 86. № 1.
Moska M., Jakubiec J., Wierzbicki H., Strzała T., Kozyra K. Low genetic variability of the edible dormouse (Glis glis) in Stolowe Mountains National Park (Poland) – preliminary results // Mamm. Res. 2016. V. 61. № 4. P. 409–415.
Naderi G., Kaboli M., Koren T., Karami M., Zupan S., Rezaei H.R., Krystufek B. Mitochondrial evidence uncovers a refugium for the fat dormouse (Glis glis Linnaeus, 1766) in Hyrcanian forests of northern Iran // Mamm. Biol. 2014. V. 79. № 3. P. 202–207.
Negro M., Novara C., Bertolino S., Rolando A. Ski-pistes are ecological barriers to Glis glis and other forest small mammals // 8th Inter. Dormouse Conf. Abstract Book. Görlitz: DFG, 2011. P. 3–5.
Nunome M., Yasuda S.P., Sato J.J., Vogel P., Suzuki H. Phylogenetic relationships and divergence times among dormice (Rodentia, Gliridae) based on three nuclear genes // Zool. Scripta. 2007. V. 36. P. 537–546.
Rohlf F.G., Slice D.E. Extension of the Procrustes method for the optimal superimposition of landmarks // System. Zool. 1990. V. 39. P. 40–59.
Storch G. Familie Gliridae Thomas, 1897 // Handbuch der Saugetiere Europas. Bd I. Rodentia I (Sciuridae, Castoridae, Gliridae, Muridae) / Eds Niethammer J., Krapp F. Wiesbaden: Akad. Verl., 1978. S. 201–280.
Worschech K. Dispersal movements of edible dormice Glis glis between small woods in a fragmented landscape in Thuringia (Germany) // Peckiana. 2012. V. 8. P. 173–179.
Zelditch M.L., Swiderski D.L., Sheets H.D., Fink W.L. Geometric morphometrics for Biologists: A Primer. USA: Elsevier Acad. Press, 2004. 437 p.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая