Известия РАН. Серия биологическая, 2021, № 2, стр. 126-136
Экспрессия генов ингибиторов протеиназ в растениях томатов при инвазии галловой нематодой Meloidogyne incognita и модуляция их активности салициловой и жасмоновой кислотами
С. В. Зиновьева 1, *, Ж. В. Удалова 1, В. В. Займль-Бухингер 2, 3, Ф. К. Хасанов 1
1 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
2 Институт биологии Карельского научного центра РАН
185910 Петрозаводск, Пушкинская ул., 11, Россия
3 Freie Universität Berlin, Institut für Biologie/ Pflanzenphysiologie
14195 Berlin, Königin-Luise-Str. 12-16, Deutschland
* E-mail: zinovievas@mail.ru
Поступила в редакцию 26.12.2019
После доработки 25.02.2020
Принята к публикации 28.02.2020
Аннотация
Проведено исследование экспрессии генов ингибиторов сериновых (ISP) и цистеиновых протеиназ (ICP) в корнях устойчивых и восприимчивых к галловой нематоде Meloidogyne incognita растений томатов при заражении и действии сигнальных молекул – салициловой (СК) и жасмоновой (ЖК) кислот. Показано, что при заражении для устойчивых растений характерно усиленное накопление транскриптов генов ингибиторов цистеиновых и сериновых протеиназ на этапах проникновения и развития в корнях, тогда как у восприимчивых растений уровень транскрипции не меняется. Установлено значительное снижение нематодной инвазии в восприимчивых растениях при обработке СК или ЖК по сравнению с растениями без обработки, что позволяет определить роль исследованных ингибиторов протеиназ (ИП) в устойчивости, индуцированной сигнальными молекулами. Выявлено, что увеличение экспрессии генов ИП сопровождается ингибированием репродуктивного потенциала самок M. incognita, их размеров, а также снижением зараженности растений.
Галловые нематоды рода Meloidogyne (Göeldi, 1892) относятся к числу наиболее опасных, высокоадаптированных, облигатных паразитов корневой системы, которые поражают практически все виды высших растений (Moens et al., 2009). Их действие на растения складывается из механического повреждения, химического воздействия и использования клеточного содержимого в качестве пищевых ресурсов. В процессе эволюции галловые нематоды выработали узкоспециализированный и уникальный способ существования в корнях растений-хозяев. Личинки внедряются в корни, мигрируют к проводящей системе и индуцируют образование специализированных областей питания, так называемых гигантских клеток. Гигантская клетка обеспечивает личинок питанием, необходимым для завершения жизненного цикла. Эти нематоды индуцируют образование галлов на корнях растений, влияют на рост и физиологические параметры хозяина, что приводит к снижению продуктивности растений. Как и все паразитические нематоды, галловые нематоды обладают специальным стилетом (копьем), который позволяет проникать в растение и питаться. Основные факторы воздействия галловых нематод, изменяющих клеточную структуру и функции хозяина, – секреторные выделения пищеводных желез, поверхности кутикулы и амфид, среди которых присутствуют белки и другие биологически активные молекулы (эффекторы). Механическое действие стилета обеспечивает точное и локализованное попадание эффекторов пищеводных желез в клетки растений-хозяев. Исследования функциональной роли эффекторов нематод подтвердили их значение во множестве процессов, происходящих в растении при инвазии нематодами: миграции по тканям растений, создании и поддержании питающих структур, а также в защитном ответе, о чем сообщается в ряде работ (Gheysen, Mitchum, 2011, 2019; Haegeman et al., 2012; Rosso et al., 2012; Mitchum et al., 2013).
Значительную часть эффекторов составляют протеазы (протеиназы) – протеолитические ферменты, расщепляющие внутренние пептидные связи белков и пептидов. Ферментативный гидролиз белков и пептидов (протеолиз) как особая форма биологического контроля относится к числу наиболее важных процессов в жизнедеятельности организмов .
Наиболее распространенный и экономически значимый вид среди галловых нематод – Meloidogyne incognita (Kofoid, White, 1919) Chitwood, 1949, – модельный вид для изучения биологии и взаимоотношений с растениями и процессов коадаптации в системе растения–нематоды. Однако, несмотря на огромные успехи, достигнутые за последние 10–15 лет, в связи с развитием уникальных методов исследований, включающих в себя методы конструкции биологически активных рекомбинантных молекул ДНК, биоинформатики, геномики и т.д., взаимоотношения этих организмов с растениями все еще остаются в большой степени “терра инкогнита”. Значительным достижением стала расшифровка генома M. incognita (Abad et al., 2008), которая предоставила огромный источник данных, позволяющих лучше понять все факторы, связанные с паразитизмом нематоды. Cтало известно, что эта нематода обладает практически всеми репрезентативными классами протеиназ, описанных в литературе. Проведенные исследования показали, что деградом галловой нематоды M. incognita состоит из 334 протеиназ, принадлежащих к различным классам, что составляет 1.74% всех белков, кодированных в геноме этой нематоды. При этом 64 из идентифицированных протеиназ содержат N-концевой пептидный сигнал, что указывает на их участие в секреторной деятельности нематод (Bellafiore et al., 2008) и предполагает их возможное влияние на растение-хозяина. Среди них известны две катепсиноподобные цистеиновые протеиназы (Neveu et al., 2003; Shingles, 2007), химотрипсиноподобные сериновые протеиназы (Rosso et al., 2012) и катепсин D – аспартатная протеиназа (Fragoso et al., 2005). Некоторые аспартатные протеаназы нематоды выделяют во время паразитирования в апопласт растений (Vieira et al., 2011).
Исследования экспрессии генов трех мажорных протеиназ M. incognita – аспартатной (Mi-asp-1), сериновой (Mi-ser-1) и цистеиновой типа катепсина L (Mi-cpl-1) – выявили значительные различия на всех этапах развития нематод (от внедрения в корни личинок до репродуктивной стади), что указывало на различные функции, которые они выполняют в процессе развития (Antonino de Souza et al., 2013).
Функции протеиназ нематод при паразитировании на растениях были определены с помощью метода избирательной инактивации экспрессии генов малыми интерферирующими РНК. Использование этого метода помогло установить, что протеиназы участвуют во многих аспектах морфогенеза и физиологии клеток растений, в деградации защитных белков растений (Vieira et al., 2011), а также в специализированных физиологических процессах нематод, таких как линька (Craig et al., 2007) и эмбриогенез (Britton, Murray, 2002; Hashmi et al., 2002). Применение метода РНК-интерференции на растениях табака, инвазированных M. incognita, в корнях которых были подавлены активности генов, кодирующих аспартатные (Mi-asp-1), сериновые (Mi-ser-1) и цистеиновые (Mi-cpl-1) протеазы, позволило получить данные о значении этих протеиназ в развитии нематод в корнях растений. Оказалось, что нокдаун генов вышеупомянутых протеаз, которые были исключены из рациона паразитирующих на них нематод, отражался на размерах, размножении, жизнеспособности яиц и вирулентности потомства (Antonino de Souza et al., 2013) .
Ввиду важности этого класса ферментов, обладающих широким спектром метаболических функций во взаимодействиях паразит–хозяин, протеиназы могут рассматриваться как важные мишени для создания новых сельскохозяйственных культур с повышенной устойчивостью к нематодам. Подавление развития нематод в растениях с генами, экспрессирующими ингибиторы протеиназ, подтверждается многими исследованиями (Atkinson et al., 2009, 2012; Dutta et al., 2015; Ali et al., 2017; и др.).
Возможно, результаты, полученные на растениях, содержащих гены ингибиторов протеиназ или экспрессирующих дцРНК для определенных протеиназ, не отражают природные ситуации в инвазированных растениях, но показывают, что одним из факторов защиты растений в ответ на нематодную инвазиию могут быть ингибиторы, способные подавить активность протеиназ. По-видимому, подавление активности ферментов белковыми ингибиторами – наиболее древний в эволюционном отношении способ регуляции протеолиза (Мосолов, 1983). Этот процесс контролируется каскадами сигнальной трансдукции, которая связана с транскрипцией генов, кодирующих эти белки-ингибиторы (Koiwa et al., 1997). Одна из причин экспрессии и накопления ингибиторов протеиназ (ИП) в клетках при заражении различными фитопатогенами – активация сигнального пути, опосредованного салициловой (СК) или жасмоновой (ЖК) кислотами (Vlot et al., 2009; Uehara et al., 2010). Данные, ранее полученные на системах томаты–галловые нематоды, свидетельствуют о влиянии СК или ЖК на устойчивость растений, оказывая ингибирующее влияние на развитие и плодовитость нематод (Зиновьева и др., 2013; Vieira dos Santos et al., 2013).
Многочисленные исследования показали, что локальная и системная аккумуляция ИП – компонент защитного ответа, инициируемого поранением, при воздействии вредителей или патогенов (Ryan, 1990; Birkenmeier, Ryan, 1998; Валуева, Мосолов, 2002). Обнаружено, что у томатов ингибиторы сериновых протеиназ I и II откладывались в стенках клеток эндосперма и секреторных клетках корневого чехлика и секретировались в окружающую среду. В связи с этим было сделано предположение, что ИП могут защищать растущую меристему корней от действия патогенных микроорганизмов и других вредителей, в том числе и нематод, поражающих корневую систему растений (Narváez-Vásquez et al., 1993). Сведения о роли ИП в защитном ответе растений на инвазию фитопаразитическими нематодами и их роли в развитии взаимоотношений в системе нематода–растения малочисленны, а данные противоречивы (Rashed et al., 2008; Turra et al., 2009; Ревина и др., 2012; Удалова и др., 2014). Отметим, что среди генов, транскрипты которых накапливаются в растениях томатов, инфицированных нематодой Meloidogyne javanica, идентифицирован ген, кодирующий ингибитор сериновой протеиназы, относящийся к структурному суперсемейству ингибитора Кунитца (SBTI), который участвует в защите пасленовых от грибных инфекций (Lambert et al., 1999).
Выбор ингибиторов связан с имеющимися в литературе данными о мажорном присутствии сериновых и цистеиновых протеиназ в организме галловой нематоды и наличии ингибиторов этих протеиназ в корнях томатов (Turra et al., 2009; Castagnone-Sereno, 2011; Kovács et al., 2016).
Цель работы – провести сравнительный анализ экспрессии генов ингибиторов сериновых и цистеиновых протеиназ в устойчивых и восприимчивых растениях томата при инвазии M. incognita и экзогенном воздействии СК и ЖК, а также выяснить значение этих ингибиторов в устойчивости растений к нематодам, используя морфофизиологические индикаторы состояния популяции нематод, паразитирующих на корнях.
МАТЕРИАЛЫ И МЕТОДЫ
Материалом для исследования служили близкородственные линии растений томата Lycopersicon esculentum L. – гибрид F1 Шагане, устойчивый к заражению галловой нематодой M. incognita, и восприимчивый гибрид F1 Гамаюн. Семена растений были поверхностно стерилизованы 1%-ным раствором Ca(OCl)2. Растения выращивали в пластиковых сосудах с пропаренной почвой в климатической камере при 25°C (фотопериод L : D – 16 : 8). Материал был получен из инвазированных культивируемых в теплице восприимчивых томатов. Из галлов, образованных нематодами на корнях этих растений, выделяли яйца, инкубировали в дистиллированной воде, после вылупления личинок проводили заражение суспензией нематод (3000 инвазионных личинок/растение). Подсчет численности нематод в аликвотах проводился под световым микроскопом. Заражение растений и их выращивание проводили по стандартным методикам, описанным ранее (Удалова, Зиновьева, 2016).
Для исследования действия сигнальных молекул (СК и ЖК) на активность генов ИП использовали растворы в концентрациях: СК 7 × 10–8М и ЖК 5 × 10–8 М (Sigma, США). Семена растений в течение 2 ч замачивали в растворах СК или ЖК в указанных концентрациях, а затем двухнедельную рассаду опрыскивали непосредственно перед внесением инвазии (7 мл растворов на каждое растение). Семена и растения контрольных вариантов обрабатывали дистиллированной водой. Каждый вариант опыта (здоровые растения–контроль; инвазированные без обработки препаратами; инвазированные + ЖК; инвазированные + СК) проводился в 10-кратной повторности.
Отбор проб для молекулярного анализа проводился перед инвазией, а также на ключевых этапах жизнедеятельности нематоды (на 1-е и 3-и сут – массовое внедрение личинок в корни, на 5-е – формирование места питания (гигантских клеток) и на 20-е – активное питание и формирование половозрелых особей). В этот же период анализировали и корни неинвазированных растений.
Уровень транскрипции генов ИП оценивали с помощью полимеразной цепной реакции (ПЦР) в режиме реального времени. Тотальную РНК выделяли с помощью набора Extract RNA (Евроген, Россия). Количество и качество тотальной РНК определяли методом капиллярного электрофореза на системе Experion (Bio-Rad, США). Тотальную РНК обрабатывали ДНКазой (1 е.а.) (Синтол, Россия). Первую цепь кДНК синтезировали с помощью обратной транскрипции и случайных гексапраймеров (Евроген, Россия). Реакцию ПЦР проводили по стандартному протоколу. Эффективность ПЦР (98%) оценивали по стандартной кривой. Относительный уровень экспрессии генов вычисляли методом ΔΔCt. В качестве контрольных образцов были выбраны кДНК, выделенные из растений, не подвергнутых экзогенному воздействию. В качестве референсного гена использовали актин. Дизайн праймеров ДНК ингибиторов сериновых протеиназ (ISP) и ингибиторов цистеиновых протеиназ (ICP) определяли с помощью программы Primer3 (http://primer3plus.com) (табл. 1). Повторность в пределах одного опыта шестикратная.
Таблица 1.
Праймеры для проведения ПЦР в режиме реального времени
| Гены | Нуклеотидная последовательность (5' … 3') | |
|---|---|---|
| прямого праймера | обратного праймера | |
| ISP | TCTTGGGTTCGGGATATG | GGGACATCTTGAATAGGC |
| ICP | GTGATGAGCCCAAGGCAAAT | GCCAATCCAGAAGATGGACAA |
| Актин | CGGTGTTATGGTAGGGATGGGTC | CTCATCAGGAGAAACACGCAAC |
Устойчивость растений к нематодам оценивали в каждом варианте по степени поражения корней (количество галлов на единицу корня) и морфофизиологическим показателям паразитов (размерам и плодовитости (число яиц в оотеке)) на 35-е сут после инвазии. Дополнительно оценивали состояние инвазированных растений по массе и высоте. Каждый вариант был проанализирован в 10-кратной повторности.
Данные были обработаны статистическим методом ANOVA, SAS Version 6.0 (Statsoft Statistica). Данные о морфофизиологических показателях нематод и параметрах роста растений анализировали с помощью наименьшей существенной разницы (НСР) – теста Фишера (P ≤ 0.05). Тесты на существенные различия в экспрессии генов у разных растений в каждый момент времени были проведены с помощью тестов Дункана (P ≤ 0.05).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Экспрессия генов ингибиторов протеиназ в корнях устойчивых и восприимчивых растений томатов в прединвазионный период. Результаты исследования показали, что устойчивые и восприимчивые растения в норме (без заражения) обладают активными генами сериновых и цистеиновых ИП, экспрессия которых находится на низком уровне (рис. 1).
Рис. 1.
Экспрессия генов ингибитров сериновых протеиназ (ISP) и цистеиновых протеиназ (ICP) в корнях устойчивых (а) и восприимчивых (б) растений томатов до заражения Meloidogyne incognita (1) и после обработки их СК (2) и ЖК (3).
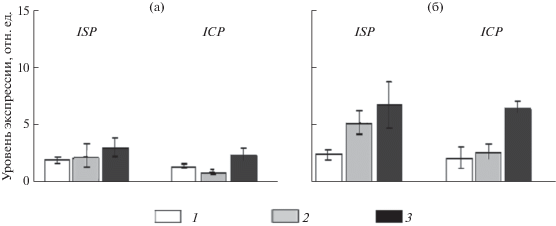
Статистически значимой разницы в уровне экспрессии генов ИП в корнях между устойчивыми и восприимчивыми растениями не было обнаружено (рис. 1). Не различались межу собой и активности генов сериновых и цистеиновых протеиназ – экспрессия генов была практически одинаковой и в устойчивых, и восприимчивых растениях (рис. 1).
Экзогенная обработка растений СК в прединвазионный период по-разному влияла на экспрессию генов ИП в корнях устойчивых и восприимчивых растений. В устойчивых растениях количество транскриптов не изменилось, в восприимчивых произошло увеличение накопления транскриптов гена ингибиторов сериновых протеиназ в 2 раза, но уровень автивности генов ингибиторов цистеиновых протеиназ оставался на уровне контрольных необработанных растений (рис. 1).
ЖК-обработка влияла на экспрессию генов в прединвазионный период – в устойчивом сорте содержание транскриптов генов ингибиторов сериновых и цистеиновых протеиназ увеличилось незначительно по сравнению с таковыми в необработанных растениях (рис. 1). Восприимчивые растения отреагировали на действие ЖК – количество транскриптов и сериновых, и цистеиновых ИП возросло по сравнению с таковыми в необработанных растениях более чем в 2 раза.
Экспрессия генов ингибиторов протеиназ в корнях устойчивых и восприимчивых растений томатов после обработки СК или ЖК и инвазии галловой нематодой M. incognita. Инвазия растений вызывала повышение активности генов обоих ИП. В устойчивых растениях достоверное увеличение транскриптов по сравнению с неинвазированными растениями было отмечено уже на 3-и сут. Уровень транскриптов изменялся в процессе прохождения жизненного цикла, и максимальное накопление транскриптов в тканях устойчивых растений происходило в период питания нематод к 20-м сут (рис. 2). Содержание транскриптов сериновых и цистеиновых ИП к этому периоду в корнях инвазированных растений было соответствено в 3.5 и 3 раза выше, чем в неинвазированных в этот период.
Рис. 2.
Экспрессия генов ингибиторов сериновых протеиназ (ISP) и цистеиновых протеиназ (ICP) в корнях устойчивых (а) и восприимчивых (б) растений томатов до заражения Meloidogyne incognita (1), после заражения (2) и после заражения и обработки СК (3) или ЖК (4). * – достоверные различия (при Р ≤ 0.05) в экспрессии генов между здоровыми и инвазированными растениями.
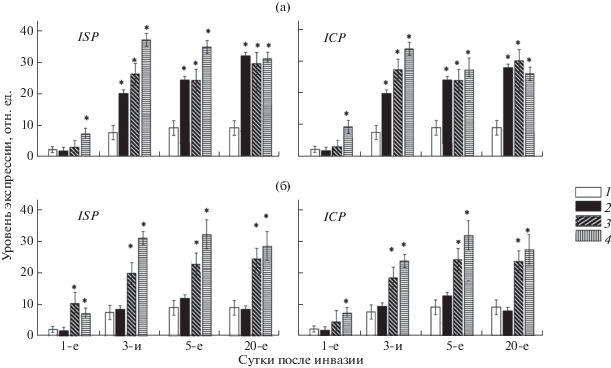
Реакция восприимчивых растений на заражение нематодой была отличной от той, что наблюдалась у устойчивых растений. Экспрессия генов и цистеиновых и сериновых ИП при заражении не изменялась: накопление транскриптов у зараженных растений было сопоставимо с таковым у незараженных (рис. 2). Тенденция к повышению экспрессии генов ингибиторов сериновых протеиназ была отмечена на 5-е сут после инвазии, однако на 20-е сут заражения, к моменту активного питания нематод, активность обоих исследованных генов была снижена по сравнению с таковой у незараженных растений (рис. 2).
При заражении устойчивых растений, обработанных СК, динамика накопления транскриптов генов в корнях была сходна с той, которая наблюдалась у зараженных растений без обработки (рис. 2). При заражении восприимчивых растений, обработанных СК, наблюдался повышенный уровень экспрессии обоих генов, который сохранялся на протяжении всего развития нематод в корнях (5-е–20-е сут). В этот период уровень транскриптов был в 2 раза больше такового в неинвазированных растениях (рис. 2). Следует отметить, что динамика и уровень накопления транскриптов генов сопоставимы с таковыми у зараженных устойчивых растений.
ЖК-обработка оказала заметное влияние на экспрессию генов в корнях томатов при инвазии. Накопление транскриптов генов и сериновых, и цистеиновых ИП в устойчивых растениях было существенно выше уже через сутки после инвазии, соответственно в 3.6 и 4.2 раза по сравнению с таковым в необработанных растениях (рис. 2). Повышенный уровень транскриптов наблюдался до 5-х сут с последующим незначительным снижением (рис. 2). К 20-м сут экспрессия обоих генов была сходна с таковой у необработанных растений.
При заражении восприимчивых растений, обработанных ЖК, гены ИП были высокоэкспрессированы в период от 3-х до 20-х сут. В отличие от зараженных устойчивых растений пик экспрессии генов в восприимчивых растениях наблюдался на 5-е сут после инвазии (рис. 2).
Таким образом, представленные данные по модуляции экспрессии генов ингибиторов сериновых и цистеиновых протеиназ на различных этапах развития нематод и при разных обработках, по-видимому, свидетельствуют об изменении функциональной активности самих ферментов, которые могут уже непосредственно воздействовать на протеиназы паразита.
Морфофизиологические показатели галловых нематод из восприимчивых растений при обработке СК и ЖК. Исследования растений, инвазированных галловой нематодой, показали, что при обработке СК или ЖК зараженность корней томатов, восприимчивых к галловой нематоде, снижалась (число галлов на корнях уменьшилось соответственно на 45.6 и 31.1%), при этом масса надземной части растений была заметно выше по сравнению с таковой в необработанных растениях (табл. 2).
Таблица 2.
Развитие восприимчивых растений томатов и морфофизиологические параметры галловой нематоды Meloidogyne incognita при обработке салициловой кислотой (СК) и жасмоновой кислотой (ЖК)
| Растения | Масса надземных органов, г | Высота
растений, см |
Число галлов/растение | Число яиц в оотеке | Размер самок, мм2 |
|---|---|---|---|---|---|
| Здоровые | 59.3 ± 4.2 | 62.3 ± 12.5 | – | – | – |
| Инвазированные | 38.2 ± 5.3 | 58.8 ± 8.2 | 759 ± 68 | 158 ± 24 | 0.336 ± 0.021 |
| СК-обработанные | 135.7 ± 15.6 | 146.4 ± 22.4 | – | – | – |
| СК-обработанные инвазированные |
103.6 ± 12.3 | 117.0 ± 13.5 | 413 ± 53 | 135 ± 26 | 0.30 ± 0.012 |
| ЖК-обработанные | 68.2 ± 9.2 | 73.6 ± 10.4 | – | – | – |
| ЖК-обработанные инвазированные |
67.2 ± 8.7 | 70.4 ± 11,4 | 523 ± 45 | 108 ± 21 | 0.272 ± 0.019 |
| НСР (P ≤ 0.05) | 24.7 | 18.3 | 73 | 26 | 0.023 |
В обработанных растениях нематоды развивались медленнее, о чем можно было судить по их размерам: они были мельче, чем в растениях без обработок – на 19% при обработке ЖК и на 11% при СК-обработке. Снизилась и плодовитость нематод: среднее число яиц в оотеках сократилось при обработке СК или ЖК сответственно на 15 и 32%.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ИП относятся к одной из групп семейства PR-белков (Pathogenesis-Related Proteins), которые в настоящее время рассматриваются как одна из важнейших стратегий защиты растений от патогенов (Ali et al., 2018). Эти белки индуцируются в растениях в ответ на воздействие патогенов в определенных стрессовых условиях. Они были классифицированы на несколько групп (от PR-1 до PR-17) на основе их аминокислотных последовательностей и биохимических функций. ИП относятся к группе PR-6 белков. В состав этой группы входят ингибиторы всех известных типов протеиназ (сериновых, цистеиновых, аспартатных и металлопротеаз). Ранее проведенные исследования показали, что уровень транскриптов генов PR-6 и динамика их активности при инвазии растений томатов или картофеля соответственно галловой (M. incoignita) и цистообразуюшей (Globodera rostochiensis) нематодами в устойчивых к нематодам сортах различались. Возрастание активности этих генов в период развития и размножения нематод указывали на возможную роль ферментов этой группы в качестве одного из основных компонентов защиты растений в ответ на инвазию (Lavrova et al., 2017а, б; Seiml-Buchinger et al., 2019). Данные настоящего исследования свидетельствуют о возможном участии в этом процессе двух классов ИП – сериновых и цистеиновых, а также о модуляции их активности биогенными элиситорами – жасмоновой и салициловой кислотами.
Полученные результаты показали, что, несмотря на присутствие активных генов ингибиторов сериновых и цистеиновых протеиназ в корнях здоровых растений, в условиях заражения для устойчивых растений характерно усиленное накопление транскриптов данных генов на этапах проникновения и развития в корнях, тогда как у восприимчивых растений отсутствуют значимые изменения в активности данных генов. Выявленные различия в динамике экспрессии генов ИП согласуются с ранее полученными нами данными по экспрессии гена Mi-1.2, определяющего устойчивость томатов к галловой нематоде, которая возрастала в корнях устойчивых растений при заражении галловой нематодой и не менялась у восприимчивых растений (Лаврова и др., 2016, 2017б). Повышенная экспрессия гена устойчивости Mi-1.2 на ранних этапах паразитирования нематоды (период проникновения личинок в корни, образование мест питания – гигантских клеток) позволяет устойчивым растениям своевременно распознавать внедрение паразита и активировать защитный сигнальный каскад реакций, результатом которого является высокая экспрессия генов ИП, что локально ограничивает распространение паразита и возможность его нормального развития. Отсутствие изменений в активности генов ИП у восприимчивых растений при инвазии свидетельствует об отсутствии развития своевременного защитного ответа и, тем самым, о создании благоприятных условий для развития нематоды.
Результаты исследований, проведенных ранее, показали, что СК и ЖК – сигнальные молекулы, влияющие на защитную систему при биотических стрессах, включая фитопаразитических нематод (Cooper et al., 2005; Halim et al., 2006; Bhattarai et al., 2008; Molinary et al., 2008; Зиновьева и др., 2013; Fan et al., 2015; Yang et al., 2018). Экзогенное применение этих соединений в значительной степени регулирует экспрессию многих защитных генов у растений (Stintzi et al., 2001; Fujimoto et al., 2011; Molinary et al., 2014).
Исследования, проведенные нами ранее, показали, что экзогенные обработки СК и ЖК несущественно влияют на характер и уровень экспрессии гена Mi-1.2 в корнях устойчивых растений томата (Лаврова и др., 2016; Seiml-Buchinger et al., 2019). Результаты, полученные в настоящем исследовании показали, что экзогенные обработки СК или ЖК в прединвазионный период в применяемых концентрациях также несущественно влияют на характер и уровень экспрессии генов ИП в корнях устойчивых растений томата. Для них характерны низкая активность генов в прединвазионный период с последующим быстрым повышением уровня экспрессии при заражении нематодой. Полученный результат свидетельствует о том, что устойчивые растения в норме (без инвазии) практически не реагируют на действие внешних факторов на уровне транскриптома. Возможно, это связано с тем, что действие СК или ЖК направлено на индуцирование защитных свойств хозяина, которые у устойчивых растений уже достаточно активны.
Восприимчивые растения, как показывают результаты, описанные выше, характеризуются очень низкой активацией ИП при заражении. Однако они могут обладать иммунным потенциалом, который реализуется при определенных экзогенных обработках, таких, как СК или ЖК. Эти соединения вызывают повышение уровня транскрипции генов ИП в корнях восприимчивых растений в прединвазионный период и стимулируют повышение уровня экспрессии при последующей инвазии галловой нематодой. Особо следует подчеркнуть, что в целом динамика активности генов в корнях обработанных восприимчивых растений при заражении свидетельствует о сходстве с устойчивыми растениями, хотя пик транскрипции генов выражен в меньшей степени по сравнению с генетически устойчивыми растениями. Тем не менее в случае заражения такие растения уже способны к межклеточному распознаванию эффекторов личинок нематод, передаче сигнала на геном и своевременной активации защитных реакций. Влияние СК и ЖК на транскрипционную активность исследованных генов у восприимчивых растений указывает также на роль этих молекул в развитии индуцированной устойчивости томатов к заражению галловой нематодой. Обработка растений ЖК оказывает более сильное влияние на экспрессию генов ИП по сравнению с СК, поскольку ЖК функционирует как мобильный сигнал для экспрессии ИП в отдаленных тканях растений (Зиновьева и др., 2013).
Проведенное исследование выявило значительное снижение нематодной инвазии у восприимчивых растений, подвергнутых до инвазии действию СК или ЖК, по сравнению с растениями без обработки, что указывает на повышение их иммунного статуса и позволяет определить роль исследованных PR-генов в устойчивости, индуцированной сигнальными молекулами. Полученные данные показали, что экспрессия генов ИП при действии СК и ЖК сопровождается измененениями их репродуктивного потенциала, размерами, а также со степенью зараженности растений. Это вполне соотносится с опубликованными ранее данными, свидетельствующими о том, что нокдаун генов этих протеиназ влияет на размножение нематод и на вирулентность потомства (Antonino de Souza et al., 2013). Кроме того, восприимчивые растения, зараженные M. incognita, характеризовались сокращением биомассы. Паразитирование нематод приводит к снижению поглощения воды и питательных веществ, что может привести к оттоку углеводов к корням, поскольку это необходимо для развития нематод и откладки яиц взрослыми самками, а следовательно, к нарушению роста растений (Amarasinghe, Dalugoda, 2009; Maleita et al., 2012). Обработка восприичивых растений СК или ЖК перед инвазией способствовала увеличению их биомассы, что также свидетельствует о снижении патогенного эффекта, наносимых инвазией.
Экспрессия генов ИП на различных этапах развития нематод в тканях устойчивых и праймированных СК или ЖК растений показала, что повышение функциональной активности этих ферментов связано в основном с седентарным периодом развития (5-е–20-е сут), во время которого происходит процесс питания и развития нематод до половозрелой стадии и последующий процесс образования и откладки яиц в оотеку. Целесообразность повышения активности ингибиторов сериновых и цистеиновых протеиназ в корнях растений как защитной реакции в этот период, по-видимому, связана с подавлением активности соответствующих протеиназ самих нематод, выполняющих определенные функции в процессах эмбриогенеза, питания и созревания яиц (Antonino de Souza et al., 2013). Известно, что нематоды во время паразитирования выделяют некоторые протеиназы в апопласт растений (Vieira et al., 2011), и этот факт указывает на их активное участие в патогенезе. Поэтому вполне понятно, что в процессе эволюции в ответ на инвазию нематод растение начинает использовать собственные ИП для нейтрализации протеиназ фитопатогена.
ЗАКЛЮЧЕНИЕ
Развитие галловых нематод в тканях растений во многом определяется активностью ингибиторов протеиназ, обнаруженных в растениях на всех стадиях развития паразита в корнях растений, и свидетельствует о перспективности путей защиты растений на их основе. Одним из механизмов повышения устойчивости растений к нематодам может быть модуляция активности ИП в растительных тканях с помощью препаратов, приводящих к длительной индукции их активности, в частности, сигнальными молекулами СК или ЖК. Экзогенная обработка СК и ЖК играет роль прайминга для восприимчивых растений, приводящего к мобилизации защитных функций растительного организма, в том числе к модуляции экспрессии генов ИП, что позволяет регулировать устойчивость растений томата к заражению галловой нематодой. Экзогенные обработки повышают транскрипцию защитных генов в восприимчивых растениях, обеспечивают подготовку организма к последующим стрессовым условиям и способствуют развитию индуцированной устойчивости к фитопаразитической нематоде по механизмам, схожим с генетической устойчивостью.
Учитывая множество протеаз, действующих на различных фазах развития нематод, при создании устойчивых к нематодам растений, экспрессирующих гены ИП, максимальный успех может быть достигнут при использовании нескольких генов, функциональные свойства которых связаны с показателями жизнедеятельности паразита, такими, как питание, темпы развития и размножение.
Работа выполнена в рамках государственного задания № 0109-2018-0066.
Список литературы
Валуева Т.А., Мосолов В.В. Роль ингибиторов протеолитических ферментов в защите растений // Успехи биол. химии. 2002. Т. 42. С. 193–216.
Зиновьева С.В., Васюкова Н.И., Удалова Ж.В., Герасимова Н.Г. Участие салициловой и жасмоновой кислот в генетической и индуцированной устойчивости томатов при инвазии галловой нематодой Meloidogyne incognita (Kofoid, White, 1919) // Изв. РАН. Сер. биол. 2013. № 3. С. 332–340. https://doi.org/10.7868/S0002332913030120
Лаврова В.В., Удалова Ж.В., Матвеева Е.М., Зиновьева С.В. Экспрессия PR-генов в тканях томатов при инвазии галловой нематодой Meloidogyne incognita (Kofoid et White, 1919) Chitwood 1949 // Докл. РАН. 2017а. Т. 476. С. 466–469. https://doi.org/10.7868/S0869565217280246
Лаврова В.В., Удалова Ж.В., Матвеева Е.М., Хасанов Ф.К., Зиновьева С.В. Экспрессия генов Mi-1 в растениях томата при заражении галловой нематодой и обработке салициловой кислотой // Докл. РАН. 2016. Т. 471. С. 358–361. https://doi.org/10.7868/S0869565216330264
Лаврова В.В., Удалова Ж.В., Матвеева Е.М., Хасанов Ф.К., Зиновьева С.В. Экспрессия PR-генов в тканях томатов при инвазии галловой нематодой Meloidogyne incognita (Kofoid et White, 1919) Chitwood 1949 // Докл. РАН. 2017б. Т. 476. С. 466–469. https://doi.org/10.7868/S0869565217280246
Мосолов В.В. Белковые ингибиторы как регуляторы процессов протеолиза. М.: Наука, 1983. 40 с.
Ревина Т.А., Удалова Ж.В, Зиновьева С.В., Валуева Т.А. Ингибиторы трипсина и химотрипсина в кopняx и листьях томатов, инфицированных галловой нематодой // Картофелеводство: сб. науч. Трудов. Минск: Науч.-практ. центр НАН Беларуси по картофелеводству и плодоовощеводству, 2012. Вып. 20. С. 119–124.
Удалова Ж.В., Ревина Т.А., Герасимова Н.А., Зиновьева С.В. Участие ингибиторов протеиназ в защите растений томатов от галловых нематод // Докл. РАН. 2014. Т. 458. С. 726–729. https://doi.org/10.7868/S0869565214300264
Удалова Ж.В., Зиновьева С.В., Хасанова О.С. Влияние устойчивости томатов на морфо-физиологическое разнообразие и популяционные характеристики галловой нематоды Meloidogyne incognita (Kofoid, White, 1919), Chitwood, 1949 // Рос. паразитол. журн. 2016. Т. 36. № 2. С. 245–252.
Abad P., Gouzy J., Aury J.M., Castagnone-Sereno P., Danchin E.G., Deleury E., Perfus-Barbeoch L., Anthouard V., Artiguenave F., Blok V.C., Caillaud M.C., Coutinho P.M., Dasilva C., De Luca F., Deau F., Esquibet M., Flutre T., Goldstone J.V., Hamamouch N., Hewezi T., Jaillon O., Jubin C., Leonetti P., Magliano M., Maier T.R., Markov G.V., McVeigh P., Pesole G., Poulain J., Robinson-Rechavi M., Sallet E., Ségurens B., Steinbach D., Tytgat T., Ugarte E., van Ghelder C., Veronico P., Baum T.J., Blaxter M., Bleve-Zacheo T., Davis E.L., Ewbank J.J., Favery B., Grenier E., Henrissat B., Jones J.T., Laudet V., Maule A.G., Quesneville H., Rosso M.N., Schiex T., Smant G., Weissenbach J., Wincker P. Genome sequence of the metazoan plant-parasitic nematode Meloidogyne incognita // Nat. Biotechnol. 2008. V. 26. № 8. P. 909–915. https://doi.org/10.1038/nbt.1482
Ali M.A., Azeem F., Abbas A., Joyia F.A., Li H., Dababat A.A. Transgenic strategies for enhancement of nematode resistance in plants // Front Plant Sci. 2017. V. 8. P. 750. https://doi.org/10.3389/fpls
Ali S., Ganai B.A., Kamili A.N., Bhat A.A., Mir Z.A., Bhat J.A., Tyagi A., Islam S.T., Mushtaq M., Yadav P., Rawat S., Grover A. Pathogenesis-related proteins and peptides as promising tools for engineering plants with multiplestress tolerance // Microbiol. Res. 2018. V. 212–213. P. 29–37. https://doi.org/10.1016/j.micres.2018.04.008
Amarasinghe L.D., Dalugoda Y.S. Susceptibility of seven tomato (Lycopersicon esculentus) varieties to root-knot nematode, Meloidogyne incognita // Pest. Technol. 2009. V. 3. № 1. P. 40–44.
Antonino de Souza, J.D., Jr, Ramos Coelho R., Tristan Lourenço I., da Rocha Fragoso R., Barbosa Viana A.A., Pepino de Macedo L.L., Mattar da Silva M.C., Gomes Carneiro R.M, Engler G, Janice de Almeida-Engler, Grossi-de-Sa M.F. // Knocking down Meloidogyne incognita proteases by plant-delivered dsRNA has negative pleiotropic effect on nematode vigor // PLoS One. 2013. V. 8. № 12. e85364. https://doi.org/10.1371/journal.pone.0085364
Atkinson H.J., Lilley C.J., Urwin P. E. Strategies for transgenic nematode control in developed and developing world crops // Curr. Opin. Biotechnol. 2012. V. 23. P. 251–256. https://doi.org/10.1016/j.copbio.2011.09.004
Atkinson H.J., Urwin P.E., Hussey R.S. Plant biotechnology and control // Root-knot nematodes / Eds Perry R.N., Moens M., Starr J.L. Wallingford; Oxfordshire: CAB International, 2009. P. 338–362.
Bellafiore S., Shen Z., Rosso M.-N., Abad P., Shih P., Briggs S.P. Direct identification of the Meloidogyne incognita secretome reveals proteins with host cell reprogramming potential// PLoS Pathog. 2008. V. 4. № 10. e1000192. https://doi.org/10.1371/journal.ppat.1000192
Birkenmeier G.F., Ryan C.A. Wound signaling in tomato plants. Evidence that aba is not a primary signal for defense gene activation // Plant Physiol. 1998. V. 117. P.687–693. https://doi.org/10.1104/pp.117.2.687
Bhattarai K.K., Xie Q.G., Mantelin S., Bishnoi U., Girke T., Navarre D.A., Kaloshian I. Tomato susceptibility to root-knot nematodes requires an intact jasmonic acid signaling pathway // Mol. Plant Microbe Interact. 2008. V. 21. P. 1205–1214. https://doi.org/10.1094/MPMI-21-9-1205
Britton C., Murray L. A cathepsin L protease essential for Caenorhabditis elegans embryogenesis is functionally conserved in parasitic nematodes // Mol. Biochem. Parasitol. 2002. V. 122. P. 21–33. https://doi.org/10.1016/S0166-6851(02)00066-X
Castagnone-Sereno P., Deleury E., Danchin E.G.J., Perfus-Barbeoch L., Abad P. Data-mining of the Meloidogyne incognita degradome and comparative analysis of proteases in nematodes // Genomics. 2011. V. 97. P. 29–36.
Cooper W.R., Jia L., Goggin L. Effects of jasmonate-induced defenses on root-knot nematode infection of resistant and susceptible tomato cultivars // J. Chem. Ecol. 2005. V. 31. P. 1953–1967. https://doi.org/10.1007/s10886-005-6070-y
Craig H., Isaac R.E., Brooks D.R. Unravelling the moulting degradome: new opportunities for chemotherapy? // Trends Parasitol. 2007.V. 23. P. 248–253. https://doi.org/10.1016/j.pt.2007.04.003
Dutta, T. K., Papolu P.K., Banakar P., Choudhary D., Sirohi A., Rao U. Tomato transgenic plants expressing hairpin construct of a nematode protease gene conferred enhanced resistance to root-knot nematodes // Front Microbiol. 2015. V. 6. P. 260. https://doi.org/10.3389/fmicb.2015.00260
Fan J.W., Hu C.L., Zhang L.N., Li Z.L., Zhao F.K., Wang S.H. Jasmonic acid mediates tomato’s response to root knot nematodes // J. Plant Growth Regul. 2015. V. 34. P. 196–205. https://doi.org/10.1007/s00344-014-9457-6
Fragoso R.R., Batista J.A., Neto O.B., Grossi de Sá M.F. Isolation and characterization of a cDNA encoding a serine proteinase from the root-knot nematode Meloidogyne incognita // Exp. Parasitol. 2005. V. 110. P. 123–133. https://doi.org/10.1016/j.exppara.2005.02.010
Fragoso R.R., Lourenço I.T., Batista J.A., Oliveira-Neto O.B., Silva M.C., Rocha T.L., Coutinho M.V., Grossi-de-Sa M.F. Meloidogyne incognita: molecular cloning and characterization of a cDNA encoding a cathepsin D-like aspartic proteinase. // Exp. Parasitol. 2009. V. 121. P. 115–123. https://doi.org/10.1016/j.exppara.2008.09.017
Fujimoto T., Tomitaka Y., Abe H., Tsuda S., Futai K., Mizukubo T. Expression profile of jasmonic acid-induced genes and the induced resistance against the root-knot nematode (Meloidogyne incognita) in tomato plants (Solanum lycopersicum) after foliar treatment with methyl jasmonate // J.Plant Physiol. 2011. V. 168. P. 1084–1097. https://doi.org/10.1016/j.jplph.2010.12.002
Gheysen G., Mitchum M.G. How nematodes manipulate plant development pathways for infection // Curr. Opin. Plant Biol. 2011. V. 14. P. 415–421. https://doi.org/10.1016/j.pbi.2011
Gheysen G., Mitchum M.G. Phytoparasitic nematode control of plant hormone pathways// Plant Physiol. 2019.V. 179. P. 1212–1226. https://doi.org/10.1104/pp.18.01067
Haegeman A., Mantelin S., Jones J.T., Gheysen G. Functional roles of effectors of plant-parasitic nematodes // Gene 2012. V. 492. P. 19–31. https://doi.org/10.1016/j.gene. 2011.10.040.
Halim A., Vess D., Scheel S. The role of salicylic acid and jasmonic acid in pathogen defence // Plant Biol. 2006. V. 8. P. 307–313. https://doi.org/10.1055/s-2006-924025
Hashmi S., Britton C., Liu J., Guiliano D.B., Oksov Y., Lustigman S. Cathepsin L is essential for embryogenesis and development of Caenorhabditis elegans // J. Biol. Chem. 2002. V. 277. P. 3477–3486. https://doi.org/10.1074/ jbc.M106117200
Koiwa H., Bressen R.A., Hasegawa P.M. Regulation of protease inhibitors and plant defense // Trends Plant Sci. 1997. V. 2. P. 379–384. https://doi.org/10.1016/S1360-1385(97)90052-2
Kovács J., Poór P., Szepesi A., Tari I. Salicylic acid induced cysteine protease activity during programmed cell death in tomato plants // Acta Biol. Hung. 2016. V. 67. P. 148–158. https://doi.org/10.1556/018.67.2016.2.3
Lambert K.N., Ferrie B.J., Nombela G., Brenner E.D., Williamson V.M. Identification of genes whose transcripts accumulate rapidly in tomato after root-knot nematode infection // Physiol. Mol. Plant Pathol. 1999. V. 55. P. 341–348.
Lavrova V.V., Matveeva E.M., Zinovieva S.V. Expression of genes, encoded defense proteins, in potato plants infected with the cyst-forming nematode Globodera rostochiensis (Wollenweber 1923) Behrens, 1975 and modulation of their activity during sort-term exposure to low temperatures // Biol. Bull . 2017. T. 44. V. 2. P. 128–136. https://doi.org/10.1134/S1062359017020108.
Maleita C.M.N., Curtis R.H.C., Powers S.J. de O., Abrantes I.M. Inoculum levels of Meloidogyne hispanica and M. javanica affect nematode reproduction, and growth of tomato genotypes // Phytopathol. Mediterranea. 2012. V. 51. P. 566–576. .https://doi.org/10.14601/Phytopathol_Mediterr-9740
Mitchum M.G., Hussey R.S., Baum T.J., Wang X., Elling A.A., Wubben M., Davis E.L. Nematode effector proteins: An emerging paradigm of parasitism // New. Phytol. 2013. V. 199. P. 879–894. https://doi.org/10.1111/nph.12323
Moens M., Perry R.N., Starr J.L. Meloidogyne species – a diverse group of novel and important plant parasites // Root-knot nematodes / Eds Perry R.N., Moens M., Starr J.L.Wallingford: L CAB International, 2009. P. 1–17.
Molinari S. Saliciylic acid as an elicitor of resistance to root-knot nematodes in tomato // Acta Hort. (ISHS). 2008. V. 78. P. 119–126.
Molinari S., Fanelli E., Leonetti P. Expression of tomato salicylic acid (SA)-responsive pathogenesis-related genes in Mi-1-mediated and SA-induced resistance to root-knot nematodes // Mol. Plant Pathol. 2014. V. 15. P. 255–264. https://doi.org/10.1111/Mpp.12085
Narváez-Vásquez J., Franceschi V.R., Ryan C.A. Proteinase–inhibitor synthesis in tomato plants: evidence for extracellular deposition in roots through the secretory pathway // Planta. 1993. V. 189. P. 725–7266. https://www.jstor.org/stable/23382113.
Neveu C., Abad P., Castagnone-Sereno P. Molecular cloning and characterization of an intestinal Cathepsin L protease from the plantparasitic nematode Meloidogyne incognita // Physiol. Mol. Plant Pathol. 2003. V. 63. P. 159–165. https://doi.org/10.1016/j.pmpp.2003.10.005
Rosso M.N., Hussey R.S., Davis E.L., Smant G., Baum T.J., Abad P., Mitchum M.G. Nematode effector proteins: targets and functions in plant parasitism // Effectors in plant–microbe interactions / Eds Martin F., Kamoun S. N.Y.: Wiley-Blackwell Publ., 2012. P. 329–356.
Ryan C.A. Protease inhibitors in plants: genes for improving defenses against insects and pathogens // Ann. Rev. Phytopathol. 1990. V. 28. P. 425–449. https://doi.org/10.1146/annurev.py.28.090190.002233
Seiml-Buchinger V.V., Zinovieva S.V., Udalova Zh.V., Matveeva E.M. Jasmonic acid modulates Meloidogyne incognita–tomato plant interactions // Nematology. 2019. V. 21. P.171–180. https://doi.org/10.1163/15685411-00003205
Shingles J., Lilley C.J., Atkinson H.J., Urwin P.E. Meloidogyne incognita: molecular and biochemical characterisation of a cathepsin L cysteine proteinase and the effect on parasitism following RNAi // Exp. Parasitol. 2007. V. 115. P. 114–120. https://doi.org/10.1016/j.exppara.2006.07.008
Stintzi A., Weber H., Reymond P., Browse J., Farmer E.E. Plant defense in the absence of jasmonic acid: The role of cyclopentenones // Proc. Natl Acad. Sci. USA. 2001. V. 98. P. 12837–12842. https://doi.org/10.1073/pnas.211311098
Turra D., Bellin D., Lorito M., Gebhardt C. Genotype-dependent expression of specific members of potato protease inhibitor gene families in different tissues and in response to wounding and nematode infection // J. Plant Physiol. 2009. V. 166. P. 762–774. https://doi.org/10.1016/j.jplph.2008.10.005
Uehara T., Sugiyama S., Matsuura H., Arie T., Masuta C. Resistant and susceptible responses in tomato to cyst nematode are differentially regulated by salicylic acid // Plant Cell Physiol. 2010. V. 51. P. 1524–1536. https://doi.org/10.1093/pcp/pcq109
Vieira P., Danchin E.G., Neveu C., Crozat C., Jaubert S., Hussey R.S., Engler G., Abad P., Almeida-Engler J., Castagnone-Sereno P., Rosso M.-N. The plant apoplasm is an important recipient compartment for nematode secreted proteins // J. Exp. Bot. 2010. V. 62. P. 1241–1253. https://doi.org/10.1093/jxb/erq352
Vieira dos Santos M.C., Curtis R.H.C., Abrantes I. Effect of plant elicitors on the reproduction of the root-knot nematode Meloidogyne chitwoodi on susceptible hosts // European J. Plant Pathol. 2013. V. P. 193–202 . https://doi.org/10.1007/S10658-012-0155-6.
Vlot A.C., Dempsey D.A., Klessig D.F. Salicylic acid, a multifaceted hormone to combat disease // Annu Rev. Phytopathol. 2009. V. 47. P. 177–206. https://doi.org/10.1146/annurev.phyto.050908.135202
Yang Y.-X., Wu C., Golam G.J., Wu C., Yang Z., Wan C., Chen J. Red light-induced systemic resistance against root-knot nematode is mediated by a coordinated regulation of salicylic acid, jasmonic acid and redox signaling in watermelon // Front Plant Sci. 2018. V. 9. P. 899. https://doi.org/10.3389/fpls.2018.00899
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


