Известия РАН. Серия биологическая, 2021, № 4, стр. 341-353
Влияние термостабильного токсина бактерии Yersinia pseudotuberculosis на функциональные и фенотипические особенности двух типов фагоцитов голотурии Eupentacta fraudatrix
Л. С. Долматова 1, *, О. А. Уланова 1, Н. Ф. Тимченко 2
1 Тихоокеанский океанологический институт им. В.И. Ильичева
690041 Владивосток, ул. Балтийская, 43, Россия
2 Научно-исследовательский институт эпидемиологии и микробиологии имени Г.П. Сомова
690087 Владивосток, ул. Сельская, 1, Россия
* E-mail: dolmatova@poi.dvo.ru
Поступила в редакцию 06.11.2020
После доработки 13.11.2020
Принята к публикации 16.12.2020
Аннотация
Исследовано влияние термостабильного токсина Yersinia pseudotuberculosis (TcТYp) на показатели функциональной активности и фенотип Ф1 и Ф2 фагоцитов голотурии Eupentacta fraudatrix. Установлено, что Ф1 и Ф2 фагоциты отличались по уровню апоптоза и содержанию восстановленного глутатиона, а также по экспрессии поверхностных рецепторов к некоторым растительным лектинам. TcТYp (0.2-2 мкг/мл) сдвигал показатели функциональной активности и фенотип Ф1 фагоцитов в сторону преобладания таковых, характерных для Ф2 типа, обладающего меньшей бактерицидной активностью. Предполагается, что ТсТYp является важным фактором перепрограммирования фагоцитов голотурий в сторону преобладания антивоспалительного типа, что может увеличивать вирулентность Y. рseudotuberculosis для голотурий.
Иммунная система живых организмов эволюционировала, прежде всего, в связи с необходимостью защиты от инфекций (Danilova, 2006). У беспозвоночных преобладает неспецифический врожденный иммунитет, хотя могут проявляться некоторые элементы иммунной памяти (Netea et al., 2011). При этом иммунитет беспозвоночных демонстрирует высокие защитные способности. Вместе с тем, эволюционирует не только иммунная система, но и инфекционные агенты, в частности, бактерии, которые адаптируются к иммунитету организма хозяина (Danilova, 2006).
Иглокожие (Echinodermata), являющиеся морскими обитателями, широко распространенными в мировом океане (Dolmatova, Dolmatov, 2020), привлекают внимание иммунологов в связи с их эволюционной близостью к позвоночным. При этом многие представители класса голотурий (Holothuroidea) являются ценными коммерческими объектами и выращиваются в марикультуре (Долматова и др., 2019), в связи с чем изучение их иммунитета представляет не только теоретический, но и практический интерес.
В частности, потенциально опасным для голотурий является заражение Yersinia pseudotuberculosis. Возбудитель псевдотуберкулеза Y. pseudotuberculosis является кишечной бактерией, заражение которой осуществляется через пищу и воду (Bi et al., 2012). Как и многие другие бактерии, иерсинии имеют различные факторы, позволяющие им выживать как в окружающей среде, так и организме хозяина (Ценева и др., 2002). Макрофаги являются главной целью иерсиний in vivo, и Y. pseudotuberculosis может выживать и размножаться внутри макрофагов. К способствующим этому факторам относят несколько известных эффекторных белков Yops (Bi et al., 2012). Меньше известна роль токсинов бактерии. При этом фактор патогенности термостабильный летальный токсин Y. pseudotuberculosis (TcТYp), белок с мол. массой 45 кДа, подавляет фагоцитоз и снижает уровень активных форм кислорода (АФК) в макрофагах перитонеального экссудата мышей, что свидетельствует об его участии в подавлении иммунитета хозяина. TcТYp продуцируется не только при высокой (37°С), но и при низкой (6–8°С) температуре, что позволяет предполагать его важную роль при выживании бактерий в окружающей среде. Известно, что Y. pseudotuberculosis может долго выживать в морской воде, вызывая гибель морских беспозвоночных, в частности, голотурий (Тимченко и др., 2004). При этом морские гидробионты не только сами страдают от инфекции, но и являются факторами передачи ее возбудителя. Поэтому необходимо разработать методы защиты животных от потенциальных инфекций. Однако особенности клеточного иммунного ответа голотурий на воздействие факторов патогенности иерсиний остаются мало изученными.
Одним из перспективных для выращивания в аквакультуре видов является голотурия Eupentacta fraudatrix (D’yakonov et Baranova, 1958) (Dendrochirotida, Sclerodactylidae). Ранее с использованием градиентного центрифугирования фагоциты голотурии, являющиеся аналогами макрофагов (Chia, Xing, 1996), были разделены на две фракции, Ф1 и Ф2 фагоциты. Было показано, что при воздействии TcТYp в фагоцитах голотурии E. fraudatrix происходит снижение уровня АФК (Dolmatova et al., 2003). TcТYp также вызывает сдвиг в соотношении маркеров двух типов фагоцитов голотурии – оксида азота, высокая концентрация которого характеризует Ф1 тип фагоцитов, и активности аргиназы, высокое значение которой характерно для Ф2 типа (Долматова и др., 2019).
Известно, что у позвоночных макрофаги могут приобретать провоспалительный (М1 макрофаги, “классически” активированные) или антивоспалительный (М2 макрофаги, “альтернативно” активированные) фенотипы в ответ на различные сигналы микроокружения. Макрофаги М1 играют ключевую роль в защите от бактериальных инфекций, а М2 макрофаги вовлечены в восстановление тканей. Два типа макрофагов имеют разные метаболические пути для генерации энергии, гликолиз преобладает в М1 типе, а окислительный метаболизм в – М2 типе клеток (Dolmatova, Dolmatov, 2020), и в их регуляции большое значение имеет восстановленный глутатион (GSH) (Peterson et al., 1998).
Сдвиг в соотношении активностей двух типов макрофагов в сторону преобладания активности М2 типа представляет собой стратегию подавления иммунитета хозяина, с участием некоторых бактериальных белковых токсинов, у ряда бактерий (Tsai et al., 2013; Merriman et al, 2015), в том числе, иерсиний (Bi et al., 2012).
Выявление сдвига в уровне маркеров двух типов фагоцитов голотурии при воздействии TcТYp (Долматова и др., 2019), позволило предположить, что, как и макрофаги позвоночных, два типа фагоцитов играют различную роль в антибактериальной защите.
Цель данного исследования - выявление особенностей влияния ТсТYp на некоторые функциональные, метаболические и фенотипические показатели двух типов фагоцитов голотурии E. fraudatrix.
Работа написана по материалам доклада, представленного на 10-ой Европейской конференции по иглокожим, которая проходила 16–19 сентября 2019 г. в Москве.
МАТЕРИАЛЫ И МЕТОДЫ
Экземпляры голотурии E. fraudatrix с длиной тела от 4 до 6 см были собраны в зимний период в бухте Восток (залив Петра Великого Японского моря) с использованием легководолазного снаряжения. Голотурий выдерживали в аквариуме с проточной аэрируемой морской водой в течение двух недель до начала экспериментов.
Для исследований in vitro (четыре независимых опыта) объединяли образцы целомической жидкости от 15–20 особей, после чего наслаивали на двухступенчатый градиент, ступени которого состояли из фиколл-верографина (1.078), разведенного антикоагулирующим раствором в два или три раза (v/v), как описано ранее (Долматова, Заика, 2007). Полученные после центрифугирования при 300 g в течение 15 мин суспензии фагоцитов с меньшей (Ф1 фагоциты) и большей (Ф2 фагоциты) плотностью отмывали дважды в фосфатно-солевом буфере (pH 7.6) с добавлением 36 г/л NaCl (ФСБН) и ресуспендировали в модифицированной среде 199 как описано ранее (Dolmatova et al., 2003). Концентрацию клеток определяли в камере Горяева; жизнеспособность – методом исключения трипанового синего.
ТсТYp изолировали из штамма 512 I серовара Y. pseudotuberculosis (коллекция НИИ эпидемиологии и микробиологии им. Г.П. Сомова). Выделение и очистку ТсТYp проводили методами, описанными ранее (Тимченко и др., 2004).
Для исследования эффектов ТсТYp в каждую лунку круглодонного планшета вносили по 1 мл суспензии фагоцитов с концентрацией 1 × 106 кл/мл. Инкубацию клеток проводили при комнатной температуре в течение 1 или 24 ч. ТсТYp использовали в конечных концентрациях 0.2, 0.5 и 2 мкг/мл. В отдельной серии экспериментов исследовали влияние ТсТYp (0.15 мкг/мл) на концентрацию GSH через 24 ч инкубации. В контрольные лунки вместо исследуемых препаратов вносили ФСБН.
По окончании экспериментов в части полученных суспензий клеток определяли жизнеспособность, еще одну часть суспензии замораживали при –80°С для последующего определения концентрации GSH. Из порции клеток выделяли ДНК с использованием 4М гуанидин гидрохлорида в качестве депротеинизирующего агента (Sigma-Aldrich, США) (Pramanick et al., 1976).
Для последующего определения конденсации хроматина еще одну порцию осадка клеток (0.3–0.5 × 106 кл/мл) фиксировали 4%-ным формалином и хранили при 4°С.
Кроме того, часть клеток для последующего анализа связывания растительных лектинов фиксировали 1%-ным глутаральдегидом в ФСБН и хранили при 4°C.
Для исследования апоптоза использовали такие маркеры, как фрагментация ДНК и конденсация хроматина. Фрагментацию ДНК изучали методом горизонтального электрофореза ДНК в 1%-ном агарозном геле в трис-боратном буфере (pH 8.3) с последующим окрашиванием геля бромистым этидием. В качестве маркера мол. массы использовали синтетический ДНК-маркер (“Сибэнзим”, Россия). Для учета апоптоза по конденсации хроматина проводили окрашивание отмытых от формалина клеток Hoechst 33342 (Sigma-Aldrich) (1 мкг/мл в ФСБН) как описано Комацу с соавт. (Komatsu et al., 1998). Образцы анализировали, используя микроскоп Leica DM 4500 (Weltzlar, Германия). В каждой повторности исследовали не менее 100 клеток.
Для определения экспрессии поверхностных рецепторов фагоцитов использовали окрашивание отмытых от глутаральдегида клеток ФИТЦ-конъюгированными растительными лектинами (ICN Biomedicals, Германия) из Arachis hypogaea (PNA), Glycin max (SBA), Dolichos biflorus (DBA) и Canavalia ensiformis (con A), которые специфично связываются с Galβ1–3GalNAc, GalNAcα1–3GalR, GalNAc и α-D-маннопиранозидами соответственно (Гнедкова и др., 2015). Окрашивание проводили по методу, описанному Мак Кензи, Престон (McKenzie, Preston, 1992). Флуоресценцию конъюгатов изучали с ипользованием микроскопа Leica DM 4500 (Weltzlar, Германия). Уровень связывания лектинов с поверхностными рецепторами фагоцитов оценивали по процентному содержанию клеток с зонами яркой зеленой флуоресценции. Ядра клеток визуализировали с помощью окраски DAPI (Merсk, Германия). В каждой повторности исследовали не менее 100 клеток.
Анализ содержания восстановленного глутатиона проводили с использованием в качестве деприватизационного реагента реактива Эллмана (5,5'-дитиобис-(2-нитробензойная кислота) (ДТНБ) по модифицированному методу Фратернале с соавт. (Fraternale et al., 2013). Клетки лизировали в 120 мкл лизирующего буфера (0.1%-ный тритон Х-100, 0.1 М Na2HPO4, 5 mM EDTA, pH 7.5), добавляли 16 мкл 0.1 н НСl и половинный объем осаждающего раствора (1.67 г ледяной ортофосфорной кислоты, 0.2 г Na2EDTA, 30 г NaCl в 100 мл раствора). После центрифугирования (10 000 × g, 10 мин) отбирали супернатант, разносили его в лунки 96-луночного планшета (две опытных и две контрольных параллели на каждую пробу). В каждую лунку вносили 25% (v/v) 0.3 М фосфорной кислоты и 10% по объему 1%-ного цитрата натрия (контроль) или ДТНБ (1 мМ) в 1%-ном растворе цитрата натрия (опыт). Через 5 мин измеряли оптическую плотность растворов на планшетном спектрофотометре STAT Fax 2100 (Awarness Technology Inc., США) при 402 нм. Концентрацию GSH в пробе определяли по калибровочной кривой со стандартом GSH (Sigma-Aldrich, США), построенной в диапазоне концентраций 12.5–100 мкМ.
Концентрацию белка в пробах измеряли с использованием красителя Кумасси G-250 (Sigma-Aldrich).
Работа частично выполнена с использованием оборудования Дальневосточного центра электронной микроскопии ННЦ морской биологии ДВО РАН.
Статистический анализ проводили с использованием программного обеспечения GraphPad InStat, v. 3.01 (GraphPad Software, Inc.). Полученные данные представлены как средние значения ± средняя ошибка измерений. Достоверность различий определяли с использованием t-критерия Стьюдента. Разницу между группами считали достоверной при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Апоптоз фагоцитов голотурии E. fraudatrix в норме и при действии TcTYp. Апоптоз макрофагов является одним из видов их смерти, ассоциированной с осуществлением микробицидной активности (Molloy et al., 1994).
С помощью электрофореза ДНК в агарозном геле выявлено, что в свежевыделенных клетках фрагментация ДНК значительно более выражена в фагоцитах второго типа по сравнению с таковой в первом типе. Такое же соотношение в уровнях фрагментации ДНК сохранялось в фагоцитах и через 24 ч инкубации (рис. 1а). Оценка апоптоза по конденсации хроматина показала, что в количественном отношении уровень последней в свежевыделенных Ф2 фагоцитах превышал таковую в Ф1 клетках в 1.9 раза (рис. 1б, 1в).
Рис. 1.
Маркеры апоптоза в Ф1 и Ф2 фагоцитах голотурии E. fraudatrix в контроле и при воздействии ТсТYp in vitro. (а) – фрагментация ДНК в свежевыделенных (0 ч) фагоцитах и через 24 ч инкубации. Стрелочками указаны маркеры молекулярной массы ДНК (п.н.); (б) – микрофотографии ядер свежевыделенных фагоцитов, окрашенных Hoechst 33342. Левая панель – Ф1 фагоциты, правая – Ф2 фагоциты. Здесь и далее увеличение х200, масштаб: 20 мкм; (в) – % ядер с конденсацией хроматина в свежевыделенных фагоцитах; (г) и (д) – микрофотографии ядер Ф1 и Ф2 фагоцитов, окрашенных Hoechst 33342, через 1 (г) и 24 ч (д) инкубации с ТсТYp (0, 0.2, 0.5, 2 мкг/мл); (е) – % ядер с конденсацией хроматина в Ф1 и Ф2 фагоцитах при воздействии ТсТYp через 1 ч; (ж) – % ядер с конденсацией хроматина в Ф1 и Ф2 фагоцитах при воздействии ТсТYp через 24 ч. * – P < 0.05 по сравнению с контролем.

Через 1 ч инкубации конденсация хроматина в Ф2 фагоцитах была выше таковой в фагоцитах Ф1 в 1.8 раза (рис. 1г, 1е). При этом добавление в среду инкубации ТсТYp через 1 ч вызывало статистически значимое изменение (снижение) апоптоза в Ф1 фагоцитах только в максимальной концентрации 2 мкг/мл, а в Ф2 фагоцитах, напротив, стимулировало апоптоз, но только в концентрации 0.5 мкг/мл.
Через 24 ч также сохранялось значительное превышение (в 2.1 раза) конденсации хроматина в Ф2 по сравнению с Ф1 клетками (рис. 1д, 1ж). При воздействии ТсТYp апоптоз в Ф1 снижался уже в концентрациях 0.2–0.5 мкг/мл, а при концентрации 2 мкг/мл возвращался к контрольному уровню. В Ф2 фагоцитах токсин в этот период проявил лишь тенденцию к стимулированию апоптоза во всех исследованных концентрациях.
Влияние TcTYp на уровень GSH. Существует тесная связь между уровнем антиоксидантной защиты и развитием апоптоза (Jeong, Joo, 2016), и уровень GSH в клетках является ключевым звеном в поддержании оксидантно-антиоксидантного баланса (Fraternale et al., 2017). Различный уровень GSH в макрофагах двух типов связан с регуляцией их метаболизма (Peterson et al., 1998). Для выявления значения GSH в развитии апоптоза фагоцитов голотурии было определено влияние TcTYp в концентрации 0.15 мкг/мл на содержание GSH в двух типах фагоцитов. Концентрация GSH в Ф1 фагоцитах через 24 ч инкубации была в 1.6 раза выше, чем в Ф2 фагоцитах. При этом TcTYp вызывал снижение уровня GSH (в 1.6 раза) в Ф1, но не в Ф2 фагоцитах, где отмечена лишь тенденция к снижению (рис. 2).
Рис. 2.
Влияние ТсТYp на концентрацию GSH в Ф1 и Ф2 фагоцитах через 24 ч инкубации.* – P < 0.05 по сравнению с контролем; ** – P < 0.05 по сравнению с Ф1.

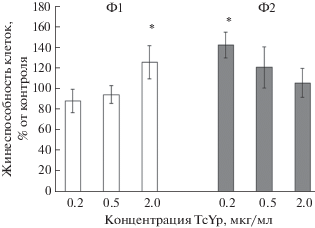
Влияние TcTYp на жизнеспособность фагоцитов. Несмотря на различные тенденции в изменениях апоптоза в Ф1 и Ф2 фагоцитах при воздействии ТсТYp через 24 ч, жизнеспособность обоих типов фагоцитов при действии ТсТYp не изменялась или даже имела тенденцию к возрастанию по сравнению с контролем. Так, жизнеспособность Ф1 фагоцитов через 24 ч при концентрациях ТсТYp 0.2 и 0.5 мкг/мл имела тенденцию к снижению по сравнению с контролем, а при концентрации 2 мкг/мл была достоверно повышена.
В Ф2 фагоцитах отмечено достоверное возрастание жизнеспособности по сравнению с контролем только при 0.2 мкг/мл ТсТYp, а с возрастанием концентрации отмечена тенденция к снижению жизнеспособности (рис. 3).
Рис. 3.
Жизнеспособность Ф1 и Ф2 фагоцитов при воздействии ТсТYp через 24 ч инкубации.* – P < 0.05 по сравнению с контролем.
Характеристика фенотипов фагоцитов Ф1 и Ф2 в норме и при воздействии TcTYp. Как свидетельствуют микрофотографии клеток, окрашенных ФИТЦ-мечеными лектинами (рис. 4) и результаты определения процентного содержания окрашенных лектинами клеток (рис. 5а), среди свежевыделенных фагоцитов Ф1 и Ф2 меченые сon А клетки обнаружены в одинаковой пропорции. Уровни связывания con А сохранялись одинаковыми для двух типов клеток в различные сроки инкубирования, при этом они не изменялись по сравнению со свежевыделенными клетками через 1 ч, но значительно снижались, более чем в 2 раза, через 24 ч.
Рис. 4.
Микрофотографии свежевыделенных (0 ч) и контрольных (1 и 24 ч инкубации) фагоцитов, окрашенных ФИТЦ-мечеными лектинами, в проходящем свете и при зеленой флуоресценции, а также ядер фагоцитов, окрашенных DAPI (синяя флуоресценция).
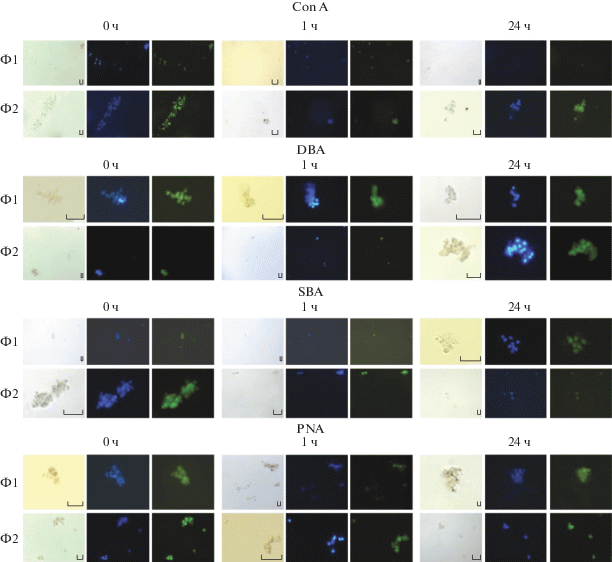
Рис. 5.
(а) – доля (%) фагоцитов Ф1 и Ф2, связывающих растительные лектины соn A, DBA, SBA и PNA в свежевыделенных и контрольных инкубируемых фагоцитах; (б) – доля (%) фагоцитов Ф1 и Ф2 (по отношению к контролю), связывающих растительные лектины при воздействии ТсТYp после 1 и 24 ч инкубации. * – P < 0.05 по сравнению с контролем; ** – P < 0.01 по сравнению с контролем.

Для DBA в свежевыделенных фагоцитах отмечена тенденция к более низкому связыванию Ф2 фагоцитами по сравнению с таковым Ф1 клетками. В последующие сроки инкубации эта разница становилась достоверной.
Свежевыделенные Ф1 фагоциты связывали SBA в самой низкой пропорции по сравнению с другими изученными лектинами. При этом связывание в Ф2 фагоцитах было значительно выше, чем в Ф1. Уровень связывания SBA в Ф1 фагоцитах возрастал через 1 ч инкубации в 2 раза, но к 24 ч возвращался к исходному значению. В Ф2 фагоцитах уровень связывания лектина, напротив, не изменялся через 1 ч инкубации, а к 24 ч возрастал в 2.4 раза по сравнению с уровнем в свежевыделенных фагоцитах.
Для PNA также отмечена тенденция к более высому уровню связывания в свежевыделенных Ф2 фагоцитах по сравнению с таковым в Ф1. Через 1 ч эта разница становилась достоверной (четырехкратное превышение в Ф2 фагоцитах по сравнению с Ф1 клетками). Однако через 24 ч соотношение связывания PNA в Ф1 и Ф2 фагоцитах менялось на противоположное, и уровень связывания в Ф2 фагоцитах был в 1.5 раза ниже, чем в Ф1 клетках.
Введение в икубационную среду TcTYp вызывало изменения в связывании растительных лектинов, которое зависело как от концентрации TcTYp, так и от времени его воздействия и типа фагоцитов (рис. 5б). Так, через 1 ч TcTYp в самой низкой концентрации (0.2 мкг/мл) не оказывал влияния на связывание con A по сравнению с контролем ни в одном типе фагоцитов. В концентрации 0.5 мкг/г TcTYp в этот же период значительно снижал уровень связывания кон А также в обоих типах фагоцитов, а при концентрации 2 мкг/мл в обоих типах фагоцитов отмечена тенденция к возвращению (в Ф1) или возвращение (в Ф2) к контрольному уровню. Однако через 24 ч TcTYp стимулировал связывание сon A в Ф1 фагоцитах в прямой концентрационной зависимости, но не оказывал влияния в Ф2 фагоцитах. Таким образом изменения, вызывамые TcTYp, были сходны в Ф1 и Ф2 фагоцитах через 1 ч инкубации, но через 24 ч они приобретали противоположную направленность по сравнению с одночасовым периодом в Ф1 фагоцитах, а в Ф2 типе клеток связывание con A возвращалось к контрольному уровню.
На связывание DBA TcTYp (0.2–0.5 мкг/мл) оказывал ингибирующее действие в Ф1 фагоцитах уже в концентрации 0.2 мкг/мл как через 1 ч, так и через 24 ч инкубации. На связывание DBA в Ф2 фагоцитах TcTYp не оказывал влияния ни в один из периодов инкубации.
Таким образом, TcTYp влиял на экспрессию рецепторов к con А и DBA преимущественно в Ф1 фагоцитах, но не в Ф2 клетках.
При этом через 24 ч инкубации TcTYp стимулировал связывание SBA в Ф1 фагоцитах, максимально при 0.5 мкг/мл, но ингибировал в Ф2 клетках (максимально – при 0.2 мкг/мл). Таким образом, связывание в Ф1 и Ф2 фагоцитах этого лектина, по уровню которого два типа свежевыделенных и контрольных фагоцитов максимально отличались, при действии TcTYp имело противоположную направленность.
Напротив, изменения в связывании фагоцитами двух типов PNA под действием TcTYp носили однонаправленный характер. TcTYp (0.5–2 мкг/мл) вызывал в них возрастание связывания в прямой концентрационной зависимости через 1 ч и в обратной концентрационной зависимости через 24 ч инкубации. Однако интенсивность связывания лектина рецепторами Ф1 фагоцитов снижалась через 24 ч по сравнению с 1 ч, а связывание Ф2 фагоцитами через 24 ч было выше, чем через 1 ч.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Известно, что макрофаги находятся на первой линии защиты от бактериальных инфекций, и важнейшей их реакцией является синтез продуктов, убивающих бактерии – АФК, прежде всего, супероксиданиона и оксида азота (Brune et al., 2013). Однако продукция этих агрессивных молекул опасна и для самой клетки, поскольку увеличение синтеза АФК часто коррелирует с развитием апоптоза и последующей гибелью клетки. При этом в отношении влияния на апоптоз иммунных клеток хозяина бактерии используют различные стратегии выживания: у некоторых бактерий она направлена на выживание внутри клеток хозяина, и отмечена прямая зависимость вирулентности от их способности ингибировать апоптоз, у других, напротив, отмечено распространение инфекции в организме благодаря гибели макрофагов путем апоптоза. При этом отмечается, что одна и та же бактерия может использовать разные стратегии на различных стадиях инфекции (Aguiló et al., 2013).
Показано, что иерсинии могут использовать стратегию колонизации новых клеток хозяина, индуцируя апоптоз (Monack, Falkow, 2000), и эффекторный белок системы секреции III типа (T3SS) фактор вирулентности YopJ может участвовать в реализации механизмов индукции апоптоза (Zhang et al., 2005). Токсины иерсиний также играют роль в вирулентности бактерий (Ценева и др., 2002), но механизмы их влияния мало изучены.
Исследования фрагментации ДНК и конденсации хроматина в настоящей работе выявили, что в свежевыделенных Ф1 фагоцитах уровень апоптоза был значительно ниже, чем в Ф2 фагоцитах. Сходным образом, более низкая чувствительность к апоптозстимулирующим факторам отмечена в М1 макрофагах по сравнению с М2 типом клеток (Kurian, Cunoosamy, 2014). Такое соотношение уровней апоптоза в двух типах фагоцитов сохранялось в контроле и в последующие сроки инкубации.
Введение ТсТYp в среду инкубации увеличивало разницу между уровнем апоптоза в Ф1 и Ф2 фагоцитах в пользу последних, как через 1 ч, так и через 24 ч концентрационно-зависимым образом. Особенно выражена была разница (в 5 раз) через 24 ч при концентрации ТсТYp 0.5 мкг/мл. Асимметричное действие на апоптоз макрофагов, с повышением в М2 макрофагах по сравнению с таковым в М1 типе, отмечается также при действии некоторых бактерий (Atri et al., 2018).
Ранее было показано, что Ф1 фагоциты голотурии обладают более высоким уровнем продукции АФК (супероксиданионрадикала и оксида азота), чем Ф2 фагоциты, а ТсТYp снижал продукцию АФК именно в Ф1 фагоцитах (Долматова и др., 2019). Снижение уровня апоптоза в Ф1 клетках, обнаруженное в настоящй работе, по-видимому, учитывая связь между продукцией АФК и апоптозом (Aguiló et al., 2013; Brune et al., 2013), является следствием снижения оксидантного стресса в Ф1 и подтверждает ранее высказанное (Долматова и др., 2019) предположение о том, что ТсТYp снижает киллерную активность наиболее микробицидного типа фагоцитов голотурии.
Известно, что Y. pseudotuberculosis вызывает сдвиг поляризации макрофагов по М2 пути, и в этом процессе могут участвовать YopJ или другие еще не установленные факторы. Такой сдвиг приводит к снижению бактерицидной активности макрофагов и, по-видимому, играет важную роль в иммуносупрессивной стратегии Y. pseudotuberculosis (Bi et al., 2012). ТсТYp способен вызывать сдвиг в фунциональной активности фагоцитов голотурии также в пользу преобладания менее бактерицидного типа, что свидетельствует о том, что он может быть одним из факторов, обеспечивающих вирулентность бактерии для голотурий. Кроме того, эти данные свидетельствуют в пользу высказанного ранее предположения о том, что Ф1 и Ф2 фагоциты являются аналогами М1 и М2 макрофагов (Dolmatova, Dolmatov, 2018; Долматова и др., 2019). О том, что фагоциты голотурий могут приобретать М2-подобный фенотип, свидетельствуют также данные об обнаружении стимуляции аргиназы различными стимулами в макрофагах без участия синтезируемых Th2 цитокинов IL-4/IL-13 (Dzik, 2014), что свидетельствует об эволюционно древнем механизме регуляции иммунного ответа, связанном с активацией аргиназы.
Вместе с тем, необходимо отметить, что функциональная разница между М1 и М2 макрофагами основана на разных метаболических путях получения энергии (Dolmatova, Dolmatov, 2020), в регуляции которых участвует GSH. Он является главным небелковым тиолом, отвечающим за поддержание клеточного гомеостаза и окислительно-восстановительного баланса (Morris et al., 2013). При этом в М1 макрофагах концентрация GSH превышает таковую в М2 макрофагах, а снижение уровня GSH способствует поляризации макрофагов в сторону М2 типа (Peterson et al., 1998).
Ранее было показано, что уровень антиоксидантной ферментативной активности значительно выше в контрольных Ф1 фагоцитах по сравнению с таковым в Ф2 типе, и также значительно выше в Ф1 фагоцитах была активность глутатионредуктазы (ГР) через 24 ч действия ТсТYp (Долматова и др., 2019). Поскольку ГР обеспечивает восстановление пула GSH при оксидантном стрессе (Чеснокова и др., 2006), это свидетельствовало в пользу предположения о поддержании концентрации GSH в Ф1 фагоцитах на более высоком уровне, чем в Ф2. Проверка этого предположения в настоящей работе показала, что через 24 ч инкубации в отсутствие ТсТYp уровень GSH в Ф1 фагоцитах двукратно превышал таковой в Ф2 фагоцитах, при этом ТсТYp в минимальной концентрации снижал уровень GSH в Ф1 до такового в Ф2, но не влиял на содержание GSH в Ф2 по сравнению с контролем. Таким образом, фагоциты Ф1 содержат GSH в значительно большей концентрации, чем в Ф2 клетках, при этом при воздействии ТсТYp этот показатель меняется до уровня, характеризующего Ф2 фагоциты, что также свидетельствует в пользу наличия метаболического сдвига Ф1 фагоцитов в сторону Ф2 клеток. Снижение уровня GSH происходит и в макрофагах при действии ряда бактерий (Morris et al., 2013), что приводит к увеличению их выживаемости в клетках хозяина (Cao et al., 2018).
Исследования связи между уровнем GSH и смертью клетки показали, что в различных типах клеток недостаток GSH может сопровождаться апоптозом, некрозом и аутофагией (Sun et al., 2018). В настоящей работе в диапазоне концентраций ТсТYp 0.2–2 мкг/мл не отмечено возрастания апоптоза через 24 ч в Ф1 фагоцитах, поэтому снижение уровня GSH, по видимому, не стимулировало гибель клеток по апоптотическому пути. В то же время значительно более низкая концентрация GSH и более высокий уровень апоптоза в Ф2 по сравнению с таковыми в Ф1 свидетельствуют в пользу ранее высказанного предположения о том, что эти клетки более чувствительны к дефициту GSH, который может влиять на возрастание в Ф2 фагоцитах апоптоза (Dolmatova, Dolmatov, 2018).
Не было выявлено также положительной корреляции между жизнеспособностью и апоптозом фагоцитов, при этом зависимость жизнеспособности от концентрации ТсТYp носила в двух типах фагоцитов противоположный характер.
Необходимо принять во внимание, что различные механизмы смерти могут осуществляться в клетке одновременно и блокирование одного типа может стимулировать другой путь (Mariño et al., 2014). Аутофагия и апоптоз являются функционально различными механизмами для удаления или разрушения цитоплазматических структур внутри клетки или клеток внутри организма, соответственно. Аутофагия может защищать клетки от апоптоза и способствовать очищению от апоптотических клеток путем эффероцитоза. При этом активация аутофагии приводит к поляризации макрофагов по 2-му типу (Haloul et al., 2019). По аналогии с макрофагами, на основании отсутствия связи между апоптозом и уровнем GSH и жизнеспособностью, и при этом выявленной трансформацией Ф1 фагоцитов в сторону приобретения функциональных черт Ф2 типа, можно предположить, что преобладающим механизмом смерти Ф1 фагоцитов при действии ТсТYp является аутофагия. Необходимы дальнейшие исследования по влиянию ТсТYp на различные виды смерти клеток для понимания механизмов его действия на фагоциты.
Макрофаги М1 и М2 отличаются между собой не только функционально, но и фенотипически. М1 макрофаги имеют, в частности, такие поверхностные маркеры, как CD80, CD86, CD14, а М2 макрофаги-CD206 (Bi et al., 2012; Dolmatova, Dolmatov, 2020). Инфицирование Y. pseudotuberculosis снижало экспрессию CD80 и CD86 макрофагами, что соответствовало представлению о преобладании М2 типа в популяции макрофагов (Bi et al., 2012). По-видимому, оценка маркеров фагоцитов Ф1 и Ф2 также может быть полезной для оценки механизма действия ТсТYp.
Фагоциты беспозвоночных (как и позвоночных) экспрессируют рецепторы к лигандам, находящимся на поверхности микробов. Однако проблема фенотипирования фагоцитов беспозвоночных является на сегодняшний день нерешенной, у беспозвоночных не выявлены маркеры, схожие с таковыми у позвоночных, а возможности типирования разных субпопуляций/типов фагоцитов недостаточно исследованы. Наиболее часто используемый подход к изучению маркеров поверхности фагоцитов беспозвоночных – использование меченых флуоресцентным красителем растительных лектинов, связывающихся с определенными углеводными остатками белков на поверхности клеток. Многие лектины избирательно связываются с клетками представителей разных таксонов и видов. На примере Mytilus edulis было установлено, что некоторые субпопуляции фагоцитов красились разными лектинами в зависмости от размеров гранул клеток (Pipe, 1990), что указывало на возможность фенотипирования отдельных типов лейкоцитов.
При этом необходимо отметить, что связывание того или иного растительного лектина с разными типами фагоцитов не носило уникальный характер, и разные типы фагоцитов отличались лишь по степени экспрессии лигандов для этих лектинов, как это отмечено и для фенотипических маркеров M1 и M2 макрофагов (Сахно и др., 2015), что, по-видимому, связано с пластичностью состояния фагоцитов.
В данной работе показано, что у голотурии E. fraudatrix свежевыделенные фагоциты Ф1 и Ф2 связывают некоторые растительные лектины с разной интенсивностью, при этом доли связывающих con A и PNA Ф1 и Ф2 фагоцитов достоверно не отличались. Однако фагоциты отличались между собой по связыванию SBA (связывание в Ф2 было значительно выше, чем в Ф1) и DBA (тенденция к превышению уровня связывания в Ф1 по сравнению с Ф2 клетками). Эти данные сходны с ранее полученными результатами (Dolmatova, Dolmatov, 2018), за исключением данных об экспрессии рецепторов к SBA, которая в указанной работе была выше в Ф1 фагоцитах по сравнению с Ф2 клетками. Основываясь на этих данных, характеристики связывания DBА клетками двух типов можно считать наиболее постоянными, и соотношение в экспрессии рецепторов с GalNAc-остатками может быть использовано для маркирования двух типов фагоцитов.
При этом степень различия в экспрессии рецепторов к DBА, SBA и PNA, но не con A как между двумя типами клеток, так и по сравнению с таковыми в свежевыделенных клетках, возрастала уже через 1 ч инкубации.
При инкубации с TcTYp выраженность экспрессии поверхностных рецепторов к лектинам менялась, а направленность изменений во многих случаях носила протвоположный характер в двух типах фагоцитов. Так, для con A соотношение в долях связывания двумя типами фагоцитов изменялось только через 24 ч, с преимущественным увеличением в Ф1 фагоцитах, что свидетельствует о том, что происходил сдвиг в связывании этого лектина преимущественно Ф1 фагоцитами как по сравнению со свежевыделенными фагоцитами, так и по сравнению с одночасовым периодом воздействия TcTYp. Соотношение же долей связывания DBА в двух типах фагоцитов при действии TcTYp менялось на протвоположное по сравнению с контролем (снижение доли в Ф1 при неизменности в Ф2), менялось также на протвоположное по сравнению с контролем соотношение долей связывания SBA двумя типами фагоцитов (возрастание в Ф1 и снижение в Ф2),
Соотношение связывания PNA в двух типах фагоцитов, в отличие от такового для con A, через 24 ч не менялось, но через 1 ч носило характер, противоположный контрольному (возрастание экспрессии в Ф1, но не в Ф2). Таким образом, TcTYp индуцировал приобретение фагоцитами Ф1 фенотипических черт, свойственных Ф2 фагоцитам в отношении связывания DBА и PNA, без изменения фенотипа Ф2. При этом он вызывал приобретение обоими типами фагоцитов фенотипической особенности противоположного типа клеток в отношении связывания SBA. Ранее было показано, что при воздействии ТсТYp в обоих типах фагоцитов происходило изменение уровня их маркеров (оксида азота и активности аргиназы) в сторону приобретения признаков другого типа клеток, что сопровождалось функциональной стимуляцией преимущественно фагоцитов второго типа (Долматова и др., 2019). Полученные данные свидетельствуют о том, что TcТYp меняет не только функциональные, но и фенотипические маркеры Ф1 и Ф2 фагоцитов, стимулируя появление у Ф1 фагоцитов особенностей Ф2 клеток.
Сравнение уровней апоптоза в двух типах контрольных фагоцитов и экспрессии поверхностных рецепторов к DBА свидетельствует о том, что окраска лектином не была избирательна по отношению к апоптотическим клеткам, более того, лектин связывался в большей степени с Ф1 клетками, в которых апоптоз был менее выражен, чем в Ф2 фагоцитах. Однако изменение соотношения экспрессии поверхностных рецепторов фагоцитов к DBА при воздействии ТсТYp соответствовало динамике соотношения апоптоза в обоих типах клеток, лектин связывался в большей мере с клетками с наибольшим уровнем апоптоза. В то же время экспрессия рецепторов фагоцитов к SBA была значительно больше в клетках с наиболее выраженным апоптозом в свежевыделенных фагоцитах, но при воздействии TcTYp наибольший уровень связывания лектина происходил в клетках с наименьшим уровнем апоптоза. Такие изменения в определенной мере соответствуют существующей концепции о том, что DBA является апоптотическим, а SBA-антиапоптотическим маркером клеток (Dini et al., 1993; Kim et al., 2014).
Предполагается, что рецепторы, содержащие маннановые остатки, связаны с реализацией апоптоза, а сами остатки являются маркерами апоптотических клеток (Shi et al., 2017). При этом есть данные, что при реализации аутофагии также экспрессируются маннановые остатки (Lai et al., 2015). Возможно, что особенности связывания соn А с фагоцитами обусловлены не столько апоптозом, сколько аутофагией клеток, обеспечивающей жизнеспособность клеток. В пользу этого предположения свидетельствует сходство динамики жизнеспособности клеток с динамикой экспресии рецепторов к con А.
Ранее Секо-Ровира с соавт. (Seco-Rovira et al., 2013) выявили аффинность PNA к апоптотическим макрофагам. Однако в настоящей работе не обнаружено определенной зависимости между связыванием PNA фагоцитами двух типов и развитием в них апоптоза при действии TcTYp, что, наряду со слабой изученностью участия рецепторов с Galβ1–3GalNAc-остатками в развитии апоптоза, не позволяет сделать вывод о значении этих рецепторов в механизмах действия TcTYp в фагоцитах голотурии.
ЗАКЛЮЧЕНИЕ
В настоящей работе продемонстрированы особенности концентрационно-зависимого (0.2–2 мкг/мл) и зависящего от времени (1 ч и 24 ч) действия термостатабильного токсина бактерии Y. рseudotuberculosis на апоптоз в двух типах фагоцитов голотурии E. fraudatrix и оценена возможая роль апоптоза в механизмазх гибели фагоцитов при действии ТсТYp. Установлено, что в Ф1 фагоцитах уровень апоптоза был значительно ниже, чем в Ф2, как в свежевыделенных клетках, так и при инкубации. Добавление ТсТYp вызывало разнонаправленные изменения в апоптозе Ф1 и Ф2 фагоцитов, с преимущественным ингибированием его уровня в Ф1 и возрастанием в Ф2 фагоцитах, различия были наиболее выражены через 24 ч инкубации, при концентрации ТсТYp 0.5 мкг/мл. Учитывая тесную связь апоптоза с функциональной активностью клеток, эти данные свидетельствуют о преимущественной активации Ф2 фагоцитов. При этом значительное превышение содержания GSH в интактных Ф1 фагоцитах по сравнению с таковым в Ф2 типе соответствует представлениям об апоптоз-протекторной роли GSH в клетках и указывает на наличие различий в метаболизме двух типов фагоцитов. Однако при действии ТсТYp снижение концентрации GSH в Ф1, но не Ф2 свидетельствовало о том, что изменения в уровне апоптоза в Ф1 клетках при воздействии токсина не зависели напрямую от уровня GSH. Сходным образом, не установлено закономерности в зависимости жизнеспособности Ф1 и Ф2 фагоцитов от колебаний апоптоза в клетках. По-видимому, ТсТYp способен включать в фагоцитах другие механизмы клеточной смерти, направленные на преимущественное выживание Ф2 фагоцитов.
Исследование с помощью ФИТЦ-меченых растительных лектинов особенностей экспрессии поверхностных клеточных рецепторов интактных и контрольных фагоцитов выявило сходный уровень экспрессии рецепторов к con A и PNA в двух типах фагоцитов. Однако выявлены различия в экспрессии рецепторов к DBA и SBA, уровень которой был выше в Ф1 фагоцитах по сравнению с Ф2 для первого лектина и, наоборот, ниже в Ф1 фагоцитах для второго, что говорит о возможности использования этих лектинов для маркирования двух типов фагоцитов. Инкубация фагоцитов с TcТYp вызывала изменения в соотношении уровней экспрессии к лектинам в двух типах фагоцитов, что свидетельствует о том, что фагоциты Ф1 приобретают фенотипические признаки Ф2 фагоцитов, а в отношении экспрессии рецепторов к SBA оба типа фагоцитов приобретали фенотип, характерный для другого типа клеток. Анализ направленности изменений в связывании лектинов клетками позволяет сделать вывод о том, что ТсТYp вызывал преимущественно трансформацию фенотипа Ф1 фагоцитов в Ф2 фенотип.
Таким образом, полученные результаты свидетельствуют о наличии функциональных и фенотипических различий между Ф1 и Ф2 фагоцитами, которые, вместе с ранее полученными данными о том, что маркером Ф1 фагоцитов является оксид азота, а Ф2 фагоцитов – активность аргиназы, позволяют сделать вывод о том, что Ф1 и Ф2 фагоциты играют различную роль в иммунном ответе, подобно М1 и М2 макрофагам позвоночных.
При этом действие TcTYp было направлено на снижение функциональной активности фагоцитов Ф1 и увеличение активности Ф2 фагоцитов без снижения их жизнеспособности, со сдвигом фенотипа Ф1 фагоцитов в сторону приобретения фенотипа, свойственного Ф2 типу клеток. Вместе с ранее установленным фактом о повышенном уровне синтеза АФК в Ф1 по сравнению с Ф2 фагоцитами, это свидетельствует о способности TcТYp снижать активность наиболее микробицидных фагоцитов и увеличивать жизнеспособность иммунных клеток хозяина, что, по аналогии с макрофагами позвоночных, связано со стратегией выживаемости бактерий. Таким образом, ТсТYp является важным фактором перепрограммирования фагоцитов голотурий в сторону преобладания антивоспалительного типа, что может увеличивать вирулентность Y. рseudotuberculosis для голотурий.
В целом, установленные механизмы воздействия TcТYp на два типа фагоцитов голотурии свидетельствуют о наличии сходства некоторых клеточных механизмов иммуносупрессии, вызываемой Y. рseudotuberculosis, у голотурий и позвоночных.
Дальнейшие исследования нужны для исследования механизмов клеточной гибели у голотурий при действии TcТYp, что может быть полезно для моделирования эффектов TcТYp и разработки препаратов, таргетированных на подавление вирулентности Y. рseudotuberculosis.
Работа выполнена в рамках госзадания Министерства науки и высшего образования РФ (АААА-А17-117030110038-5).
Список литературы
Гнедкова И.А., Лисяный Н.И., Станецкая Д.Н., Розуменко В.Д., Главацкий А.Я., Шмелева А.А., Малышева Т.А., Черненко О.Г., Гнедкова М.А. Лектинсвязывающие и туморогенные свойства клеток глиомы С6 // Онкология. 2015. Т. 17. С. 4–11.
Долматова Л.С., Заика О.А. Апоптозмодулирующее действие простагландина Е2 в целомоцитах голотурии Eupentacta fraudatrix зависит от антиоксидантного ферментного статуса клеток // Изв. РАН. Сер. биол. 2007. № 2. С. 273–282.
Долматова Л.С., Уланова О.А., Тимченко Н. Ф. Термостабильный токсин бактерии Yersinia pseudotuberculosis дизрегулирует функциональную активность двух типов фагоцитов голотурии Eupentacta fraudatrix // Изв. РАН. Сер. биол. 2019. № 2. С. 115–126.
Сахно Л.В., Шевела Е.Я., Черных Е.Р. Фенотипические и функциональные особенности альтернативно активированнных макрофагов: возможное использование в регенеративной медицине // Иммунология. 2015. Т. 36. С. 242–246.
Тимченко Н.Ф., Недашковская Е.П., Долматова Л.С., Сомова–Исачкова Л.М. Токсины Yersinia pseudotuberculosis. Владивосток: Примполиграфкомбинат, 2004. 219 с.
Ценева Г.Я., Солодовникова Н.Ю., Воскресенская Е.А. Молекулярные аспекты вирулентности иерсиний // КМАХ. 2002. № 3. Т. 4. С. 248–266.
Чеснокова Н.П., Понукалина Е.В., Бизенкова М.Н. Молекулярно-клеточные механизмы инактивации свободных радикалов в биологических системах // Успехи соврем. естествознания. 2006. № 7. С. 29–36.
Aguiló N., Marinova D., Martín C., Pardo J. ESX-1-induced apoptosis during mycobacterial infection: to be or not to be, that is the question // Front. Cell Infect. Microbiol. 2013. V. 3. P. 88.
Atri Ch., Guerfali F.Z., Laouini D. Role of human macrophage polarization in inflammation during infectious diseases // Int. J. Mol. Sci. 2018. 19. 1801.
Bi Y., Wang X., Han Y., Guo Z., Yang R. Yersinia pestis versus Yersinia pseudotuberculosis: effects on host macrophages // Scand. J. Immunol. 2012. V. 76. P. 541–551.
Brune B., Dehne N., Grossmann N., Jung M., Namgaladze D., Schmid T., von Knethen, A., Weigert A. Redox control of inflammation in macrophages // Antioxid. Redox. Signal. 2013. V. 19. P. 595–637.
Cao R., Teskey G., Islamoglu H., Abrahem R., Munjal S., Gyurjian K., Zhong L., Venketaraman V. Characterizing the effects of glutathione as an immunoadjuvant in the treatment of tuberculosis // Antimicrob. Agents Chemother. 2018. 62:e01132–18.
Chia F.-S., Xing J. Echinoderm coelomocytes // Zool.Studies. 1996. V. 35. P. 231–254.
Danilova N. The evolution of immune mechanisms // J. Exp. Zool. (Mol. Dev. Evol.). 2006. V. 306B. P. 496–520.
Dini L., Falasca L., Lentini A., Mattioli P., Piacentini M., Piredda L., Autuori F. Galactose-specific receptor modulation related to the onset of apoptosis in rat liver // Eur. J. Cell Biol. 1993. V. 61. P. 329–337.
Dolmatova L.S., Dolmatov I.Yu. Lead induces different responses of two subpopulations of phagocytes in the holothurian Eupentacta fraudatrix // J. Ocean Univ. China. 2018. V. 17. P. 1391–1403.
Dolmatova L.S., Dolmatov I.Yu. Different macrophage type triggering as target of the action of biologically active substances from marine invertebrates // Mar. Drugs. 2020. 18, 37.
Dolmatova L.S., Eliseykina M.G., Timchenko N.F., Kovaleva A.L., Shitkova O.A. Generation of reactive oxygen species in the different fractions of the coelomocytes of holothurian Eupentacta fraudatrix in response to the thermostable toxin of Yersinia pseudotuberculosis in vitro // Chinese J. Oceanol. Limnol. 2003. V. 21. P. 293–304.
Dzik J.M. Evolutionary roots of arginase expression and regulation. Front. Immunol. 2014. V. 5. P. 544.
Fraternale A., Brundu S., Magnani M. Glutathione and glutathione derivatives in immunotherapy // Biol. Chem. 2017. V. 398. P. 261–275.
Fraternale A., Crinelli R., Casabianca A., Paoletti M., Orlandi Ch., Carloni E., Smietana M., Palamara A. Molecules altering the intracellular thiol content modulate NF-kB and STAT-1/IRF-1 signalling pathways and IL-12 p40 and IL-27 p28 production in murine macrophages // PLoS ONE. 2013. V. 8. № 3. Article ID e57866.
Haloul M., Oliveira E.R.A, Kader M., Wells J.Z., Tominello T.R., El Andaloussi A., Yates C.C., Ismail N. mTORC1-mediated polarization of M1 macrophages and their accumulation in the liver correlate with immunopathology in fatal ehrlichiosis // Scientific Reports. 2019. 9:14050.
Jeong C.H., Joo S.H. Downregulation of reactive oxygen species in apoptosis // J. Cancer Prev. 2016. V. 21 P. 13–20.
Kim S.-M., Fujihara M., Sahare M., Minami N., Yamada M., Imai H. Effects of extracellular matrices and lectin Dolichos biflorus agglutinin on cell adhesion and self-renewal of bovine gonocytes cultured in vitro // Reprod. Fertil. Dev. 2014. V. 26. P. 268–281.
Komatsu N., Oda T., Muramatsu T. Involvement of both caspase-like proteases and serine proteases in apoptotic cell death induced by ricin, modeccin, diphtheria toxin, and Pseudomonas toxin // J. Biochem. 1998. V. 124. P. 1038–1044.
Kurian N., Cunoosamy D. Differential sensitivity of subsets of monocyte-derived macrophages to apoptosis; its impact on lung inflammation // European Respiratory J. 2014. V. 44: P1470.
Lai Y., Chuang Y., Chang C., Yeh T.M. Macrophage migration inhibitory factor has a permissive role in concanavalin A-induced cell death of human hepatoma cells through autophagy // Cell Death Dis. 2015. 6(12): e2008.
Mariño G., Niso-Santano M., Baehrecke E.H., Kroemer G. Self-consumption: the interplay of autophagy and apoptosis // Nat. Rev. Mol. Cell Bio. 2014. V. 15. P. 81–94.
McKenzie A.N.J., Preston T.M. Functional studies on Calliphora vomitoria haemocyte subpopulations defined by lectin staining and density centrifugation // Devel. Compar. Immunol. 1992. V. 16. P. 19–30.
Merriman J.A., Klingelhutz A.J., Diekema D.J., Leung D.Y. Novel Staphylococcus aureus secreted protein alters keratinocyte proliferation and elicits a proinflammatory response in vitro and in vivo // Biochemistry. 2015. V. 54. P. 4855–4862.
Molloy A., Laochumroonvorapong P., Kaplan G. Apoptosis, but not necrosis, of infected monocytes is coupled with killing of intracellular bacillus Calmette-Guerin // J. Exp. Med. 1994. V. 180. P. 1499–1509.
Monack D., Falkow S. Apoptosis as a common bacterial virulence strategy // Int. J. Med. Microbiol. 2000. V. 290. P. 7–13.
Morris D., Carlos Guerra C., Khurasany M., Guilford F., Saviola B., Huang Y., Venketaraman.V. Glutathione supplementation improves macrophage functions in HIV // J. Interfer.Cytokine Res. 2013. V. 33. P. 270–279.
Netea M.G, Quintin J., van der Meer J.W.M. Trained immunity: a memory for innate host defense // Cell Host Microbe. 2011. V. 9. P. 355–361.
Peterson J.D., Herzenberg L.A., Vasquez K., Waltenbaugh C. Glutathione levels in antigen-presenting cells modulate Th1 versus Th2 response patterns. Proc. Natl. Acad. Sci. USA. 1998. V. 95. P. 3071–3076.
Pipe R. K. Differential binding of lectins to haemocytes of the mussel Mytilus edulis // Cell Tissue Res. 1990. V. 261. P. 261–268.
Pramanick D., Forstova J., Pivec L. 4 M guanidine hydrochloride applied to the isolation of DNA from different sources // FEBS Lett. 1976. V. 62. P. 81–84.
Seco-Rovira V., Beltrán-Frutos E., Ferrer C., Sánchez-Huertas M.M., Madrid J.F., Saez F.J., Pastor L.M. Lectin histochemistry as a tool to identify apoptotic cells in the seminiferous epithelium of Syrian hamster (Mesocricetus auratus) subjected to short photoperiod // Reprod. Domest. Anim. 2013. V. 48. P. 974–983.
Shi Z., Li W.W., Tang Y., Cheng L.J. A novel molecular model of plant lectin-induced programmed cell death in cancer // Biol. Pharm. Bull. 2017. V. 40. P. 1625–1629.
Sun Y., Zheng Y., Wang Ch., Liu Y. Glutathione depletion induces ferroptosis, autophagy, and premature cell senescence in retinal pigment epithelial cells // Cell Death and Disease. 2018. 9:753.
Tsai H.C., Wu R. Cholera toxin directly enhances IL-17A production from human CD4+ T cells // J. Immunol. 2013. V. 191. P. 4095–4102.
Zhang Y., Ting A.T., Marcu K.B., Bliska J.B. Inhibition of MAPK and NF-kappa B pathways is necessary for rapid apoptosis in macrophages infected with Yersinia // J. Immunol. 2005. V. 174. P. 7939–7949.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


