Известия РАН. Серия биологическая, 2021, № 5, стр. 486-494
Жизненный цикл трематоды Gynaecotyla adunca (Trematoda: Microphallidae) в Черном море
Ю. В. Белоусова *
ФГБУН ФИЦ “Институт биологии южных морей им. А.О. Ковалевского РАН”
299011 Севастополь, пр. Нахимова, 2, Россия
* E-mail: julls.belousova@gmail.com
Поступила в редакцию 17.04.2020
После доработки 14.07.2020
Принята к публикации 14.07.2020
Аннотация
В настоящей работе описаны полный жизненный цикл и стадии развития трематоды Gynaecotyla adunca (Linton, 1905) (Yamaguti, 1939) из двух различных биотопов. Показано, что в Черном море для трематод G. adunca первыми промежуточными хозяевами являются брюхоногие моллюски Hydrobia acuta (Draparnaud, 1805), а вторыми промежуточными – креветки Palaemon adspersus (Rathke, 1837). Окончательным хозяином, согласно нашим исследованиям, является серебристая чайка Larus argentatus (Pontoppidan, 1763). Приведены промеры, рисунки и морфологические характеристики данного вида трематоды на всех стадиях развития.
Семейство Microphallidae включает 30 родов, из которых 4 встречаются в Черном море. Род Gynaecotyla представлен одним видом G. adunca (Определитель паразитов…, 1975).
Впервые жизненный микрофаллидной трематоды цикл G. adunca в акватории Средиземного моря описал Превот (Prévot, 1974). Жизненный цикл G. adunca в Черном море пока неизвестен.
Средиземное море характеризуется большим спектром промежуточных хозяев для гельминтов, в то время как черноморская фауна хозяев является более бедной по сравнению со средиземноморской. Поэтому представляет интерес рассмотреть жизненный цикл и уточнить круг хозяев для трематоды G. adunca в акватории Черного моря.
В моллюсках Hydrobia acuta (Draparnaud, 1805) из Севастопольской (эстуарий р. Черная) и Казачьей бухт Севастополя нами обнаружены микрофаллидные церкарии, определенные первоначально как Cercaria sevillana (Russell-Pinto, Bartoli, 2002) [syn. C. misenensis Palombi, 1940 sensu Долгих, 1965)], а в креветках Palaemon adspersus (Rathke, 1837) – метацеркарии Gynaecotyla adunca (Linton, 1905) (Yamaguti, 1939) (Microphallidae) [syn. Gynaecotyla longiintestinata Leonov, 1958]. Недавние молекулярно-генетические исследования (Pina et al., 2007), основанные на сборах личинок трематод от ракообразных Carcinus maenas (Linnaeus, 1758) и моллюсков Nassarius reticulatus (Linnaeus, 1758) у побережья Португалии (эстуарий Авейру) показали, что Cercaria sevillana является личинкой микрофаллидной трематоды G. adunca.
Род Gynaecotyla (Yamaguti, 1939) описан в 1939 г. (Rankin, 1939) под названием Cornucopula (Rankin, 1939); созданный Ранкином новый род отличался от остальных представителей Microphallidae наличием двух брюшных присосок и строением копулятивного органа. В 1940 г. Ранкин (Rankin, 1940) определяет роды Cornucopula и Gynaecotyla как синонимы, а также впервые приводит данные о цикле развития трематоды G. nassicola в акватории Массачусетса (Вудс Хол).
Жизненный цикл трематоды G. adunca в Черном море до настоящего времени не расшифрован. Цель настоящего исследования – описание основных жизненных стадий и жизненного цикла этого вида трематоды.
МАТЕРИАЛЫ И МЕТОДЫ
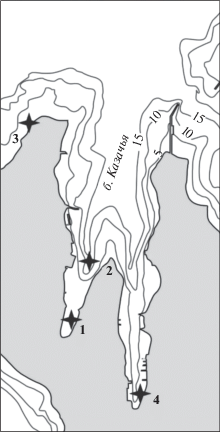
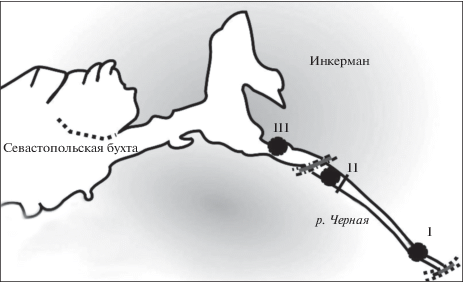
Моллюсков H. acuta собирали в течение 2012 г. ежемесячно в двух различных биотопах – эстуарии реки Черная (Севастополь, Черное Море) (44°27′49′′ N, 33°51′37′′ E) (рис. 1) и бухта Казачья (44°36′29′′ N, 33°35′54′′ E) (рис. 2). Пробы гидробионтов собирали в биотопах, расположенных в месте впадения реки Черная в Севастопольскую бухту: I – биотоп, в котором соленость на протяжении исследования (2011–2013 гг.) колебалась в пределах 4–5‰, расположен ~ в 1.5 км выше устья реки, II – в устье реки, где соленость воды была 12–16‰ и III – в куту Инкерманской бухты, где соленость составляла 17–18‰ (рис. 1). C помощью метода полного гельминтологического вскрытия (Быховская-Павловская, 1969) изучено 6790 экз. моллюсков. Нога, жабры, мантия, гонады и печень H. acuta были исследованы компрессорным методом (Быховская-Павловская, 1969) между двумя предметными стеклами. Отлов травяной креветки Palaemon adspersus (Rathke, 1837) был осуществлен в июне 2013 г. в эстуарии р. Черная (Севастополь) (рис. 1) неводом 1 × 0.4 м, с ячейками 6–8 мм.
Рис. 1.
Станции отбора проб (I–III) в экосистеме эстуарного типа, расположенной в районе впадения р. Черная в Севастопольскую бухту (Черное море).
Найденных партенит трематод исследовали живыми с помощью микроскопа Olympus CX41, оснащенного фотокамерой CX50 с программным обеспечением Infinity Analyze. Церкарий исследовали живыми, метацеркарий и марит обследовали окрашенными ацетокармином по стандартной методике (Роскин, Левинсон, 1957). Степень окраски дифференцировали “железной водой” (H2O + Fe2O3) и подкисленным спиртом (70%-ный этанол + 3%-ная HCl). После дегидратации в этаноле различной концентрации (70, 80, 90 и 100°) и просветления в гвоздичном масле трематод заключали в канадский бальзам ( Роскин, Левинсон, 1957). Все измерения были проведены на живых и окрашенных паразитах. Экскреторную систему личинок исследовали на живых особях при подкрашивании личинок нейтральным красным, в результате чего наблюдали мерцание пламенных клеток. Для каждого морфологического параметра вычисляли среднее арифметическое со стандартной ошибкой (µm).
Также были изучены препараты № 1.5 и 1.6 марит сем. Microphallidae от серебристой чайки Larus argentatus (Pontoppidan) из акватории бухты Омега, приготовленные в 1977 г. Т.Н. Мордвиновой, и препараты № 204.Tr.3f.V1-5 от травяной креветки P. adspersus из эстуария р. Черная, созданные в феврале 2006 г. В.К. Мачкевским (материалы подколлекции паразитических организмов Коллекции гидробионтов Мирового океана ФИЦ ИнБЮМ, (http://marineparasites.org).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Далее приводится морфологическое описание каждой жизненной стадии от соответствующего хозяина.
Партениты G. adunca паразитируют в гонадах брюхоногих моллюсков H. acuta. Материнская спороциста и мирацидий не обнаружены. Гемипопуляция партенит представлена несколькими генерациями дочерних спороцист, микрогемипопуляции которых имеют, в зависимости от сезона, различный состав.
Известно, что в условиях северных широт становление локальной гемипопуляции микрофаллид начинается с момента внедрения мирацидия в моллюска-хозяина. В этот момент личинка претерпевает метаморфоз. Недифференцированные клетки формируют герминальную массу, которая впоследствии может частично фрагментироваться. Отделившиеся фрагменты дают начало самостоятельным герминальным массам, которые продуцируют дочерних спороцист. Численность локальных группировок дочерних спороцист ограничивается репродуктивным потенциалом. Впоследствии все генеративные клетки созревают и приступают к дроблению. Одновозрастность состава спороцист связана с тем, что для микрофаллид характерен одновременный процесс дробления клеток (Galakrionov, Dobrovolskij, 2003).
При проведении паразитологических вскрытий моллюсков в зависимости от характера и стадии развития рождаемого спороцистами потомства было условно выделено 4 типа дочерних спороцист:
I тип – дочерние спороцисты, содержащие только зародышевые шары (ЗШ); II тип – дочерние спороцисты, содержащие зародышевые шары и эмбрионы церкарий (ЭЦ-ЗШ ) (рис. 3); III тип – дочерние спороцисты, содержащие только эмбрионы (ЭЦ) (рис. 4); IV тип – дочерние спороцисты, содержащие только зрелые церкарии (ЗЦ).
Рис. 3.
Партениты трематод Gynaecotyla adunca. (а) – содержащие только зародышевые шары; (б) – содержащие зародышевые шары и эмбрионы церкарий. Масштабная линейка: (а) –150, (б) – 200 µm.
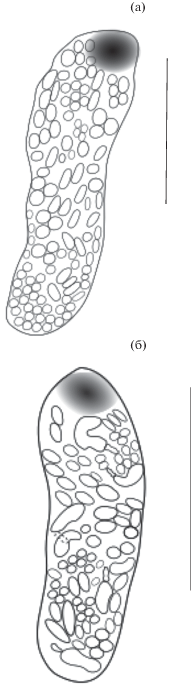
Рис. 4.
Дочерняя спороциста, содержащая эмбрионов церкарий Gynaecotyla adunca (а), (б) – извлеченная из спороцисты церкария на стадии формирования. Масштабная линейка (а) – 100, (б) – 50 µm.
Зараженность H. acuta партенитами, различающимися по стадиям развития и характеру рождаемого потомства, заметно варьирует на протяжении года (рис. 5, рис. 6).
Рис. 5.
Соотношение различных типов дочерних спороцист Gynaecotyla adunca на протяжении года в эстуарии реки Черная (Севастополь).
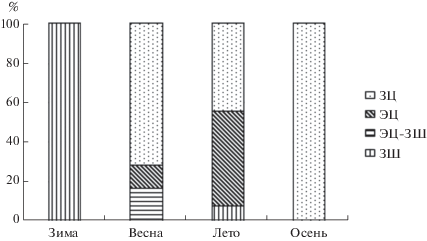
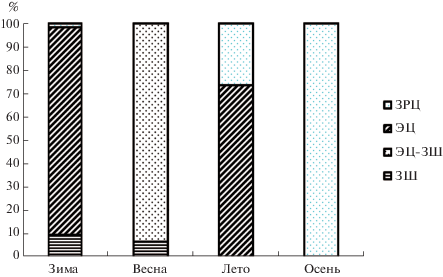
Рис. 6.
Соотношение различных типов дочерних спороцист Gynaecotyla adunca на протяжении года в бухте Казачья (Севастополь, Черное море).
Дочерняя спороциста, продуцирующая следующее поколение дочерних спороцист, была обнаружена нами единоразово в ноябре в эстуарии реки Черная. В дальнейшем такого типа микрогемипопуляция не отмечалась.
Таким образом, вероятнее всего, в ноябре происходило полное обновление гемипопуляции партенит.
В зимний период (с декабря по март) в моллюсках встречались только спороцисты, содержащие зародышевые шары, и преобладала дочерние спороцисты с зародышевыми шарами.
В марте появилась микрогемипопуляция партенит со смешанным содержимым (зародышевые шары и эмбрионы церкарий). Таким образом, происходит формирование партенит II и III типов, в результате развития молодых, преобладавших в зимние месяцы спороцист.
В апреле–мае доля этих группировок резко снизилась, вплоть до полного исчезновения. Все моллюски, зараженные личинками Gynaecotyla, в период с мая по октябрь, содержали в гонадах значительное количество зрелых церкарий (IV тип). Однако полностью рождение нового поколения партенит не прекращается, что приводит к увеличению количества партенит в моллюсках (рис. 5)
В ноябре у части спороцист происходит переопределение характера рождаемого потомства. Это приводит к тому, что к наступлению холодов в моллюсках увеличивается число относительно молодых спороцист с зародышевыми шарами, которые, по всей видимости, легче переносят неблагоприятные условия. В дальнейшем происходит формирование партенит II и III типов в результате развития молодых спороцист I типа
В другом исследованном биотопе – в бухте Казачья – динамика несколько отличалась (рис. 6). В зимние месяцы в моллюсках доминировали группировки, состоящие из спороцист, содержащих эмбрионы церкарий, небольшую долю составляли спороцисты с зародышевыми шарами, но также встречались и зрелые группировки. Весной доля группировок I типа уменьшилась, в моллюсках доминировали группировки, состоящие из спороцист со смешанным содержимым (группировки II типа). Летом на смену им пришли группировки, включающие спороцисты с эмбрионами церкарий и небольшая часть зрелых группировок. А осенью преобладали спороцисты со зрелыми церкариями (IV тип).
Таким образом, в этом биоценозе зрелые эмбрионы и сформированные церкарии встречались в моллюсках практически весь год. Формирование зрелых церкарий происходит практически круглый год с пиками в конце весны и осенью. В целом, можно сказать, что для партенит G. adunca характерно несинхронное отрождение дочерних спороцист и церкарий.
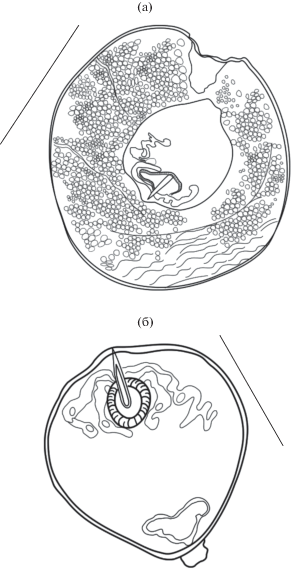
Церкарии (рис. 7) мелкие. Тело церкарий овальной формы. Длина их тела 84 ± 3 µm, ширина – 36 ± 2 µm. Ротовая присоска размером 16 ± 1 × × 15 ± 0.5 µm, расположена субтерминально и вооружена крупным стилетом (10 ± 0.5 µm) (рис. 7б), идущим из центра ротовой присоски. Острие стилета может немного выступать над передним краем тела церкарии. Две пары стилетных желез открываются в передней части тела у начала ротовой присоски. Зачатки брюшной присоски просматриваются между железами проникновения. Пищеварительная система не развита. Выделительный пузырь имеет Y-образную форму. Выделительная система трематоды хорошо дифференцируется на живых объектах, формула экскреторной системы 2 (2 + 2) = 8 (рис. 7а). Хвост длиной 78 ± ± 3 µm, сужается к своему концу (рис. 7а)
Рис. 7.
Церкария Gynaecotyla adunca (Linton, 1905) (Yamaguti, 1939) (рисунок с живого гельминта) от черноморских моллюсков Hydrobia acuta (Draparnaud, 1805). (а) – пламенные клетки экскреторной системы; (б) – форма и положение стилета. Масштабная линейка: 50 µm.
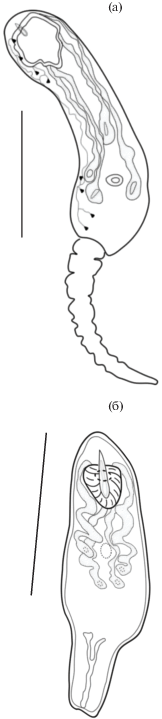
На основании указанных морфологических признаков (форма и положение стилета, формула выделительной системы), анализируемые личинки трематод нами отнесены к семейству Microphallidae. Из всех представителей семейства по основному систематическому признаку – форме стилета – наша церкария наиболее близка к роду Gynaecotyla.
У берегов Крыма церкарии этого вида найдены нами впервые. В Черном море до нас микрофаллидную церкарию нашла А.В. Долгих (Долгих, 1965) под названием C. misenensis. Церкарии C. sevillana от моллюска Nassarius reticulatus (L.) у берегов Португалии (Pinto, Bartoli, 2002) идентичны церкариям, найденным Долгих (Долгих, 1965) в том же виде моллюска в акватории Черного моря, однако ошибочно названы C. misenensis (Palombi, 1940), которые являются паразитами моллюсков Cerithium rupeste (Risso, 1826). C. sevillana отличается от C. misenensis формой и размером выделительного пузыря, длиной и формой хвоста, а также поведенческими реакциями. Эти морфологические отличия были показаны в работе португальских авторов (Pinto, Bartoli, 2002).
Найденные нами церкарии по всем параметрам совпадают c последним морфологическим описанием: Y-образная форма мочевого пузыря обнаруженной нами церкарии G. adunca vs грушевидной формы у С. misenensis, ребристая структура хвоста vs гладкая у C. misenensis (Долгих, 1965), положение и форма стилета.
Метацеркарии паразитируют в мышцах карапакса и абдомена травяной креветки P. adspersus (Rathke) (интенсивность 3–20 экз, экстенсивность 27 экз). Метацеркарии заключены в овальные цисты размером 444–516 × 252–322 µm. Тело метацеркарий (рис. 8) овальной формы. Длина их тела 969 ± 29, ширина 297 ± 20 µm. Тегумент покрыт шипиками, достигающими уровня семенников. Ротовая присоска субтерминальная размером 74 ± 6 × 84 ± 5 µm. Посередине тела располагаются две брюшных присоcки: одна более крупная размером 70 ± 5 × 73 ± 4 µm, другая меньше диаметром 57 ± 4 × 63 ± 4 µm. Префаринкс короткий 99 ± 12 µm, пищевод длинный 125 ± 38 µm. Фаринкс крупный округлой формы 59 ± 4 × 65 ± ± 4 µm. Семенники цельнокрайние, располагаются в одной плоскости. Длина левого семенника 119 ± 4, при ширине 78 ± 2 µm. Длина правого семенника 105 ± 8, при ширине 74 ± 3 µm. Округлый яичник размером 67 ± 7 × 70 ± 6 µm, находится над двумя семенниками, под бурсой. Удлиненной формы бурса размером 174 ± 14 × 41 ± 3 µm располагается горизонтально над двумя брюшными присосками – под бифуркацией кишечника. Кишечные ветви доходят до уровня брюшных присосок, иногда немного выступая за их нижние границы. На конце бурсы имеется половая пора диаметром 28 ± 3 × 28 ± 3 µm. Выделительный пузырь, заполненный гранулами, имеет Y-образную форму.
Рис. 8.
Метацеркария Gynaecotyla adunca (Linton, 1905) (Yamaguti, 1939) (рисунок живого гельминта) от креветок Palaemon adspersus в Черном море. Масштабная линейка 200 µm.
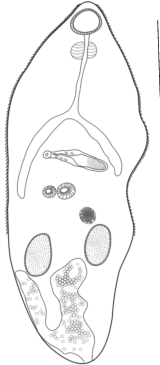
Рис. 9.
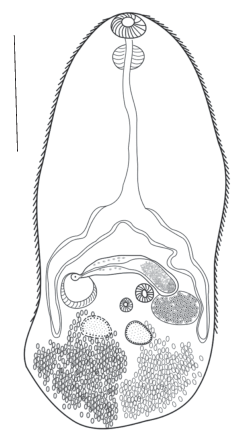
Марита Gynaecotyla adunca из серебристой чайки в акватории бухты Казачьей (Севастополь, Черное море). Масштабная линейка 500 µm.
Сведения в литературе о метацеркариях, паразитирующих у черноморских ракообразных, немногочисленны. В 1980-х гг. Т.Н. Мордвиновой (Мордвинова, 1980) проведено крупное диссертационное исследование гельминтофауны черноморских ракообразных и отмечено паразитирование метацеркарий G. adunca у ракообразных Macropipus hosatus в акватории Карадага.
Марита. Впервые морфология мариты G.adunca была описана Ранкином в 1939 г. (Rankin, 1939) на материале от мелких околоводных песчанок Crocethia alba у побережья Массачусетса (Вудс Хол).
Тело мариты (рис. 9 ) овальной формы 1542 ± ± 58 µm, при ширине 588 ± 28 µm. Тегумент покрыт шипиками, достигающими уровня семенников. Ротовая присоска субтерминальная, диаметром 110 ± 3 × 128 ± 6 µm. Для данного вида трематод характерно наличие двух брюшных присосок. Одна брюшная присоска более мелкая, имеет диаметр 107 ± 11 × 110 ± 5 µm, вторая – 104 ± 16 × 121 ± 4 µm. Префаринкс – короткий длиной 56 ± 10 µm. Фаринкс – крупный, хорошо выражен. Пищевод – длинный 366 ± 11 µm. У взрослых особей кишечные ветви достигают заднего края семенников. Семенники – цельнокрайние, располагаются под яичником. Длина левого семенника 155 ± 2 µm при ширине 103 ± 15 µm. Правый семенник всегда плохо просматривался на препаратах, поскольку в зоне его локализации мы отмечаем большое скопление яиц. Округлый яичник занимает место под бурсой. Длина яичника 100 ± 15 µm, ширина 101 ± 16 µm. Вытянутой формы бурса располагается под местом бифуркации кишечника, над двумя брюшными присосками. Длина бурсы 347 ± 15 µm, ширина 74 ± 9 µm. Половая пора расположена в генитальном предсердии, в котором находится копулятивный орган. Желточники состоят из желточных фолликулов овальной формы – по 6 с каждой стороны, позади яичника и семенников. Яйца овальные, коричневого цвета с плотной оболочкой. Длина яиц 15 ± 5 µm, при ширине 10 ± 5 µm
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В Черном море до настоящего времени была зарегистрирована марита 1 рода Gynaecotyla – G. adunca (Смогоржевская, 1976).
Форма тела, расположение и форма внутренних органов, наличие двух брюшных присосок у обнаруженных нами метацеркарий и марит G. adunca сходны с таковыми у метацеркарий и марит от других хозяев (Rankin, 1939; Мордвинова, 1980), что позволяет отнести обнаруженных нами трематод к виду G. adunca.
Изучение гельминтов рыбоядных птиц было начато более 50 лет назад Сааковой (1952), Скрябиным (1952), Леоновым (1958), Смогоржевской (1976). В акватории половозрелые формы G. adunca (syn. G. longiinstinata) впервые описал Леонов (1958) от серебристой чайки L. argentatus.
Результаты многолетних исследований были обобщены в монографии Смогоржевской “Гельминты водоплавающих и болотных птиц фауны Украины” (1976). Однако эти литературные данные являются последней крупной публикацией в настоящее время.
Последние данные о численности микрофаллидных трематод от водоплавающих птиц Севастопольских бухт получены в 2010 г. (регистрационный код отчета 0106U001630) Отдела экологической паразитологии, ИнБЮМ В.К. Мачкевским) (Machkevsky, 2010). В работе были представлены первичные данные по видовому составу и показателям зараженности околоводных птиц микрофаллидными трематодами. Согласно данным НИР, экстенсивность инвазии представителями семейства Microphallidae составила: у лысухи в бухте Омега Levinseniella pellucida (Jägerskiöld, 1909) – 10%, в бухте Соленая Microphallus papillorobustus (Rankin, 1940), (Baer, 1944) – 7%. Levinseniella brachysoma (Creplin, 1837) Stossich, 1899 – 7%. У кряквы в бухте Соленая – Maritrema subdolum, (Jägerskiöld, 1909) – 80%, Maritrema papillorobustus – 80%, L. brachysoma – 90%. У крякв из б. Омега Мачкевским (2010) было отмечено наибольшее видовое разнообразие представителей семейства Microphallidae Microphallus pygmaeus (Levinsen, 1881) – 50%, Microphallus similis (syn. M. excellence) (Jägerskiöld, 1900) (Nichol, 1906) – 50%, L. brachysoma – 17%, Maritrema echinocirratum (Leonov, 1958) – 67%, M. subdollum – 34%.
Жизненный цикл G. adunca в Средиземном море впервые описал Превот (Prevot, 1974). Согласно его данным, первым промежуточным хозяином является Tritia neritea (Linnaeus, 1758) (syn. Cyclonaeca neritea (Linnaeus, 1758)), вторым краб Carcinus aestuarii (Nardo, 1847) (syn. C. mediterraneus (Czerniavsky, 1884)), а дефинитивным серебристая чайка L. argentatus. Наши исследования показали, что в акватории Черного моря серебристая чайка Larus argentatus является окончательным хозяином для трематоды G. adunca, церкарии которой отмечаются в севастопольских бухтах у гастропод Hydrobia acuta, а метацеркарии – у креветок рода Palaemon.
Таким образом, наша работа дает полное морфологическое описание всех стадий развития трематоды G. adunca в акватории Черного моря и демонстрирует, что жизненный цикл G. adunca полностью реализуется в исследуемых нами биоценозах и протекает аналогично средиземноморскому.
Работа выполнена в рамках государственного задания ФГБУН ФИЦ ИнБЮМ им. А.О. Ковалевского РАН (тема АААА-А18-118020890074-2).
Благодарности. Автор выражает благодарность М. Макарову (ФИЦ ИнБЮМ) за помощь в сборе и определении видового состава моллюсков; Т.Н. Мордвиновой за приготовление препаратов трематод от серебристой чайки; В.К. Мачкевскому за отбор проб креветок Palaemon adspersus и Ю.М. Корнийчук за научную консультацию при подготовке статьи к печати.
Список литературы
Быховская–Павловская И.Е. Паразитологическое исследование рыб. Ленинград: Наука, 1969. 108 с.
Долгих А.В. Личинки трематод паразиты моллюсков крымского побережья Черного моря: Автореферат дис. канд. биол. наук. Севастополь-Львов, 1965. 24 с.
Леонов В.А. Гельминтофауна чайковых птиц Черноморского заповедника и сопредельной территории Херсонской области // Ученые записки Горьк. пед. ин-та. Биол-географ. ф-т. 1958. Т. 20. С. 266–296.
Мачкевский В.К. Видовая структура сообществ и параметры популяции паразитов околоводных птиц в условиях естественной неоднородности параметров их среды обитания в азово-черноморском регионе // Отчет НИР “Изучение механизмов адаптации и трансформации паразитарной составляющей морских прибрежных сообществ в условиях неоднородности среды и антропогенного влияния”. № госрегистрации 0106U001630. Раздел 2. 2010. С. 50–59.
Мордвинова Т.Н. Гельминтофауна высших ракообразных крымского побережья и северо-западной части Черного моря: Автореф. дис. канд. биол. наук. М., 1980. 24 с.
Определитель паразитов позвоночных Черного и Азовского морей. Паразиты беспозвоночные рыб, рыбоядных птиц и морских млекопитающих / Под ред. А.В. Гаевской, А.В. Гусева, С.Л. Делямуре и др. АН УССР. Ин-т биологии юж. морей им. А.О. Ковалевского. Киев: Наук. Думка, 1975. 551 с.
Роскин Г.И., Левинсон Л.Б. Микроскопическая техника: учеб. пособие для вузов. / Под ред. Г.И. Роскина. 3-е изд. М.: Совет. Наука, 1957. 466 с.
Саакова Э.О. Фауна паразитических червей птиц дельты Дуная : Автореф. дис. канд. биол. наук. Ленинград, 1952. 24 с.
Смогоржевская А.А. Гельминты водоплавающих и болотных птиц фауны Украины. Киев: Наукова думка, 1976. 416 с.
Скрябин К.И. Трематоды животных и человека. Основы трематодологии. Том VI. Изд. Академии наук СССР. М., 1952. 689 с.
Galaktionov K.V., Dobrovolskij A.A. The biology and evolution of trematodes: an essay on the biology, morphology, life cycles, transmissions, and evolution of digenetic trematodes. Kluwer Academic Publishing. London, 2003. 594 p.
Pina S., Russell-Pinto F., Rodrigues P. Clarification of Cercaria sevillana (Digenea: Microphallidae) life cycle using morphological and molecular data // J. Parasitology. 2007. V. 93. № 2. P. 318–322.
Prévot G. 1974. Recherches sur le cycle biologique et l'écologie de quelques Trématodes nouveaux de Larus argentatus michaellis Naumann dans le Midi de la France. Thèse de Doctorat d’Etat, Université Droit. Economie & Sciences d’Aix-Marseille, 1974. 319 p.
Rankin J.S. Studies on the trematode family Microphallidae Travassos, 1921. I. The genus Levinseniella Stiles and Hassall, 1901, and description of the new genus Cornucopula // Trans. Amer.micr. Soc. 1939. V. 58. P. 431–447.
Rankin J.S. Studies on the Trematode family Microphallidae Travassos, 1921. IV. The life cycle and ecology of Gynaecotyla nassicola (Cable and Hunninen, 1938) (Yamaguti, 1939) // Biol. Bull. Woods Hole. 1940. V. 79. P. 439–451.
Russel-Pinto F., Bartoli P. Cercaria sevillana n. sp., a new cercaria (Digenea: Microphallidae) from Nassarius reticulatus (L.) (Mollusca: Prosobranchia) in Portugal // System. Parasit. 2002. V. 53. P. 175–182.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая