Известия РАН. Серия биологическая, 2021, № 5, стр. 547-555
Выявление и регуляция антагонистических свойств почвенного актиномицета Streptomyces sp. 89
Ю. М. Поляк 1, *, В. И. Сухаревич 1
1 Санкт-Петербургский НИЦ экологической безопасности РАН – обособленное структурное подразделение ФГБУН Санкт-Петербургский ФИЦ РАН
197110 Санкт-Петербург, Корпусная ул., 18, Россия
* E-mail: yuliapolyak@mail.ru
Поступила в редакцию 25.01.2018
После доработки 30.10.2018
Принята к публикации 17.03.2021
Аннотация
Из чернозема типичного выделена культура актиномицета Streptomyces sp. 89, обладающая антагонистическими свойствами по отношению к фитопатогенным микроорганизмам. Из биомассы актиномицета выделены и идентифицированы антибиотические вещества, обладающие физиологической активностью по отношению к фитопатогенным грибам и бактериям. Показано, что соотношение компонентов антибиотического комплекса актиномицета определяется в значительной степени окислительно-восстановительным потенциалом (ОВП) среды. Показано, что ОВП и другие факторы среды оказывают заметное влияние на образование полиена, но в меньшей степени – на синтез неполиеновых компонентов. Показана возможность целенаправленного регулирования компонентного состава антибиотика и, как следствие, спектра его биологического действия.
Интерес к антагонистическим свойствам почвенных микроорганизмов, как фактору защиты растений от фитопатогенов, существенно возрос в последние десятилетия в связи с повышенным использованием для этих целей химикатов, негативно влияющих на окружающую среду (Whipps, 2001). Поэтому микробиологический контроль фитопатогенов рассматривается, как альтернатива химическим соединениям, применяемым в сельском хозяйстве, или как дополнительный способ сокращения их количества (Compant et al., 2005; Ulloa-Ogaz et al., 2015).
Основная часть исследований, посвященных данной проблеме, выполнена с бактериями и грибами, многие из которых могут весьма эффективно осуществлять биологический контроль над фитопатогенами (Whipps, 2001; Raaijmakers et al., 2009; Beneduzi et al., 2012). Показано, что бактерии, ассоциированные с растениями, стимулируют их рост и подавляют развитие фитопатогенных микроорганизмов, выделяя различные вещества, обладающие антимикробной активностью – антибиотики, сидерофоры, бактериоцины, гидролитические ферменты и др. (Compant et al., 2005; Максимов и др. 2011; Леонтьевская, Добровольская, 2014).
Среди указанных метаболитов наиболее эффективными являются антибиотики, проявляющие высокую антимикробную активность и специфичность действия, а наиболее перспективную группу продуцентов антибиотиков составляют актиномицеты, относящиеся к роду Streptomyces (Beneduzi et al., 2012; Поляк, Сухаревич, 2017). Высокая биоцидная активность продуктов метаболизма стрептомицетов против бактерий и грибов позволяет использовать их для производства медицинских и ветеринарных препаратов, однако, в качестве агентов биологического контроля за фитопатогенами микроорганизмы данной группы, в настоящее время исследованы недостаточно (Berg et al., 2001; El-Tarabily, Sivasithamparam, 2006).
Тем не менее, известно, что антагонистические свойства стрептомицетов играют важную роль в снижении численности нежелательных популяций и регулировании взаимоотношений в почвенном микробоценозе (Звягинцев, Зенова, 2001; Звенигородский и др., 2004). Проявление и уровень антагонистической активности почвенных микроорганизмов – бактерий, грибов, актиномицетов, зависит не только от химического состава и путей биосинтеза веществ аллелопатической природы, но и от факторов среды, оказывающих влияние на биологический контроль (Duffy, Défago, 1999; Поляк, Сухаревич, 2019).
К числу факторов, от которых зависят антагонистические свойства микроорганизмов, относятся наличие минеральных и органических элементов питания, тип источника органического вещества, рН, свойства почвы, ризосферы и др. (Johansson et al., 2004; Prashar, Kapoor, 2014; Schlatter et al., 2015; Polyak, Sukcharevich, 2019). Важным, но малоизученным в проблеме биологического контроля, остается такой физико-химический фактор как окислительно-восстановительный потенциал (ОВП) (Шигаева и др. 2020).
Многими исследователями показано, что этот параметр среды оказывает значительное влияние на генезис и плодородие почв, превращение органических веществ, соединений азота, фосфора, серы, железа, марганца и других элементов, на процессы роста и физиолого-биохимическую активность различных групп микроорганизмов (Сухаревич и др., 1994; Wlodarczyk et al., 2001; Shi et al., 2003).
Существует связь почвенной микробиоты и ОВП: величина потенциала влияет на развитие микроорганизмов и биологическую активность почв (Wlodarczyk et al., 2002), а микроорганизмы, в свою очередь, создают условия для изменения ОВП (повышения или понижения). В почве с ОВП, равном или менее 150 мВ, интенсивнее происходят восстановительные процессы, присутствуют сероводород, метан и другие углеводороды. Преобладание окислительных процессов характеризуется присутствием свободного кислорода или других сильных окислителей, а величина ОВП почвы составляет от 150 до 700 мВ. С помощью величины ОВП среды можно определить уровень ее аэрации, степень окисленности или восстановленности (Nishiyama, Hisabori, 2009; Szafranek-Nakonieczna, Stępniewska, 2015).
Учитывая значительную роль данного фактора в жизнедеятельности микроорганизмов, очевидно, что в различных окислительно-восстановительных условиях будут происходить изменения в образовании микробами-антагонистами биологически активных веществ, а, следовательно, изменится и их способность осуществлять биоконтроль над фитопатогенами. В первую очередь, это относится к актиномицетам, образующим комплексные антибиотики, отдельные компоненты которых обладают различным спектром биологического действия (Звягинцев, Зенова, 2001).
Настоящая работа посвящена выделению и идентификации культуры актиномицета, обладающего антагонистическими свойствами по отношению к фитопатогенным микроорганизмам, изучению состава и антимикробных свойств образуемых биологически активных веществ, определению характера и степени воздействия на биосинтез антибиотических компонентов такого важного фактора почвенной среды, как окислительно-восстановительный потенциал.
МАТЕРИАЛЫ И МЕТОДЫ
Выделение и идентификация актиномицета. В работе использовали культуру актиномицета, выделенную из верхнего 0–20 см горизонта чернозема типичного (Chernozem typical) Полтавской области (Украина), характеризующегося следующими физико-химическими свойствами: Сорг – 7.3%, рН 6.9, обменные катионы (ммоль/100 г): Са2+ – 28.4, Mg2+ – 6.3, Kобм 16.2 мг/100 г, Р2О5подв 9.6 мг/100 г, содержание физической глины – 55.3%, ила – 28.1%.
Для выделения актиномицета использовали традиционный метод посева на крахмало-аммиачный агар (КАА). Идентификацию изолята проводили с использованием диагностических сред и методов, рекомендованных в определителях Берджи (Williams et al., 1989) и Гаузе с соавт. (1983). Морфологию мицелия, спороносцев, поверхность спор изучали с использованием сканирующей электронной микроскопии по методу Блэк (Black, 1974) и просматривали в микроскопе JMS – 35C (Япония) при ускоряющем напряжении 15 кВ. Изометрическую форму диаминопимелиновой кислоты (ДАП) клеточных стенок изолята определяли по методу Станека и Робертса (Stanek, Roberts, 1974).
Культивирование в жидкой среде. Изолят, обозначенный как Streptomyces sp. 89, культивировали в глубинных условиях на среде следующего состава (г/л): соевая мука – 15, глюкоза – 15, глицерин – 5, крахмал – 5, натрий хлористый – 5, кальций углекислый – 1, рН 6.8–7.2. Культивирование проводили в течение 5 сут в колбах объемом 250 мл на качалке (240 об./мин) при 28°С.
Для регуляции окислительно-восстановительного потенциала среды использовали восстановители (Na2S2O3, K4Fe(CN)6, цистеин) в концентрации от 0.05 до 1.0%, окислители (KMnO4, K3Fe(CN)6) в концентрации от 0.001 до 0.2%, и кислород воздуха. Интенсивность аэрации среды варьировали изменением объема среды в колбах объемом от 30 до 150 мл. Для регуляции процесса биосинтеза антибиотических веществ в среду вносили соли натрия и калия – Na2CO3, NaCl, Na2HPO4, K2НРO4, в концентрации от 0.3 до 3%.
Уровень ОВП среды определяли с использованием платинового игольчатого электрода (d = 0.5 мм) и хлорсеребряного электрода сравнения ЭВЛ-1М4 на рН метре № 5170 и выражали в мВ. Рост актиномицета в среде контролировали по изменению его сухого веса. Спектры поглощения метанольных экстрактов биомассы и нативных растворов в УФ свете определяли на спектрофотометре Genesys 10uv scanning (“Thermo Spectronic”, США).
Определение антагонистической активности актиномицета. Активность антибиотических веществ определяли методом диффузии в агар (Поляк и др., 1979) среды Чапека с крахмалом для грибов, и МПА – для бактерий. При определении спектра биологического действия в качестве тест-культур использовали чистые культуры фитопатогенных и токсигенных грибов Alternaria solani Sorauer, Fusarium oxysporum Schlecht, Aspergillus flavus Link, Aspergillus niger van Tieghem, Aspergillus terreus Thom, Botrytis cinerea f. lini, Penicillium cyclopium Westling, Penicillium ochrochloron Biourge, Penicillium granulatum Bainier, Trichoderma viride Pers. ex Fries, дрожжеподобных грибов Candida utilis (Henneberg) Lodder и Kreger, Candida albicans Berkhout, бактерий Bacillus mesentericus Trevisan, Bacillus subtilis Cohn, Corynebacterium sepedonicum Spieckermann & Kotthoff, Pseudomonas syringae van Hall, Pseudomonas fluorescens Migula, Staphylococcus aureus Rosenbach, Xanthomonas campestris Dowson, полученные из Всероссийской коллекции микроорганизмов (ВКМ). Зоны ингибирования роста грибов замеряли после инкубации при температуре 28°С в течение 5 сут, бактерий – 2 сут.
Определение биологически активных веществ, образуемых актиномицетом. Антибиотики, образуемые Streptomyces sp. 89, выделяли из биомассы и подвергали химической очистке от биологически неактивных веществ.
Для выделения неполиеновых антибиотиков Streptomyces sp. 89 культивировали в среде следующего состава (г/л): соевая мука – 15, глюкоза – 15, глицерин – 5, крахмал – 5, натрий хлористый – 5, кальций углекислый – 1, K4Fe(CN)6 – 0.5 в течение 5 сут. Из полученной микробной биомассы антибиотик экстрагировали гексаном. Экстракты высушивали свежепрокаленным MgSO4, упаривали в вакууме, после чего полученное бесцветное масло перекристаллизовывали гексаном. После экстракции гексаном мицелий Streptomyces sp. 89 экстрагировали этилацетатом (трехкратно) и получали другой антибиотический компонент. Экстракты упаривали в вакууме на роторном испарителе и перекристаллизовали смесью этилацетата с ацетоном (в соотношении 1 : 1).
Для выделения из биомассы антибиотического вещества, имеющего максимум поглощения в УФ свете при 265 нм, после экстракции гексаном и этилацетатом, проводили экстракцию метанолом. Метанольный экстракт упаривали в вакууме на роторном испарителе. Полученный сироп коричневого цвета снова растворяли в метаноле и пропускали через колонку с силикагелем (Kieselgur G, 100–200 мин., “Merck”, Германия, колонка d = 5 см, высота слоя 10 см). Элюцию проводили сначала смесью СH3COOH–CHCl3 (6 : 4), затем смесью бутанол – вода (4 : 1). Объединенные фракции бутанол – вода упаривали досуха на роторном испарителе. Полученный гигроскопичный продукт коричневого цвета пропускали через сефадекс LH-20 (элюция метанолом).
Полиеновый антибиотик выделяли из биомассы продуцента Streptomyces sp. 89, который культивировали на среде следующего состава: соевая мука – 15, глюкоза – 15, глицерин – 5, крахмал – 5, натрий хлористый – 5, кальций углекислый – 1, Na2НРO4 – 5. Антибиотик экстрагировали метанолом в соотношении 1 : 3, экстракт упаривали на роторном испарителе до водного слоя. Для удаления неполиеновых антибиотиков водный слой несколько раз экстрагировали гексаном и этилацетатом. Из водного остатка гептаен экстрагировали н-бутанолом и упаривали бутанольный экстракт досуха.
ЯМР (1Н и 13С) спектры выделенных антибиотиков получали на спектрофотометре Bruker АС-200 (Германия), ИК-спектры в таблетках KBr – на приборе Specord IR-75 (Германия), ВЭЖХ проводили на хроматографе Миллихром-2 (Россия), масс-спектры получали на приборном комплексе ХЖ-МХ-3303 (НПО “Научные приборы”, Россия).
Статистическую обработку результатов проводили с помощью пакета компьютерных программ Statistica 10.0 (StatSoft).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На первом этапе исследований проводили идентификацию актиномицета-антагониста, выделенного из окультуренной почвы Полтавской области (Украина). Электронная микроскопия показала, что почвенный изолят образует характерный для актиномицетов воздушный и субстратный мицелий, состоящий из переплетения гиф с диаметром 0.5–2 мкм. Специальные структуры, такие как спорангиум и склероции отсутствуют, но образуются хорошо сформированные спороносцы в виде крючковидных или растянутых спиралей. Поверхность спор покрыта зубцевидными выростами.
Изолят актиномицета хорошо растет на диагностических средах и, в зависимости от состава среды, окраска воздушного мицелия варьирует от светло до темно-зеленой. Растворимый пигмент изолят не образует. Гидролизат мицелия содержит LL-диаминопимелиновую кислоту (ДАП). При изучении физиолого-биохимических признаков отмечено, что культура разжижает желатину, гидролизует крахмал, в разной степени потребляет многие сахара (кроме арабинозы, мальтозы, рибозы и сорбозы) и обладает широким спектром антимикробного действия (табл. 1). На основании морфолого-культуральных и физиологических признаков с учетом наличия в клетках ДАП, изолят отнесен к роду стрептомицетов и обозначен, как Streptomyces sp. 89.
Таблица 1.
Противомикробный спектр действия Streptomyces sp. 89
| Тест-культура | Диаметр зоны подавления роста, мм |
|---|---|
| Alternaria solani | 23 ± 4 |
| Aspergillus flavus | 18 ± 1 |
| Aspergillus niger | 21 ± 2 |
| Botrytis cinerea | 24 ± 3 |
| Fusarium oxysporum | 22 ± 5 |
| Penicillium funiculosum | 15 ± 2 |
| Penicillium cyclopium | 25 ± 3 |
| Trichoderma viride | 30 ± 5 |
| Candida albicans | 26 ± 3 |
| Candida utilis | 25 ± 4 |
| Bacillus mesentericus | 5 ± 2 |
| Bacillus subtilis | 4 ± 2 |
| Corynebacterium sepedonicum | 3 ± 1 |
| Pseudomonas fluorescens | 0 |
| Pseudomonas syringae | 2 ± 1 |
| Staphylococcus aureus | 8 ± 2 |
| Xanthomonas campestris | 2 ± 1 |
Таблица 2.
Биосинтез антибиотиков Streptomyces sp. 89 при снижении ОВП среды восстановителями
| Восстановитель (В) | Концентрация В, % | ОВП, мВ | Пики УФ спектра (% к контролю) | Прирост биомассы (% к контролю) | Пик 265 нм/380 нм | |
|---|---|---|---|---|---|---|
| неполиеновый комплекс (265 нм) |
гептаен (380 нм) |
|||||
| Контроль* | – | 207 | 100 ± 6.1 | 100 ± 5.3 | 100 ± 7.9 | 1.3 ± 0.1 |
| K4Fe(CN)6 | 0.05 | 31 | 98.6 ± 4.7 | 26.1 ± 3.2 | 123.2 ± 11.8 | 4.9 ± 0.7 |
| 0.15 | 21 | 100.3 ± 5.8 | 15.2 ± 0.7 | 109.1 ± 7.3 | 8.5 ± 0.9 | |
| Цистеин | 0.05 | 98 | 119.5 ± 9.0 | 94.4 ± 7.3 | 95.8 ± 6.3 | 1.6 ± 0.1 |
| 0.15 | 17 | 33.4 ± 2.1 | 4.1 ± 1.1 | 100.2 ± 5,4 | 10.6 ± 1.2 | |
| Na2S2O3 | 0.5 | 53 | 43.0 ± 2.9 | 40.8 ± 3.6 | 100.0 ± 6.1 | 3.7 ± 0.2 |
| 1.0 | 31 | 32.1 ± 3.1 | 23.1 ± 1.7 | 102.1 ± 4.5 | 5.4 ± 0.7 | |
Таблица 3.
Биосинтез антибиотиков Streptomyces sp. 89 при повышении ОВП среды окислителями
| Окислитель (О) | Концен-трация О, % | ОВП среды, мВ | Величина пиков УФ спектра (% к контролю) | Прирост биомассы (% к контролю) | Соотношение пиков при 265 и 380 нм |
|
|---|---|---|---|---|---|---|
| неполиеновый комплекс (265 нм) |
гептаен (380 нм) |
|||||
| Контроль* | – | 204 | 100 ± 6.0 | 100 ± 4.6 | 100 ± 4.6 | 1.2 ± 0.3 |
| K3Fe(CN)6 | 0.05 | 375 | 70.1 ± 3.8 | 50.4 ± 3.6 | 102.6 ± 7.3 | 3.3 ± 0.5 |
| 0.20 | 407 | 60.4 ± 5.5 | 21.4 ± 4.3 | 109.1 ± 7.1 | 7.9 ± 0.8 | |
| KMnO4 | 0.001 | 310 | 70.6 ± 3.7 | 76.5 ± 6.6 | 121.4 ± 8.2 | 2.3 ± 0.2 |
| 0.002 | 380 | 73.2 ± 4.8 | 47.2 ± 3.9 | 111.9 ± 5.6 | 3.4 ± 0.6 | |
Стрептомицет обладает широким спектром антимикробного действия, его наибольшая активность проявляется по отношению к микромицетам, а наименьшая – к бактериям (табл. 1). Высокая фунгицидная активность Streptomyces sp. 89 (диаметр зоны ингибирования роста микромицетов 20 мм и более) была выявлена по отношению к возбудителю альтернариоза A. solani, мягкой гнили A. niger и P. cyclopium, серой гнили – B. cinerea, фузариоза F. oxysporum, “зеленой плесени”, поражающей высшие грибы, T. viride, дрожжеподобным грибам рода Candida.
По отношению к грамположительным бактериям – возбудителям бактериоза растений B. mesentericus, B. subtilis, C. sepedonicum и стафилококковой инфекции S. aureus, антагонистические свойства Streptomyces sp. 89 были менее выражены (диаметр зоны ингибирования роста 3–8 мм). Слабее всего антагонизм стрептомицета проявлялся по отношению к грамотрицательным бактериям – облигатному фитопатогену Ps. syringae, факультативному фитопатогену Ps. fluorescens, возбудителю сосудистого бактериоза растений X. campestris (диаметр зоны ингибирования роста 2 мм или ингибирование отсутствует).
Широкий спектр антимикробного действия изученного стрептомицета позволяет предположить, что культура образует не одно, а несколько соединений с антагонистическими свойствами. Биологический контроль фитопатогенов в почве достаточно часто представляет собой результат совместного действия различных биологически активных соединений (Raaijmakers et al., 2009).
На основании УФ-спектров биомассы и нативного раствора, полученных при глубинном культивировании актиномицета была проведена первичная оценка аллелопатических веществ, синтезируемых Streptomyces sp. 89. Показано, что культура образует не менее двух антибиотических соединений, одно из которых имеет спектр поглощения характерный для гептаеновых антибиотиков с максимумами при 362, 380 и 405 нм (рис. 1). Второй компонент имеет максимум поглощения в УФ свете при 265 нм и не относится к числу полиенов. Оба упомянутых антибиотика содержатся, главным образом, в биомассе стрептомицета.
Рис. 1.
Спектры поглощения метанольного экстракта биомассы и нативного раствора Streptomyces sp. 89 в УФ свете.
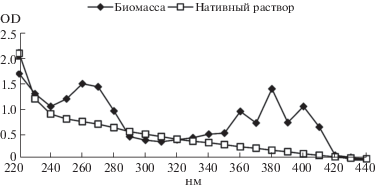
Дальнейшие исследования показали, что антибиотический комплекс Streptomyces sp. 89 содержит четыре антибиотических вещества, в т.ч. один гептаеновый и три неполиеновых антибиотика.
Первый из выделенных неполиеновых антибиотиков проявлял активность в отношении грамположительных бактерий, и, в меньшей степени, некоторых грамотрицательных бактерий и грибов. Выделенный антибиотик по своим свойствам идентичен полиэфирному антибиотику нигерицину и не имеет поглощения в ультрафиолете. Его ИК-спектр имеет следующие полосы поглощения: 1705 (СООН) и 1660 (С=О) см–1. Антибиотик оптически деятелен: α$J_{D}^{{20}}$ = +33.4 (Cl, CHCO3), +5.6 (Cl, MeOH).
Физико-химические характеристики второго неполиенового антибиотика (проявляет активность в отношении грамположительных бактерий), хорошо согласуются с таковыми антибиотика элайофилина (Gerlitz et al., 1992). УФ спектр метанольных растворов антибиотика характеризуется максимумом поглощения при 253 нм. Удельное вращение α$J_{D}^{{18}}$ = –43 (C 0.5, CHCl3). ЯМР-спектр выделенного препарата и его хроматографическая подвижность в системе хлороформ-метанол (9 : 1) соответствуют аналогичным характеристикам элайофилина, что подтверждает сделанные выводы.
Третье антибиотическое вещество неполиеновой природы с максимумом поглощения в УФ свете при 265 нм проявляло биологическую активность в отношении грамположительных бактерий и слабее – в отношении грибов. УФ-спектр метанольных растворов этого антибиотика имеет два максимума поглощения при длинах волн 238 и 260–262 нм, удельное вращение $J_{D}^{{}}$ = +43 (Cl, MeOH). По выявленным характеристикам антибиотик был отнесен в группу макроциклических лактонов типа азаломицина F.
Четвертое выделенное из мицелия Streptomyces sp. 89 антибиотическое вещество имело максимумы поглощения в УФ свете при длинах волн: 362, 380 и 405 нм ($E_{{1\,{\text{см}}}}^{{1\% }}$ соответственно 460, 840 и 980). Такой спектр характерен для неароматических гептаенов типа амфотерицина B. Антибиотик проявлял активность в отношении фитопатогенных грибов и был неактивен в отношении грамположительных и грамотрицательных бактерий. Антигрибная активность гептаена значительно превышала антигрибную активность неполиеновых антибиотиков.
Таким образом, выделенный из почвы актиномицет Streptomyces sp. 89 является продуцентом четырех биологически активных соединений:
1) полиенового антибиотика из группы неароматических гептаенов типа амфотерицина B – высокоактивного антагониста грибов;
2) макролидного антибиотика элайофилина – антагониста грамположительных бактерий;
3) антибиотика из группы макроциклических лактонов типа азаломицина F – антагониста грамположительных бактерий и грибов;
4) полиэфирного антибиотика нигерицина – антагониста грамположительных и грамотрицательных бактерий и грибов.
Способность почвенных антагонистов к биосинтезу нескольких антибиотиков с различным спектром биологического действия известна и для других групп микроорганизмов (Raaijmakers et al., 2002). Например, бактерии Bacillus cereus и Ps. fluorescens образуют комплексы антибиотиков, которые могут, как совпадать, так и различаться по уровню активности против фитопатогенных микроорганизмов (Handelsman, Stabb, 1996; Bender et al., 1999). Образование комплекса антибиотиков с различным спектром действия повышает конкурентоспособность почвенных микроорганизмов и усиливает их роль в антагонистических взаимоотношениях с фитопатогенами (Pal, McSpadden, 2006).
Сложный компонентный состав антибиотического комплекса предполагает возможность изменения спектра антимикробного действия актиномицета при изменении условий среды почвы. От условий среды во многом зависит как синтез, так и значимость каждого из компонентов антибиотического комплекса микробов-антагонистов (Thomashow, Weller, 1996). В настоящей работе изучали действие важнейшего фактора почвенной среды – окислительно-восстановительного потенциала, на антагонистические свойства Streptomyces sp. 89.
Известно, что результаты, полученные при культивировании микробов-антагонистов на жидких средах, позволяют достаточно точно оценить влияние факторов окружающей среды на синтез антибиотических веществ (Duffy, Défago, 1999). В то же время (по сравнению с почвой) использование жидкой среды значительно упрощает выделение и определение антибиотиков. Учитывая опыт предыдущих исследователей, регуляцию ОВП проводили в глубинных условиях внесением в питательную среду восстановителей и окислителей.
Результаты, представленные в табл. 2, свидетельствуют, что при снижении ОВП достоверные различия в приросте биомассы актиномицета не выявлены, однако ОВП значимо влияет на синтез антибиотиков Streptomyces sp. 89 (р < 0.05).
В восстановленных условиях наблюдается значительное подавление синтеза гептаена и, в меньшей степени, комплекса неполиеновых антибиотиков. Соотношение оптических плотностей метанольных экстрактов биомассы при 265 и 380 нм (пики неполиенового антибиотического комплекса и гептаена соответственно) варьирует в зависимости от значения ОВП от 1.3 в контроле (207 мВ) до 10.6 в восстановленных условиях (табл. 2).
Аналогичные результаты получены при культивировании Streptomyces sp. 89 в условиях повышенного ОВП среды (табл. 3). Он негативно действует на синтез антибиотиков, а для гептаена, как и в восстановленных условиях, ингибирующий эффект более выражен. Так, при увеличении ОВП среды до 407 мВ (внесение K3Fe(CN)6) пик УФ спектра неполиеновых антибиотиков составляет 60.4% от контроля, а гептаена – лишь 21.4%.
Основным окислителем в почве является молекулярный кислород почвенного раствора и воздуха, а также продукты жизнедеятельности почвенных организмов, содержание которых тесно связано с аэрацией почвы. Учитывая, что между аэрацией и ОВП почвы существует прямая зависимость, были проведены эксперименты в средах, в которых ОВП регулировали кислородом воздуха.
При снижении интенсивности аэрации среды, изменения биосинтеза антибиотиков были аналогичны изменениям, происходящим под влиянием химических веществ (табл. 4). Так, при снижении ОВП среды на 61 мВ отношение неполиеновые антибиотики : гептаен возрастает в 1.5 раза, а на 103 мв – в 2 раза. В этих условиях наблюдается незначительное (на 13–14%) снижение прироста биомассы, что, по-видимому, связано с недостатком кислорода для роста, поскольку исследуемый стрептомицет относится к строгим аэробам.
Таблица 4.
Влияние аэрации на рост и образование антибиотиков Streptomyces sp. 89
| Объем среды в колбе, мл | ОВП среды, мВ | Прирост биомассы, г/л | Величина пиков УФ спектра (% к контролю*) | Соотношение пиков при 265 и 380 нм |
|
|---|---|---|---|---|---|
| неполиеновый комплекс (265 нм) | гептаен (380 нм) |
||||
| 30 | 239 | 14.4±0.9 | 116.1 ± 5.8 | 110.9 ± 7.2 | 1.5 ± 0.1 |
| 50 | 205 | 14.7±0.6 | 100.0 ± 4.9 | 100.0 ± 6.0 | 1.2 ± 0.1 |
| 100 | 144 | 13.0±0.8 | 70.1 ± 8.4 | 53.2 ± 3.7 | 1.7 ± 0.2 |
| 150 | 102 | 12.6±0.9 | 37.3 ± 5.1 | 15.5 ± 3.4 | 2.4 ± 0.2 |
Таким образом, гептаен, определяющий высокую фунгицидную активность изученного стрептомицета, наиболее чувствителен к ОВП среды. При изменении ОВП происходило ингибирование синтеза гептаена и образование преимущественно неполиеновых антибиотиков. Полученные результаты согласуются с данными многих авторов о значительной роли ОВП в регуляции микробного метаболизма, синтеза вторичных метаболитов, влиянии на их состав и свойства (Shi et al., 2003; Поляк и др., 2013; Поляк и др., 2014; Tokarz, Urban, 2015).
На биосинтез антибиотических веществ могут оказывать регуляторное действие обменные катионы почвы, например натрий (Ng et al., 2014). Ионы натрия влияют на проницаемость клеточных мембран и транспорт веществ в микробную клетку. В настоящей работе исследовали действие солей натрия на образование противогрибкового и противобактериального компонентов антибиотического комплекса Streptomyces sp. 89.
Соли Na2CO3, NaCl, Na2HPO4 вносили в среду по отдельности, при этом концентрация ионов Na была одинаковой. В ряду концентраций от 1.0 до 6.0 г Na/л, наибольший стимулирующий эффект выявлен при 2.0 г Na+/л (рис. 2). В варианте 6.0 г Na+/л происходило ингибирование синтеза неполиеновых антибиотиков (рис. 2а) и гептаена (рис. 2б). В отношении гептаена проявлялся как стимулирующий (до 167% от контроля), так и ингибирующий эффект (до 18%).
Рис. 2.
Влияние солей натрия на образование комплекса неполиеновых антибиотиков (а) и гептаена (б) культурой Streptomyces sp. 89.
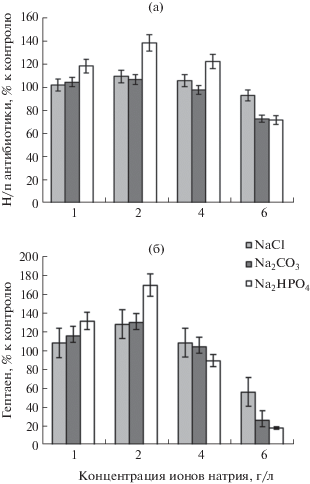
Наиболее высокий стимулирующий эффект был достигнут в варианте с фосфорсодержащей солью натрия, при этом доля антигрибного компонента превышала таковую антибактериального. Аналогичную зависимость наблюдали и при использовании гидрофосфата калия (рис. 3).
Рис. 3.
Влияние фосфорнокислых солей натрия и калия на синтез антибиотиков Streptomyces sp. 89: 1 – Na2HPO4 (6 мг %), 2 – K2HPO4 (6 мг %), 3 – Na2HPO4 (12 мг %), 4 – K2HPO4 (12 мг %).
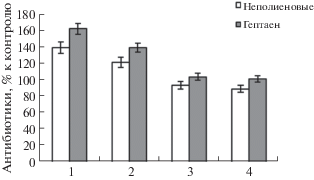
Внесение неорганического фосфора (1–2 г/л) в виде натриевой и калийной солей, способствовало повышенному синтезу антибиотиков культурой Streptomyces sp. 89. Стимулирующий эффект достигал 138 и 169% от контроля для неполиеновых антибиотиков и гептаена, соответственно. Следовательно, фосфор может влиять на биосинтез антибиотиков даже в большей степени, чем натрий. Полученные результаты согласуются с данными других авторов о существовании связи между синтезом антибиотиков микробами-антагонистами и содержанием фосфатов в почве (Raaijmakers et al., 2002). На рост Streptomyces sp. 89 фосфор в наших экспериментах оказывал стимулирующее действие (110–117%).
Таким образом, содержание фосфора и ОВП среды оказывают наибольшее влияние на образование полиенового антибиотика Streptomyces sp. 89. Дополнительное внесение в среду источников фосфора (Na2НРO4 или K2НРO4) приводило к повышенному синтезу гептаена, но не влияло на синтез неполиеновых компонентов.
* * *
При биологическом контроле фитопатогенов в окружающей среде особое внимание уделяют антагонистическим свойствам почвенных микроорганизмов (преимущественно, бактерий и грибов). Многочисленной группе почвенных актиномицетов, прежде всего из рода стрептомицетов, посвящены лишь единичные сообщения.
Проведенные исследования показывают, что актиномицеты, образующие комплексные антибиотики с широким спектром действия, являются перспективными агентами биоконтроля. Установлено, что культура Streptomyces sp. 89 (выделена из чернозема типичного) продуцирует четыре антибиотика, три из которых подавляют рост фитопатогенных бактерий, и один (полиеновый гептаен) обладает высокой антифунгальной активностью. Показано, что при изменении условий среды компонентный состав антибиотиков или их соотношение в антибиотическом комплексе может меняться.
Значительное влияние на процесс образования антибиотиков оказывает ОВП. Снижение или повышение ОВП способствует образованию Streptomyces sp. 89 антибиотического комплекса, преимущественно с противобактериальной активностью. Есть основание полагать, что направленность и уровень антибиотической активности многих почвенных микроорганизмов будет зависеть от ОВП среды, хотя его влияние во многом еще не изучено.
Авторы выражают глубокую признательность Ю.Д. Шенину (Всероссийский институт защиты растений, Санкт-Петербург) за идентификацию антибиотических веществ Streptomyces sp. 89.
Список литературы
Гаузе Г.Ф., Преображенская Т.П., Свешникова М.А., Терехова Л.П., Максимова Т.С. Определитель актиномицетов. М.: Наука, 1983. 245 с.
Звенигородский В.И., Кузин А.И., Шагов Е. М., Азизбекян Р.Р., Зенова Г.М., Воейкова Т.А. Микробы-антагонисты (стрептомицеты и бациллы), выделенные из почв разных типов // Почвоведение. 2004. № 7. С. 860–866.
Звягинцев Д.Г., Зенова Г.М. Экология актиномицетов. М.: ГЕОС, 2001. 256 с.
Леонтьевская Е.А., Добровольская Т.Г. Эпифитные бактериальные комплексы зерновых культур – таксономический состав и антагонистические свойства // Почвоведение. 2014. № 10. С. 1235–1239.
Максимов И.В., Абизгильдина Р.Р., Пусенкова Л.И. Стимулирующие рост растений микроорганизмы как альтернатива химическим средствам защиты от патогенов (обзор) // Прикладная биохимия и микробиология. 2011. Т. 47. № 4. С. 386–396.
Поляк М.С., Васильева Н.Г., Берштейн Е.М., Фрадкова Т.А. Определение биологической активности полиеновых антибиотиков: Методические указания. Л.: Всесоюз. н.-и. технол. ин-т антибиотиков и ферментов мед. назначения, 1979. 38 с.
Поляк Ю.М., Сухаревич В.И. Аллелопатические взаимоотношения растений и микроорганизмов в почвенных экосистемах // Усп. cоврем. биологии. 2019. Т. 2. С. 147–160.
Поляк Ю.М., Шигаева Т.Д., Кудрявцева В.А., Сухаревич В.И. Окислительно-восстановительный потенциал в процессе культивирования цианобактерий Anabaena variabilis // Вода: химия и экология. 2013. № 8. С. 66–70.
Поляк Ю.М., Шигаева Т.Д., Кудрявцева В.А., Сухаревич В.И. Влияние аэрации и редокспотенциала на рост, фотосинтез и токсинообразование цианобактерии Microcystis aeruginosa 973 // Вода: химия и экология. 2014. № 10. С. 60–68.
Поляк Ю.М., Сухаревич В.И. Выделение почвенных стрептомицетов – продуцентов комплексных антибиотиков // Вестник биотехнологии и физико-химической биологии им. Ю.А. Овчинникова. 2017. Т. 13. № 1. С. 18–24.
Сухаревич В.И., Семенова И.Р., Денисова Н.П. Влияние аэрации и окислительно-восстановительного потенциала среды на рост и биосинтез протеиназ фибринолитического действия грибом Coprinus cinereus // Биотехнология. 1994. № 11–12. С. 16–19.
Шигаева Т.Д., Поляк Ю.М., Кудрявцева В.А. Окислительно-восстановительный потенциал как показатель состояния объектов окружающей среды // Биосфера. 2020. Т. 12. № 3. С. 549.
Bender C.L., Rangaswamy V., Loper J.E. Polyketide production by plant-associated pseudomonads // Annu. Rev. Phytopathol. 1999. V. 37. P. 175–196.
Beneduzi A., Ambrosini A., Passaglia L.M. Plant growth-promoting rhizobacteria (PGPR): their potential as antagonists and biocontrol agents // Genet. Mol. Biol. 2012. V. 35. P. 1044–1051.
Berg G., Marten P., Minkwitz A., Bruckner S. Efficient biological control of fungal plant diseases by Streptomyces sp. DSMZ 12424 // J. Plant Diseases Protec. 2001. V. 108. P. 1–10.
Black I.T. Principles and techniques of scanning electron microscopy. Biological application. N.Y.: Van Nostrand Reinhold Co, 1974. V. 1. № 1. P. 1–43.
Compant S., Duffy B., Nowak J., Clément C., Barka E.A. Use of plant growth-promoting bacteria for biocontrol of plant diseases: principles, mechanisms of action, and future prospects // Appl. Environ. Microbiol. 2005. V. 71. № 9. P. 4951–4959.
Duffy B.K., Défago G. Environmental factors modulating antibiotic and siderophore biosynthesis by Pseudomonas fluorescens biocontrol strains // Appl. Environ. Microbiol. 1999. V. 65. № 9. P. 2429–2438.
El-Tarabily K.A., Sivasithamparam K. Non-streptomycete actinomycete as biocontrol agents of soil-bourne fungal plant pathogens and as plant growth promoters // Soil Biol. Biochem. 2006. V. 38. № 7. P. 1505–1520.
Gerlitz M., Hammann P., Thiericke R., Rohr J. The biogenetic origin of the carbon skeleton and the oxygen atoms of elaiphylin, a symmetric macrodiolide antibiotic // J. Org. Chem. 1992. V. 57. № 14. P. 4030–4033.
Handelsman J., Stabb E.V. Biocontrol of soilborne plant pathogens // Plant Cell 1996. V. 8. P. 1855–1869.
Johansson J.F., Paul L.R., Finlay R.D. Microbial interactions in the mycorrhizosphere and their significance for sustainable agriculture // FEMS Microbiol. Ecol. 2004. V. 48. 2004. P. 1–13.
Ng Y.K., Hodson M.P., Hewavitharana A.K., Bose U., Shaw P.N., Fuerst J.A. Effects of salinity on antibiotic production in sponge-derived Salinispora actinobacteria // J. Appl. Microbiol. 2014. 117. № 1. P. 109–125.
Nishiyama Y., Hisabori T. Physiological impact of thioredoxin- and glutaredoxin-mediated redox regulation in cyanobacteria // Adv. Bot. Res. 2009. V. 52. P. 187–205.
Pal K.K., McSpadden Gardener B. Biological control of plant pathogens. The plant health instructor. 2006. 25 p. https://doi.org/10.1094/PHI-A-2006-1117-02
Polyak Y.M., Sukcharevich V.I. Allelopathic interactions between plants and microorganisms in soil ecosystems // Biology Bulletin Reviews. 2019. V. 9. № 6. P. 562–574.
Prashar P., Kapoor N. Rhizosphere: its structure, bacterial diversity and significance // Rev. Environ. Sci. Biotechnol. 2014. V. 13. P. 63–77.
Raaijmakers J.M., Vlami M., de Souza J.T. Antibiotic production by bacterial biocontrol agents // Antonie van Leeuwenhoek. 2002. V. 81. P. 537–547.
Raaijmakers J.M., Paulitz T.C., Steinberg C., Alabouvette C., Moënne-Loccoz Y. The rhizosphere: a playground and battlefield for soilborne pathogens and beneficial microorganisms // Plant Soil. 2009. V. 321. P. 341–361.
Schlatter D.C., Bakker M.G., Bradeen M.J. Plant community richness and microbial interactions structure bacterial communities in soil // Ecology 2015. V. 96. № 1. P. 134–142.
Shi X., Yang L., Niu X., Xiao L., Kong Z., Qin B., Gao G. Intracellular phosphorus metabolism of Microcystis aeruginosa under various redox potential in darkness // Microbiological Research. 2003. V. 158. № 4. P. 345–352.
Stanek J.L., Roberts G.D. Simplified approach to identification of aerobic actinomycetes by thin-layer chromatography // Appl. Microbiol. 1974. V. 28. P. 226–231.
Szafranek-Nakonieczna A., Stępniewska Z. The influence of the aeration status (ODR, Eh) of peat soils on their ability to produce methane // Wetlands Ecol. and Management 2015. V. 23. № 4. P. 665–676.
Thomashow L.S., Weller D.M. Current concepts in the use of introduced bacteria for biological disease control: Mechanisms and antifungal metabolites / Plant-Microbe Interact. V. 1. 1996. P. 187–235.
Tokarz E., Urban D. Soil redox potential and its impact on microorganisms and plants of wetlands // J. Ecol. Engineering 2015. V. 16. № 3. P. 20–30.
Ulloa-Ogaz A.L., Muñoz-Castellanos L.N., Nevárez-Moorillón G.V. Biocontrol of phytopathogens: Antibiotic production as mechanism of control / In: Méndez-Vilas A. (eds.) The battle against microbial pathogens: Basic science, technological advances and educational programs. Formatex, 2015. P. 305–309.
Whipps J.M. Microbial interactions and biocontrol in the rhizosphere // J. Exp. Bot. 2001. V. 52. P. 487–511.
Williams S.T., Goodfellow M., Alderson G. Genus Streptomyces Waksman and Henrici 1943, 339AL. In: Williams S.T., Sharpe M.E., Holt J.G. (eds.) Bergey’s manual of systematic bacteriology, Vol. 4, Williams and Wilkins, Baltimore, 1989. P. 2452–2492.
Wlodarczyk T., Gliñski J., Stêpniewski W., Stêpniewska Z., Brzeziñska M., Kurá V. Aeration properties and enzyme activity on the example of Arenic Chernozem (Tišice) // Int. Agrophysics 2001. V. 15. P. 131–138.
Wlodarczyk T., Stêpniewski W., Brzeziñska M., Kotowska U. N2O emission and sorption in relation to soil dehydrogenase activity and redox potential // Int. Agrophysics 2002. V. 16. P. 249–252.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


