Известия РАН. Серия биологическая, 2021, № 6, стр. 644-650
Оценка возможных трансформаций фитопланктона крупных рек восточной сибири в условиях глобального изменения климата
В. А. Габышев *
Институт биологических проблем криолитозоны СО РАН
677980 Якутск, пр. Ленина, 41, Россия
* E-mail: v.a.gabyshev@yandex.ru
Поступила в редакцию 01.11.2019
После доработки 12.04.2021
Принята к публикации 12.04.2021
Аннотация
С применением метода искусственной нейронной сети, а также подхода пространственно-временного замещения, оценены основные пути возможной трансформации фитопланктона крупных рек Восточной Сибири в условиях глобальных климатических изменений. Определено, что при сохранении тенденции к увеличению безледного периода на субарктических реках, вероятным ответом планктонных сообществ водорослей, будет: 1) возрастание численности и рост риска “цветения” воды, 2) увеличение числа видов за счет инвазий, 3) снижение размерных показателей клеток фитопланктона, 4) сокращение числа монотипных таксонов в составе флоры. Водные экосистемы исследованных нами рек сохраняют неимпактный характер, что позволило оценить влияние климатических изменений, а не локальных антропогенных факторов.
В течение XX в. среднегодовая температура у поверхности Земли увеличилась на 0.6°, для Арктики этот показатель выше почти в два раза и, как прогнозируется, увеличится еще на 4–7°C в течение этого столетия (Field et al., 2014). Высокая чувствительность к климатическим изменениям структуры сообществ внутренних вод, по сравнению с таковыми морских и наземных, была отмечена исследователями ранее (Strayer, Dudgeon, 2010). Широко обсуждаются вопросы, связанные с воздействием климатических параметров на структуру водорослевых сообществ континентальных водоемов (Winder, Sommer, 2012; Iatskiu et al., 2018). Для построения моделей структуры сообществ по градиенту климата, исследование должно опираться на данные в масштабе гамма-разнообразия (Heino еt al., 2009). Современные работы в этом направлении проведены на примере водных сообществ Южной Америки (Schiaffino et al., 2011), бореальных озер Европы (Angeler, Drakare, 2013). Актуальность исследований по разработке моделей климат-сообщество подтверждается возможностью их применения для решения важной проблемы экологии – прогнозированию реакции пресноводных сообществ на климатические изменения. По мнению ряда авторов, трансформация, вызванная глобальными климатическими изменениями, может быть наиболее драматичной для арктических регионов (Frey, McClelland, 2009). Несмотря на это, для северных континентальных водоемов ощущается недостаток исследований, посвященных изучению структуры водорослевых сообществ в градиенте климата.
Одним из важных факторов среды, связанных с режимом температуры воздуха, признается продолжительность безледного периода на водных объектах и, как следствие – вегетационного периода (Magnuson et al., 2000). Рост продолжительности отсутствия льда на различных водных объектах Азиатской России с 1980 по 2014 гг. составил, в среднем, от 4.63 до 11 сут за десятилетие (Vuglinsky, Valatin, 2018). Прогноз на ближайшие десятилетия подтверждает сохранение этой тенденции (Field et al., 2014). Регулирующая роль этого фактора была подтверждена нами ранее. При исследовании флористической и ценотической структуры речного фитопланктона в масштабе гамма-разнообразия была определена статистически значимая связь между продолжительностью безледного периода на реках Восточной Сибири и численностью водорослей планктона, числом видов в пробе, средним объемом клеток, а также флористическими пропорциями (отношение числа видов к числу семейств) (Габышев, Габышева, 2018). Для некоторых из этих показателей были построены прогнозные модели их изменений при сохранении современных климатических тенденций (Gabyshev, 2018).
Целью настоящего исследования является оценка возможной флористической и ценотической трансформации фитопланктона в условиях глобального изменения климата на примере крупных рек Восточной Сибири.
МАТЕРИАЛ И МЕТОДЫ
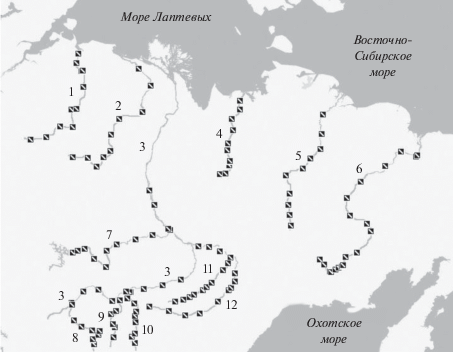
В основу исследования положены результаты альгологических наблюдений, выполненных на 12 крупных реках Восточной Сибири: Лена, Вилюй, Колыма, Алдан, Оленек, Витим, Индигирка, Амга, Олекма, Анабар, Яна и Чара (рис. 1). Собранный материал имеет широкий географический масштаб, район работ ограничен в меридиональном направлении в пределах 106°53′–160°58′ в.д., а по широте – от 56°13′ до 73°10′ с.ш. Отбор проб фитопланктона проводили в 2000–2011 гг. в летнюю межень (июнь-август) в период максимальной вегетации водорослей, из поверхностного горизонта воды (0–0.3 м) как в прибрежной зоне, так и по фарватеру. Сбор и обработка проб фитопланктона выполнены в соответствии с методами, принятыми в гидробиологии (Садчиков, 2003).
Рис. 1.
Карта-схема района работ и пункты отбора проб. Исследованные реки: 1 – Анабар; 2 – Оленек; 3 – Лена; 4 – Яна; 5 – Индигирка; 6 – Колыма; 7 – Вилюй; 8 – Витим; 9 – Чара; 10 – Олекма; 11 – Амга; 12 – Алдан.
В качестве инструмента статистического прогнозирования нами выбран метод искусственной нейронной сети, выбор обусловлен главным достоинством нейронных сетей – способностью моделировать нелинейные зависимости (Haykin, 2009). При этом анализ прошедших событий и получение вероятностной модели будущего происходит на основе временных рядов данных. В прогнозную модель был включен показатель численности фитопланктона. Вторая количественная переменная анализируемого массива данных характеризует продолжительность безледного периода на исследованных реках. Массив содержит 303 наблюдения, по которым отсутствуют пропуски, недопустимые при статистической обработке данных. Сведения о продолжительности безледного периода получены из гидрологических справочников (Ресурсы…, 1972, 1966).
Процедуры статистического анализа выполняли в модуле Statistica Automated Neural Networks (SANN) программного пакета Statistica 10.
Для конвенциональных подходов при формировании временных рядов данных требуются материалы, отражающие продолжительный временной интервал, в частности, полученные путем долгосрочных мониторинговых наблюдений. Поскольку наши данные о фитопланктоне не являются мониторинговыми, для построения временного ряда данных использован предложенный нами ранее подход (Gabyshev, 2018), который не имеет подобных ограничений. В основе данного подхода лежит метод пространственно-временного замещения (Pickett, 1989). Исследователь, применяя данный метод, исходит из предположения, что пространственные и временные изменения эквивалентны. При изучении влияния климатических изменений на биоразнообразие, прогнозы, основанные на пространственно-временнóм замещении, показывают высокую эффективность (Blois et al., 2013).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
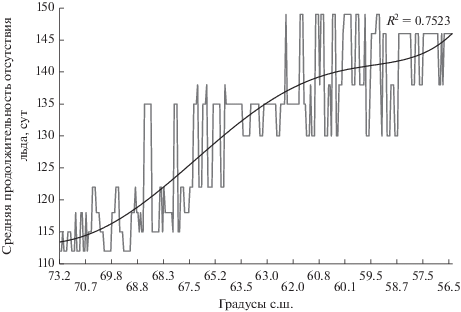
Данные о средней продолжительности безледного периода в каждом пункте отбора проб на исследованных нами реках, ранжированные по убыванию географической широты, а также результаты полиномиальной аппроксимации пятой степени и значение статистики R-квадрат (рис. 2) свидетельствуют, что период отсутствия льда увеличивается в направлении с севера на юг. Имеющиеся сведения о динамике продолжительности ледовых явлений в бассейнах рек Азиатской России за последние 35 лет, указывают на постепенный рост безледного периода (Vuglinsky, Valatin, 2018), а прогноз на ближайшие десятилетия подтверждает, что эта тенденция сохранится (Field et al., 2014). Очевидно, что основной принцип метода пространственно-временного замещения, об эквивалентности пространственных и временных вариаций (Blois et al., 2013; Pickett, 1989), соблюдается – безледный период на реках региона увеличивается как по “географической шкале” (с севера на юг), так и по “временной шкале”. Исходя из этого, при использовании наших данных для построения прогнозной модели, отсутствующую у нас “временнýю шкалу” следует заместить переменной “географическая широта наблюдений”. Ранжировав показатели численности фитопланктона по уменьшению широты наблюдений, мы ввели их в анализ как временной ряд.
Рис. 2.
Значения средней продолжительности безледного периода в пунктах отбора проб, сут. (ось ординат), ранжированные по убыванию географической широты, °с.ш. (ось абсцисс).
Для выявления внутренней цикличности данных временного ряда, был применен аналитический метод одномерного спектрального анализа Фурье. Результат анализа показывает, что внутри пула данных из 303 наблюдений есть периодичность, значение периода соответствует 100 единицам. Используя сведения о внутренней периодичности данных и применив регрессию временных рядов, мы обучили 50 нейро-сетевых моделей с условием случайного размера подвыборок в пределах 70% выборочной совокупности для обучающей подвыборки и по 15% для контрольной и тестовой. В анализе оставлено 5 наиболее удачных сетей, которые будут прогнозировать анализируемый ряд наблюдений (табл. 1).
Таблица 1.
Итоги нейросетевых моделей по показателю численности фитопланктона
| № п/п | Архитектура | Производительность обучения | Контрольная производительность | Алгоритм обучения | Функция активации скрытых нейронов | Функция активации выходных нейронов |
|---|---|---|---|---|---|---|
| 4 | МСП 100-7-1 | 0.79 | 0.78 | БФГШ 5 | Экспонента | Гиперболическая |
| 3 | МСП 100-6-1 | 0.70 | 0.68 | БФГШ 5 | Тождественная | Гиперболическая |
| 2 | МСП 100-7-1 | 0.69 | 0.72 | БФГШ 5 | Гиперболическая | Тождественная |
| 5 | МСП 100-4-1 | 0.67 | 0.68 | БФГШ 4 | Тождественная | Тождественная |
| 1 | МСП 100-7-1 | 0.67 | 0.67 | БФГШ 3 | Тождественная | Тождественная |
По типу все сети представляют многослойный персептрон (МСП) со 100 входящими, 1 выходным и от 4 до 7 скрытыми нейронами. Кроме архитектуры нейро-сетевых моделей, в сводке представлены такие характеристики, как обучающий алгоритм (метод Бройдена–Флетчера–Гольдфарба–Шанно – БФГШ) и номер конечной итерации, на которой получена модель, а также метод активации скрытых и выходных нейронов. Сети ранжированы по величине их производительности, которая представляет собой величину корреляции между исходным рядом данных и предсказанным, чем ближе это значение к 1, тем лучше модель.
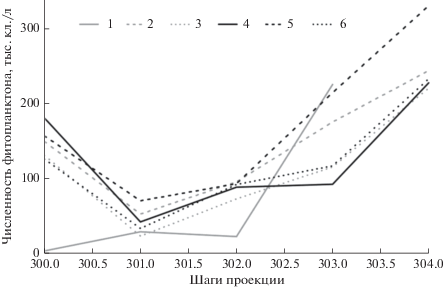
Для того чтобы узнать прогноз изменения переменной “численность фитопланктона” за пределами нашей выборки, построен график проекции временных рядов (рис. 3), где каждое следующее значение временного ряда строится по предыдущим значениям этого же временного ряда. Непрерывной серой кривой обозначен исходный ряд данных, другие кривые иллюстрируют предсказанные ряды для каждой нейросетевой модели. Как видно на графике проекций, все наиболее производительные модели предсказывают рост общей численности фитопланктона.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты нашего анализа показывают, что при современных тенденциях изменения климата, в качестве вероятного ответа высокоширотных сообществ фитопланктона, следует ожидать рост численности водорослей. На возможность роста уровня продукционных процессов в планктонных сообществах водоемов высоких широт, при увеличении вегетационного периода в рамках глобальных климатических изменений, исследователи указывали и ранее (George, 1991). Этот прогноз подтверждается данными о водоемах европейского севера, где история альгологических наблюдений насчитывает несколько десятилетий. Ряд авторов уже сейчас отмечают массовое развитие водорослей планктона водоемов Фенноскандии, и рост количественных показателей развития фитопланктона на порядок, объясняя это явление положительными температурными аномалиями последних десятилетий (Денисов, Кашулин, 2016). В водоемах Кольского полуострова, начиная с 2000 г., отмечаются ежегодные локальные явления массового развития цианобактерий, приводящие к “цветению”. Высокая вероятность нашего прогноза подтверждается также данными диатомового анализа донных отложений водоемов Мурманской области (Кашулин и др., 2018). Максимальное, для исследованной колонки, значение численности диатомей в слоях, датируемых последними десятилетиями, исследователи связывают с современным потеплением в Арктике. Известно, что ответ пресноводных водорослевых сообществ на потепление по окончании малого ледникового периода, начиная с 1850 г., также выражался в резком увеличении их обилия и продукционного потенциала, о чем свидетельствуют результаты палеоклиматического диатомового анализа донных отложений водоемов Мурманской области и Норвегии (Кашулин и др., 2018).
При разработке и апробации нового подхода к прогнозированию, нами ранее были построены прогнозные модели (Gabyshev, 2018), согласно которым, возможным ответом высокоширотных сообществ фитопланктона на рост продолжительности безледного периода будет: 1) увеличение числа видов водорослей в пробе; 2) снижение среднего объема клеток фитопланктона; 3) рост флористических пропорций (отношения числа видов к числу семейств).
Известно, что в глобальном масштабе, с увеличением широты отмечается сокращение числа видов пресноводных местообитаний (Gaston, Blackburn, 2000). Это явление характерно и в пределах бореального региона и связывается некоторыми исследователями с реакцией различных таксономических групп на изменение температуры среды (Heino, 2001). Те же авторы указывают на вероятность увеличения количества пресноводных видов в бореальных регионах в связи с изменением климата, и объясняют это смещением видов теплых вод на север (Heino еt al., 2009). Основным фактором, способствующим расширению биогеографических границ южных видов в сторону высоких широт, считают увеличение температуры воды и, как следствие, рост продолжительности вегетационного периода (Корнева, 2007). Уже к настоящему времени к чужеродным видам, проникающим в новые экологические пространства, причисляют около пяти десятков видов планктонных водорослей, основное направление распространения которых – с юга на север (Корнева, 2014). Так, например, повышение температуры воды в Волге, начиная со второй половины XX в., где непрерывные мониторинговые наблюдения проводятся в течение ряда последних десятилетий, способствовало появлению и увеличению разнообразия “экзотических” видов диатомовых из рода Thalassiоsira (Корнева, 2015). Поэтому наш прогноз на увеличение числа видов водорослей в пробе с ростом продолжительности безледного периода, вероятнее всего будет обусловлен распространением инвазийных видов планктона.
Гипотеза о том, что уменьшение размеров является универсальным экологическим ответом на глобальное потепление для водных экзотермных организмов, давно обсуждается (Atkinson, 1994) и находит ряд подтверждений (Daufresne et al., 2009), несмотря на то, что некоторыми исследователями признается спорной ее универсальность (Rueger, Sommer, 2012). На примере диатомей арктических озер финской Лапландии было показано, что повышение температуры воды и сокращение периода ледовых явлений способствовало доминированию мелких видов планктона с быстрыми темпами роста (Sorvari et al., 2002). Результаты диатомового анализа, выполненного для оз. Лугуху (Юньнань-Гуйчжоуское нагорье, Китай), показали тенденцию к уменьшению размеров клеток диатомей за последние шестьдесят лет и связь этого процесса с потеплением в регионе (Chen et al., 2014). Ряд палеолимнологических исследований, выполненных на водоемах высоких широт и высокогорий, свидетельствуют о росте доли мелкоклеточных диатомовых водорослей в последние десятилетия (Sorvari et al., 2002; Saros et al., 2003; Rühland, Smol, 2005), что связывается с увеличением продолжительности безледного периода (Rühland et al., 2008). Глобальные климатические изменения названы также причиной увеличения числа мелкоклеточных видов водорослей оз. Байкал, которое было выявлено при сравнительном анализе размерных характеристик планктонного сообщества пелагиали озера по наблюдениям 1990-х гг. и 2016 г. (Bondarenko et al., 2019).
По мнению ряда авторов, для альгофлоры высоких широт характерна значительная доля семейств и родов, включающих по одному виду и низкие флористические пропорции в целом (Гецен и др., 1994; Науменко, 1994; Комулайнен и др., 2006). За счет высокой доли монотипных таксонов, в планктонных сообществах северных водоемов происходит смягчение межвидовой конкуренции в условиях борьбы за ресурсы в ограниченный вегетационный период. Результаты нашего анализа показывают, что с увеличением продолжительности безледного периода следует ожидать повышение флористических пропорций, т.е. сокращение числа монотипных таксонов и ослабление этой зональной специфики таксономического спектра альгофлоры рек субарктики.
* * *
Построенные нами прогнозные модели возможных трансформаций фитопланктона крупных рек Восточной Сибири в условиях глобальных климатических изменений свидетельствуют, что наиболее вероятным ответом высокоширотных сообществ планктонных водорослей будет снижение размерных показателей клеток фитопланктона, сокращение количества монотипных таксонов, рост численности и риск возникновения “цветения” воды, а также увеличение числа видов за счет инвазий. Примененный нами прогнозный метод имеет свои ограничения, так как “временные ряды”, вводимые в анализ, получены путем пространственно-временного замещения. Следовательно, мы определили имеющуюся тенденцию изменения анализируемых показателей речного фитопланктона, но пока не можем судить о временном масштабе прогноза. Водные экосистемы исследованных нами рек до сих пор сохраняют преимущественно неимпактный характер. Это позволило нам оценить влияние на фитопланктон климатических изменений, а не локальных антропогенных факторов.
Финансирование. Работа выполнена в рамках Госзадания ИБПК СО РАН по теме “Растительный покров криолитозоны таежной Якутии: биоразнообразие, средообразующие функции, охрана и рациональное использование” (0297-2021-0023; регистрационный номер АААА-А21-121012190038-0).
Список литературы
Габышев В.А., Габышева О.И. Фитопланктон крупных рек Якутии и сопредельных территорий Восточной Сибири. Новосибирск: Изд. АНС “СибАК”, 2018. 416 с.
Гецен М.В., Стенина А.С., Патова Е.Н. Альгофлора Большеземельской тундры в условиях антропогенного воздействия. Екатеринбург: Наука, 1994. 145 с.
Денисов Д.Б., Кашулин Н.А. Цианопрокариоты в составе планктона оз. Имандра (К0ольский полуостров) // Тр. Кольского научного центра РАН. Прикладная экология Севера. Апатиты: Издательство КНЦ РАН, 2016. Вып. 4. № 7(41). С. 40–56.
Кашулин Н.А., Даувальтер В.А., Денисов Д.Б., Валькова С.А., Вандыш О.И., Терентьев П.М., Зубова Е.М., Королева И.М., Косова А.Л., Черепанов А.А. Комплексные исследования пресноводных экосистем Фенноскандии // Тр. Кольского научного центра РАН. Прикладная экология Севера. Апатиты: Издательство ФИЦ КНЦ РАН, 2018. Вып. 6. № 9(9). С. 34–86.
Комулайнен С.Ф., Чекрыжева Т.А., Вислянская И.Г. Альгофлора озер и рек Карелии. Таксономический состав и экология. Петрозаводск: Карельский научный центр РАН, 2006. 81 с.
Корнева Л.Г. Современные инвазии планктонных диатомовых водорослей в бассейне р. Волги и их причины // Биология внутренних вод. 2007. № 1. С. 30–39.
Корнева Л.Г. Инвазии чужеродных видов планктонных водорослей в пресных водах Голарктики (обзор) // Рос. журнал биол. инвазий. 2014. № 1. С. 9–37
Корнева Л.Г. Фитопланктон водохранилищ бассейна Волги. Кострома: Костромской печатный дом, 2015. 284 с.
Науменко Ю.В. Видовое разнообразие фитопланктона Оби // Сиб. экологический журнал. 1994. № 6. С. 575–580.
Ресурсы поверхностных вод СССР. Ленско-Индигирский район. Т. 17. Л.: Гидрометеоиздат., 1972. 651 с.
Ресурсы поверхностных вод СССР. Северо-Восток. Т. 19. Л.: Гидрометеоиздат, 1966. 602 с.
Садчиков А.П. Методы изучения пресноводного фитопланктона: методическое руководство. М.: Издательство “Университет и школа”, 2003. 157 с.
Angeler D.G., Drakare S. Tracing alpha, beta, and gamma diversity responses to environmental change in boreal lakes // Oecologia. 2013. V. 172. I. 4. P. 1191–1202. https:// doi.org/0101 10.1007/s00442-012-2554-y.
Atkinson D. Temperature and organism size – a biological law for ectotherms // Adv. Ecol. Res. 1994. V. 25. P. 1–58. https://doi.org/10.1016/s0065-2504(08)60212-3
Bondarenko N.A., Ozersky T., Obolkina L.A., Tikhonova I.V., Sorokovikova E.G., Sakirko M.V., Potapov S.A., Blinov V.V., Zhdanov A.A., Belykh O.I. Recent changes in the spring microplankton of Lake Baikal, Russia // Limnologica. 2019. V. 75. P. 19–29. https://doi.org/10.1016/j.limno.2019.01.002
Blois J.L., Williams J.W., Fitzpatrick M.C., Jackson S.T., Ferrier S. Space can substitute for time in predicting climate-change effects on biodiversity // Proc. Nat. Acad. Sci. USA. 2013. V. 110. I. 23. P. 9374–9379.https://doi.org/10.1073/pnas.1220228110
Chen C., Zhao L., Zhu C., Wang J., Jiang J., Yang S. Response of diatom community in Lugu Lake (Yunnan–Guizhou Plateau, China) to climate change over the past century // J. Paleolimnology. 2014. V. 51. I. 3. P. 357–373. https://doi.org/10.1007/s10933-013-9760-4
Daufresne M., Lengfellner K., Sommer U. Global warming benefits the small in aquatic ecosystems // Proc. Nat. Acad. Sci. USA. 2009. V. 106. I. 31. P. 12788–12793. https://doi.org/10.1073/pnas.0902080106
Field, C.B., Barros, V.R., Dokken, D.J., Mach, K.J., Mastrandrea, M.D., Bilir, T.E., Chatterjee M., Ebi K.L., Estrada Y.O., Genova R.C., Girma B., Kissel E.S., Levy A.N., MacCracken S., Mastrandrea P.R., White, L.L. IPCC 2014: Summary for policymakers in Climate Change 2014: Impacts, Adaptation, and Vulnerability. Part A: Global and Sectoral Aspects. Contribution of Working Group II to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge; New York: Cambridge University Press, 2014. P. 1–32.
Frey K.E., McClelland J.W. Impacts of permafrost degradation on arctic river biogeochemistry // Hydrological Processes. 2009. V. 23. I. 1. P. 169–182. https://doi.org/10.1002/hyp.7196
Gabyshev V.A. New approach to predicting change in aquatic ecosystems without having long-term monitoring data // Eur. J. Nat. History. 2018. № 3. P. 47–52. https://doi.org/10.4236/nr.2018.93006
Gaston K.J., Blackburn T.M. Patterns and Process in Macroecology. Oxford: Blackwell Science, 2000. 392 p. https://doi.org/10.1002/9780470999592.
George D.G. The influence of global warming on freshwater plankton communities in Britain // Freshwater Forum. 1991. V. 1. I. 3. P. 204–214.
Haykin S. Neural networks and learning machines. 3rd Edition. Upper Saddle River, NJ: Prentice Hall, 2009. 906 p.
Heino J. Regional gradient analysis of freshwater biota: do similar biogeographic patterns exist among multiple taxonomic groups? // J. Biogeography. 2001. V. 28, I. 1. P. 69–76. https://doi.org/10.1046/j.1365-2699.2001.00538.x
Heino J., Virkkala R., Toivonen H. Climate change and freshwater biodiversity: detected patterns, future trends and adaptations in northern regions // Biol. Rev. 2009. V. 84. I. 1. P. 39–54. https://doi.org/10.1111/j.1469-185X.2008.00060.x
Iatskiu P., Bovo-Scomparin V.M., Segovia B.T., Velho L.F.M., Lemke M.J., Rodrigues L.C. Variability in mean size of phytoplankton in two floodplain lakes of different climatic regions // Hydrobiologia. 2018. V. 823. I. 1. P. 135–151. https://doi.org/10.1007/s10750-018-3702-0
Magnuson J.J., Robertson D.M., Benson B.J., Wynne R.H., Livingstone D.M., Arai R.A., Barry R.G., Card V., Kuusisto E., Granin N.G., Prowse T.D., Stewart K.M., Vuglinski V.S. Historical trends in lake and river ice cover in the Northern Hemisphere // Science. 2000. V. 289. I. 5485. P. 1743–1746. https://doi.org/10.1126/science.289.5485.1743
Pickett S.T.A. Space-for-time substitution as an alternative to long-term studies // Long-Term Studies in Ecology. New York: Springer-Verlag, 1989. P. 110–135. https://doi.org/10.1007/978-1-4615-7358-6_5.
Rueger T., Sommer U. Warming does not always benefit the small – Results from a plankton experiment // Aquatic Botany. 2012. V. 97. I. 1. P. 64–68. https://doi.org/10.1016/j.aquabot.2011.12.001
Rühland K., Smol J.P. Diatom shifts as evidence for recent Subarctic warming in a remote tundra lake, NWT, Canada // Palaeogeography, Palaeoclimatology, Palaeoecology. 2005. V. 226. I. 1–2. P. 1–16. https://doi.org/10.1016/j.palaeo.2005.05.001
Rühland K., Paterson A.M., Smol J.P. Hemispheric-scale patterns of climate-related shifts in planktonic diatoms from North American and European lakes // Global Change Biology. 2008. V. 14. I. 11. P. 2740–2754. https://doi.org/10.1111/j.1365-2486.2008.01670.x
Saros J.E., Interlandi S.J., Wolfe A.P., Engstrom D.R. Recent changes in the diatom community structure of lakes in the Beartooth Mountain Range, USA // Arctic, Antarctic, and Alpine Research. 2003. V. 35. I. 1. P. 18–23.https://doi.org/10.1657/1523-0430(2003)035[0018:rcitdc]2.0.co;2
Schiaffino R.M., Unrein F., Gasol J.M., Massana R., Balague V., Izaguirre I. Bacterial community structure in a latitudinal gradient of lakes: the roles of spatial versus environmental factors // Freshwater Biology. 2011. V. 56. I. 10. P. 1973–1991. https://doi.org/10.1111/j.1365-2427.2011.02628.x
Sorvari S., Korhola A., Thompson R. Lake diatom response to recent Arctic warming in Finnish Lapland // Global Change Biology. 2002. V. 8. I. 2. P. 171–181. https://doi.org/10.1046/j.1365-2486.2002.00463.x
Strayer L.S., Dudgeon D. Freshwater biodiversity conservation: recent progress and future challenges // J. North Amer. Benthol. Society. 2010. V. 29. I. 1. P. 344–358. https://doi.org/10.1899/08-171.1
Vuglinsky V., Valatin D. Changes in Ice Cover Duration and Maximum Ice Thickness for Rivers and Lakes in the Asian Part of Russia // Nat. Res. 2018. V. 9. P. 73–87. https://doi.org/10.4236/nr.2018.93006
Winder M., Sommer U. Phytoplankton response to a changing climate // Hydrobiologia. 2012. V. 698. I. 1. P. 5–16. https://doi.org/10.1007/s10750-012-1149-2
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая