Известия РАН. Серия биологическая, 2021, № 6, стр. 622-628
Морфологические, экологические, физиологические и биохимические особенности Achillea × submicrantha Tzvelev (Asteraceae) в сравнении с родительскими видами
В. Н. Нестеров 1, *, С. А. Сенатор 1, С. В. Саксонов 1, В. М. Васюков 1, Е. С. Богданова 1, О. А. Розенцвет 1
1 Самарский федеральный исследовательский центр РАН,
Институт экологии Волжского бассейна РАН
445003 Тольятти, ул. Комзина, 10, Россия
* E-mail: nesvik1@mail.ru
Поступила в редакцию 28.05.2020
После доработки 15.06.2020
Принята к публикации 30.06.2020
Аннотация
Исследованы морфологические, экологические и физиолого-биохимические особенности представителей рода Achillea (Asteraceae). Объекты исследования – гибрид Achillea × submicrantha Tzvelev и его родительские виды A. micrantha Willd. и A. setacea Waldst. et Kit. A. × submicrantha габитуально схож с A. micrantha, отличаясь от него желтовато-белыми цветками и более широкими листьями. Гибридный вид менее подвержен окислительному стрессу, содержит больше зеленых пигментов, мембранных и запасных липидов, что говорит о его большей функциональной активности в сравнении с родительскими видами. С помощью метода искусственных нейронных сетей показано, что по физиолого-биохимическим признакам A. × submicrantha ближе к A. setacea.
Род Achillea L. (тысячелистник) из семейства Asteraceae Bercht. et J. Presl (сложноцветные) представлен, в основном, многолетними корневищными травами, реже – полукустарничками. В роде насчитывается от 115 до 200 видов, распространенных, как правило, в субтропических, умеренных и арктических регионах Евразии и Северной Америки (Цвелев, 1994; Ehrendorfer, Guo, 2006; Trock, 2006; Shi et al., 2011). В европейской части России разнообразие рода Achillea представлено 17 видами и их гибридами (Цвелев, 1994; Борский, 2018).
Широкое распространение гибридизации у тысячелистников вносит существенный вклад в видообразование (Rieseberg, Wills, 2007), обеспечивая перенос генов между видами и расширяя адаптационные возможности представителей рода Achillea, произрастающих в различных экологических условиях (Seehausen, 2004). Цвелев (1994) объясняет происхождение многих таксонов в роде Achillea межвидовой гибридизацией. Согласно Ehrendorfer, Guo (2006), гибридизация и дифференциация в роде Achillea сформировали сложные видовые комплексы и позволили его представителям заселить самые разнообразные местообитания по всему Северному полушарию (цит. по: Борский, 2018).
У представителей рода Achillea часто встречаются гибриды даже между морфологически четко разделенными таксонами с различными уровнями плоидности. Это свидетельствует о том, что вариация кариотипа у тысячелистников не играет большой роли в развитии репродуктивных барьеров (Baltisberger, Widmer, 2016). Известно, что межвидовые и внутривидовые скрещивания приводят к непредсказуемым изменениям генома и, как следствие, метаболома, тем самым влияя на морфологию, адаптацию, рост и развитие новых видов растений (Hammer, 1984). Исследования метаболизма гибридов растений (= нотовидов) может быть инструментом для создания новых форм на основе генетического материала дикорастущих видов при поиске продуцентов биологически активных соединений и гибридов, устойчивых к абиотическим и биотическим воздействиям (Недолужко, 2016; Rai et al., 2017).
Адаптационную способность растений можно оценить по ряду параметров, характеризующих их функциональную активность и уровень стресса. Например, по составу и содержанию липидов оценивается степень проницаемости клеточных мембран, структурные особенности фотосинтетического аппарата, уровень окислительно-восстановительного потенциала (Крепс, 1981; Гонтарь и др., 2006; Розенцвет и др., 2017; Labudda, 2013). Вместе с пигментами такие липиды как моно- (МГДГ) и дигалактозилдиацилглицерины (ДГДГ), сульфохиновозилдиацилглицерины (СХДГ), входящие в состав хлоропластов, участвуют в фотосинтезе (Nakamura, Li-Beisson, 2016). Предполагают, что каждая молекула таких веществ выполняет специфические биохимические и структурные функции (Хотимченко, 2003; Minoda et al., 2003; Wu et al., 2013; Розенцвет и др., 2019). Фосфолипиды (ФЛ), такие как фосфатидилхолин (ФХ), фосфатидилэтаноламин (ФЭ), как правило, составляют базис бислойных непластидных мембран клетки – плазмалеммы, тонопласта, ЭПР и пр. (Nakamura, 2017). Изменение параметров абсолютного и относительного содержания липидов сказывается на сохранении упорядоченности и структурированности мембран, необходимых для контроля клеточной проницаемости и функциональной активности (Розенцвет и др., 2017). Перекисное окисление липидов (ПОЛ) до сих пор является интегральной характеристикой соотношения процессов анаболизма и катаболизма биополимеров (Тарчевский, 2001). Основным субстратом ПОЛ в клетках являются полиненасыщенные жирные кислоты (ЖК) в составе липидов.
Многие представители рода Achillea используются в официальной и народной медицине во всем мире из-за присутствия в них флавоноидов, кумаринов, эфирных масел, обладающих высокой биологической активностью и выраженными целебными свойствами (Saeidnia et al., 2011; Растительные ресурсы…, 2012). При этом химический состав может существенно меняться в зависимости от вида растений и условий произрастания (Юсубов и др., 2000). Выявление степени химической изменчивости полиморфных видов с широким ареалом особенно важно для лекарственных растений, так как от этого зависят возможность заготовки лекарственного сырья и оценка его запасов.
Цель работы – сравнение физиолого-биохимических, морфологических и экологических особенностей гибрида Achillea × submicrantha Tzvelev и его родительских видов A. micrantha Willd. и A. setacea Waldst. et Kit.
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал собран 26.07.2017 г. на территории национального парка “Бузулукский бор” (Оренбургская область, Бузулукский район, 52°56′ с.ш., 52°02′ в.д.), где была заложена площадка 20 × 20 м, на которой произрастали все три вида. Влажность почвы составила 19%, рН 8.0. Из средней части листьев, собранных с 10–15 растений одного вида, формировали общую биомассу, отбирали три параллельные пробы, замораживали в жидком азоте и хранили до начала анализов.
Оводненность тканей рассчитывали после определения сырой и сухой массы (сыр. и сух. м.) и выражали в % от сыр. м.
Содержание пигментов определяли спектрофотометрически в ацетоновом экстракте (90%) на УФ-спектрофотометре ПЭ-3000 (Россия) при λ 662, 645 и 470 нм. Расчет концентрации хлорофиллов (Хл) а, b и каротиноидов (Кар) проводили в соответствии с рекомендациями Lichtenthaler (1987).
Интенсивность ПОЛ в листьях растений определяли по накоплению малонового диальдегида и его реакции с тиобарбитуровой кислотой (Uchiyama, Mihara, 1978).
Липиды экстрагировали смесью хлороформа и метанола (1 : 2) с одновременным механическим разрушением тканей (Кейтс, 1975). Разделение липидов осуществляли методом тонкослойной хроматографии. Количество мембранных ФЛ, гликолипидов (ГЛ) и запасных нейтральных липидов (НЛ) определяли денситометрическим методом, используя программу Денскан-04 (Россия). Хроматограммы анализировали в режиме параболической аппроксимации по градуировочным зависимостям, используя ФХ, МГДГ и стерины (СТ) в качестве стандартов.
Метанолиз ЖК осуществляли кипячением в 5%-ном растворе HCl в метаноле. Полученные эфиры анализировали на хроматографе Хроматэк Кристалл 5000.1 (Россия) в изотермическом режиме с использованием капиллярной колонки длиной 105 м и диаметром 0.25 мм RESTEK (США). Температура колонки – 180°С, испарителя и детектора – 260°С, скорость тока газа-носителя (гелий) – 2 мл/мин.
Статистика. Анализ каждого компонента проводили трижды в каждой параллельной пробе. На рисунках результаты представлены в виде средних значений параметра (Mean), их стандартных ошибок (SE), максимальных (Max) и минимальных (Min) значений. Дополнительно проведены стандартный дисперсионный анализ, а также метод моделирования на основе использования нейронных сетей для установления различий/сходства между видами растений. Расчеты выполняли, используя программы Statistica 10 for Windows, Microsoft Excel 2003, Past 3 и Statgraphics Centurion XVI.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Морфология и экология A. × submicrantha в сравнении с родительскими видами. В таб. 1 представлены характерные морфологические признаки исследуемых видов (Цвелев, 1994; Растительные ресурсы…., 2012; Борский, 2018). Можно отметить, что по габитусу A. × submicrantha ближе к A. micrantha.
Согласно Цвелеву (1994) и Борскому (2018), A. micrantha и A. setacea являются широко распространенными в степной зоне видами. При этом A. micrantha предпочитает песчаные почвы и каменистые осыпи, тогда как A. setacea населяет более широкий спектр биотопов, встречаясь в злаковых и разнотравных степях, а также по лесным опушкам. Нотовид встречается в полосе контакта родительских видов, как правило, на песках надпойменных террас и в песчаных степях.
Физиолого-биохимические свойства A. × submicrantha в сравнении с родительскими видами. Состояние растений оценивали по оводненности надземной части растений, содержанию мембранных липидов (МЛ), уровню пигментов и окислительных процессов. Вода – главный компонент активных растительных клеток, обычно на ее долю приходится до 90% сыр. м. зеленых растений (Алехина и др., 2005). Оводненность листьев всех трех видов Achillea была на одном уровне и составила 65–67% от сыр. м.
Уровень ПОЛ, характеризующий баланс между процессами катаболизма и анаболизма в клетках и тканях листа и отображающий степень стресса, показан на рис. 1а. У A.× submicrantha содержание МДА – маркера процессов ПОЛ, было в 1.8 раз ниже (F = 49, p = 0.001), чем у A. setacea и A. micrantha.
Рис. 1.
Содержание малонового диальдегида (МДА) (а) и пигментов (б) в листьях растений Achillea. 1 – Хл а, 2 – Хл b, 3 – Кар. I – A. setacea, II – A. micrantha, III – A. × submicrantha. Данные представлены как среднее арифметическое значение ± ошибка средней (n = 3, где n – число биологических проб).
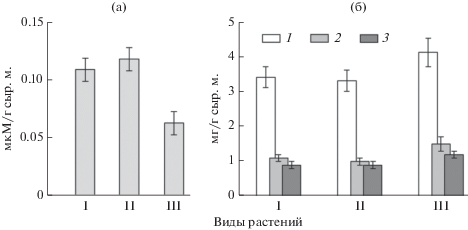
Количество пигментов у A. × submicrantha оказалось выше в сравнении с родительскими видами. Так количество Хл а было на 20% выше (F = 14, p = 0.01), чем у A. setacea и A. micrantha, а количество Хл b – на 43% (F = 21, p = 0.002) (рис. 1б). В результате отношение Хл а/b у A. × submicrantha было более низким – 2.7, в сравнении с A. setacea – 3.1 и A. micrantha – 3.3. Кроме того, содержание Кар у нотовида было также выше на 25%.
Процесс фотосинтеза в клетках листьев наряду с пигментами обеспечивается структурой мембран хлоропластов, главными компонентами которых являются ГЛ. По содержанию ГЛ A. × submicrantha заметно выделялся на фоне родительских видов, в листьях которого ГЛ было, в среднем, на 37% (F = 11, p = 0.01) больше (рис. 2а). Кроме того, исследованные виды различались по количеству индивидуальных ГЛ (рис. 2б). Причем, в составе ГЛ A. × × submicrantha обнаружен самый низкий уровень СХДГ (7% против 10.5%) (F = 34, p = 0.001) и самое высокое значение соотношения МГДГ/ДГДГ – 1.6 (F = 27, p = 0.001) против 1.3 у A. setacea и 1.4 у A. micrantha.
Рис. 2.
Общее содержание и состав гликолипидов (а, б), фосфолипидов (в, г) и нейтральных липидов (д, е) в листьях растений Achillea; б – гликолипиды: 1 – МГДГ, 2 – ДГДГ, 3 – СХДГ; г – фосфолипиды: 1 – ФХ, 2 – ФГ, 3 – ФК, 4 – ФИ, 5 – ФЭ, 6 – ДФГ; е – нейтральные липиды: 1 – ЭС, 2 – ДАГ, 3 – СЖК, 4 – ТАГ, 5 –СТ. I – A. setacea, II – A. micrantha, III – A. × submicrantha. Mean – среднее значение, Mean ± SE среднее значение и их стандартные ошибки, Max, Min – максимальное и минимальное значение. Данные представлены как среднее арифметическое значение ± ± ошибка средней (n = 3, где n – число биологических проб).
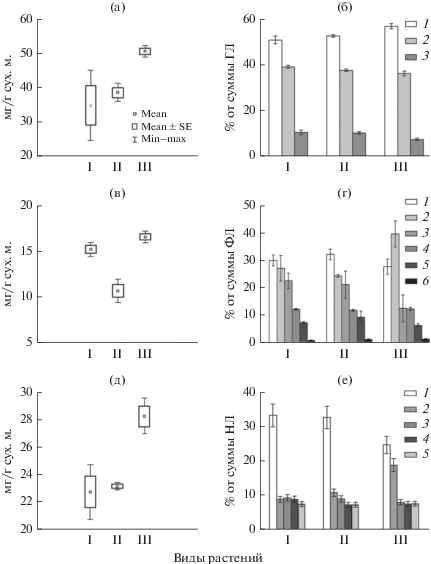
В отличие от ГЛ фосфорсодержащие липиды являются главными компонентами бислойных непластидных мембран клетки. Содержание ФЛ в листьях A. × submicrantha составило в среднем 16.5 мг/г сух. м. и было практически таким же как у A. setacea, но на 54% больше (F = 53, p = 0.001), чем у A. micrantha (рис. 2в). Еще большие различия обнаружены в составе индивидуальных ФЛ. Обычно в листьях растений основными ФЛ являются ФХ, ФЭ, фосфатидилглицерин (ФГ), в меньшем количестве присутствуют фосфатидилинозит (ФИ), фосфатидная кислота (ФК), дифосфатидилглицерин (ДФГ). На долю первых трех компонентов в листьях трех видов Achillea приходилось 64–74% от суммы ФЛ (рис. 2г). Необходимо отметить необычно высокий вклад ФГ в состав главных компонентов, доля которого у всех видов варьирует от 24 до 40% от суммы ФЛ. Причем у нотовида вклад ФГ был в 1.7 раза (F = 27, p = 0.001) выше в сравнении с родительскими видами. Однако у родительских видов был выше уровень ФК (F = 10, p = 0.01). В отношении остальных ФЛ каких-либо отличий не обнаружено.
Некоторые отличия выявлены также в количестве и составе НЛ, которые являются энергетическим и строительным резервом живой клетки. На рис. 2д показано, что общее содержание НЛ в листьях A. × submicrantha было выше, чем в родительских видах на 23% (F = 58, p = 0.001). При этом содержание компонентов, влияющих на структуру мембран – стеринов (СТ), у исследованных видов не различалось, также как не отличался уровень триацилглицеринов (ТАГ) и свободных жирных кислот (СЖК). Основные различия связаны с компонентами являющимися предшественниками в синтезе мембранных липидов, а именно диацилглицеринов (ДАГ), а также компонентами, выполняющими запасающие функции, такими как эфиры стеринов (ЭС) (рис. 2е). Отличия состава НЛ гибрида от A. setacea и A. micrantha заключались в более низком (на 8%) (F = 18, p = 0.004) содержании ЭС в клетках листьев и в более высоком содержании ДАГ (на 9%) (F = 47, p = 0.002). Следует отметить, что во всех видах Achillea основную запасающую функцию среди НЛ, по-видимому, выполняют ЭС, но не ТАГ.
Таблица 1.
Морфологические признаки трех таксонов Achillea
| Габитус/орган | Вид растений | ||
|---|---|---|---|
| A. setacea | A. micrantha | A. × submicrantha | |
| Внешний вид | Растение густо опушено длинными спутанными волосками, 10–60 см выс. | Растение, покрытое тонким сероватым войлочком, 20–50 см выс. Стебли простые, обычно с укороченными побегами в пазухах стеблевых листьев, реже – в верхней части слабо разветвленные | Сероватое от обильного, более или менее прижатого опушения многолетнее травянистое растение 15–50 см выс. с розеточными вегетативными побегами и прямостоячими облиственными цветущими стеблями |
| Корневая система | Корневища горизонтальные, длинные, дающие одиночные надземные побеги | Имеется каудекс либо короткое вертикальное корневище, иногда – тонкие горизонтальные ползучие корневища желтоватого цвета, дающие тесно расположенные надземные побеги | Корневище тонкое, с недлинными подземными побегами. Способен к активному вегетативному размножению – часто формирует клоны |
| Листья | Стержень листа 0.5–0.8 мм дл. Нижние листья в очертании узколанцетные, до 25 см дл., 2 см шир. Стеблевые листья триждыперистые. Листовых сегментов второго порядка 7 или 9 шт. | Стеблевые листья, как правило, перистые или дваждыперистые. Концевой шипик листа хорошо выражен, начинается внезапно. Промежуточных сегментов листа обычно нет | Листья очередные, 3–5(10) см дл. с рассеченными пластинками, в очертании линейные или ланцетные, без промежуточных долек или зубцов; доли первого порядка у основания до 1.5 мм шир. |
| Соцветия | Корзинки в плотных, сильно выпуклых, часто полушаровидных щитках, цилиндрические; обертки корзинок 2.8–3.3 мм дл. и 1.5–2.2 мм шир., листочки обертки без каймы по краю. Ложноязычковые цветки белые, 1–1.5 мм дл. | Корзинки в густых, слабо выпуклых щитках. Обертки 2–3 мм шир.; листочки обертки, как правило, с белой каймой по краям, килеватые. Ложноязычковые цветки, как правило, желтые | Общие соцветия – относительно густые сложные щитки. Обертки 2–3.3 мм дл. и 1.7–2.6 мм шир.; листочки обертки явно отделены от прицветников; цветоложе выпуклое. Ложноязычковые цветки светло-желтые или желтовато-белые |
Основными ЖК в листьях исследованных растений были С18:3, С18:2, С18:1, С16:0, С18:0. Их доля составила 89–92% от суммы всех ЖК (табл. 2). Относительное содержание главной ненасыщенной кислоты С18:3 у всех трех видов растений было на уровне 43–50% от суммы ЖК, главной насыщенной кислоты С16:0 – на уровне 18–20%. То есть, состав ЖК A. × submicrantha практически не отличался от состава ЖК A. setacea и A. micrantha.
Таблица 2.
Состав основных жирных кислот в листьях растений Achillea
| Жирные кислоты | A. setacea | A. micrantha | A. × submicrantha |
|---|---|---|---|
| С16:0 | 20.1 ± 2.1 | 18.8 ± 0.8 | 17.8 ± 1.8 |
| С18:0 | 1.2 ± 0.2 | 1.4 ± 0.2 | 1.1 ± 0.3 |
| С18:1 | 3.9 ± 1.9 | 2.9 ± 0.5 | 3.5 ± 1.5 |
| С18:2 | 22.8 ± 1.8 | 19.3 ± 1.3 | 19.7 ± 2.7 |
| С18:3 | 42.6 ± 2.3 | 46.7 ± 2.6 | 50.4 ± 4.0 |
| Другие | 9.4 ± 0.4 | 10.9 ± 1.0 | 7.5 ± 1.2 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведенный анализ морфологических признаков выявил как черты сходства, так и различий у A. × submicrantha в сравнении с родительскими видами. A. × submicrantha габитуально схож с A. micrantha, отличаясь от него желтовато-белыми цветками и более широкими листьями.
В то же время анализ особенностей физиолого-биохимического состава позволил выявить, что A. × submicrantha менее подвержен окислительному стрессу, при этом в его листьях содержится больше зеленых пигментов, мембранных и запасных липидов, что говорит о его большей функциональной активности. Следует отметить, что в составе липидов наиболее быстро и выраженно отображаются все изменения, происходящие в организме, инициируемые как внутренними, так и внешними факторами (Акмурзина, 2012).
Для выявления степени родства A. × submicrantha по отношению к родительским видам по всем исследованным физиолого-биохимическим параметрам и их комбинациям была обучена нейронная сеть (на основе характеристик родительских видов A. setacea и A. micrantha), которая в 83% случаев правильно определяла виды A. setacea и A. micrantha (рис. 3).
Рис. 3.
Архитектура построенной сети. Слева – 10 биохимических характеристик (уровень ПОЛ, содержание пигментов, содержание общих и индивидуальных ГЛ, ФЛ, НЛ) по которым обучалась сеть. Справа – результат классификации: A. setacea и A. micrantha.
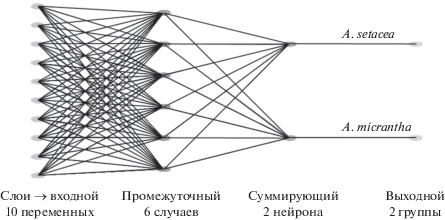
Проведенный анализ нотовида в сравнении с родительскими видами с использованием нейронной сети показал, что в отличие от внешнего сходства с A. micrantha по физиолого-биохимическим признакам нотовид ближе расположен к A. setacea. Это может быть связано с элиминацией хромосом одного из родителей, что приводит к изменениям функциональных параметров и влияет на морфологию, адаптацию, рост и развитие нового вида растений (Hammer, 1984; Родионов и др., 2019). Появление A. × submicrantha в природе привело к тому, что он занял не промежуточное положение между A. setacea и A. micrantha по липидному и пигментному профилю листьев, а получил “новые” биохимические особенности, которые, вероятно, и позволили ему занять часть ареала родительских видов. Большее содержание зеленых пигментов может положительно отразиться на способности растения к улавливанию света и увеличению фотосинтетической активности. Это в свою очередь влияет на синтез биополимеров, с чем может быть связано более высокое содержание мембранных ГЛ, ФЛ и запасных НЛ. Возможно, в случае с Achillea конкурентное преимущество в плане роста и распространения получит именно A. × submicrantha, а не A. setacea и A. micrantha.
Представленный в работе подход к исследованию гибридов растений, основанный на выявлении их физиолого-биохимических особенностей и применении моделирования на основе нейронных сетей с привлечением родительских видов, может использоваться для анализа процессов видообразования и прогноза распространения новых видов растений, а также для отбора видов с заданными свойствами.
Список литературы
Акмурзина В.А., Селищева А.А., Швец В.И. От анализа липидов к липидомике // Вестник МИТХТ. 2012. № 6. С. 3–21.
Алехина Н.Д., Балнокин Ю.В., Гавриленко В.Ф., Жигалова Т.В., Мейчик Н.Р., Носов А.М., Полесская О.Г., Харитонашвилли Е.В., Чуб В.В. // Физиология растений. М.: Изд. Центр Академия, 2005. 640 с.
Борский М.Н. Изменчивость и таксономия видов рода Achillea L. (подрода Achillea) Европейской России: дисс. … канд. биол. наук. М.: МСХА им. К.А. Тимирязева, 2018. 222 с.
Гонтарь О.Б., Жиров В.К., Хаитбаев А.Х., Говорова А.Ф. Возрастные аспекты адаптации растений в экстремальных условиях // Вестник МГТУ. 2006. № 5. С. 729–734.
Кейтс М. Техника липидологии. М.: Мир, 1975. 322 с.
Крепс Е.М. Липиды клеточных мембран. Л.: Наука, 1981. 339 с.
Недолужко А.И. Межвидовые гибриды некоторых восточно-азиатских представителей рода Chrysanthemum L. и анализ их устойчивости // Вавиловский журн. генетики и селекции. 2016. № 5. С. 658–665.
Растительные ресурсы России: дикорастущие цветковые растения, их компонентный состав и биологическая активность. Т. 5. Семейство Asteraceae (Compositae). Ч. 1. Роды Achillea – Doronicum. СПб.; М.: Товарищество науч. изд. КМК, 2012. 316 с.
Родионов А.В., Амосова А.В., Беляков Е.А., Журбенко П.М., Михайлова Ю.В., Пунина Е.О., Шнеер В.С., Лоскутов И.Г., Муравенко О.В. Генетические последствия межвидовой гибридизации, ее роль в видообразовании и фенотипическом разнообразии растений // Генетика. 2019. № 3. С. 255–272.
Розенцвет О.А., Нестеров В.Н., Богданова Е.С. Структурные и физиолого-биохимические аспекты солеустойчивости галофитов // Физиология растений. 2017. № 4. С. 251–265.
Розенцвет О.А., Кособрюхов А.А., Богданова Е.С., Нестеров В.Н. Дневная динамика структурно-функциональных параметров фотосинтетического аппарата галофитов дикой флоры // Физиология растений. 2019. № 6. С. 1–10.
Тарчевский И.А. Метаболизм растений при стрессе. Казань: Фэн, 2001. 448 с.
Хотимченко С.В. Липиды морских водорослей-макрофитов и трав. Структура. Распределение. Анализ. Владивосток: Дальнаука, 2003. 233 с.
Цвелев Н.Н. Флора европейской части СССР. Т. 7. СПб.: Наука, 1994. С. 114–127.
Юсубов М.С., Калинкина Г.И., Дрыгунова Л.А., Покровский Л.М., Королюк Е.А., Ткачев А.В. Химический состав эфирного масла тысячелистников обыкновенного (Achillea millefolium L.) и азиатского (Achillea asiatica Serg.) // Химия растительного сырья. 2000. № 3. С. 25–32.
Baltisberger M., Widmer A. Chromosome numbers and karyotypes within the genus Achillea (Asteraceae: Anthemideae) // Willdenowia. 2016. V. 46. P. 121–135.
Ehrendorfer F., Guo Y.-P. Multidisciplinary studies Achillea L. sensu lato (Compositae – Anthemideae): new data on systematics and phylogeography // Willdenowia. 2006. V. 36. P. 69–87.
Hammer K. Das domestikationssyndrom // Kulturpflanze. 1984. V. 32. P. 11–34.
Labudda M. Lipid peroxidation as a biochemical marker for oxidative stress during drought. An effective tool for plant breeding. E-wydawnictwo, Poland. 2013. http://org./doi:wydawnictwo.eu/document/documentpreview/3342. P. 1–12.
Lichtenthaler H.K. Chlorophyll and carotinoids: pigments of photosyntethetic biomembranes // Meth. Enzimol. 1987. V. 48. P. 331–382.
Minoda A., Sonoike K., Okada K., Sato N., Tsuzuki M. Decrease in the efficiency of the electron donation to tyrosine Z of photosystem II in an SQDG-deficient mutant of Chlamydomonas // FEBS Lett. 2003. V. 553. P. 109–112.
Nakamura Y., Li-Beisson Y. Lipids in plant and algae development. Springer International Publishing: Switzerland, 2016. 533 p.
Nakamura Y. Plant phospholipid diversity: emerging functions in metabolism and protein-lipid // Trend Plants Sci. 2017. V. 22. P. 1027–1040.
Rai A., Saito K., Yamazaki M. Integrated omics analysis of specialized metabolism in medicinal plants // Plant J. 2017. V. 90. P. 764–787.
Rieseberg L.H., Wills J.H. Plant speciation // Science. 2007. V. 317. P. 910–913.
Saeidnia S., Gohari A.R., Mokhber-Dezfuli N., Kiuchi F. A review on phytochemistry and medicinal properties of the genus Achillea // DARU J. Pharm. Sci. 2011. V. 19. P. 173–186.
Seehausen O. Hybridization and adaptive radiation // Trends Ecol. Evol. 2004. V. 19. P. 198–207.
Shi Z., Humphries C.J., Gilbert M.G. Achillea // Flora of China Vols. 20–21 (Asteraceae) / Eds Wu Z.Y., Raven P.H. Beijing: Science Press, Missouri Botanical Garden Press, 2011. P. 759–762.
Trock D.K. Achillea / Flora of North America North of Mexico. New York, Oxford University Press. 2006. P. 492–494.
Wu W., Ping W., Wu H., Li M., Gu D., Xu Y. Monogalactosyldiacylglycerol deficiency in tobacco inhibits the cytochrome b6f-mediated intersystem electron transport process and affects the photostability of the photosystem II apparatus // Biochim. Biophys. Acta. 2013. V. 1827. P. 709–722.
Uchiyama M., Mihara M. Determination of malonaldehyde precursor in tissues by thiobarbituric acid test // Anal. Biochem. 1978. V. 86. P. 287–297.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


