Известия РАН. Серия биологическая, 2021, № 6, стр. 594-601
Различие содержания ионов в крови у кумжи Salmo trutta из двух близкорасположенных рек до смолтификации
Е. Д. Павлов 1, *, Е. В. Ганжа 1, Д. С. Павлов 1
1 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
* E-mail: p-a-v@nxt.ru
Поступила в редакцию 09.03.2021
После доработки 27.03.2021
Принята к публикации 27.03.2021
Аннотация
Проведено сравнение содержания ионов Cl–, Ca2+, Na+ и K+ в крови кумжи Salmo trutta из двух рек бассейна Ладожского озера – Алатсоя и Улмасенйоки. Концентрация Cl– и Ca2+ в крови рыб различается и коррелирует с содержанием хлоридов и гидрокарбонатов в реках. Уровень Na+ (у рыб в обеих реках) и Cl– (у рыб в р. Улмасенйоки) повышается к возрасту особей 2+, в дальнейшем (в возрасте ≥3+) практически не меняется. Выявлен половой диморфизм по концентрации K+ в крови – у самок содержание этого иона на 13% выше, чем у самцов. У самок в возрасте 1+ в р. Улмасенйоки содержание K+ заметно выше, чем у самок того же возраста в р. Алатсоя. Предполагается, что, наряду с другими факторами, изменения ионного состава у кумжи за полгода до смолтификации может определять степень их подготовки к покатной миграции.
Многим лососевым свойственна внутрипопуляционная дифференциация, при которой особи выбирают резидентную или анадромную жизненные стратегии, формирующиеся в ранний период развития рыб (Jonsson, Jonsson, 2011, 2014; Ferguson et al., 2019). Кумжа Salmo trutta обитает во многих реках Фенноскандии и характеризуется разнообразием условий обитания, которые во многом определяют жизненный цикл и физиологическое состояние рыб, а также долю проходных особей в популяции (Northcote, 1984; Lucas, Baras, 2001; Jonsson, Jonsson, 2011, 2018; Huusko et al., 2018).
Способность к модификации осморегуляции является одним из механизмов реализации у особей проходной жизненной стратегии (McCormick, 2001; Jonsson, Jonsson, 2011; Zydlewski, Wilkie, 2012; Ferguson et al., 2019). На примере черноморской кумжи Salmo trutta labrax показано, что у смолтов изменение концентрации ионов происходит еще в пресной воде – повышаются Na+ и Ca2+ в крови, а K+ и Cl– снижается (Павлов и др., 2017). На данный момент неизвестно, за какое время до смолтификации наступают изменения в осморегуляции у проходной кумжи Salmo trutta. Есть гипотеза (Thorpe et al., 1998) о том, что подготовка к смолтификации у атлантического лосося Salmo salar начинается в конце лета, предшествующего последующей весенней покатной миграции смолтов, т.е. более чем за 6 мес. до смолтификации. Гетерогенность условий обитания в период, предшествующий смолтификации, связана с долей мигрантов в популяции (Thorpe et al., 1987). Кумжа, как и многие другие лососевые (Груздева и др., 2017), способна смолтифицироваться в разном возрасте (чаще в 2–3 года) (L’Abée-Lund et al., 1989; Jonsson, L’Abée-Lund, 1993; Jonsson et al., 2001), что предполагает возможность модификации ионного состава крови у рыб на протяжении всей жизни в пресной воде. Ранее нами установлено (Павлов, Павлов, 2018), что кумжа из разных водоемов бассейнов Ладожского и Онежского озер, различается по уровню ионов. Однако остается до конца неясно, насколько велика степень изменчивости ионного состава крови у кумжи из разных рек, разного возраста и биологического состояния.
Цель работы – сравнить уровень Cl–, Ca2+ Na+ и K+ в крови кумжи разного возраста за полгода до смолтификации из двух близкорасположенных рек Фенноскандии.
МАТЕРИАЛЫ И МЕТОДЫ
Работа проведена в августе 2019 г. на рыбах, отловленных в двух реках, относящихся к бассейну Ладожского озера – р. Алатсоя и р. Улмaсенйоки (рис. 1). Река Улмaсенйоки имеет протяженность всего 2.7 км, а ее истоком является озеро Суйстамонъярви (61°53′36.3′′ N 31°08′12.2′′ E). Эта река впадает в более крупное озеро Янисъярви, соединяющееся через р. Янисйоки с Ладожским озером. Длина реки Алатсоя составляет 14 км, а ее истоком является оз. Алатунлампи (http://textual.ru/gvr), которое находится в 5 км на юго-запад от оз. Суйстамонъярви (61°52′30.8′′ N 31°03′01.8′′ E). Таким образом, истоки двух рек расположены рядом друг с другом, но не соединены между собой. Река Алатсоя впадает в р. Янисъйоки в среднем течении. На реке Янисъйоки расположены две плотины, не имеющие рыбохода и блокирующие возврат производителей кумжи из озера на нерест в реки Улмасенйоки и Алатсоя. Тем не менее, в реках бассейнов Ладожского озера часть молоди кумжи смолтифицируется, выбирая проходную жизненную стратегию (Павлов, Павлов, 2018). Смолтификация и покатная миграция кумжи в северной части ареала, как правило, происходит в апреле–мае (Rasmussen, 1986; Bohlin et al., 1993). Период проведения работ был выбран такой, когда смолты (под термином “смолт” понимается особь, совершающая покатные миграции независимо от конечного пункта этих миграций – река, озеро, море (Jones et al., 2015; Huusko et al., 2018; Ferguson et al., 2019)) кумжи в исследованных реках отсутствуют (за полгода до смолтификации). Это позволяет оценить неоднородность рыб по ионному составу задолго до подготовки смолтов к покатной миграции.
Для оценки гидрохимии исследованных водоемов в начале сентября (через две недели после отлова рыб) с помощью портативного многопараметрового прибора WTW Multi 3620 Set G были определены температура воды, pH, общая масса растворенных примесей (TDS), окислительно-восстановительный потенциал (ОВП, U), проводимость (ϗ), удельное электрическое сопротивление (ρ). Уровень ионов Na+, K+, Ca2+, гидрокарбонатов и хлоридов в воде определяли в Центре лабораторного анализа и технических измерений по Республике Карелия (ЦЛАТИ по Республике Карелия, г. Петрозаводск) с помощью спектрометра эмиссионного с индуктивно связанной плазмой Optima 7000DV и ионного хроматографа “Стайер”.
Кумжа отловлена с помощью электролова Fa-2 (Норвегия). В период исследования встречались молодь (пестрятки) и половозрелые особи в возрасте ≥1+. Все пестрятки и половозрелые особи в возрасте 1+ имеют окраску серого цвета с оливковым оттенком и ярко выраженные черные поперечные полосы по бокам тела. Окраска половозрелой кумжи старшего возраста (≥3+) оливковая с темным оттенком на дорзальной стороне тела до светлого на вентральной. По всему телу яркие красные пятна чередуются с небольшими черными пятнами неправильной формы. В течение часа после поимки рыб перевозили в лабораторию в аэрируемом баке, объемом 100 л (плотность посадки ≤300 экз./м3). Перевозку осуществляли в воде из того же водоема, в котором были пойманы рыбы.
В течение 3-х часов после поимки у рыб прижизненно отбирали кровь из хвостовой вены за анальным плавником шприцом объемом 1 мл (объем пробы в зависимости от размера особи варьировал от 100 до 300 мкл). Концентрацию Cl–, Ca2+, Na+ и K+ определяли индивидуально (для каждой особи) в цельной крови непосредственно после ее отбора портативным прибором Abbot i‑STAT 1 (“Abbott Point-of-Care Inc.”) с набором одноразовых картриджей CHEM 8+. У особей измеряли длину по Смиту (L) и массу (W) тела, определяли пол (по морфологическому строению половых желез при вскрытии), возраст (по чешуе) и стадию зрелости половых желез (Макеева, 1992): II‑я стадия у молоди, III–IV-я – у половозрелых рыб.
Всего выловлено и проанализировано 83 экз. рыб, из них 42 экз. из р. Алатсоя и 41 экз. из р. Улмасенйоки. Статистическая обработка материала выполнена по индивидуальным и обобщенным показателям, совокупность значений в выборках соответствует нормальному распределению – p > 0.05 (Колмогоров-Смирнов). Малые реки Республики Карелия, как правило, характеризуются низкой численностью кумжи (Веселов и др., 2016). Принимая во внимание ограниченность выборки, был проведен дисперсионный анализ (ANOVA) для оценки связи содержания ионов в крови кумжи с принадлежностью особи к конкретной реке, ее возрастом и полом. Использован коэффициент корреляции Пирсона, t-критерий Стьюдента.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Физико-химические показатели рек. Исследуемые реки различаются по ряду физико-химических показателей (табл. 1). Температура воды в р. Улмасенйоки заметно ниже, чем в Алатсоя, за счет впадения родника в ее нижнем течении. Общая минерализация (TDS) в реках низкая, не превышает 37 мг/л, что обуславливает низкую электропроводность воды и высокое ее удельное электрическое сопротивление, затрудняющие отлов кумжи электроловом. Наибольший вклад в общую минерализацию вносят неорганические соли (бикарбонаты, хлориды и сульфаты кальция, калия и натрия), а также небольшое количество органических веществ. Исследованные реки характеризуются положительным окислительно-восстановительным потенциалом. Вода в р. Улмасенйоки имеет низкую концентрацию Na+ и высокую концентрацию хлоридов. Высокое удельное электрическое сопротивление воды в р. Улмасенйоки обусловлено не только ее низкой минерализацией, но и низкой температурой воды.
Таблица 1.
Физико-химические показатели воды в исследованных реках
| Показатель | р. Алатсоя | р. Улмасенйоки |
|---|---|---|
| Температура, °C | 13.0 | 8.5 |
| Ph | 6.719 | 7.021 |
| Na+, мг/дм3 | 0.98 ± 0.23 | <0.5 |
| K+, мг/дм3 | 0.21 ± 0.05 | 0.2 ± 0.05 |
| Ca2+, мг/дм3 | 3.2 ± 0.5 | 3.8 ± 0.6 |
| Гидрокарбонаты, мг/дм3 | 58 ± 6 | 43 ± 6 |
| Хлориды, мг/дм3 | 1.85 ± 0.28 | 7.0 ± 1.0 |
| Общая масса растворенных примесей (TDS), мг/л | 37 | 33 |
| Окислительно-восстановительный потенциал (ОВП, U), мВ | 12.7‒22.8 | 0.2‒1.4 |
| Электропроводность (ϗ), мкСм/см | 37 | 32.7 |
Возрастная структура и биологические показатели кумжи. В реках были отловлены пестрятки (57 экз.) и половозрелые особи (26 экз.). Половозрелые особи в р. Алатсоя были представлены только самцами, возраст которых соответствовал возрасту пестряток (табл. 2). В р. Улмасенйоки половозрелые самки и самцы были старше пестряток.
Таблица 2.
Возрастная структура и биологические показатели кумжи Salmo trutta из рр. Алатсоя и Улмасенйоки
| Река | Группа и возраст | FL, см | W, г | n, экз. |
|---|---|---|---|---|
| Алатсоя | Пестрятки 1+ | $\frac{{12.4 \pm 0.12}}{{10.9{\kern 1pt} - {\kern 1pt} 13.3}}$ | $\frac{{21.8 \pm 0.60}}{{15.4{\kern 1pt} - {\kern 1pt} 26.6}}$ | 25 |
| Пестрятки 2+ | $\frac{{17.3 \pm 0.53}}{{14.9{\kern 1pt} - {\kern 1pt} 19.3}}$ | $\frac{{56.5 \pm 5.16}}{{36.7{\kern 1pt} - {\kern 1pt} 76.5}}$ | 7 | |
| Половозрелые особи 1+...2+ | $\frac{{17.0 \pm 0.71}}{{12.9{\kern 1pt} - {\kern 1pt} 19.6}}$ | $\frac{{61.6 \pm 6.20}}{{25.6{\kern 1pt} - {\kern 1pt} 84.5}}$ | 10 | |
| Улмасенйоки | Пестрятки 1+ | $\frac{{15.5 \pm 0.30}}{{12.8{\kern 1pt} - {\kern 1pt} 18.2}}$ | $\frac{{40.9 \pm 2.45}}{{20.5{\kern 1pt} - {\kern 1pt} 61.5}}$ | 17 |
| Пестрятки 2+ | $\frac{{18.9 \pm 0.61}}{{15.5{\kern 1pt} - {\kern 1pt} 20.1}}$ | $\frac{{70.9 \pm 6.03}}{{43.1{\kern 1pt} - {\kern 1pt} 87.9}}$ | 8 | |
| Половозрелые особи 3+...6+ | $\frac{{29 \pm 1.6}}{{21{\kern 1pt} - {\kern 1pt} 47}}$ | $\frac{{263 \pm 46.8}}{{96{\kern 1pt} - {\kern 1pt} 820}}$ | 16 |
Однофакторный дисперсионный анализ показал, что длина и масса тела пестряток в возрасте 1+ в р. Улмасенйоки заметно (почти в 2 раза по массе), выше (p < 0.001 по t-критерию Стьюдента), чем у пестряток из р. Алатсоя; к возрасту 2+ различия нивелируются (p > 0.05).
Уровень Cl–, Ca2+, Na+ и K+ в крови кумжи. Концентрация ионов в крови кумжи представлена в табл. 3. У пестряток самок в возрасте 1+ из р. Улмасенйоки уровень K+ значительно выше, чем у пестряток самцов 1+ из той же реки и пестряток самок 1+ из р. Алатсоя (соответственно p = 0.001 и p = 0.01 по t-критерию Стьюдента). Концентрация Cl– в крови пестряток самцов 1+ из р. Алатсоя ниже, чем у особей той же группы из р. Улмасенйоки. Другие различия не выявлены (p > 0.05).
Таблица 3.
Концентрация Cl–, Ca2+, Na+ и K+ в крови кумжи Salmo trutta, ммоль/л
| Группа и возраст | Пол | Cl– | Ca2+ | Na+ | K+ | n, экз. |
|---|---|---|---|---|---|---|
| р. Алатсоя | ||||||
| Пестрятки 1+ | ♀ | $\frac{{127 \pm 0.91}}{{19{\kern 1pt} - {\kern 1pt} 130}}$ | $\frac{{1.56 \pm 0.034}}{{1.40{\kern 1pt} - {\kern 1pt} 1.77}}$ | $\frac{{143 \pm 1.0}}{{137{\kern 1pt} - {\kern 1pt} 147}}$ | $\frac{{4.4 \pm 0.21}}{{3.6{\kern 1pt} - {\kern 1pt} 5.6}}$ | 12 |
| ♂ | $\frac{{126 \pm 0.91}}{{21{\kern 1pt} - {\kern 1pt} 131}}$ | $\frac{{1.62 \pm 0.026}}{{1.47{\kern 1pt} - {\kern 1pt} 1.80}}$ | $\frac{{144 \pm 0.6}}{{141{\kern 1pt} - {\kern 1pt} 148}}$ | $\frac{{4.2 \pm 0.19}}{{2.9{\kern 1pt} - {\kern 1pt} 5.1}}$ | 13 | |
| Пестрятки 2+ | ♀ | $\frac{{130 \pm 1.41}}{{24{\kern 1pt} - {\kern 1pt} 134}}$ | $\frac{{1.58 \pm 0.036}}{{1.40{\kern 1pt} - {\kern 1pt} 1.63}}$ | $\frac{{146 \pm 0.7}}{{144{\kern 1pt} - {\kern 1pt} 148}}$ | $\frac{{4.1 \pm 0.31}}{{3.4{\kern 1pt} - {\kern 1pt} 5.5}}$ | 6 |
| ♂ | 123 | 1.45 | 141 | 3.5 | 1 | |
| Половозрелые особи 1+...2+ | ♂ | $\frac{{128 \pm 0.91}}{{24{\kern 1pt} - {\kern 1pt} 132}}$ | $\frac{{1.56 \pm 0.024}}{{1.47{\kern 1pt} - {\kern 1pt} 1.70}}$ | $\frac{{145 \pm 1.0}}{{140{\kern 1pt} - {\kern 1pt} 150}}$ | $\frac{{4.3 \pm 0.16}}{{3.5{\kern 1pt} - {\kern 1pt} 5.1}}$ | 10 |
| р. Улмасенйоки | ||||||
| Пестрятки 1+ | ♀ | $\frac{{127 \pm 1.81}}{{15{\kern 1pt} - {\kern 1pt} 135}}$ | $\frac{{1.49 \pm 0.050}}{{1.25{\kern 1pt} - {\kern 1pt} 1.66}}$ | $\frac{{141 \pm 1.4}}{{133{\kern 1pt} - {\kern 1pt} 147}}$ | $\frac{{5.5 \pm 0.16}}{{4.4{\kern 1pt} - {\kern 1pt} 7.3}}$ | 10 |
| ♂ | $\frac{{130 \pm 1.01}}{{27{\kern 1pt} - {\kern 1pt} 133}}$ | $\frac{{1.45 \pm 0.038}}{{1.33{\kern 1pt} - {\kern 1pt} 1.57}}$ | $\frac{{143 \pm 1.0}}{{141{\kern 1pt} - {\kern 1pt} 149}}$ | $\frac{{4.1 \pm 0.17}}{{3.4{\kern 1pt} - {\kern 1pt} 4.7}}$ | 7 | |
| Пестрятки 2+ | ♀ | $\frac{{135{\text{ }} \pm {\text{ }}1.0}}{{134{\kern 1pt} - {\kern 1pt} 137}}$ | $\frac{{1.62 \pm 0.040}}{{1.57{\kern 1pt} - {\kern 1pt} 1.70}}$ | $\frac{{146 \pm 0.31}}{{45{\kern 1pt} - {\kern 1pt} 146}}$ | $\frac{{4.4 \pm 0.49}}{{3.5{\kern 1pt} - {\kern 1pt} 5.2}}$ | 3 |
| ♂ | $\frac{{132 \pm 2.7}}{{123{\kern 1pt} - {\kern 1pt} 140}}$ | $\frac{{1.51 \pm 0.065}}{{1.27{\kern 1pt} - {\kern 1pt} 1.63}}$ | $\frac{{146 \pm 1.7}}{{142{\kern 1pt} - {\kern 1pt} 150}}$ | $\frac{{4.1 \pm 0.29}}{{3.2{\kern 1pt} - {\kern 1pt} 4.9}}$ | 5 | |
| Половозрелые особи 3+...6+ | ♀ | $\frac{{132 \pm 2.0}}{{126{\kern 1pt} - {\kern 1pt} 136}}$ | $\frac{{1.54 \pm 0.061}}{{1.31{\kern 1pt} - {\kern 1pt} 1.77}}$ | $\frac{{147 \pm 1.5}}{{142{\kern 1pt} - {\kern 1pt} 153}}$ | $\frac{{4.8 \pm 0.37}}{{3.7{\kern 1pt} - {\kern 1pt} 6.6}}$ | 7 |
| ♂ | $\frac{{133 \pm 2.1}}{{121{\kern 1pt} - {\kern 1pt} 139}}$ | $\frac{{1.53 \pm 0.052}}{{1.40{\kern 1pt} - {\kern 1pt} 1.77}}$ | $\frac{{147 \pm 1.9}}{{136{\kern 1pt} - {\kern 1pt} 156}}$ | $\frac{{4.1 \pm 0.35}}{{3.1{\kern 1pt} - {\kern 1pt} 6.1}}$ | 9 | |
Дисперсионный анализ показал, что кумжа из двух рек различается только по содержанию двух ионов – Ca2+ и Cl– (табл. 4). Концентрация в крови двух других ионов (Na+ и K+) одинакова у рыб из двух рек (p > 0.05). Концентрация ионов Cl– и Na+, связана с возрастом рыб. Содержание K+ в крови кумжи связано только с полом особи.
Таблица 4.
Уровни значимости (p) зависимости концентрации ионов Cl–, Ca2+, Na+ и K+ в крови кумжи Salmo trutta (однофакторный дисперсионный анализ ANOVA) от возраста, пола и принадлежности рыб к реке. Выделены значения p < 0.05
| Cl‒ | Ca2+ | Na+ | K+ | |
|---|---|---|---|---|
| Река | 0.001/0.018 | 0.035/0.040 | 0.600/0.403 | 0.131/0.078 |
| Возраст | 0.014/0.005 | 0.146/0.630 | 0.019/0.003 | 0.162/0.088 |
| Пол | 0.782/0.560 | 0.780/0.711 | 0.583/0.767 | 0.005/0.017 |
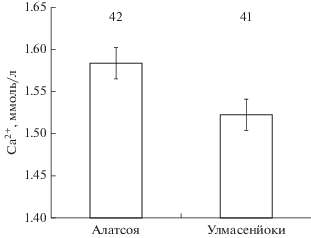
У рыб старшего возраста (≥2+) из р. Алатсоя уровень Cl‒ в крови заметно ниже (p = 0.003 здесь и далее по t-критерию Стьюдента), чем у особей из р. Улмасенйоки (рис. 2). Достоверные различия (p = 0.018) по концентрациям Cl– получены только между рыбами из р. Улмасенйоки в возрасте 1+ и особями старшего возраста (≥2+); у кумжи из р. Алатсоя прослеживается сходная тенденция. Концентрация Ca2+ выше у рыб из р. Алатсоя по сравнению с кумжей из р. Улмасенйоки (рис. 3). Высокий уровень Cl– у рыб старшего возраста (≥2+) и Ca2+ у разновозрастных особей из рр. Алатсоя и Улмасенйоки соответствует повышенному содержанию хлоридов (7.0 против 1.85 мг/дм3) и гидрокарбонатов (58 против 43 мг/дм3) в воде исследованных рек.
Рис. 2.
Концентрация Cl– в крови кумжи Salmo trutta в возрасте 1+ и ≥2+ из двух близкорасположенных рек. Различия достоверны между а и б по t-критерию Стьюдента (p < 0.05). Рис. 2–5 построены по суммарным выборкам рыб на основании данных из табл. 4 – уровень каждого иона оценен по достоверным различиям (p > 0.05). Здесь и на рис. 3–5 (│) – ошибка средней, цифры над столбиками – число экз. (n).
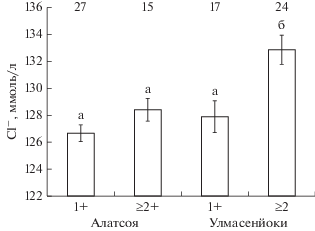
Рис. 3.
Концентрация Ca2+ в крови кумжи Salmo trutta из рр. Алатсоя и Улмасенйоки. Здесь и на рис. 4–5 различия между столбцами достоверны по ANOVA (p < 0.05).
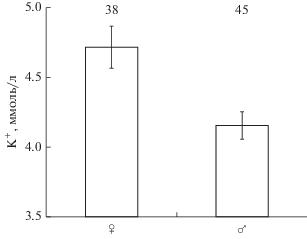
Уровни ионов Na+ повышаются в крови кумжи к возрасту 2+, в дальнейшем (возраст ≥3) концентрация этих ионов у особей заметно не меняется (p > 0.05) (рис 4). В крови самок уровень K+ выше, чем у самцов (рис. 5).
Рис. 4.
Концентрации Na+ в крови кумжи Salmo trutta в возрасте 1+ и ≥2+ из двух близкорасположенных рек (рр. Алатсоя и Улмасенйоки).
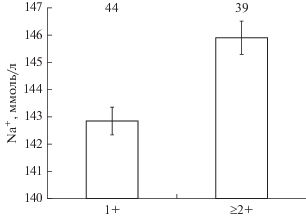
Рис. 5.
Концентрация K+ в крови самок и самцов кумжи Salmo trutta из двух близкорасположенных рек (рр. Алатсоя и Улмасенйоки).
В крови кумжи выявлена положительная корреляция между концентрациями ионов Cl– и Na+ (0.71, р < 0.001), Cl– и Ca2+ (0.55, р < 0.001) и отрицательная – между Na+ и K+ (–0.46, р < 0.001), Cl– и K+ (–0.38, р < 0.01). Не установлено корреляции уровня ионов с длиной и массой тела у пестряток из двух рек в возрасте 1+. Уровень Cl– в крови пестряток 2+ коррелирует с их длиной и массой тела (соответственно 0.76 и 0.70 при р < 0.01). У особей старшего возраста (≥3+) содержание K+ также коррелирует с длиной и массой тела (соответственно 0.40 и 0.51 при р < 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные результаты свидетельствуют о том, что уровень ионов в крови рыб зависит как от условий среды обитания (гидрохимический состав воды), так и от возраста и пола особи. Рассмотрим специфику выявленных зависимостей.
Концентрации Cl– и Ca2+ в крови у кумжи из рек Алатсоя и Улмасенйоки различаются, что, по всей видимости, обусловлено различиями в химическом составе воды в этих реках. Так, низкий уровень Cl– в крови кумжи из р. Алатсоя по сравнению с особями из р. Улмасенйоки соответствует пониженному (в 3.8 раза) содержанию хлоридов в воде р. Алатсоя. В то же время высокий уровень Ca2+ в крови рыб соответствует повышенному содержанию гидрокарбонатов в р. Алатсоя. Эти результаты согласуются с нашим предположением (Павлов, Павлов, 2018), что различия количественного содержания ионов в крови рыб могут быть связаны с гидрохимией рек. На наличие такой связи обращали внимание и другие исследователи (Evans, 1980; Laurent, Hebibi, 2011).
Концентрация Na+ в крови кумжи из двух рек практически не различается несмотря на то, что вода в рр. Алатсоя и Улмасенйоки различается по этому иону почти в 2 раза. Концентрация Na+ и Cl– зависит от возраста особи – уровень этих ионов выше у рыб в возрасте 2+ (по сравнению с годовиками), в дальнейшем (у особей в возрасте ≥2+) остается практически неизменным. При этом по уровню Cl– достоверно различаются только годовики и рыбы старшего возраста из р. Улмасенйоки. Ранее установлено (Павлов и др., 2017), что в крови пестряток черноморской кумжи за 1–2 мес. до смолтификации из четырех исследованных ионов, в первую очередь, снижается Cl–. Изменения содержания ионов Cl– в крови кумжи в возрасте 1+ могут свидетельствовать о подготовке части пестряток в этом возрасте к смолтификации и покатной миграции. В свою очередь, повышение и стабилизация концентраций Cl– и Na+ у особей старших возрастных групп (≥2+) в исследованных реках указывают на заметное снижение вероятности смолтификации у кумжи в этом возрасте. Кумжа чаще смолтифицируется в возрасте 2–3 года (L’Abée-Lund et al., 1989; Jonsson, L’Abée-Lund, 1993; Jonsson et al., 2001), в старшем возрасте (≥3+) вероятность ее покатной миграции снижается. По всей видимости, в реках Алатсоя и Улмасенйоки кумжа преимущественно совершает покатную миграцию в возрасте 2-х лет. А к возрасту 2+ в реках остаются преимущественно резидентные особи, имеющие более высокие уровни ионов Cl– и Na+ в крови по сравнению с мигрировавшими рыбами. При этом, отсутствие выраженных различий по уровню Cl– в крови кумжи разного возраста из р. Алатсоя может быть связано с меньшей вероятностью их смолтификации по сравнению с особями из р. Улмасенйоки.
Концентрация K+ в крови кумжи зависит только от ее пола – у самок она, в среднем, на 13% выше, чем у самцов. Различия у самок и самцов могут быть обусловлены как разной скоростью протекания обменных процессов в организме, так и особенностями их жизненного цикла. Cамки кумжи в отличие от самцов имеют бóльшую склонность к миграциям, в то время как самцы, напротив, чаще ведут оседлый образ жизни (Jonsson et al., 2001; García-Vega et al., 2018; Ferguson et al., 2017, 2019; Huusko et al., 2018). Самки в возрасте 1+ из р. Улмасенйоки имеют уровень K+ в крови на 25% выше, чем самки 1+ из р. Алатсоя, что может отражать разную степень подготовки рыб из этих рек к смолтификации.
Установленные корреляции концентраций исследованных ионов в крови кумжи разного возраста, пола и принадлежности к реке являются отражением осморегуляторного процесса в организме рыб. Он заключается в работе механизмов активного транспорта Na+, K+ и Cl– через цитоплазматическую мембрану против градиента концентрации (Karnaky, 1986; Tipsmark et al., 2002). Для удаления избытка Na+ и Cl– из крови Na+/K+-АТФ-аза за один цикл своей работы переносит три иона натрия (3Na+) из клетки и два иона калия (2K+) в клетку. В частности, этим процессом обусловлена отрицательная зависимость (–0.46, р < 0.001) уровня Na+ в крови от K+.
Согласно гипотезе Тhоrре et al., для атлантического лосося (Thorpe et al., 1998) вероятность смолтификации и покатной миграции напрямую связаны с половым созреванием. При траектории развития, направленной преимущественно на раннее половое созревание, уже в конце летнего периода может происходить блокировка смолтификации весной следующего года. Мы предполагаем, что такие процессы могут происходить и у кумжи, которая имеет более разнообразную жизненную историю, чем атлантический лосось. Ранее было показано (Павлов и др., 2020), что формирование траектории развития у кумжи из р. Алатсоя, направленной на раннее созревание происходит в конце первого лета жизни. Обнаруженная в данной работе заметная вариабельность по содержанию ионов в крови кумжи из исследованных рек может дополнительно свидетельствовать о раннем разделении рыб на мигрантов и резидентов. Это означает, что в конце первого лета жизни у кумжи может происходить не только формирование траектории развития, направленной на раннее созревание, но и проходной жизненной стратегии.
Исследованные реки, географически находящиеся рядом, значительно отличаются друг от друга химическим составом воды, что вызывает модификации тех или иных процессов у кумжи, являющейся чрезвычайно пластичным видом (Jonsson, Jonsson, 2011). Известно, что на осморегуляцию рыб оказывают влияние температура (Handeland et al., 2004; Masroor et al., 2018) и pH воды (Gonzalez, Wilson, 2001; Yanagitsuru et al., 2019), которые различаются и в исследованных реках. Степень влияния этих факторов во многом определяется видом рыбы, ее физиологическим состоянием и адаптационными возможностями (Gonzalez, Wilson, 2001; Yanagitsuru et al., 2019). Очевидно, что выявленные различия по концентрациям ионов у кумжи из двух рек помимо гидрохимического режима могут быть обусловлены как другими гидрологическими особенностями водоемов (температурой и расходом воды, их суточными колебаниями), так и физиологическим состоянием кумжи, относящейся к разным популяциям. Оценка этих сложных зависимостей требует дальнейшего исследования.
Таким образом, кумжа из двух исследованных рек различается по содержанию ионов Cl–, Ca2+ в крови рыб. Эти различия связаны с условиями обитания, в частности, с гидрохимией рек. Концентрация Na+ в крови кумжи отражает возрастные различия рыб, а K+ – половые. Пестрятки кумжи в возрасте 1+ из двух рек характеризуются различным уровнем Cl–, Na+ и K+, что может отразиться на степени их подготовки к смолтификации весной следующего года.
Авторы выражают благодарность А.О. Касумяну (биологический факультет МГУ) за ценные замечания по тексту рукописи; М.А. Ручьёву (КарНЦ РАН) и Д.А. Ручьеву (ООО “Янисъярви”) за содействие и помощь в проведении исследований.
Работа выполнена при финансовой поддержке РНФ (грант 19-14-00015).
Список литературы
Веселов А.Е., Скоробогатов М.А., Ефремов Д.А. Нерестовые популяции пресноводного лосося и кумжи Северного Приладожья // Петрозаводск: Форевер, 2016. 128 с.
Груздева М.А., Кузищин К.В., Павлов Е.Д., Буш А.Г., Белова Н.В., Поляков М.П., Павлов Д.С. Морфофизиологические закономерности формирования жизненных стратегий мальмы Salvelinus malma Камчатки // Вопр. ихтиологии. 2017. Т. 57. № 5. С. 587–602.
Макеева А.П. Эмбриология рыб. М.: Изд‑во МГУ, 1992. 216 с.
Павлов Д.С., Павлов Е.Д., Ганжа Е.В., Костин В.В. Содержание Na+, K+, Cl– и Ca2+ в крови молоди черноморской кумжи Salmo trutta labrax при внутрипопуляционной дифференциации // Известия РАН. Серия биологическая. 2017. № 6. С. 585–592.
Павлов Е.Д., Буш А.Г., Костин В.В., Павлов Д.С. Рост и раннее половое созревание кумжи Salmo trutta р. Алатсоя (Республика Карелия) // Биол. внутр. вод. 2020. № 6. С. 584–591. https://doi.org/10.31857/S0320965220060145
Павлов Е.Д., Павлов Д.С. Cравнение содержания ионов Na+, K+, Ca+ и Cl– в крови кумжи Salmo trutta из разных рек // Доклады академии наук. 2018. Т. 481. № 3. С. 336–339.
Bohlin T., Dellefors C., Faremo U. Timing of sea-run brown trout (Salmo trutta) smolt megration: effects of climatic variation // Can. J. Fish. Aquat. Sci. 1993. V. 50. № 6. P. 1132–1136. https://doi.org/10.1139/f93-128
Evans D.H. Osmotic and ionic regulation by freshwater and marine fishes. In M.A. Ali (ed.), Environmental physiology of fishes, Plenum Publ. Corp., New York, 1980. P. 93–122.
Ferguson A., Reed T., McGinnity P., Prodöhl P. Anadromy in brown trout (Salmo trutta): A review of the relative roles of genes and environmental factors and the implications for management and conservation. In G. Harris (Ed.), Sea trout: Management & science (pp. 1–40). Leicestershire, England: Matador Publishing Ltd. 2017.
Ferguson A., Reed T.E., Cross T.F. et al. Anadromy, potamodromy and residency in brown trout Salmo trutta: the role of genes and the environment // J. Fish Biol. 2019. P. 1. https://doi.org/10.1111/jfb.14005
García-Vega A., Sanz-Ronda F.J., Celestino F.L., Makrakis S., Leunda P.M. Potamodromous brown trout movements in the north of the Iberian Peninsula: Modelling past, present and future based on continuous fishway monitoring. Science of the Total Environment. 2018. V. 640–641. P. 1521–1536. https://doi.org/10.1016/j.scitotenv.2018.05.339
Gonzalez R.J. and Wilson R.W. Patterns of ion regulation in acidophilic fish native to the ion-poor, acidic Rio Negro // J. Fish Biol. 2001. V. 58. P. 1680–1690.
Handeland S.O., Wilkinson E., Sveinsbø B. et al. Temperature influence on the development and loss of seawater tolerance in two fast-growing strains of Atlantic salmon // Aquaculture. 2004. V. 233. P. 513–529.
Huusko A., Vainikka A., Syrjänen J.T., Orell P. Louhi P., Vehanen T. Life-history of the adfluvial brown trout (Salmo trutta L.) in eastern Fennoscandia. In J. Lobón-Cerviá & N. Sanz (Eds.), Brown trout: Biology, ecology and management (pp. 267–295). Holboken N.J.: Wiley. 2018.
Jones D.A., Bergman E., Greenberg L., Jonsson B. Food availability in spring affects smolting in brown trout (Salmo trutta) // Can. J. Fish. Aquat. Sci. 2015. V. 72. P. 1694–1699.
Jonsson B., Jonsson N. Ecology of Atlantic salmon and brown trout: habitat as a template for life histories // Fish Fish. Ser. 2011. V. 33. 680 p.
Jonsson B., Jonsson N. Early environment influences later performance in fishes // J. Fish Biol. 2014. V. 85. P. 151–188.
Jonsson B., Jonsson N. Egg incubation temperature affects the timing of the Atlantic salmon Salmo salar homing migration // J. Fish Biol. 2018. V. 93. P. 1016–1020. https://doi.org/10.1111/jfb.13817
Jonsson B., Jonsson N., Brodtkorb E., Ingebrigtsen P.-J. Life-history traits of Brown Trout vary with the size of small streams // Functional Ecology. 2001. V. 15. P. 310–317.
Jonsson B., L’Abée-Lund J.H. Latitudinal clines in life history variables of anadromous brown trout in Europe // J. Fish Biol. 1993.V. 43 (Suppl A). P. 1–16.
Karnaky K.J. Structure and function of the chloride cell of Fundulus heteroclitus and other teleosts // Am. Zool. 1986. V. 26. P. 209–224.
L’Abée-Lund J.H., Jonsson B., Jensen A.J. et al. Latitudinal variation in life history characteristics of sea-run migrant brown trout Salmo trutta // J. Anim. Ecol. 1989. V. 58. P. 525–542.
Laurent P., Hebibi N. Gill morphology and fish osmoregulation // J. of Zoology. 2011. V. 67(12). P. 3055–3063.https://doi.org/10.1139/z89-429
Lucas M.C., Baras E. Migration of Freshwater Fishes. Blackwell Science, 2001. 420 p.
Masroor W., Farcy E., Gros R., Lorin-Nebel C. Effect of combined stress (salinity and temperature) in European sea bass Dicentrarchus labrax osmoregulatory processes // Comp. Biochem. Physiol. Part A. 2018. V. 215. P. 45–54.
McCormick S.D. Endocrine Control of Osmoregulation in Teleost Fish // Am. Zoologist. 2001. V. 41(4). https://doi.org/10.1093/icb/41.4.781
Northcote T.G. Mechanisms of fish migration in rivers // “Mech. Migrat. Fishes. Proc. NATOAdv. Res. Inst., Acquafredda di Maratea, Dec. 13–17 1982”. New York; London. 1984. P. 317–355.
Rasmussen G.H. The population dynamics of brown trout (Salmo trutta L.) in relation to year-class size // Pols. Arch. Hydrobiol. 1986. V. 33. № 3/4. P. 489–508.
Thorpe J.E. Sea trout: an archetypallife history strategy for Salmo trutta L. In: The Sea Trout in Scotland. Eds. M.J. Picker and W.M. Shearer. Proc. Symposium at Dunstaffmage Marine Research Laboratory, 1987. 102 p.
Thorpe J.E., Mangel M., Metcalfe N.B., Huntingford F.A. Modelling the proximate basis of salmonid life-history variation, with application to Atlantic salmon, Salmo salar L. // Evol. Ecology. 1998. V. 12. P. 581–599.
Tipsmark C.K., Madsen S.S., Seidelin M. et al. Dynamics of Na+, K+, 2Cl– cotransporter and Na+, K+-ATPase expression in the branchial epithelium or brown trout (Salmo trutta) and atlantic salmon (Salmo salar) // J. Exp. Zool. 2002. V. 293. P. 106–118.
Yanagitsuru Y.R., Hewittb C.R., Le Thi Hong Gam, Pham Phuong-Linh, Rodgerse E.M., Wang T., Bayley M., Do Thi Thanh Huong, Nguyen Thanh Phuong, Brauner C.J. Effect of water pH and calcium on ion balance in five fish species of the Mekong Delta // Comp. Biochem. Physiol. Part A. 2019. V. 232. P. 34–39.
Zydlewski J., Wilkie M.P. Freshwater to seawater transitions in migratory fishes // Euryhaline Fishes. 2012. P. 253–326.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая