Известия РАН. Серия биологическая, 2021, № 6, стр. 637-643
Сезонная динамика лизоцима у щуки Esox lucius L. Рыбинского водохранилища
М. Ф. Субботкин 1, *, Т. А. Субботкина 1
1 Институт биологии внутренних вод им. И.Д. Папанина РАН
152742 пос. Борок, Некоузский р-н, Ярославская обл., Россия
* E-mail: smif@ibiw.ru
Поступила в редакцию 13.08.2019
После доработки 30.04.2021
Принята к публикации 14.05.2021
Аннотация
Анализировали концентрацию лизоцима в иммунных органах щуки: почках, селезенке и печени, а также в сыворотке крови. Обнаружена противоположная направленность внутригодовой флуктуации показателя неспецифического иммунитета в почках и селезенке относительно печени и сыворотки. Наиболее высокий уровень фермента в почках наблюдался в зимние месяцы и весной, а в сыворотке – с весны до осени. В мае месяце во всех исследованных органах и сыворотке наблюдалось значительное повышение концентрации лизоцима, независимо от направленности изменений в предшествующий период. Размеры особей не влияли на концентрацию лизоцима в органах, и только в сыворотке обнаружена корреляция с длиной рыб. Стадии зрелости гонад у щуки показали разнонаправленное влияние на концентрацию фермента в почках и сыворотке. Внутригодовая динамика показателя неспецифического иммунитета у взрослых рыб имеет сезонную зависимость, в том числе от температуры водоема. В печени и сыворотке крови связь фермента с температурой прямая, а в почках и селезенке обратная. Исследования показали, что сезонная динамика концентрации лизоцима щуки находится под влиянием совокупности параметров, характеризующих физиологическое состояние рыб, и факторов внешней среды. Сывороточный лизоцим оказался более зависимым от разных факторов, чем фермент из органов.
В условиях интенсивного развития мировой аквакультуры существует необходимость разработки мероприятий для защиты коммерческой продукции от больших потерь из-за болезней и других негативных воздействий, возникающих при выращивании рыб. Одним из путей решения таких задач является воздействие на иммунитет с целью его повышения или улучшения. Неспецифический иммунитет рыб является первой и эффективной линией защиты от неблагоприятных факторов внешнего воздействия. Лизоцим – фермент из группы гликозидаз – один из важных компонентов неспецифической резистентности, который наиболее активно изучается у этой группы животных. Считается, что повышенная концентрация или активность иммунных показателей может свидетельствовать о хорошем или эффективном иммунитете. Однако стимулирование повышения иммунитета вызывает и повышение энергетических затрат организма (Kortet, Vainikka, 2008). Ресурсы организма ограничены, и в этой связи важно понимание того, как происходит их перераспределение между необходимым иммунным ответом и другими жизненно важными физиологическими функциями (Viney et al., 2005). Результаты экспериментов по влиянию разных факторов на иммунитет рыб, и в частности на активность или концентрацию лизоцима, различны. Также показано, что значительные вариации активности лизоцима могут быть и у контрольных рыб, на которых не действовал изучаемый фактор (Kozinska, Guz, 2004; Yin et al., 2009; Kaleeswaran et al., 2011; Das et al., 2013). Количественные показатели иммунитета у рыб не постоянны и существенно варьируют в их жизненном цикле. Поэтому для адекватной оценки результатов воздействия на иммунные функции необходимо учитывать физиологическое состояние и характер нормальных количественных изменений показателей иммунитета у изучаемых рыб. Анализ сезонной или внутригодовой флуктуации показателей, которая проходит под влиянием максимально полного спектра внешних и внутренних факторов, позволяет выявить направленность и масштаб таких преобразований у рыб.
Список рыб, выращиваемых в аквакультуре, постоянно расширяется за счет новых и перспективных видов. Щука Esox lucius L., 1758 рассматривается как один из таких объектов в некоторых хозяйствах России (Маслова, Петрушин, 2013; Скворцова и др., 2018). Искусственное разведение щуки началось в 70-х гг. прошлого столетия и получило наибольшее развитие в ряде европейских стран (Harvey, 2009). Несмотря на то, что щука широко распространена в водоемах северного полушария и относится к объектам аквакультуры, ее неспецифический иммунитет, включая такой важный иммунный показатель как лизоцим, изучен крайне слабо. Некоторые исследования, связанные с паразитарными инвазиями у вида, отражают распространение этого фермента в кишечнике и других органах, а также реакции рыб на наличие или отсутствие гельминтов (Извекова и др., 2010; Dezfuli et al., 2018).
Цель представленной работы – изучить динамику концентрации лизоцима в иммунных органах и сыворотке крови щуки в разные сезоны годового цикла, с гонадами на разных стадиях развития, в естественных условиях обитания.
МАТЕРИАЛЫ И МЕТОДЫ
Щуку отлавливали в прибрежной зоне Рыбинского водохранилища около пос. Борок и в р. Сутка, в районе с. Верхне-Никульское. В теплые месяцы образцы крови отбирали на месте, сразу же после вылова рыбы. Затем рыб помещали в термос со льдом и доставляли в лабораторию. В зимние месяцы отбор образцов проводили в лаборатории, куда рыбу доставляли в живом виде, сразу после вылова. Перед отбором крови рыбу обездвиживали резким ударом по голове. Кровь брали из хвостовых сосудов. Образцы сыворотки крови, тканей печени, почек и селезенки до анализа хранили замороженными при –18°С в течение нескольких суток. Проводили неполный биологический анализ: рыб взвешивали, измеряли длину до конца чешуйного покрова, определяли стадии зрелости гонад (Сакун, Буцкая, 1963). В исследовании представлены рыбы трехлетних сборов в количестве 110 особей (табл. 1).
Таблица 1.
Время сбора и характеристика исследованных рыб
| Время лова, мес. |
Количество рыб, экз. | Стадия зрелости | Длина (l), см $\frac{{\min - {\kern 1pt} \max }}{{M \pm m}}$ | Масса общая, г $\frac{{\min - {\kern 1pt} \max }}{{M \pm m}}$ |
|---|---|---|---|---|
| Июнь | 7 | I, II | $\frac{{30{\kern 1pt} - {\kern 1pt} 54.5}}{{38.8 \pm 3.0}}$ | $\frac{{230{\kern 1pt} - {\kern 1pt} 1350}}{{570.0 \pm 138.3}}$ |
| Июль | 8 | I, II | $\frac{{28{\kern 1pt} - {\kern 1pt} 44.8}}{{36.1 \pm 2.0}}$ | $\frac{{200{\kern 1pt} - {\kern 1pt} 752}}{{372.4 \pm 81.5}}$ |
| Сентябрь | 6 | II, II−III | $\frac{{39{\kern 1pt} - {\kern 1pt} 44.5}}{{41.1 \pm 1.1}}$ | $\frac{{435{\kern 1pt} - {\kern 1pt} 760}}{{584.2 \pm 52.8}}$ |
| Октябрь | 12 | II, II−III | $\frac{{37{\kern 1pt} - {\kern 1pt} 52}}{{47.0 \pm 1.8}}$ | $\frac{{442{\kern 1pt} - {\kern 1pt} 1410}}{{747.4 \pm 128.4}}$ |
| Декабрь | 15 | II−III | $\frac{{48{\kern 1pt} - {\kern 1pt} 65}}{{52.1 \pm 1.2}}$ | Нет данных |
| Январь | 20 | II−III | $\frac{{41.5{\kern 1pt} - {\kern 1pt} 61}}{{55.5 \pm 1.2}}$ | $\frac{{510{\kern 1pt} - {\kern 1pt} 1900}}{{1014.0 \pm 92.5}}$ |
| Февраль | 8 | II−III, III | $\frac{{38.5{\kern 1pt} - {\kern 1pt} 56.5}}{{48.8 \pm 2.2}}$ | $\frac{{452{\kern 1pt} - {\kern 1pt} 1345}}{{860.5 \pm 105.4}}$ |
| Март | 14 | III−IV | $\frac{{47{\kern 1pt} - {\kern 1pt} 75}}{{56.9 \pm 2.5}}$ | $\frac{{670{\kern 1pt} - {\kern 1pt} 3770}}{{1667.1 \pm 270.0}}$ |
| Апрель | 13 | IV, IV–V | $\frac{{39{\kern 1pt} - {\kern 1pt} 65}}{{52.3 \pm 1.8}}$ | $\frac{{515{\kern 1pt} - {\kern 1pt} 2270}}{{1047.0 \pm 139.6}}$ |
| Май | 7 | I, II, IV | $\frac{{33{\kern 1pt} - {\kern 1pt} 54}}{{41.4 \pm 2.7}}$ | $\frac{{280{\kern 1pt} - {\kern 1pt} 1100}}{{640.0 \pm 110.9}}$ |
Концентрацию лизоцима в тканях печени, почек, селезенки и сыворотке определяли методом “диффузии в агар”, который основан на способности этого фермента лизировать клетки Micrococcus lysodeikticus (Schroeter 1872), диспергированные в слое агарового геля. Диаметр зоны просветления пропорционален логарифму концентрации лизоцима (Osserman, Lawlor, 1966). Концентрацию фермента в исследуемых образцах определяли по калибровочной кривой на основе стандартного препарата из белка куриных яиц. Более подробно метод описан ранее (Субботкина, Субботкин, 2003). Концентрацию лизоцима выражали в мкг/г ткани органа и мкг/мл сыворотки как средняя ± ± стандартная ошибка. Для сравнения выборок применяли непараметрический критерий Манна–Уитни, а корреляционные связи определяли по критерию Спирмена (rs) при значимости р < 0.05. Возможное влияние некоторых факторов на лизоцим щуки оценивали по критерию Краскела–Уоллиса (Н) при р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Внутригодовая флуктуация концентрации лизоцима в почках щуки имела существенные сезонные различия, при которых максимальные значения в 2.5 раза превышали минимальные. Летом (в июне–июле) в тканях органа зарегистрирован наименьший уровень лизоцима (рис. 1). С осени количество фермента нарастало и достигло максимума зимой. В почках щуки обнаружены два периода самых высоких концентраций лизоцима. Первый, наиболее продолжительный период, охватывал три зимних месяца декабрь, январь и февраль. Затем весной концентрация лизоцима снижалась и вновь возрaстала до максимума в мае.
Рис. 1.
Динамика лизоцима в почках и селезенке щуки (среднее ± стандартная ошибка). Разные буквы (а–г) над столбцами обозначают достоверные различия для одного и того же органа (p < 0.05).
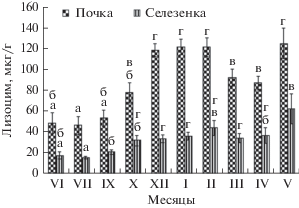
В селезенке в летний период, также как в почках, обнаружена самая низкая концентрация лизоцима (рис. 1). Более высокий и одинаковый уровень фермента в тканях этого органа наблюдался в течение длительного времени − с октября до мая месяца. В мае у рыб также были самые высокие концентрации лизоцима, средние значения которых отличались от таковых в предыдущие весенние месяцы и последующие летний и осенний период.
В печени щуки обнаружен скачкообразный характер изменений концентрации лизоцима (рис. 2). Наиболее значительные различия такого плана наблюдались в осенний и весенний периоды. В начале осени концентрация фермента в органе снизилась по сравнению с июлем, но уже в октябре было зарегистрировано ее двукратное повышение. В зимний период количество фермента в печени сохранялось на пониженном уровне. В феврале–марте наблюдалось незначительное (на 40%) повышение уровня лизоцима. Однако в апреле наблюдалось более чем двукратное снижение концентрации этого показателя неспецифического иммунитета. Конец весны и начало лета характеризовались самыми высокими значениями параметра, когда концентрация лизоцима в печени более чем в 2.5−3 раза превышала апрельский уровень.
Рис. 2.
Динамика лизоцима в печени и сыворотке щуки (среднее ± стандартная ошибка). Разные буквы (а–д) над столбцами обозначают достоверные различия для одного и того же органа или ткани (p < 0.05).
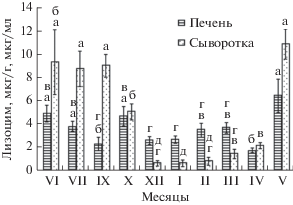
Сыворотка щуки в исследованный период продемонстрировала самый широкий диапазон внутригодовой флуктуации концентрации лизоцима (рис. 2). Летний период и начало осени характеризовались очень высоким содержанием фермента. В дальнейшем его концентрация снизилась до минимального уровня, который наблюдался в течение трех зимних месяцев. Наступление весны сопровождалось плавным ростом концентрации лизоцима, однако в мае произошел резкий скачок до максимальных годовых значений. В итоге самые высокие концентрации лизоцима, обнаруженные в течение продолжительного периода, включающего май, июнь, июль и сентябрь, оказались в 10−13 раз выше значений зимнего периода.
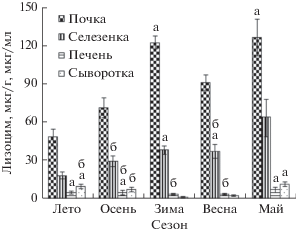
Анализ данных показал, что концентрация фермента в органах и сыворотке внутри сезонов во многих случаях более сходна, чем в разные сезоны, исключение − месяц май, когда количество лизоцима у рыб отличалось от предыдущего и последующего месяцев. Остальные данные были сгруппированы в сезоны (рис. 3). Показано, что для зимы и весны характерны самые высокие концентрации лизоцима в почках и селезенке, и напротив − самые низкие − в печени и сыворотке. Летом и осенью наблюдалось повышение концентрации фермента в печени и сыворотке, и понижение его в почках и селезенке. В мае концентрации фермента в почках и селезенке были сходными с холодным временем года, а в печени и сыворотке − с летнее-осенним периодом.
Рис. 3.
Сезонная динамика лизоцима в органах и сыворотке щуки (среднее ± стандартная ошибка). Отсутствие букв и разные буквы (а, б) над столбцами обозначает достоверные различия для одного и того же органа или ткани (p < 0.05).
Полученные данные выявили общую положительную корреляцию средней силы между концентрациями лизоцима в почках и селезенке (rs = = 0.6). Однако между лизоцимом в почках и сыворотке обнаружена обратная зависимость (rs = –0.4). Подобный, но более слабый, характер связи проявлялся между концентраций фермента в селезенке и сыворотке (rs = –0.21). Печень, напротив, показала положительную, но также не высокую, корреляцию концентрации фермента с сывороткой (rs = 0.31).
Изучение влияния сезонности на иммунитет диких рыб в природе позволяет установить диапазон естественной флуктуации иммунных показателей и способствует выяснению потенциала защитных возможностей организма. Исследования, которые проводятся в этой области, указывают на отсутствие общей закономерности иммунных реакций − у каждого вида рыб или группы родственных видов может быть свой, уникальный сезонный иммунный ответ (Субботкин, Субботкина, 2016; Papezikova et al., 2016). Этот ответ, сформированный на основе биологических и физиологических возможностей организма, может быть результатом прямого или опосредованного влияния экологии.
Среди абиотических факторов окружающей среды важную роль в жизни пойкилотермных животных играет температура. Ее влияние на количественные характеристики лизоцима в крови рыб показано в экспериментальных условиях, тогда как результаты, полученные в естественной среде, не только неоднозначны, но и порой противоречивы (Kortet, Vainikka, 2008). Этот аспект обсуждался при рассмотрении сезонной динамики фермента у леща Abramis brama L., 1758 (Субботкин, Субботкина, 2016). Мы не определяли температуру воды непосредственно при отлове щуки, поскольку общий термический режим водохранилища известен (Буторин и др., 1982). Однофакторный анализ Краскела–Уоллиса выявил зависимость концентрации лизоцима от температуры воды в водоеме во всех исследованных тканях (табл. 2). Для лизоцима в почках и селезенке характерна обратная зависимость от температуры (rs = –0.54 и rs = –0.39 соответственно), тогда как фермент в печени и сыворотке, напротив, имел положительную связь (rs = 0.34 и rs = 0.75). Дифференцировка рыб по сезонам показала, что совокупность различных внешних факторов, действующих в рамках категорий “сезон”, также влияет на концентрацию лизоцима в органах и сыворотке щуки.
Таблица 2.
Значения критерия Краскела-Уоллиса (Н) для факторов и концентрации лизоцима в тканях щуки
| Факторы | Показатели | |||
|---|---|---|---|---|
| Концентрация лизоцима | ||||
| почки | селезенка | печень | сыворотка | |
| Температура | 40.130; p = 0.000* | 31.893; p = 0.000* | 17.643; p = 0.001* | 68.379; p = 0.000* |
| Сезон | 49.456; p = 0.000* | 32.472; p = 0.000* | 17.793; p = 0.001* | 75.250; p = 0.000* |
| Пол | 4.738; p = 0.094 | 5.800; p = 0.055 | 0.211; p = 0.900 | 3.072; p = 0.215 |
| Стадии зрелости гонад | 19.974; p = 0.001* | 6.536; p = 0.258 | 4.567; p = 0.471 | 25.956; p = 0.000* |
Возможность влияния физиологического состояния на иммунный показатель оценивали по биологическим параметрам щуки. Обнаружено, что концентрация фермента ни в одной исследованной ткани не связана с полом рыб (p > 0.05) (табл. 2). Другие морфо-физиологические показатели рыб широко варьировали в разные сезоны при разной температуре. Чтобы минимизировать влияние этих внешних факторов мы анализировали выборки зимнего и весеннего сезонов. В это время изменения температурного режима водоема и фактора сезонности проявляются в меньшей степени, чем в другие периоды. Для определения влияния размеров особи щуки были разделены по длине на две группы: I – от 38.5 до 50 см, II – от 55 до 75 см (табл. 3). Статистический анализ показал, что эти группы рыб различались в высшей степени по длине и массе (p < 0.000), тогда как по концентрации фермента были сходны (p = 0.08–0.97). Однофакторный анализ по критерию H не выявил влияния размеров рыб на концентрацию лизоцима в органах и сыворотке. Корреляция фермента наблюдалась только у сывороточного лизоцима с длиной рыб (rs = 0.31; p < 0.05).
Таблица 3.
Показатели щуки в зимний и весенний сезоны (M ± m)
| Показатели | Группы | |
|---|---|---|
| I | II | |
| Длина (см) | 46.5 ± 0.6 (n = 26) | 60.6 ± 1.34 (n = 19) |
| Масса (г) | 738.9 ± 34.0 (n = 21) | 1898.8 ± 198.5 (n = 16) |
| Концентрация лизоцима: | ||
| почки (мкг/г) селезенка (мкг/г) печень (мкг/г) сыворотка (мкг/мл) |
117.12 ± 6.68 41.00 ± 4.44 2.80 ± 0.30 0.85 ± 0.24 |
109.58 ± 7.65 38.24 ± 4.13 2.89 ± 0.39 1.53 ± 0.32 |
Возможное влияние стадий зрелости гонад на лизоцим у щуки также оценивали в зимне-весенний период. Было обнаружено, что концентрация фермента в почках и сыворотке зависела от стадий зрелости гонад по критерию Краскела-Уоллиса (табл. 2). Лизоцим в почках был связан со зрелостью гонад в обратной зависимости (rs = –0.50), тогда как в сыворотке зависимость была прямая (rs = 0.54). Между динамикой концентрации фермента в печени и селезенке и развитием гонад связь не обнаружена.
Разнонаправленные изменения концентрации лизоцима в исследованных тканях, которые могут быть зависимы от физиологических особенностей рыб (созревание гонад), а также внешнего воздействия (температура воды) указывают на то, что один источник − сыворотка или плазма крови, который анализируется значительно чаще других, не отражает динамику фермента во всем организме. Учитывая концентрацию лизоцима в почках и селезенке, которая у многих видов может значительно превышать таковую в крови (Субботкина, Субботкин, 2003; Субботкин, Субботкина 2016), исследование фермента только в сыворотке для оценки влияния каких-либо факторов на состояния иммунитета рыб оказывается недостаточным. Это подтверждается и определенной корреляционной связью лизоцима в сыворотке с его количеством в иммунных органах, обнаруженной у исследованной щуки.
Наличие высоких концентраций лизоцима в почках и селезенке в зимний период, с последующим снижением в летние месяцы, скачок уровня фермента до максимальных значений во всех исследованных тканях щуки в мае, вероятно, не может указывать на зависимость этого показателя от освещенности и продолжительности светового дня. Однако изменения отдельных факторов внешней среды, например, температуры или освещенности, могут выступать пусковым сигналом, вызывающим ответные реакций иммунной системы (Kortet, Vainikka, 2008).
Пиковые концентрации лизоцима, обнаруженные у щуки в мае, могут быть обусловлены посленерестовыми изменениями в организме рыб. Во внешней среде в это время происходит значительное повышение температуры воды (Буторин и др., 1982), что также может способствовать активизации иммунных реакций. Высокие значения фермента в зимние месяцы при низких температурах могут быть вызваны физиологическими преобразованиями, когда рыбы интенсивно накапливают резервы, необходимые для развития гонад. Например, лещ в отличие от щуки, входит в зимний период с хорошо сформированными половыми продуктами, и у него максимальные значения лизоцима обнаружены только в марте, на завершающем этапе зимовки (Субботкин, Субботкина, 2016).
Необходимо отметить, что при формировании половых продуктов у рыб могут существенно изменяться абсолютные и относительные размерно-массовые показатели как отдельных органов, включая иммунные, так и всего организма. Медфорд и Маккей (Medford, Mackay, 1978) указывали, что у щуки E. lucius вес печени более тесно связан с ростом гонад, чем с интенсивностью питания. Была показана корреляция гонадосоматического и гепатосоматического индексов щуки (Lenhardt, 1992). Сезонные различия печени наблюдались и у молоди щуки, с увеличением индексов весной по сравнению с предыдущей осенью (Bennett, Janz, 2007). Изменения размеров иммунных органов остались за рамками проведенных исследований, и их влияние на сезонную динамику лизоцима рыб не ясно. Взаимосвязь иммунной системы с физиологическим состоянием, в том числе половым созреванием и размножением, может быть более сложной, чем корреляции со зрелостью гонад.
* * *
Внутригодовая динамика концентрации лизоцима у щуки проявляется значительными флуктуациями в иммунных органах и сыворотке. Повышение концентрации лизоцима в почках почти в 3 раза, с 47.9 ± 6.4 мкг/г летом, до 121.6 ± 4.3 мкг/г зимой, происходит на фоне более чем 13-кратного снижения в сыворотке, с 9.0 ± 1.47 мкг/мл летом, до 0.68 ± 0.16 мкг/мл зимой. Обнаружены изменения, которые тесно связаны c сезонными факторами, в том числе с термическим режимом водоема. Концентрация фермента не зависит от пола и размеров рыб, но зрелость гонад влияет на лизоцим в почках и сыворотке.
Направленность и сила факторов, влияющих на количественный параметр лизоцима в исследованных тканях неодинакова, что свидетельствует о сложном характере взаимосвязи изменений во внешней среде и физиологических процессов в организме рыб. Сезонная динамика иммунного показателя отражает одно из направлений распределения внутренних ресурсов щуки между жизненно важными физиологическими функциями защиты организма и размножения, а также воздействиями условий обитания.
Направленность и сила факторов, влияющих на количественный параметр лизоцима в исследованных тканях неодинакова, что свидетельствует о сложном характере взаимосвязи изменений во внешней среде и физиологических процессов в организме рыб. Сезонная динамика иммунного показателя отражает одно из направлений распределения внутренних ресурсов щуки между жизненно важными физиологическими функциями защиты организма и размножения, а также воздействиями условий обитания.
Работа выполнена в рамках государственного задания (тема: АААА-А18-118012690222-4).
Список литературы
Буторин Н.В., Курдина Т.Н., Бакастов С.С. Температура воды и грунтов Рыбинского водохранилища. Л.: Наука, 1982, 224 с.
Извекова Г.И., Субботкина Т.А., Субботкин М.Ф. Содержание лизоцима в организме щуки при заражении цестодами // Биол. внутр. вод. 2010. № 2. С. 73–76.
Маслова Н.И., Петрушин В.А. Рыбоводно-биологическая оценка щуки – перспективного объекта поликультуры // Состояние и перспективы развития пресноводной аквакультуры. Докл. международ. научно-практич. конф. 5–6 февраля 2013 г. М.: ВНИИР, 2013. С. 276−290.
Сакун О.Ф., Буцкая Н.А. Определение стадий зрелости и изучение половых циклов рыб // М.: Рыбное хоз-во, 1963, 36 с.
Скворцова Е.Г., Флёрова Е.А., Лозина Я.В. Выращивание щуки в различных рыбоводных хозяйствах // Вестник АПК Верхневолжья. 2018. № 4 (44). С. 42−47.
Субботкин М.Ф., Субботкина Т.А. Изменчивость содержания лизоцима у леща Рыбинского водохранилища в разные сезоны годового цикла // Изв. РАН. Сер. Биол. 2016. Т. 43. № 3. С. 309–314.
Субботкина Т.А., Субботкин М.Ф. Содержание лизоцима в органах и сыворотке крови у различных видов рыб р. Волги // Журн. эволюционной биохимии физиол. 2003. Т. 39. №. 5. С. 430–437.
Bennett P.M., Janz D.M. Seasonal changes in morphometric and biochemical endpoints in northern pike (Esox lucius), burbot (Lota lota) and slimy sculpin (Cottus cognatus) // Freshwater Biol. 2007. V. 52. № 10. P. 2056–2072.
Das B.K., Pradhan J., Sahu S., Marhual N.P., Mishra B.K., Eknath A.E. Microcystis aeruginosa (Kütz) incorporated diets increase immunity and survival of Indian major carp Labeo rohita (Ham.) against Aeromonas hydrophila infection // Aquacult. Res. 2013. V. 44. № 6. P. 918–927.
Dezfuli B.S., Giari L., Lorenzoni M., Carosi A., Manera M., Bosi G. Pike intestinal reaction to Acanthocephalus lucii (Acanthocephala): immunohistochemical and ultrastructural surveys // Parasites Vectors. 2018. 11, 424.
Harvey B. A biological synopsis of northern pike (Esox lucius). Can. Manuscr. Rep. Fish. Aquat. Sci. 2009. 2885: 31 p.
Kaleeswaran B., Ilavenil S., Ravikumar S. Dietary supplementation with Cynodon dactylon (L.) enhances innate immunity and disease resistance of Indian major carp, Catla catla (Ham.) // Fish Shellfish. Immunol. 2011. V. 31. № 6. P. 953–962.
Kortet R., Vainikka A. Seasonality of innate immunity; evolutionary aspects and latest updates // New research on innate immunity / Eds: Durand M., Morel C.V.; Nova Science Publishers Inc., 2008. P. 13–45.
Kozinska A., Guz L. The effect of various Aeromonas bestiarum vaccines on non-specific immune parameters and protection of carp (Cyprinus carpio L.) // Fish Shellfish. Immunol. 2004. V. 16. № 3. P. 437–445.
Lenhardt M. Seasonal changes in some blood chemistry parameters and in relative liver and gonad weights of pike (Esox lucius L.) from the River Danube // J. Fish Biol. 1992. V. 40. № 5. P. 709–718.
Medford B.A., Mackay W.C. Protein and lipid content of gonads, liver, and muscle of northern pike (Esox lucius) in relation to gonad growth // J. Fish. Res. Board Can. 1978. V. 35. № 2. P. 213–219.
Osserman E.F., Lawlor D.P. Serum and urinary lysozyme (Muramidase) in monocytic and monomyelocytic leukemia // J. Exp. Med. 1966. V. 124. № 8. P. 921–952.
Papezikova I., Mares J., Vojtek L., Hyrsl P., Markova Z., Simkova A., Bartonkova J., Navratil S., Palikova M. Seasonal changes in immune parameters of rainbow trout (Oncorhynchus mykiss), brook trout (Salvelinus fontinalis) and brook trout × Arctic charr hybrids (Salvelinus fontinalis × Salvelinus alpines alpinus) // Fish Shellfish Immunol. 2016. V. 57. P. 400–405.
Viney M.E., Riley E.M., Buchanan K.L. Optimal immune responses: immunocompetence revisited // Trends Ecol. Evolut. 2005. V. 20. № 12. P. 665–669.
Yin G., Ardo L., Thompson K.D., Adams A., Jeney Z., Jeney G. Chinese herbs (Astragalus radix and Ganoderma lucidum) enhance immune response of carp, Cyprinus carpio, and protection against Aeromonas hydrophila // Fish Shellfish. Immunol. 2009. V. 26. № 1. P. 140–145.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


