Известия РАН. Серия биологическая, 2021, № 6, стр. 615-621
Влияние кадмия на антиоксидантный статус in vitro культур Rhododendron japonicum
Н. В. Загоскина 1, *, В. М. Катанская 1, **, Т. Н. Николаева 1
1 Институт физиологии растений им. К.А.Тимирязева РАН
127276 Москва, ул. Ботаническая, 35, Россия
* E-mail: zagoskina@ifr.moscow
** E-mail: vera@katanski.com
Поступила в редакцию 18.05.2021
После доработки 24.05.2021
Принята к публикации 24.05.2021
Аннотация
Исследовано воздействие различных концентрация кадмия (Cd, 42–126 мкМ) на антиоксидантную систему in vitro культур рододендрона японского. Показано уменьшение активности супероксиддисмутазы, одного из основных высокомолекулярных антиоксидантов, у гетеротрофных каллусов, выращиваемых на средах с возрастающими концентрациями поллютанта, и увеличение – у фотомиксотрофных. Накопление низкомолекулярных антиоксидантов фенольной природы в этих культурах в большинстве случаев повышалось, особенно у фотомиксотрофного каллуса. Полученные результаты свидетельствуют об изменениях в антиоксидантном статусе каллусных культур рододендрона японского, выращиваемых на средах с Cd, и важной роли как антиоксидантных ферментов, так и низкомолекулярных антиоксидантов в сохранении их жизнеспособности.
Одним из приоритетных направлений современной физиологии растений является изучение физиолого-биохимических и молекулярно-генетических механизмов устойчивости дикорастущих и культурных видов к действию тяжелых металлов (Asati et al., 2016; Fryzova et al., 2017). К числу широко распространенных их представителей относится кадмий (Сd). Известно о его высокой подвижности в почвенном растворе, кумулятивности и фитотоксичности (Haider et al., 2021). При действии Cd отмечалось изменение роста и развития растений, ультраструктуры клеточных органелл (митохондрии, хлоропласты), водного и гормонального баланса, увеличение количества активных форм кислорода (АФК) и развитие окислительного стресса (Seregin et al., 2015; Manquián-Cerda et al., 2016; Hayat et al., 2019).
Ослабление окислительной атаки в клетках растений, вызванной действием стрессора, обеспечивается функционированием многокомпонентной системы антиоксидантной защиты, состоящей из высокомолекулярных и низкомолекулярных метаболитов (Pradedova et al., 2011). К их числу относится супероксиддисмутаза (СОД) – высокомолекулярный фермент «первой линии защиты», поддерживающий баланс между генерацией и удалением АФК (Yu et al., 2020). При ее участии осуществляет превращение двух молекул O–2 в пероксид водорода и кислород, что способствует снижению (предотвращению) перекисного окисления липидов (ПОЛ) и сохранению стабильности клеточных мембран (Kolahi et al., 2020). К низкомолекулярным антиоксидантам относятся фенольные соединения – одни их наиболее распространенных в растениях вторичных метаболитов (Pradedova et al., 2011; Naikoo et al., 2019). Для них характерно наличие гидроксильных групп в ароматическом кольце, которые легко взаимодействуют со свободными радикалами и ингибируют процессы радикально-цепного окисления (Belščak-Cvitanović et al., 2018). Этот эффект в значительной степени зависит от вида растения, условий его произрастания и содержания фенольных соединений (Llugany et al., 2013; Katanskaya, Zagoskina, 2018; Kolahi et al., 2020).
К числу растений с высоким адаптивным потенциалом и устойчивостью к действию тяжелых металлов, в том числе Cd, относятся представители рода Rhododendron L. (Kwon et al., 2020). Для них характерно образование различных фенольных соединений (Qiang et al., 2011). К ним относятся оксибензойные кислоты (протокатеховая, хлорогеновая, галловая) и редко – производные коричной кислоты (кофейная кислота) (Prakash et al., 2007). У большинства представителей рода Rhododendron L. были идентифицированы флавоноиды: гиперозид, авикулярин и кверцетин, и значительно реже – кемпферол и рутин (Prakash et al., 2007; Olennikov, Tankhaeva, 2010). Сообщалось o накоплении в них катехинов – веществ с Р-витаминной капилляроукрепляющей активностью (Bagratishvili, Jikia, 2015). Наличие фенольных соединений в тканях рододендронов позволяет использовать их в фармакологических целях для профилактики и лечения заболеваний различной этиологии (Popescu, Kopp, 2013; Katanskaya, Zagoskina, 2018). Кроме того, они успешно используются для озеленения крупных городов с высоким уровнем промышленных загрязнений, а также в качестве фиторемедиаторов и биоиндикаторов состояния окружающей среды (Katanskaya, Zagoskina, 2018).
Успешным подходом для изучения стрессовых реакций растений являются культуры клеток и тканей, сохраняющие в условиях in vitro основные характеристики исходных эксплантов, в том числе способность к образованию фенольных соединений (Nosov, 2012; Nielsen et al., 2019). Однако данные о влиянии тяжелых металлов, в частности Cd, на накопление этих соединений вторичного метаболизма в клеточных культурах рододендронов с различным уровнем внутриклеточной дифференциации отсутствуют.
В связи с этим, целью работы являлось изучение реакции антиоксидантной системы каллусных культур Rhododendron japonicum с различным уровнем внутриклеточной дифференциации (гетеротрофные, фотомиксотрофные) на действие Cd.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования служили каллусные культуры, полученные из стерильных проростков рододендрона японского (Rh. japonicum (A. Gray) Suring) и культивируемые на питательной среде Андерсона, содержащей 2-изопентиладенин (5 мг/л), 2,4-дихлорфеноксиуксусную кислоту (5 мг/л), сахарозу (30 г/л), агар (8 г/л). Каллусы выращивали при температуре 25–26°С, относительной влажности воздуха 70% в темноте или при 16-ти часовом фотопериоде (5000 лк). Продолжительность пассажа составляла 45 сут.
При проведении опытов к основной питательной среде добавляли различные концентрации Cd(NO3)2 (42, 63, 126 мкМ). Культуры выращивали в течение 33-х сут. Контролем служили каллусы, культивируемые на среде без Cd.
Оценивали морфофизиологические параметры каллусных культур (Zubova et al., 2020).
Содержание воды определяли путем высушивания растительного материала до постоянной массы в термостате при 70°С в течение 72 ч (Zubova et al., 2020).
Фенольные соединения извлекали 96%-ным этанолом из свежего растительного материала при 45°С в течение 45 мин. Полученные экстракты центрифугировали (16000 об./мин, 15 мин) и надосадочную жидкость использовали для спектрофотометрических исследований. Содержание суммы растворимых фенольных соединений определяли с реактивом Фолина-Дениса, флаванов — с 1%-ным ванилиновым реактивом (Zubova et al., 2020). Калибровочные кривые в обоих случаях строили по (–)-эпикатехину.
Интенсивность перекисного окисления липидов (ПОЛ) определяли по реакции с тиобарбитуровой кислотой (ТБК), анализируя содержание одного из ее конечных продуктов – малонового диальдегида (МДА). Навеску каллусной ткани гомогенизировали в 5 мл 0.1 М Tris-HCl буфера (рН 7.5), содержащего 0.35 М NaCl, после чего добавляли 1 мл 0.5%-ного раствора ТБК в 20% трихлоруксусной кислоте. Реакционную смесь инкубировали на кипящей водяной бане (30 мин), охлаждали и измеряли оптическую плотность раствора при 532 нм. Для расчета содержания МДА (мкмоль/г сырой массы) использовали коэффициент молярной экстинкции равный 1.56 × 10–5 см–1 М–1 (Hodges et al., 1999).
Активность супероксиддисмутазы (СОД) определяли стандартным методом с использованием нитросинего тетразолия (НСТ) (Никерова и др., 2019). Измеряли уменьшение оптической плотности раствора при 560 нм через 30 мин после инкубации на свету. Активность СОД выражали в единицах активности/г сырой массы.
Эксперименты проводили в 3-кратных биологических и аналитических повторностях. Корреляционный и факторный (ANOVA) анализ осуществляли в программе SigmaPlot 12.3. На диаграммах представлены средние арифметические значения определений (М) и их стандартные отклонения (±SEM).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Морфологические характеристики каллусных культур. Важным аспектом жизнедеятельности in vitro культивируемых клеток и тканей является оценка их морфо-физиологических характеристик (Zagoskina et al., 2007; Martins et al., 2020). Каллусные культуры Rh. japonicum, выращиваемые поверхностным способом на агаризованной питательной среде, имели низкую скорость роста (в среднем, 170–180%). Гетеротрофные каллусы были светло-кремового цвета и средней плотности. Фотомиксотрофные культуры были несколько плотнее, имели зеленовато-желтое окрашивание с небольшими участками сиренево-розового цвета. Во всех вариантах оводненность каллусов составляла ~82%.
У культур, выращиваемых на средах с различными концентрациями Cd, морфологические характеристики, рост и оводненность были аналогичны таковым контроля. Лишь у фотомиксотрофного каллуса на среде с высокой концентрацией металла (126 мкМ) отмечалось формирование некротизированных участков темно-коричневого цвета, что свидетельствует об изменениях в морфо-физиологических характеристиках.
Следовательно, как гетеротрофная, так и фотомиксотрофная каллусные культуры рододендрона японского проявляли достаточно высокую устойчивость к действию Cd, о чем свидетельствовало сохранение их жизнеспособности. Об устойчивости растений рода Rhododendron L. к действию Cd отмечено и в литературе (Katanskaya, Zagoskina, 2018).
Уровень перекисного окисления липидов (ПОЛ). Для всех растительных клеток изменение уровня ПОЛ, оцениваемое по содержанию малонового диальдегида (МДА), может служить показателем их реакции на действие различных экзогенных факторов (Полесская, 2007). Его увеличение часто считают признаком развития окислительного стресса и изменения физиологического состояния растений (Sin’kevich et al., 2011; de Dios Alché, 2019).
Каллусные культуры рододендрона японского, выращиваемые в контрольных условиях, значительно отличались по содержанию МДА (рис. 1). У гетеротрофной культуры оно было почти в два раза ниже по сравнению с фотомиксотрофной. Это согласуется с данными о том, что при формировании хлоропластов в клетках растений достаточно часто повышается количество АФК (Полесская, 2007; Kreslavski et al., 2012).
Рис. 1.
Содержание малонового диальдегида (МДА) в гетеротрофных (ГК) и фотомиксотрофных (ФК) каллусных культурах Rhododendron japonicum, выращенных на основной питательной среде (контроль) или на средах с различными концентрациями Cd. Возраст культур – 30 дней.
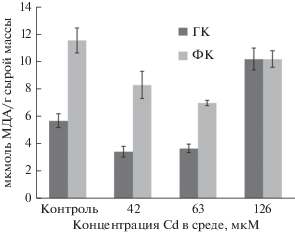
При выращивании каллусов рододендрона на средах с поллютантом уровень ПОЛ в них изменялся (рис. 1). В гетеротрофной культуре содержание МДА на средах с 42 и 63 мкМ Cd было статистически равным и на 50% ниже, чем в контроле. При высокой его концентрации (126 мкМ) уровень ПОЛ в каллусе значительно повышался и превышал значение контрольного варианта почти в два раза, что может быть следствием образования значительных количеств АФК и развития окислительного стресса, как отмечалось и другими авторами (Sin’kevich et al., 2011; Fryzova et al., 2017). В фотомиксотрофных культурах во всех исследованных вариантах содержание МДА было ниже, чем в контроле (на 33, 40 и 10% при 42, 63 и 126 мкМ Cd соответственно).
Исходя из полученных данных можно заключить, что снижение уровня ПОЛ в клетках Rh. japonicum при действии Cd может свидетельствовать об активации системы антиоксидантной защиты, включая высокомолекулярные и низкомолекулярных антиоксиданты, эффективно элиминирующие АФК (de Dios Alché, 2019; Haider et al., 2021).
Высокомолекулярные антиоксиданты. К их числу относятся различные ферменты, в том числе СОД – один из важных и эффективных их представителей, участвующих в реакции дисмутации супероксид-анион радикала до Н2О2 и O2 (Saibi, Brini, 2018). Эта реакция имеет спонтанный характер и протекает чрезвычайно быстро, тем самым защищая клетки от повреждения продуктами реакций (Никерова и др., 2019).
Определение активности СОД показало почти вдвое более высокий ее уровень в гетеротрофной культуре рододендрона по сравнению с фотомиксотрофной (рис. 2). При выращивании гетеротрофного каллуса на средах с различными концентрациями Cd она возрастала и во всех случаях была выше, чем в контроле. При действии 42 и 63 мкМ металла увеличение активности СОД составило 20%, а при 126 мкМ – 30%. Эти различия в определенной степени согласуются с данными по уровню ПОЛ в этих культурах (рис. 1). Следовательно, более высокая активность СОД в гетеротрофном каллусе рододендрона “обеспечивает” более низкий уровень ПОЛ, что свидетельствует о важной роли этого высокомолекулярного антиоксиданта в поддержании баланса АФК, как это отмечалось и другими авторами (Полесская, 2007; de Dios Alché, 2019).
Рис. 2.
Активность супероксиддисмутазы в гетеротрофных (ГК) и фотомиксотрофных (ФК) каллусных культурах Rhododendron japonicum, выращенных на основной питательной среде (контроль) или на средах с различными концентрациями Cd. Возраст культур – 30 дней.
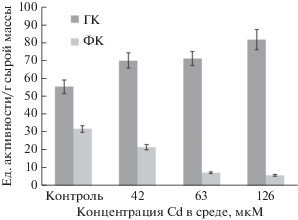
Иная тенденция отмечена для фотомиксотрофной культуры Rh. japonicum, у которой активность СОД на средах с Cd снижалась по сравнению с контролем (на 40% в варианте с 42 мкМ металла и на 80% –при 63 и 126 мкМ). Все это свидетельствует о существенных различиях в активности СОД, одного из основных ферментов антиоксидантной защиты, в каллусных тканях Rh. japonicum с различным уровнем дифференциации.
Низкомолекулярные антиоксиданты. К их числу относятся фенольные соединения, для которых характерно как взаимодействие с АФК, так и комплексообразование с тяжелыми металлами, в том числе Cd (Llugany et al., 2013; Belščak-Cvitanović et al., 2018).
Каллусные культуры рододендрона значительно отличались по суммарному содержанию фенольных соединений, которое в большинстве исследованных вариантов в 2 и более раз было выше у фотомиксотрофного каллуса (рис. 3а). О том, что in vitro культивируемые фотомиксотрофные каллусы, инициированнные из эксплантов различных растений, накапливали больше этих вторичных метаболитов, сообщалось в литературе (Zubova et al., 2020). Это может быть следствием как формирования в них хлоропластов – одного из основных центров биосинтеза фенольных соединений, так и светорегуляции ферментов, ответственных за их образование (Dias et al., 2016; Katanskaya, Zagoskina, 2018).
Рис. 3.
Содержание суммы растворимых фенольных соединений (а) и флаванов (б) в гетеротрофных (ГК) и фотомиксотрофных (ФК) каллусных культурах Rhododendron japonicum, выращенных на основной питательной среде (контроль) или на средах с различными концентрациями Cd. Возраст культур – 30 дней.
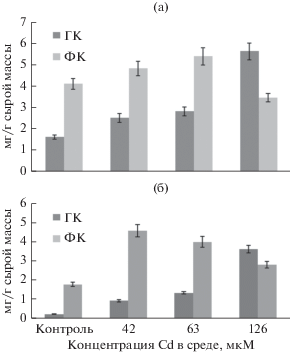
При культивировании как гетеротрофного, так и фотомиксотрофного каллусов рододендрона на средах с Cd происходило увеличение суммарного содержания в них фенольных соединений (рис. 3а). При этом можно отметить четкую взаимосвязь между концентрацией металла в среде и уровнем накоплением этих вторичных метаболитов: чем она была выше, тем больше накапливалось фенольных соединений. О повышении содержания фенольных соединений при действии этого поллютанта на in vitro культивируемые клетки и ткани растений сообщалось в литературе (Zagoskina et al., 2007; Manquián-Cerda et al., 2016). Исключение был вариант с высокой концентрацией Cd (126 мкМ), когда у гетеротрофного каллуса содержание этих веществ в 3.5 раза превышало таковое контроля, тогда как у фотомиксотрофного – всего лишь в 1.5 раза и было даже ниже, чем в варианте с 63 мкМ Cd. Следовательно, значительное количество Cd в питательной среде оказывает негативное действие на биосинтез фенольных соединений в фотомиксотрофной культуре рододендрона.
К компонентам фенольного комплекса растений рода Rhododendron L. относятся флаваны – вещества с антиоксидантной активностью, успешно используемые в фармакологии (Popescu, Kopp, 2013). Способность к их образованию характерна и для каллусов рододендрона японского (рис. 3б). У фотомиксотрофной культуры их количество было значительно выше, по сравнению с гетеротрофной. При выращивании этих культур на средах с Cd количество флаванов возрастало: в гетеротрофном каллусе при всех исследованных концентрациях поллютанта, а в фотомиксотрофном – в большей степени при 42 мкМ Cd.
Все это свидетельствует о том, что выращивание каллусных культур Rh. japonicum с различным уровнем дифференциации на средах с Cd сопровождалось активацией фенольного метаболизма, в том числе и биосинтеза флаванов, количество которых зависло от действующей концентрации поллютанта.
* * *
Высокотоксичный поллютант Cd оказывает стрессовое воздействие на растения: угнетает рост, снижает продуктивность, повышает образование АФК, вследствие нарушения баланса (образование/инактивация). Однако во многих случаях их жизнеспособность сохраняется, что обусловлено различными факторами, включая их видовую принадлежность, устойчивость к действию поллютантов, наличие и регуляцию количества антиоксидантов. В связи с этим представляло интерес изучить ответные реакции клеток на присутствие Cd, используя в качестве модельных объектов каллусы Rh. japonicum, сохраняющие в условиях in vitro способность к накоплению фенольных соединений (см. рис. 3).
В первую очередь следует подчеркнуть, что выращивание гетеротрофных и фотомиксотрофных культур рододендрона на средах с различными концентрациями Cd не вызывало изменений в их морфофизиологических и ростовых характеристиках, которые сохранялись на уровне контроля (данные не приводятся). Подобная тенденция может быть следствием его “ограниченного” поступлении в клетки и, возможно, частичной сорбцией компонентами питательной среды. Кроме того, рододендроны являются аккумуляторами тяжелых металлов, обладают высокой устойчивостью к действию Cd и аналогичная тенденция характерна для культур рододендрона японского, выращиваемых в условиях in vitro.
О жизнеспособности растительных клеток, особенно в условиях действия стрессовых факторов, судят по уровню ПОЛ. В гетеротрофных и фотомиксотрофных культурах Rh. japonicum растущих на средах с низким уровнем Cd (42 и 63 мкМ) он был ниже по сравнению с контролем, что свидетельствовало об активации систем защиты Однако при высокой концентрации поллютанта (126 мкМ) уровень ПОЛ в каллусах повышался: в фотомиксотрофной культуре – до уровня контроля, а в гетеротрофной – значительно превышая его, т.е. антиоксидантная система клеток не справлялась с элиминацией АФК, что, вероятно, приводило к развитию окислительного стресса. Следовательно, количество Cd в питательной среде имеет важное значение для каллусных культур рододендрона японского с различным уровнем дифференциации.
Определение активности СОД – одного их ключевых высокомолекулярных антиоксидантов в клетках растений, показало ее более высокий уровень в гетеротрофных каллусах рододендрона японского по сравнению с фотомиксотрофными (рис. 2). На средах с Cd у гетеротрофной культуры она повышалась, тогда как у фотомиксотрофной – снижалась. Это свидетельствует о значительных отличиях в регуляции СОД в культурах рододендрона при действии Сd. Ее функциональная роль в поддержании баланса АФК и предотвращения окислительного стресса более выражена у гетеротрофного каллуса, о чем свидетельствуют данные по увеличению в нем активности СОД (рис. 2) на фоне снижение уровня ПОЛ (рис. 1) в присутствии Cd (42 и 63 мкМ).
Иная тенденция характерна для накопления низкомолекулярных антиоксидантов фенольной природы в каллусных культурах рододендрона японского (рис. 3). Во всех вариантах их количество было выше в фотомиксотрофной культуре, по сравнению с гетеротрофной.
На средах с Cd суммарное содержание фенольных соединений и флаванов в большинстве случаев увеличивалось. Исключением являлись лишь варианты с высокой концентрацией Cd (126 мкМ), когда у фотомиксотрофной культуры оно было ниже по сравнению с таковым у гетеротрофной.
Все это свидетельствует об изменениях в антиоксидантном статусе каллусных культур рододендрона японского, выращиваемых на средах с Cd, и важной роли как антиоксидантных ферментов, так и низкомолекулярных антиоксидантов в сохранении их жизнеспособности.
Работа выполнена при финансовой поддержке Минобрнауки РФ в рамках темы Государственного задания Института физиологии растений им. К.А. Тимирязева РАН (АААА-А-19-11904189005-8).
Список литературы
Никерова К.М., Галибина Н.А., Мощенская Ю.Л., Бородина М.Н., Софронова И.Н. Определение активности супероксиддисмутазы и полифенолоксидазы в древесине Betula pendula var. Carelica (Betulaceae) при разной степени нарушения ксилогенеза // Растительные ресурсы. 2019. Т. 55(2). С. 213–230.
Полесская О.Г. Растительная клетка и активные формы кислорода. М.: КДУ, 2007. 140 с.
Asati A., Pichhode M., Nikhil K. Effect of heavy metals on plants: an overview // Int. J. Appl. Innov. Eng. Manage. 2016. V. 5(3). P. 56–66.
Bagratishvili D., Jikia R. Formation of phenolic compounds in callus culture from Rhododendron caucasicum Pall. and influence of hormonal effectors on the process // Bull. Georg. Nat. Acad. Sci. 2015. V. 9(2). P. 105–109.
Belščak-Cvitanović A., Durgo K., Huđek A., Bačun-Družina V., Komes D. Overview of polyphenols and their properties // Polyphenols: Properties, Recovery, and Applications / Ed. Galanakis C.M. Duxford. UK.: Woodhead Publ., 2018. P. 3–44.
Dias M.I., Sousa M.J., Alve R.C., Ferreira I.C. Exploring plant tissue culture to improve the production of phenolic compounds: a review // Ind. Crops Prod. 2016. V. 82. P. 9–22.
de Dios Alché J. A concise appraisal of lipid oxidation and lipoxidation in higher plants // Redox Biology. 2019. V. 23. 101136. https:// doi. org/ .https://doi.org/10.1016/j.redox.2019.101136
Fryzova R., Pohanka M., Martinkova P., Cihlarova H., Brtnicky M., Hladky J., Kynicky J. Oxidative stress and heavy metals in plants // Rev. Envir. Cont. Toxicol. 2017. V. 245. P. 129–156.
Haider F.U., Liqun C., Coulter J.A., Cheema S.A., Wu J., Zhang R., Wenjun M., Farooq M. Cadmium toxicity in plants: Impacts and remediation strategies // Ecotox. Environ. Safety. 2021. V. 211. 111887. P. 1–22.
Hayat M.T., Nauman M., Nazir N., Ali S., Bangash N. Environmental hazards of cadmium: past, present, and future // Cadmium Toxicity and Tolerance in Plants / Eds. Hasanuzzaman M., Prasad M.N.V., Fujita M. Academic Press, 2019. P. 163–183.
Hodges D.M., DeLong J.M., Forney C.F., Prange R.K. Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds // Planta. 1999. V. 207(4). P. 604–611.
Katanskaya V.M., Zagoskina N.V. Plants of genus Rhododendron L.: classification, distribution, resistance to stress influences // The Bull. Kharkiv National Agrarian University. Series Biology. 2018. V. 3(45). P. 74–84.
Kolahi M., Kazemi E.M., Yazdi M., Goldson-Barnaby A. Oxidative stress induced by cadmium in lettuce (Lactuca sativa Linn.): Oxidative stress indicators and prediction of their genes // Plant Physiol. Biochem. 2020. V. 146. P. 71–89.
Kreslavski V.D., Los D.A., Allakhverdiev S.I. Signaling role of reactive oxygen species in plants under stress // Rus. J. Plant Physiol. 2012. V. 59. P. 141–154.
Kwon S.J., Cha S.J., Lee J.K., Park J.H. Evaluation of accumulated particulate matter on roadside tree leaves and its metal content // J. Applied Biol. Chemistry. 2020. V. 63(2) P. 161–168.
Llugany M., Tolrà R., Martín S.R., Poschenrieder C., Barceló J. Cadmium-induced changes in glutathione and phenolics of Thlaspi and Noccaea species differing in Cd accumulation // J. Plant Nutr. Soil Sci. 2013. V. 176. P. 851–858.
Manquián-Cerda K., Escudey M., Zúñiga G., Arancibia-Miranda N., Molina M., Cruces E. Effect of cadmium on phenolic compounds, antioxidant enzyme activity and oxidative stress in blueberry (Vaccinium corymbosum L.) plantlets grown in vitro // Ecot. Environ. Safety. 2016. V. 133. P. 316–326.
Martins J.P.R., de Vasconcelos L.L., de Souza Braga P.D.C., Rossini F.P., Conde L.T., de Almeida Rodrigues L.C., Gontijo A.B.P.L. Morphophysiological responses, bioaccumulation and tolerance of Alternanthera tenella Colla (Amaranthaceae) to excess copper under in vitro conditions // Plant Cell, Tissue and Organ Culture (PCTOC). 2020. V. 143(2). P. 303–318.
Naikoo M.I., Dar M.I., Raghib F., Jaleel H., Ahmad B., Raina A., Khan F.A., Naushin F. Role and regulation of plants phenolics in abiotic stress tolerance: an overview // Plant Sign. Mol. 2019. P. 157–168.
Nielsen E., Elisabetta M., Temporiti E., Cella R. Improvement of phytochemical production by plant cells and organ culture and by genetic engineering // Plant Cell Reports. 2019. V. 38. P. 1199–1215.
Nosov A.M. Application of cell technologies for production of plant-derived bioactive substances of plant origin // Appl. Biochem. Microbiol. 2012. V. 48. № 7. P. 609–624.
Olennikov D.N., Tankhaeva L.M. Phenolic compounds from Rhododendron dauricum from the Baikal region // Chem. Nat. Compounds. 2010. V. 46(3). P. 471–473.
Popescu R., Kopp B. The genus Rhododendron: An ethnopharmacological and toxicological review // J. Ethnopharm. 2013. V. 147. P. 42–62.
Pradedova E.V., Isheeva O.D., Salyaev R.K. Classification of the antioxidant defense system as the ground for reasonable organization of experimental studies of the oxidative stress in plants // Rus. J. Plant Physiol. 2011. V. 58. P. 210–217.
Prakash D., Upadhyay G., Singh B., Dhakarey R., Kumar S., Singh K. Free-radical scavenging activities of Himalayan rhododendrons // Cur. Science. 2007. V. 92. P. 526–531.
Qiang Y., Zhou B.S., Gao K. Chemical constituents of plants from the genus Rhododendron // Chem. Biodivers. 2011. V. 8. P. 792–815.
Saibi W., Brini F. Superoxide dismutase (SOD) and abiotic stress tolerance in plants: An overview // Superoxide Dismutase: Structure, Synthesis and Applications / Ed. Magliozzi S. Nova Science Publishers, 2018. P. 101–142.
Seregin I.V., Kozhevnikova A.D., Zhukovskaya N.V., Schat H. Cadmium tolerance and accumulation in excluder Thlaspi arvense and various accessions of hyperaccumulator Noccaea caerulescens // Rus. J. Plant Physiol. 2015. V. 62. P. 837–846.
Sin’kevich M.S., Naraikina N.V., Trunova T.I. Processes hindering activation of lipid peroxidation in cold-tolerant plants under hypothermia // Russ. J. Plant Physiol. 2011. V. 58. P. 1020–1026.
Yu X.Z., Yang L., Feng Y.X. Comparative response of SOD in different plants against cadmium and drought stress at the molecular level // Applied Env. Biotech. 2020. V. 5(1). P. 15–28.
Zagoskina N.V., Goncharuk E.A., Alyavina A.K. Effect of cadmium on the phenolic compounds formation in the callus cultures derived from various organs of the tea plant // Rus. J. Plant Physiol. 2007. V. 54. P. 237–243.
Zubova M.Yu., Nechaeva T.L., Kartashov A.V., Zagoskina N.V. Regulation of the phenolic compounds accumulation in the tea-plant callus culture with a separate and combined effect of light and cadmium Ions // Biology Bulletin. 2020. V. 47. P. 593–604.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


