Известия РАН. Серия биологическая, 2022, № 2, стр. 174-180
Зависимость концентрации тестостерона в крови самцов белухи Delphinapterus leucas от возраста и времени года
Н. В. Инякина 1, *, А. А. Мусидрай 2, Е. В. Никиткина 2, Е. В. Мухачев 1, В. П. Политов 2, Г. В. Ширяев 2
1 ФГУП “Государственный научно-исследовательский институт прикладных проблем”
191119 Санкт-Петербург, наб. Обводного канала, 29, Россия
2 ВНИИГРЖ – филиал ФГБНУ “Федеральный научный центр животноводства – ВИЖ им. академика Л.К. Эрнста”
196601 Санкт-Петербург, п. Тярлево, Московское шоссе, 55а, Россия
* E-mail: piratkanata@rambler.ru
Поступила в редакцию 23.04.2020
После доработки 30.07.2020
Принята к публикации 30.07.2020
- EDN: THKOLD
- DOI: 10.31857/S1026347022020111
Аннотация
В статье приводятся результаты исследования репродуктивной системы самцов белухи (Delphinapterus leucas), в частности, анализ содержания сывороточного тестостерона в образцах сыворотки крови в процессе роста и развития животных. Сравнительная оценка концентрации данного стероидного гормона у молодых и половозрелых животных показала положительную линейную корреляцию между уровнем секреции тестостерона и возрастом животного. Исследования показали, что половая зрелость самцов белух наступает к 8–10 г., при достижении уровня сывороточного тестостерона от 15 нмоль/л и выше.
Нелетальные методы определения концентрации мужских половых гормонов, в первую очередь тестостерона, часто используется при оценке репродуктивного статуса самцов. Это особенно актуально у диких видов животных, имеющих по разным причинам проблемы с воспроизводством при содержании их в неволе. Это в полной мере касается и самцов морских млекопитающих, к которым относится белуха (Delphinapterus leucas) – вид зубатых китов из семейства нарваловых. У самцов белухи, как и у любых мигрирующих видов, живущих в стесненных условиях неволи, возможна утрата естественного поведения, связанная с доминированием и спариванием.
В природных условиях самцы белухи становятся репродуктивно зрелыми в период от 4–7 до 6–9 лет. Однако потомство в основном появляется от самцов, достигших 13-летнего возраста (Robeck et al., 2005). Вполне очевидно, что исследователи обратились к фиксации более точного срока наступления периода зрелости через определение уровня тестостерона, при котором репродуктивная система функционирует наиболее сбалансировано.
Ранее связь между определенными концентрациями тестостерона в крови и состоянием зрелости была продемонстрирована для нескольких видов китообразных: Tursiops truncatus (Kirby, 1990), Phocoenoides dalli (Temte, 1991), Globicephala melas (Desportes et al., 1994), Globicephala macrorhynchus (Kita et al., 1999) и др. На виде D. leucas исследования в этой области впервые начали Høier и Heide-Jørgensen, которые оценивали сыворотку крови самцов белух, собранную “postmortem” в течение мая и сентября. Они установили средние уровни тестостерона – 4.14 нмоль/л (1.19 нг/мл) и 0.96 нмоль/л (0.27 нг/мл) у зрелых и незрелых самцов белухи соответственно (Høier, Heide-Jørgensen, 1994).
В дальнейшем Robeck et al. показали, что наивысшие значения тестостерона в сыворотке крови фиксируются с января по март, а самые низкие показатели – с августа по сентябрь (Robeck et al., 2005). Ранее в докладе Calle et al. были озвучены схожие значения (Calle et al., 2000). Пиковые концентрации тестостерона у взрослых самцов белух с октября по апрель продемонстрированы в работе (O’Brien et al., 2008). Интересные исследования провела в 2016 г. группа ученых под руководством Дж. Т. Ричарда. Было проведено сравнение концентраций тестостерона в сыворотке крови самцов белух различных возрастов и образцах их выдыхаемого воздуха (столбе выдыхаемого конденсированного пара) с целью нахождения корреляций. Концентрации тестостерона (среднее значение ± стандартное отклонение) в образцах выдыхаемого воздуха, взятых у взрослых самцов (119.3 ± 14.2 пг/мл) были выше (р < 0.01), чем у неполовозрелых (<8 лет) (59.4 ± 6.5 пг/мл). Концентрация тестостерона сыворотки крови при этом составляла: 2462.4 ± ± 644.6 и 114.3 ± 21.6 пг/мл соответственно. Концентрация тестостерона в образцах выдыхаемого воздуха у взрослых самцов также продемонстрировала сезонный характер секреции, причем пик секреции происходил в период размножения (февраль–апрель 136.95 ± 33.8 пг/мл). Концентрация тестостерона в этом случае составила 4024.4 ± 836.0 пг/мл (Richard et al., 2016).
Все эти данные согласуются с исследованиями Glabicky et al., в которых проанализированы поведенческие реакции самцов белух, связанные с размножением. Отмечено, что пик их проявления наблюдается в марте (Glabicky et al., 2010).
Robeck et al. также установили, что в отличие от других видов китообразных, схоже демонстрирующих сезонность размножения (Stenella longirostris, Lagenorhynchus obliquidens, Tursiops truncates и др.), средние ежемесячные концентрации тестостерона в сыворотке крови взрослых самцов белух не опускаются ниже 1 нг/мл. У Orcinus orca зафиксированы аналогичные пороговые уровни тестостерона (Robeck, Monfort, 2006). Минимальный уровень тестостерона необходимый для поддержания сперматогенеза для белух в настоящее время неизвестен. При этом минимальное среднее значение 1 нг/мл может свидетельствовать о некоторой степени процесса сперматогенеза в течение всего года (Robeck et al., 2005). В исследованиях Katsumata et al. отмечено, что при достижении и удержании уровня тестостерона в крови самцов белух стабильно выше 1.0 нг/мл, можно фиксировать половую зрелость (Katsumata et al., 2012). Данные исследования интересны также и тем, что рассматриваемые самцы имели различное происхождение и в зависимости от этого демонстрировали различные пики концентрации тестостерона. В частности, у самца, привезенного из России, пик секреции тестостерона отмечен в феврале (Katsumata et al., 2012).
Целью нашей работы было изучение динамики концентрации эндогенного тестостерона в сыворотке крови самцов белух в зависимости от различных факторов (возраста и сезона года).
Результаты данного исследования могут найти практическое применение в решении нескольких прикладных задач:
1. Оценка текущего гормонального состояния морского млекопитающего для контроля его поведения, в особенности при работах на открытой акватории.
2. Выявление репродуктивного статуса самцов белух при определении наиболее подходящих сроков отбора семени для создания криобанков и длительного хранения генетического материала от особей, представляющих наибольшую ценность в разведении и дальнейшей селекции, например по способности к обучению. Выявление доминантных особей в группе за счет оценки уровня тестостерона с учетом поведения поможет контролировать время возможного спаривания с самками естественным путем.
МАТЕРИАЛЫ И МЕТОДЫ
Исследуемое поголовье состояло из самцов белух, содержащихся в полувольных условиях морского вольерного комплекса открытого типа на Баренцевом море. Животные были размещены в разных отсеках плавучих сетевых вольеров по 1–2 особи. На время исследования контакты между животными исключили.
Пробы венозной крови для иммунологического исследования и определения концентрации эндогенного тестостерона получали от морских млекопитающих в течение года. Образцы крови получали от обученных белух в возрасте от 4 до 20 лет, при этом особи моложе 7 лет считались неполовозрелыми. Всего обследовано 9 белух, произведен анализ 50 проб. Отбор проб крови осуществляли из вентральной или дорсальной вены хвостового плавника (рис. 1) с использованием вакуумной системы забора крови в пластиковые вакуумные пробирки типа “Improvacuter” без наполнителя и с активатором свертывания (гелевым). Объем образцов составлял от 3 до 12 мл нативной крови.
Процедура забора крови длилась не более 1 мин. Непосредственно перед забором пробирки предварительно отогревали до температуры не ниже 20°С во избежание температурного гемолиза.
После отбора образцы доставляли в лабораторию и отстаивали при комнатной температуре в течение 1 ч. Далее пробы центрифугировали с целью получения сыворотки при следующих параметрах: 2000 об./мин в течение 10–15 мин. Из 8 мл нативной крови получали около 2.5–3 мл сыворотки. Сыворотку отделяли и разливали в микроцентрифужные пробирки, далее замораживали и хранили при температуре –20°С. Непосредственно перед проведением анализа исследуемые образцы сыворотки крови размораживали и выдерживали при температуре от +18 до +25°С не менее 30 мин.
Концентрацию тестостерона в образцах определяли методом гетерогенного иммуноферментного анализа (ИФА) с использованием иммуноферментного планшетного анализатора “StatFax 2100” (“Awareness Technology”, США). Измеряли оптическую плотность в ячейках 96-луночного иммунологического планшета при длине волны 450. Для определения концентрации тестостерона использовали набор “ХЕМА” (Россия).
Принцип метода основан на конкуренции тестостерона из образца и конъюгированного тестостерона за связывание с антителами на поверхности лунки, в результате чего образуется связанный с пластиком “сэндвич”, содержащий пероксидазу. Во время инкубации с раствором субстрата тетраметилбензидина (ТМБ) происходит окрашивание растворов в лунках. Интенсивность окраски обратно пропорциональна концентрации тестостерона в исследуемом образце. Концентрацию тестостерона в исследуемых образцах определяли по калибровочному графику зависимости оптической плотности от содержания тестостерона в калибровочных пробах. В каждом образце измерение тестостерона проводили дважды, рассчитывая среднее значение.
Полученные результаты были внесены в таблицы 1 MS Excel и проанализированы. Определяли индивидуальные средние показатели для каждого самца за отдельный период года, рассчитывали средние значения от индивидуальных показателей для объединения животных в возрастные группы. Представленные в работе графики и гистограммы выполнены в программе MS Excel.
Таблица 1.
Концентрация тестостерона (нмоль/л) в крови белух (Delphinapterus leucas) в зависимости от возраста, сезона года
| Категория | Количество животных | Количество проб | Тестостерон крови, нмоль/л | ||
|---|---|---|---|---|---|
| среднее значение | SD | максимальные и минимальные значения | |||
| Взрослый самец 8–10 лет (весь год) | 2 | 18 | 13.22 | ± 5.36 | 1.36–26.27 |
| – взрослый самец 8–10 лет (январь–март) | 2 | 12 | 18.85 | ± 8.63 | 7.45–26.27 |
| – взрослый самец 8–10 лет (май–сентябрь) | 2 | 6 | 3.53 | ± 2.22 | 1.36–7.98 |
| Зрелые самцы 18–1 год (июль–сентябрь) | 2 | 4 | 9.13 | ± 0.98 | 7.13–12.51 |
| Пубертатный самец 6–7 лет (все сезоны) | 2 | 16 | 5.18 | ± 2.29 | 1.65–15.91 |
| – пубертатный самец 6–7 лет (январь–март) | 2 | 12 | 5.56 | ± 2.82 | 1.65–15.91 |
| – пубертатный самец 6–7 лет (май–сентябрь) | 1 | 4 | 5.02 | ± 3.23 | 2.11–8.93 |
| Молодой самец 5–6 лет (все сезоны) | 3 | 12 | 1.15 | ± 0.36 | 0.43–2.66 |
| – молодой самец 5–6 лет (январь–март) | 1 | 6 | 1.26 | ± 0.81 | 0.43–2.66 |
| – молодой самец 5–6 лет (май–сентябрь) | 3 | 6 | 1.09 | ± 0.37 | 0.67–2.05 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Это первое исследование, посвященное анализу возрастной и сезонной динамики изменения концентрации сывороточного тестостерона у самцов белухи, содержащихся в полувольных условиях естественной морской акватории. Усредненные данные показывают положительную линейную корреляцию между уровнем секреции тестостерона и возрастом животного, так что средний уровень, диапазон значений, а также максимальные (пиковые) концентрации гормона с возрастом значительно повышаются (рис. 2).
При представлении тех же данных в зависимости от времени года (рис. 3) мы также наблюдаем у половозрелых животных старше 8 лет наличие сезонного пика концентрации тестостерона в январе, феврале и марте и спад уровня этого гормона в летний период (с мая по сентябрь). Данные по пиковым значениям тестостерона согласуются с данными Robeck et al. однако незначительно разнятся по снижению концентрации тестостерона – в наших исследованиях подобный спад происходил в период май–сентябрь, в исследованиях Robeck et al. – август–сентябрь (Robeck et al., 2005). Наши результаты также дополняют выводы исследований (Glabicky et al., 2010), в которых фиксируется пик проявления в марте поведенческих реакций самцов белух, связанные с размножением.
Рис. 3.
Сезонная динамика секреции тестостерона в сыворотке крови разновозрастных (от 5 до 20 лет) самцов белухи. Представленные периоды: январь–март и май–сентябрь.
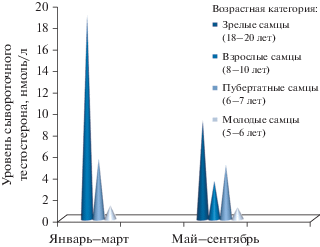
Стоит отметить, что подобные исследования приобретают повышенную значимость в свете отсутствия необходимых референсных значений, которые могли бы быть использованы при организации воспроизводственных мероприятий у белух, содержащихся в полувольных условиях. Например, наиболее популярное в настоящее время третье издание руководства по медицине морских млекопитающих (O’Brien et al., 2018) в своем разделе о репродукции китообразных не содержит справочных данных о нормах содержания половых гормонов в крови самцов белух.
Возрастные особенности изменения концентрации тестостерона в сыворотке крови самцов белух ранее не были отмечены другими авторами. Поэтому в наших исследованиях мы впервые разделили полученные данные по возрастным категориям, а также выделили сезоны года (по месяцам), в которых наблюдались явные различия показателей.
Всего выделяли 4 возрастные категории, из которых молодые самцы (около 5–6 лет); пубертатные самцы (около 6–7 лет) – это самцы переходного возраста, в крови которых наблюдаются гормональные “пики” в разные периоды времени вне зависимости от сезона года; категория взрослые самцы – особи от 8 лет, гормональный статус которых подразумевает ярко выраженную сезонность; зрелые самцы – белухи старше 18 лет, уровень тестостерона которых даже вне пиковых сезонов выше уровня взрослых животных.
Исходя из полученных данных, можно отметить, что уровень тестостерона у каждого самца белухи из всех 4-х возрастных категорий позволяет говорить о постоянном сперматогенезе, который снижается, но не прекращается, что согласуется с данными (Robeck et al., 2005).
Из представленного в таблице 1 материала следует, что уровень сывороточного тестостерона молодых самцов возрастом до 6 лет не превышал 2.66 нмоль/л, сезонной динамики в этой возрастной категории не наблюдалось. Показатели варьировались от 0.43 до 2.66 нмоль/л в течение всего года и, в среднем, составили 1.15 ± 0.36 нмоль/л (или 0.33 ± 0.11 нг/мл).
На рис. 4 (слева) представлен график изменения уровня тестостерона у молодых самцов белухи с января по сентябрь. Определен примерный диапазон значений, максимальные и минимальные значения уровня гормона наблюдаются как в январе, так и в мае.
Рис. 4.
Концентрация сывороточного тестостерона в разные сезоны года у молодых самцов белух в возрасте 5–6 лет (слева), у пубертатного самца белухи в возрасте 6–7 лет (справа).
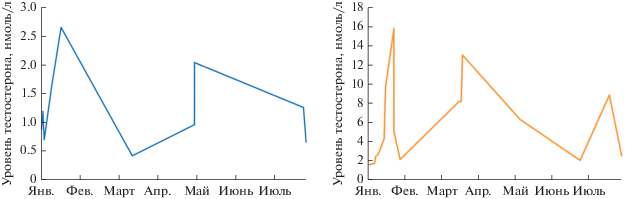
Возрастную категорию самцов белух 6–7 лет мы назвали пубертатной группой – это самцы переходного возраста, концентрация тестостерона в их крови составляет, в среднем, 5.18 ± 2.29 нмоль/л в течение года и в большинстве проб не опускается ниже 2 нмоль/л. В этой категории уже отмечаются некоторые сезонные закономерности, так что значения в период январь–март варьируют в пределах 1.65–15.91 нмоль/л, а в период май–сентябрь – в пределах 2.11–8.93 нмоль/л.
На рис. 4 (справа) представлен график изменения уровня тестостерона у пубертатного самца белухи за год. На графике видно, что уровень гормона к сентябрю в целом снижается, однако пиковые максимальные значения наблюдаются как в январе–марте, так и в сентябре. Вместе с тем минимальные для этой категории белух значения (1.65–2.11 нмоль/л) появляются также в январе–феврале (т.е. и в репродуктивный сезон).
В литературе, если и встречаются сведения об особенностях воспроизводства белух, в большинстве случаев ограничиваются достаточно общими сведениями. Например, в Энциклопедии морских млекопитающих указано, что “самки белух становятся половозрелыми в возрасте 9–12 лет, самцы – несколько позднее” (O’Corry-Crowe G.M., 2017). Поэтому вызывает интерес установление более точных возрастных категорий самцов белух, способных к успешному спариванию с самками, а также более точных воспроизводственных периодов.
Согласно нашим данным, категория взрослых самцов включает в себя животных старше 8 лет с ярко выраженной репродуктивной сезонностью, явно повышенным средним уровнем тестостерона в крови по сравнению с остальными особями исследуемого поголовья.
Графики, представленные на рис. 5, наглядно демонстрируют особенности этой возрастной категории. Средний уровень сывороточного мужского гормона у 8–10-летних самцов белухи составляет 13.22 ± 5.36 нмоль/л при этом в репродуктивный сезон (середина января–март) это значение увеличивается до 18.85 ± 8.63 нмоль/л, достигая у отдельных самцов пиковых значений 26.27 нмоль/л, а далее к маю–сентябрю уровень снижается и составляет, в среднем, уже 3.53 ± 2.22 нмоль/л.
Рис. 5.
Концентрация сывороточного тестостерона двух взрослых самцов белухи в возрасте 8–10 лет в разные сезоны года.
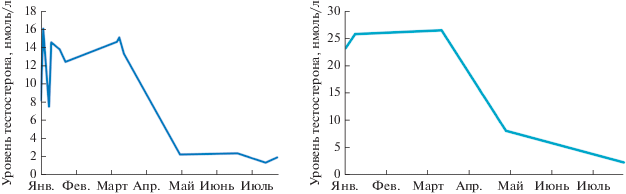
В отдельную категорию мы выделили зрелых самцов старше 18 лет. Сыворотки от этих животных были исследованы только в июле и сентябре, но даже в этот период (нерепродуктивный) средний уровень концентрации тестостерона у них составил 9.13 ± 0.98 нмоль/л, а максимальное значение, которое мы получили – 12.51 нмоль/л. Этот результат значительно выше, чем у категории взрослых животных в это же время.
Мы планируем дальнейшее изучение гормонального статуса зрелых животных и предполагаем, что в пиковый период (январь–март) результаты анализа сывороточного тестостерона будут значительно выше, чем у половозрелых самцов 8–10 лет.
Сопоставление данных о гормональном статусе с информацией об изменениях поведения морских животных в разные периоды поможет выявлять тенденции пищевой и половой мотивации служебных морских животных, что, на наш взгляд, при рутинном определении репродуктивного статуса позволит существенно повысить эффективность работы морских биотехнических систем на основе морских млекопитающих.
Финансирование. Работа выполнена в рамках научных исследований Министерства науки и высшего образования РФ по теме № АААА-121052600354-7.
Список литературы
Calle P.P., Monfort S., Dunn J.L., Jensen E., Boehm J.R., Young S., Robeck T. Seasonal Testosterone Secretion in Male White Whales (Delphinapterus leucas), in Proceeding of American Association of Zoo Veterinarians and International Association for Aquatic Animal Medicine Joint Meeting. 2000. 49–50.
Desportes G., Saboureau M., Lacroix A. Growth-related changes in testicular mass and plasma testosterone concentrations in long-finned pilot whales, Globicephala melas // J. Reprod. Fertility. 1994. V. 102. P. 237–244.
Glabicky N., DuBrava A., Noonan M. Social–sexual behavior seasonality in captive beluga whales (Delphinapterus leucas) // Polar Biology. 2010. V. 33(8). P. 1145–1147. https://doi.org/10.1007/s00300-010-0790-3
Høier R., Heide-Jørgensen M.P. Steroid hormones and prolactin in white whales (Delphinapterus leucas) from West Greenland // Bioscience. 1994. V. 39. P. 227–238.
Katsumata E., Ueda Y., Arai K., Katsumata H., Kishimoto M., Watanabe G., Taya K. Circulating Testosterone and inhibin levels at different ages in the male beluga (Delphinapterus leucas) // J. Veter. Med. Sci. 2012. V. 74(3). P. 293–300. https://doi.org/10.1292/jvms.10-0289
Kirby V.L. Endocrinology of marine mammals. L.A. Dierauf, ed. Handbook of marine mammal medicine: health, disease and rehabilitation. CRC Press Inc., Boca Raton, FL. 1990. P. 303–351.
Kita S., Yoshioka M., Kashiwagi M. Relationship between sexual maturity and serum and testis testosterone concentrations in short-finned pilot whales Globicephala macrorhynchus // Fisheries Science. 1999. V. 65(6). P. 878–883. https://doi.org/10.2331/fishsci.65.878
O’Brien J.K., Steinman K.J., Schmitt T., Robeck T.R. Semen collection, characterization and artificial insemination in beluga (Delphinapterus leucas) using liquid-stored spermatozoa // Reprod. Fert. Develop. 2008. V. 20(7). P. 83.
O’Brien J.K., Robeck T.R., Atkinson S. Reproduction. In F.M.D. Gulland, L.A. Dierauf, K.L. Whitman (Eds), CRC Handbook of Marine Mammal Medicine. (3d ed.). Boca Raton: CRC Press. 2018. P. 169–207.
O’Corry-Crowe G.M. Beluga Whale. Encyclopedia of Marine Mammals. 2017. P. 93–96. https://doi.org/10.1016/b978-0-12-373553-9.00030-4
Richard J.T., Robeck T.R., Osborn S.D., Naples L., McDermott A., LaForge R., Romano T.A., Sartini B.L. Testosterone and progesterone concentration in blow samples are biologically relevant in belugas (Delphinapterus leucas) // Gen. Compar. Endocrin. 2016. 11 p.
Robeck T.R., Monfort S.L., Calle P.P., Dunn J.L., Boehrn J.R., Young S., Clark S.T. Reproduction, growth and development in captive beluga (Delphinapterus leucas) // Zoo Biology. 2005. V. 24. P. 29–49.
Robeck T.R., Monfort S.L. Characterization of male killer whale (Orcinus orca) sexual maturation and reproductive seasonality // Theriogenology. 2006. V. 66(2). P. 242–250. https://doi.org/10.1016/j.theriogenology.2005.11.007
Temte J.L. Use of serum progesterone and testosterone to estimate sexual maturity in Dall’s porpoise Phocoenoides dalli // Fishery Bulletin. 1991. V. 89. P. 161–166.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая




