Известия РАН. Серия биологическая, 2022, № 5, стр. 555-560
Первая регистрация вибрационных сигналов у мух рода Meromyza (Diptera, Chloropidae)
А. А. Яцук 1, *, Л. С. Шестаков 2
1 ФГБУН Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
2 ФГБУН Институт проблем передачи информации им. А.А. Харкевича РАН
127051 Москва, Большой Каретный пер., 19, Россия
* E-mail: sasha_djedi@mail.ru
Поступила в редакцию 16.04.2021
После доработки 10.12.2021
Принята к публикации 10.01.2022
- EDN: ADTNOY
- DOI: 10.31857/S1026347022040163
Аннотация
В статье приводится первое описание вибрационных сигналов самок двух видов злаковых мух рода Meromyza. Длительность сигнала самок Meromyza saltatrix составляет в 0.153 ± 0.06 с, частотный диапазон – от 229 до 650 Гц. Длительность сигнала самок Meromyza femorata составляет, в среднем, 0.142 ± ± 0.12 с, частотный диапазон – от 183 до 368 Гц. Зарегистрированные сигналы мух рода Meromyza отличаются от известных сигналов мух из соседних родов и семейств.
Акустические и вибрационные сигналы часто являются неотъемлемым элементом брачного поведения, одним из механизмов прекопуляционной межвидовой изоляции и важным фактором полового отбора (Тишечкин, Веденина, 2016). У двукрылых обнаружены следующие типы сигналов: звуки, передаваемые с помощью воздушной среды, производимые вибрацией крыльев или других придатков; звуки, передаваемые с помощью вибрации субстрата (Kanmiya, 2006).
Насекомые могут использовать различные субстраты для коммуникации. Одним из основных субстратов для коммуникации являются растения (Michelsen et al., 1982; Cocroft, Rodriguez, 2005,). Считается, что сигналы насекомых оптимально приспособлены к тому типу субстрата, на котором осуществляется коммуникация (Cocroft, Rodriguez, 2005).
Для короткоусых двукрылых известно, что вибрационная коммуникация является частью видоспецифичного прекопуляционного поведения у представителей семейств Drosophilidae (Hoy et al., 1988, Mazzoni et al., 2013), Agromyzidae (Ge et al., 2019), Tephritidae (Webb et al., 1983) и Chloropidae (Kanmiya, 1990; Kanmiya, 2006,).
Настоящая работа посвящена изучению вибрационной коммуникации у мух рода Meromyza (Meigen, 1830), которые представляются хорошим модельным объектом для исследования механизмов межвидовой изоляции, благодаря высокой изученности эволюционных и филогенетических взаимоотношений между видами (Яцук, 2019), а также из-за наличия развитой системы вибрационных сигналов у представителей близких родов (Kanmiya, 1990; Kanmiya, 2006). Род Meromyza относится к семейству Chloropidae, которое является на открытых стациях едва ли не самой массовой группой двукрылых (Нарчук, 1987). Имаго меромиз приурочены к открытым стациям с низким травостоем, где одновременно встречается несколько разных видов (Лескова, 1953, Пантелеева, 1989). Использование одинаковых биоценозов разными видами предполагает существование механизмов репродуктивной изоляции на пре-, копулятивном и посткопулятивном уровнях, не связанных с экологическими или географическими преградами. Одним из таких механизмов могут быть видоспецифичные вибрационные сигналы, как это было установлено для хлоропид рода Calamoncosis (Enderlein, 1911) (Kanmiya, 2006) и Lipara (Meigen, 1830) (Kanmiya, 1990).
Цель данной работы заключается в проверке предположения об использовании меромизами вибрационных сигналов при прекопуляционном поведении и предварительной оценке возможности их использования для идентификации видов рода Meromyza.
МАТЕРИАЛЫ И МЕТОДЫ
Материалом для данной работы послужили записи вибрационных сигналов видов Meromyza femorata (Macquart, 1835) (записано 6 особей), сделанные в июле 2019 г., и Meromyza saltatrix (L., 1761) (записано 3 особи), сделанные в июне 2020 г., в Москве (координаты места сбора: 55.7120206, 37.5878901). Были зарегистрированы прекопуляционные сигналы самок. Самцы во время конспецифических взаимодействий явных сигналов не издавали, при встрече с рецептивной самкой сразу пытались копулировать. У вида M. femorata был зарегистрирован сигнал, издаваемый в процессе копуляции. У самцов этого вида были дополнительно записаны вибрационные колебания, создаваемые ими при прыжках.
Эксперименты проводили при температуре 19–24°C. Именно этот диапазон температур наиболее оптимален для нормальной активности меромиз (Nishijima, 1960).
Вибрационные сигналы регистрировали с помощью монофонического пьезокристаллического адаптера ГЗК-661. Калибровку оборудования проводили с помощью лазерного виброметра PDV 100 (“Polytec”, Germany) и вибростенда 4810 (Bruel & Kjaer). Подобная методика записи вибрационных сигналов в полевых условиях является одной из наиболее распространенных, и описана в работах Шестакова (2015) и Тишечкина (Tishechkin, 2015). Во время записи сигналов мухи находились в широкой пластиковой пробирке объемом 50 мл и диаметром 3 см, закрытой бумажной мембраной, через которую были просунуты свежие соломины злаков. Адаптер ГЗК-661 был присоединен к соломинам. Одновременно с записью вибрационных сигналов велось визуальное наблюдение за поведением исследуемых мух. Во время эксперимента в пробирке находилось от 5 до 10 особей, среди которых было не менее двух самок и не менее двух самцов, поскольку определить готовность к спариванию у конкретной особи не представлялось возможным.
Анализ и измерение параметров сигналов осуществляли с использованием программы CoolEdit Pro (“Syntrillium software corporation”, США).
Статистическую обработку данных (критерий Стьюдента) проводили в программах Microsoft Office Excel 2007 (“Microsoft Corporation”, США) и Statistica 10 (“StatSoft, Inc.”, США).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
У самок M. saltatrix и M. femorata обнаружены вибрационные сигналы, издаваемые при контактах с самцами перед копуляцией. Данные сигналы производились тремуляцией брюшка. Во время эмиссии сигнала самка трясет брюшком, не касаясь субстрата. Длительность сигнала самок M. saltatrix составляет, в среднем, 0.153 с, спектр сигнала шумовой, частотный диапазон – от 229 до 650 Гц. Длительность сигнала самок M. femorata составляет, в среднем, 0.142 с, спектр сигнала так же шумовой, частотный диапазон – от 183 до 368 Гц. Подробные параметры длительностей пульса, частоты, периода повторения для записанных сигналов указаны в таблице 1. Сонограммы и осцилограммы для сигналов приведены на рис. 1.
Таблица 1.
Параметры вибрационных сигналов и вибрационных колебаний (Xср ± Xст. откл) у M. saltatrix и M. femorata
| Параметр | Прекапуля ционный сигнал самок M. saltatrix |
Прекапуля ционный сигнал самок M. femorata |
Вибрационные колебания при прыжках самцов M. femorata |
Тремуляция брюшка во время копуляции M. femorata |
|---|---|---|---|---|
| Длительность сигнала (с) | 0.153 ± 0.06 | 0.142 ± 0.12 | 0.28 ± 0.07 | 0.296 ± 0.026 |
| Диапазон частот (ГЦ) | 229–650 | 183–368 | 292–602 | 420–700 |
| Преобладающая частота (ГЦ) | Начальная часть
сигнала 645 ± 0.08; Остальная часть сигнала 240 ± 10.6 |
Начальная часть
сигнала 306 ± 58; остальная часть сигнала 239 ± 54 |
380 ± 84 | 621.25 ± 18 |
| Период повторения (с) | 1.13 ± 0.13 | 2.24 ± 0.59 | – | 13.58 ± 21.76 |
Рис. 1.
Осциллограммы и сонограммы зарегистрированных сигналов и вибрационных колебаний меромиз: прекапуляционный сигнал самок M. saltatrix (а), M. femorata (б), тремуляция брюшка во время копуляции M. femorata (в), вибрационные колебания во время прыжка самца M. femorata (г); 1 – начальная часть сигнала, 2 – остальная часть сигнала.
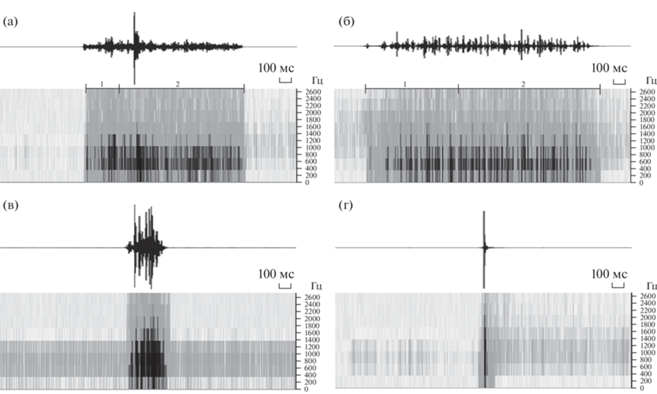
Частотный диапазон сигнала самок M. saltatrix шире, чем у сигнала самок M. femorata. Внутри этих сигналов можно выделить начальную часть и остальную по заметному изменению преобладающей частоты. Преобладающая частота начальной части сигнала у самок M. saltatrix составляет 645 Гц, а остальной части – 240 Гц. У самок M. femorata преобладающая частота начальной части сигнала составляет 306 Гц, а остальной части – 239 Гц. Критерий Стьюдента показал достоверные отличия начальной части сигнала самок M. femorata от M. saltatrix (tst = 10.12; df = 4; p = 0.000). При этом уровень внутривидовой изменчивости записанных сигналов не превышает межвидовых различий.
Согласно нашим наблюдениям, меромизы при передвижении часто используют прыжки, которые представляют собой резкое перемещение вперед на большое расстояние за счет быстрого разгибания задних ног. Вибрации, создаваемые прыжками, могут быть частью прекопуляционного поведения. У самки M. femorata перед копуляцией наблюдается снижение двигательной активности и расправление крыльев, в то время как самец перемещается с места на место вокруг нее в т. ч. и с помощью прыжков. Параметры вибрационных колебаний, создаваемых самцами во время прыжков, представлены в таблице. Как только самка издает сигнал, самец приземляется на нее сверху и начинается процесс копуляции. Между замиранием самки и началом копуляции проходит 18 ± 2 с. Во время копуляции мухи могут перемещаться по субстрату и могут совершать прыжки, иногда останавливаясь на месте. Периодически самец начинает особенно интенсивно двигать брюшком (тремуляция брюшка во время копуляции). Частотный диапазон тремуляции брюшка во время копуляции у M. femorata составляет 420–700 Гц. Подробные параметры сигнала указаны в таблице. Сонограмма и осцилограмма приведены на рис. 1. Процесс копуляции продолжается 13 ± 0.4 мин. Интересно отметить, что издавать сигналы и копулировать мухи начинали только при ярком солнечном освещении.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Мы предполагаем, что у меромиз сигналы самок могут нести информационную функцию при распознавании конспецифичного полового партнера и являются частью ритуала ухаживания. Поскольку сигналов самцов при конспецифических взаимодействиях не зарегистрировано, можно предположить, что сигналы такого типа сохранились в процессе эволюции только у самок. Косвенным подтверждением этой гипотезы является то, что у представителей близкого к меромизам рода Lipara (Meigen, 1830) сигналы самцов весьма вариабельны и сильно различаются между географическими популяциями, в то время как сигналы самок практически не подвержены географической изменчивости и более надежны в качестве видоспецифичных признаков при различении близких таксонов (Kanmiya, 1990). Эти данные говорят о том, что сигналы самок злаковых мух потенциально могут быть использованы как таксономический признак при идентификации видов. Зарегистрированные нами сигналы самок двух видов меромиз подтверждают это предположение, так как они достоверно различаются по частотным параметрам. В свою очередь, самцы могут использовать другие типы сигналов (визуальные, химические и т.д.) в процессе ухаживания. Так, у видов Drosophila persimilis (Dobzhansky, Epling, 1944) и D. pseudoobscura (Frolova, 1929) помимо вибрационных и тактильных сигналов используются визуальные сигналы (Hernández, Fabre, 2016).
У представителей некоторых групп двукрылых, близких к роду Meromyza, известны вибрационные сигналы самок, которые играют важную роль во внутривидовой коммуникации. Так, у представителей рода Calamoncosis (Enderlein, 1911), чьи личинки по морфологии и биологии близки к меромизам (Нарчук, 1987), сигналы самок состоят из нескольких предварительных колебаний с последующей одиночной непрерывной вибрацией (Kanmiya, 2006), в то время как спектр сигнала самок меромиз шумовой. У вида Lipara lucens (Meigen, 1830) (также близкого к роду Meromyza) после выхода из галлов самки остаются малоподвижными, а самцы перемещаются между стеблями в поисках партнерши для спаривания, издавая при этом сигнал, состоящий из двух фраз (Kanmiya, 1990). Сигналы самок L. lucens по своей частоте отличаются от сигналов самок рода Meromyza. По тем же параметрам отличается от них и Liriomyza huidobrensis (Blanchard, 1926), представитель соседнего семейства Agromyzidae (Ge et al., 2019). Теоретически, все эти отличия могут обеспечивать успешную одновременную коммуникацию этих видов в одном биотопе, где встречаются кормовые растения всех перечисленных групп мух.
Различия преобладающих частот начальной части сигналов самок M. femorata и самок M. saltatrix могут быть обусловлены совпадением фенологии этих видов. Лёт имаго M. saltatrix идет с мая до начала августа, а M. femorata – с июля по август. При этом данные виды способны населять одни и те же биотопы (Федосеева, 1961).
Прыжки также могут являться частью прекопуляционного поведения. Триба Meromyzini, в которую входит род Meromyza, отличается от других групп семейства Chloropidae утолщенными бедрышками задних ног, позволяющими такой способ перемещения (Нарчук, 1987).
Тремуляция брюшка самцов M. femorata во время копуляции возможно связана с выделением феромонов, с тактильным стимулом к продолжению копуляции, а также с передачей спермы, как, например, предполагается для копулятивных сигналов самок некоторых видов Drosophila (Fallen, 1823) (Kerwin, Philipsborn, 2020).
Отсутствие у самцов выраженных призывных вибрационных сигналов можно объяснить тем, что для некоторых групп двукрылых известны такие поведенческие особенности как скопления в особых “местах встречи”, которые позволяют обеспечить возможность использования систем прекопуляционной коммуникации ближнего действия. Например, самцы видов рода Anastrepha (Schiner, 1868) (Diptera, Tephritidae) образуют скопления на вершинах деревьев (Arita, Kaneshiro,1989). Известно, что меромизы предпочитают более низкую и редкую растительность (Лескова, 1953; Hughes, 1955), что может являться специальным местом встречи у самок и самцов меромиз. Ранее, в работах Лесковой (1953) и Hughes (1955) была выдвинута гипотеза о том, что приуроченность меромиз к низкому травостою связана с хорошей освещенностью внутри растительности. В этом случае можно ожидать наличия важных визуальных сигналов в ритуале ухаживания. Известно, что вибрации с частотой от 100 до 500 Гц распространяются по растениям с минимальными потерями энергии (Michelsen et al., 1982; Cokl, Virant–Doberlet, 2003), однако междоузлия гасят сигнал (Cokl, Virant–Doberlet, 2003), что может вынуждать меромиз скапливаться для поиска партнера на участках с низкой травой для максимально эффективной передачи вибрационных сигналов. Можно предположить, что в ритуале ухаживая меромиз есть как вибрационные сигналы, так и визуальные, а низкая хорошо освещенная растительность обеспечивает наилучшие условия для прекопуляционной коммуникации.
Для меромиз известно, что на стадии копуляции межвидовая изоляция обеспечивается за счет морфологических различий полового аппарата самцов (Яцук, Сафонкин, 2018). Мы предполагаем, что вибрационная коммуникация является важной частью видоспецифичного прекопуляционного поведения мух рода Meromyza. Возможно, зарегистрированный нами сигнал самок необходим самцам для продолжения ритуала ухаживания, или данные сигналы несут функцию сообщения самцу о готовности самки к копуляции.
С практической точки зрения, сигналы самок меромиз похожи между собой, что ограничивает возможности их использования в качестве маркера, определяющего видовую принадлежность исследуемых мух.
Список литературы
Лескова А.Я. Некоторые биологические особенности злаковой мухи меромизы – Meromyza saltatrix L. // Тр. Белорус. с.-х. академии. 1953. Т. 19. С. 44–53.
Нарчук Э.П. Злаковые мухи (Diptera: Chloropidae), их система, эволюция и связь с растениями. Л.: Наука, 1987. 280 с.
Пантелеева Н.Ю. Злаковые мухи (Diptera; Chloropidae) Центрального Черноземья (фауна, некоторые экологические особенности): Автореф. дис. канд. биол. наук. Л.: 1989. 20 с.
Тишечкин Д.Ю., Веденина В.Ю. Акустические сигналы насекомых: репродуктивный барьер и таксономический признак // Зоол. журн. 2016. Т. 95. № 11. С. 1240–1276.
Федосеева Л.И. К экологии злаковых мух Meromyza (Diptera, Chloropidae) в Московской области // Зоол. журн. 1961. Т. 40. № 8. С. 1205–1213.
Шестаков Л.С. Сравнительный анализ вибрационных сигналов 16 видов клопов–щитников семейства Pentatomidae (Heteroptera) // Зоол. журн. 2015. Т. 94. № 3. С. 320–335.
Яцук А.А., Сафонкин А.Ф. Закономерности изменения формы постгонитов мух рода Meromyza (Diptera: Chloropidae) // Журн. общей биологии. 2018. Т. 79. № 1. С. 18–27.
Яцук А.А. Морфологическое и генетическое разнообразие злаковых мух рода Meromyza (Meigen, 1830) (Diptera, Chloropidae): Автореф. дис. канд. биол. наук. М.: 2019. 25 с.
Arita L.H., Kaneshiro K.Y. Sexual selection and lek behavior in the Mediterranean fruit fly, Ceratitis capitata (Diptera: Tephritidae) // Pacific Science. 1989. V. 43. № 2. P. 135–143. http://doi.org/handle.net/10125/1210
Cocroft R.B., Rodriguez R.L. The behadoivioral ecology of insect vibrational communcation // BioScience. 2005. V. 55. № 7. P. 323–334.
Cokl A., Virant–Doberlet M. Communication with substrate–borne signals in small plant–dwelling insects // Annu. Rev. Entomol. 2003. V. 48. P. 29–50. https://doi.org/10.1146/annurev.ento.48.091801.112605
Ge J., Wei J., Zhang D., Hu C., Zheng D., Kang L. Pea leafminer Liriomyza huidobrensis (Diptera: Agromyzidae) uses vibrational duets for efficient sexual communication // Insect Science. 2019. V. 26. P. 510–522.
Hernández M.V., Fabre C.C.G. The elaborate postural display of courting Drosophila persimilis flies produces substrate-borne vibratory signals // J. Insect. Behav. 2016. V. 29. P. 578–590. https://doi.org/10.1007/s10905-016-9579-8
Hoy R.R., Hoikkala A., Kaneshiro K. Hawaiian courtship songs: evolutionary innovation in communication signals of Drosophila // Science. 1988. V. 240. № 4849. P. 217–219https://doi.org/10.1126/science.3127882
Hughes R.D. The influence of the prevailing weather on the numbers of Meromyza variegata Meigen (Diptera, Chloropidae) caught with a sweepnet // J. Anim. Ecol. 1955. V. 24. № 2. P. 324–335.
Kanmiya K. Acoustic properties and geographic variation in the vibratory courtship signals of the european chloropid fly, Lipara lucens (Meigen) (Diptera, Chloropidae) // J. Ethology. 1990. V. 8. P. 105–119.
Kanmiya K. Signals in Diptera // Insect sounds and communication / Eds Drosopoulos S., Claridge M. F.; New York: Taylor & Francis Group, 2006. P. 381–396.
Kerwin P., von Philipsborn A.C. Copulation song in Drosophila: Do females sing to change male ejaculate allocation and incite postcopulatory mate choice? // BioEssays. 2020. V. 42. № 11. https://doi.org/10.1002/bies.202000109
Mazzoni V., Anfora G., Virant–Doberlet M. Substrate vibrations during courtship in three Drosophila species // PLoS ONE. 2013. V. 8. № 11. P. e80708. https://doi.org/10.1371/journal.pone.0080708
Michelsen A., Fink F., Gogala M., Traue D. Plants as transmission channels for insect vibrational songs // Behav. Ecol. Sociobiol. 1982. V. 11. P. 269–281.
Nishijima Y. Studies of the barley stem maggot, Meromyza saltatrix (Linné), with special reference to the ecological aspects // J. faculty agricult. Hokkaido univers. 1960. V. 51. Pt. 2. P. 382–449.
Tishechkin D. Yu. Speciation in Macropsinae leafhoppers (Homoptera: Auchenorrhyncha: Cicadellidae) – the role of acoustic signal divergence and host plant shifts // Rus. Entomolog. J. 2015. V. 24. № 1. P. 7–16.
Webb J.C., Calkins C.O., Chambers D.L., Schwienbacher W., Russ K. Acoustical aspects of behavior of Mediterranean fruit fly, Ceratitis capitata: analysis and identification of courtship sounds // Entom. Exper. Applicata. 1983. V. 33. № 1. P. 1–8.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


