Известия РАН. Серия биологическая, 2023, № 1, стр. 43-51
Регуляция активности декарбоксилирующих малатдегидрогеназ в листьях кукурузы при адаптивной реакции на солевой стресс
А. Т. Епринцев 1, *, М. О. Гатауллина 1
1 ФГБОУ ВО “Воронежский государственный университет”
394018 Воронеж, Университетская пл., 1, Россия
* E-mail: bc366@bio.vsu.ru
Поступила в редакцию 03.11.2021
После доработки 05.04.2022
Принята к публикации 05.04.2022
- EDN: IJBHED
- DOI: 10.31857/S1026347023010043
Аннотация
Исследовано влияние солевого стресса на активность декарбоксилирующих малатдегидрогеназ в листьях кукурузы при осуществлении адаптивной реакции клеточного метаболизма к солевому стрессу. Показано, что избыточные концентрации NaCl вызывают увеличение ферментативной активности как НАД+-МЭ, так и НАДФ+-МЭ. Наибольший вклад в увеличение активности НАД+-МЭ вносит интенсификация экспрессии гена nad-me2, тогда как экспрессия nad-me1 при засолении увеличивается в меньшей степени. Метил-специфичная ПЦР показала обратную зависимость между экспрессией nad-me2 и степенью метилирования промотора данного гена, в то время как nad-me1 и nadf-me, по-видимому, регулируются иными механизмами. Предполагается разная функциональная роль каждой изоформы исследуемых малик-энзимов в адаптивной реакции клеточного метаболизма.
Роль органических кислот очень важна при перестройке клеточного метаболизма к стрессовым условиям различной природы. Особое значение имеет малат – яблочная кислота, которая способна запасаться в вакуоли растительных клеток в значительных количествах, что обеспечивает ей специфическую функцию источника С4- и С3-органических веществ (Igamberdiev, Eprintsev, 2016). В условиях засоления доминирующую роль в адаптивном варианте перестройки метаболизма играет интенсификация цикла трикарбоновых кислот, что получило название “солевое дыхание” (Полевой, 1989; Eprintsev et al., 2021).
Ранее была показана важная роль малатдегидрогеназной ферментной системы в регуляции и трансформации метаболизма яблочной кислоты. Особо хорошо изучено действие оксидоредуктаз – НАД+ и НАДФ+-малатдегидрогеназ ((МДГ) КФ 1.1.1.37, КФ 1.1.1.82) в процессах энергизации катаболических и анаболических реакций. НАД+-зависимая малатдегидрогеназа оказывает сильное действие на функционирование цикла трикарбоновых кислот, и было установлено ее резкое активирование путем изменения экспрессии соответствующих генов и при этом выявлен эпигенетический механизм ее регуляции (Eprintsev et al., 2021). Гораздо меньше работ посвящено роли декарбоксилирующих малатдегидрогеназ (НАД+-МЭ, КФ 1.1.1.39) и НАДФ+-зависимой (НАДФ+-МЭ, КФ 1.1.1.40). Хотелось бы отметить важное значение обозначенных энзимов, обусловленное способностью ферментативно изменять углеродный скелет малата, в частности синтезировать пируват (Badia et al., 2017).
Декарбоксилирующие малатдегидрогеназы включают в себя семейство белков с несколькими изоформами, расположенными в разных компартментах эукариотических клеток. Это ключевой фермент, регулирующий метаболизм малата. Кроме того, малик-энзимы широко присутствуют в митохондриях, хлоропластах и цитоплазме растений и участвуют в регуляции роста, развития растений и их реакции на стресс (Sun et al., 2019; Eprintsev et al., 2020b).
НАД+-зависимый малик-энзим (К.Ф. 1.1.1.39) использует в качестве кофермента НАД+/НАДН. Получение гомогенных препаратов НАД+-малик-энзимов позволило установить их отличие в таких важных характеристиках, как сродство к субстратам и в значениях рН-оптимумов (Епринцев, Гатауллина, 2021). Сообщается о регулирующем влиянии ионов металлов, включая катионы натрия на активность различных малатдегидрогеназ (Weimberg, 1967; Emami at al., 2016).
НАДФ+-зависимый малик-энзим служит источником углекислого газа для фотосинтеза в хлоропластах оболочки C4-растений и в цитозоле растений с СAM-метаболизмом, а также источником НАДФН и пирувата в цитозоле и пластидах различных тканей (Hill et al., 1996).
В настоящее время имеется много доказательств участия малик-энзимов в адаптивных реакциях на различные стрессы (Chen et al., 2019), однако регуляция активности данных ферментных систем на экспрессионном уровне практически не изучена.
Эпигенетический механизм регуляции характерен для ключевых энзимов цикла Кребса. Причем, этот способ регуляции ферментов ЦТК имел высокую эффективность (Aceituno et al., 2008). Однако, наблюдается явный дефицит данных о возможном эпигенетическом механизме регуляции их функционирования. В связи с этим целью нашей работы было исследование динамики активности НАД+- и НАДФ+-малик-энзимов в листьях кукурузы в условиях солевого стресса, экспрессии генов, кодирующих данные ферменты, и изменения величины метильного статуса CpG-островков промоторов их генов.
МАТЕРИАЛЫ И МЕТОДЫ
Использовали листья 10-дневной кукурузы (Zea mays L.) сорта Воронежская-76, выращенные гидропонно при десятичасовом световом дне и интенсивности света 25 Вт/м2 в климатической камере (“LabTech”, Корея).
Группы растений без корневой системы инкубировали в растворе NaCI 24 ч. Концентрация солевого раствора хлорида натрия (NaCI) составляла 150 мМ. Контрольной группой являлись растения, помещенные в воду.
Первые образцы для исследования извлекали еще до начала инкубации (нулевой образец) из контрольной, и из опытной группы растений. Далее образцы отбирали из инкубационной среды через 1, 3, 6, 12 и 24 ч от начала эксперимента.
Получение митохондриальной и цитоплазматической форм осуществляли путем проведения дифференциального центрифугирования. Первоначально получали фракцию хлоропластов центрифугированием при 3000 g 8–10 мин. Митохондрии из цитозоля осаждали центрифугированием при 12 000 g 20 мин, добавляя 0.1%-ный ТВИН-60 (Селиванова и др., 2014). В качестве маркерных ферментов для контроля уровня загрязнения использовали сукцинатдегидрогеназу, алкогольдегидрогеназу, а также концентрацию хлорофилла.
Изоформы малик-энзимов идентифицировали в 7%-ном полиакриламидном геле (Mayer et al., 2015). Разделение исследуемых белков проводили в основной буферной системе (рН 8.3). Электрофорез белков осуществляли при температуре 2–4°С. Подавали постоянный электрический ток 1.5–2.5 мА на один карман пластинки геля (Гааль и др., 1982). Специфическое проявление малатдегидрогеназы осуществляли тетразолиевым методом. Для повышения специфичности метода и сведения до минимума возможности проявления оксидоредуцирующих малатдегидрогеназ гели проявляли при более низких значениях рН (рН 5.5 для НАД+-малик-энзима и 6.5 НАДФ+-малик-энзима). Гель инкубировали в темноте при 37°С в среде, содержащей 100 мМ Hepes-буфер; 2 мМ раствор малата натрия; 18 мг НАД+; 10 мг НСТ (предварительно растворенный в 0.5 мл этиленгликоля) и 0.6 мг ФМС.
Общую активность МЭ определяли в гомогенате по скорости окисления НАД(Ф)Н при 340 нм. Масса навески составляла 0.1 г листьев кукурузы. Среда спектрофотометрирования содержала 100 мМ Hepes-HCl, рН 6.5 для НАД+-малик-энзима и 7.0 для НАДФ+-малик-энзима; 1.5 мМ пируват, 0.15 мМ НАД(Ф)Н; 5 мМ MnCl2. Соотношение навески к среде спектрофотометрирования при гомогенизации составляло 1 : 10. Ферментативной единицей активности фермента считали количество энзима, которое превращало (обратная реакция) или образовывало (прямая реакция) 1 мкмоль НАД(Ф)Н за 1 мин при 25°С.
РНК из растений выделяли методом фенол-хлороформной экстракции (Chomczynski et al., 1987).
Обратную транскрипцию мРНК проводили с использованием обратной транскриптазы M-MuLV (“Евроген”, Россия). Подбор праймеров осуществляли на основе нуклеотидных последовательностей из GenBank, с помощью программы Primer-BLAST (табл. 1). Полимеразную цепную реакцию в реальном времени проводили на приборе LightCycler96 (“Roche”, Швеция) с красителем SybrGreen I (“Евроген”). Количество матрицы контролировали с помощью параллельной амплификации фактора элонгации ef-1α (Nicot et al., 2005). В качестве отрицательного контроля использовали суммарную РНК без этапа обратной транскрипции. Относительный уровень экспрессии исследуемых генов определяли с применением 2–ΔΔCt-метода (Livak, Schmittgen, 2001).
Таблица 1.
Специфические праймеры к генам декарбоксилирующей малатдегидрогеназы
| Ген | Прямой | Обратный |
|---|---|---|
| nad-me1 | TGGGATTGGTTTAGGTGCC | GGTTCCCGTGGCAGTATGAA |
| nad-me2 | TTTTAGGAGCTGTACGGGCA | CTCCTCGCACTCTCAAAAGC |
| nadf-me: | GCAAGAAGGTTTGGCTGGTG | GGTGAAGGGTGGGAAGATGG |
ДНК выделяли с помощью набора ПРОБА – ГС (“ДНК-Tехнология”, Россия) согласно рекомендациям производителя. Для исследования изменения статуса метилирования CpG-динуклеотидов промоторов генов nad-me1, nad-me2, nadf-me, кодирующих декарбоксилирующие малатдегидрогеназы, была проведена модификация образцов ДНК (Hsieh, 1999).
Анализ промоторов исследуемых генов на наличие CpG-островков и подбор праймеров для МС-ПЦР осуществляли с помощью программы MethPrimer. Последовательности праймеров для проведения МС-ПЦР представлены в табл. 2.
Таблица 2.
Праймеры к генам декарбоксилирующих малатдегидрогеназ для метилспецифичной ПЦР
| Ген | Название | Последовательность | |
|---|---|---|---|
| nad-me1 | I | Прямой М | TATTTTTTTTTTGATTTAATCGG |
| Обратный М | TACCACGAATCGTAAAAAATATCGTT | ||
| Прямой U | TATTTTTTTTTTGATTTAATTGG | ||
| Обратный U | TACCACAAATCATAAAAAATATCA | ||
| II | Прямой М | TTTTATTTTTTTGTTTTTATCGC | |
| Обратный М | TACCACGAATCGTAAAAAATATCGTT | ||
| Прямой U | TTTTATTTTTTTGTTTTTATTGC | ||
| Обратный U | TACCACAAATCATAAAAAATATCA | ||
| III | Прямой М | TTAGGAGTTAGGGGTTTCGG | |
| Обратный М | TACCACGAATCGTAAAAAATATCGTT | ||
| Прямой U | TTAGGAGTTAGGGGTTTTGG | ||
| Обратный U | TACCACAAATCATAAAAAATATCA | ||
| nad-me2 | I | Прямой | GTTTTTGATCGTTTTTTGTTTTAGC |
| Обратный М | ACTAACAACTAACTACCTAC | ||
| Прямой U | TGTTTTTGATTGTTTTTTGTTTTAGT | ||
| Обратный U | ACTAACAACTAACTACCTAC | ||
| II | Прямой М | TTTTTTTTTTATAAATAAATCG | |
| Обратный М | ACTAACAACTAACTACCTAC | ||
| Прямой U | TTTTTTTTTTATAAATAAATTG | ||
| Обратный U | ACTAACAACTAACTACCTAC | ||
| III | Прямой М | AGTGTATAAAGTAGTAGAACG | |
| Обратный М | ACTAACAACTAACTACCTAC | ||
| Прямой U | AGTGTATAAAGTAGTAGAATG | ||
| Обратный U | ACTAACAACTAACTACCTAC | ||
| nadf-me | I | Прямой М | TAGAGAGTCGAAAGTATTCGATACG |
| Обратный М | CAAACAAAAACAACTTAAAAACGAT | ||
| Прямой U | AAAATAGAGAGTTGAAAGTATTTGATATGG | ||
| Обратный U | CAAACAAAAACAACTTAAAAACAAT | ||
| II | Прямой М | TAAATAAAAAAATAGAGAGTCG | |
| Обратный М | CAAACAAAAACAACTTAAAAACGAT | ||
| Прямой U | TAAATAAAAAAATAGAGAGTAG | ||
| Обратный U | CAAACAAAAACAACTTAAAAACAAT | ||
| III | Прямой М | GAGATAAAAAGGTTTAGTTCG | |
| Обратный М | CAAACAAAAACAACTTAAAAACGAT | ||
| Прямой U | GAGATAAAAAGGTTTAGTTAG | ||
| Обратный U | CAAACAAAAACAACTTAAAAACAAT | ||
Опыты проводили в 3–4-кратной повторности, аналитические определения для каждой пробы осуществляли в трех повторностях. Предварительная оценка характера распределения проводилась по асимметрии и эксцессу (Excel, Microsoft Office). Полученные значения позволили оценить характер распределения как нормальный. Критерий Стьюдента использовался с применением поправки на множественные сравнения (поправка Бонферрони) (Лакин, 1990). Дополнительно применяли однофакторный дисперсионный анализ ANOVA, который показал, что исследуемый в работе фактор действительно оказывал влияние (влияние фактора достоверно при p < 0.05).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В листьях кукурузы активность малик-энзимов обнаружена преимущественно в митохондриях для НАД+-МЭ и в хлоропластах для НАДФ+-зависимой декарбоксилирующей малатдегидрогеназы. С помощью дифференциального центрифугирования были получены исследуемые фракции митохондрий и хлоропластов и определена их степень перекрестного загрязнения по маркерным ферментам, которая составляла не более 3–8%. Анализ полученных данных свидетельствует о преимущественной локализации изучаемых энзимов в митохондриях (НАД-малик-энзим, 88%) и в хлоропластах (НАДФ-малик-энзим, 91%) (табл. 3).
Таблица 3.
Распределение общей активности малик-энзимов по локализации
| Локализация | НАД-МЭ | НАДФ-МЭ | ||
|---|---|---|---|---|
| общая активность E/г сырой массы | % активности фермента от общего содержания | общая активность E/г сырой массы | % активности фермента от общего содержания | |
| Митохондрии | 13.7 ± 0.07 | 88 | 0 | 0 |
| Хлоропласты | 0 | 0 | 15.6 ± 0.08 | 91 |
| Цитоплазма | 1.9 ± 0.01 | 12 | 1.5 ± 0.008 | 9 |
Исследование изоферментного состава декарбоксилирующих малатдегидрогеназ было проведено в полиакриламидном геле. НАД+-зависимый малик-энзим в листьях кукурузы был представлен двумя изоферментами: первая изоформа характеризуется относительной электрофоретической подвижностью 0.44, а вторая – 0.49. Для НАДФ+-малик-энзима была обнаружена одна форма энзима с Rf = 0.1 (рис. 1, 2). Следует обратить внимание, что изоферментный состав декарбоксилирующих малатдегидрогеназ в листьях кукурузы являлся постоянным и не менялся в стрессовых условиях, вызванных засолением.
Рис. 1.
Электрофореграмма НАД+-МЭ из митохондриальной фракции листьев кукурузы в нормальных условиях (а) и в условиях солевого стресса (б) F – линия фронта, P1 и P2 – искомые белки.
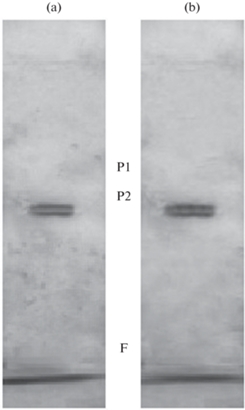
Рис. 2.
Электрофоретическая подвижность НАДФ+-МЭ из хлоропластов листьев кукурузы в нормальных условиях (а) и в условиях солевого стресса (б). F – линия фронта, P – искомый белок.

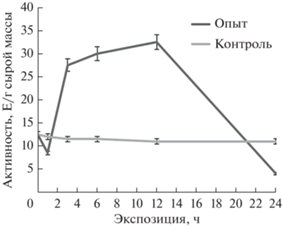
В условиях засоления активность НАД+-МЭ в кукурузе снижалась в течение первого часа, но затем возрастала и достигала максимального значения к 12 ч (рис. 3). Повышение активности изучаемого малик-энзима может указывать на его важное значение в перестройке клеточного метаболизма, обусловленного интенсификацией окислительных реакций в митохондриях (Davies, 1979).
Ранее в наших работах была показана роль ключевых ферментов цикла трикарбоновых кислот в осуществлении адаптивной реакции клеточного метаболизма к стрессовым условиям и, в частности, к засолению. Так, цитратсинтаза, аконитатгидратаза и сукцинатдегидрогеназа резко увеличивали свою активность, что обеспечивало интенсификацию работы центрального звена энергетического обмена (Eprintsev et al., 2017, 2018, 2020a). Следовательно, если учитывать митохондриальную локализацию НАД+-зависимого малик-энзима, то можно предполагать его участие в регуляции этого метаболического пути.
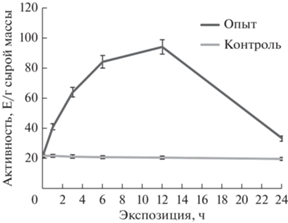
Динамика активности НАДФ+-зависимой декарбоксилирующей малатдегидрогеназы в условиях солевого стресса имела куполообразную форму с максимумом на 12 ч экспозиции. Активность фермента возрастала более, чем в 4.5 раза в растениях, находящихся в условиях солевого стресса. Следует отметить, что величина активности оставалась высокой длительный промежуток времени и снижалась только к 24 ч экспозиции (рис. 4).
Регуляция скорости ферментативной реакции в стрессовых условиях может осуществляться посредством конформационных трансформаций белковой молекулы, либо изменением экспрессии генов, кодирующих данные ферменты. Проведенный поиск нуклеотидных последовательностей в базе данных GenBank для декарбоксилирующих МДГ показал, что НАД+-зависимые малик-энзимы представлены двумя изоферментами, кодируемыми ядерными генами. Ген НАД+-МЭ 1 расположен в хромосоме 5 (Gene ID: 100501486), имеет длину 6148 нуклеотидов и содержит в своем составе 19 экзонов. Ген НАД+-МЭ 2 расположен в хромосоме 5 (Gene ID: 100191942), имеет длину 9231 нуклеотид и содержит в своем составе 18 экзонов (Eprintsev et al., 2020b).
НАДФ+-зависимый малик-энзим имеет в геноме кукурузы не менее 6 генов и 4 псевдогенов. Однако, для листьев кукурузы характерна только одна экспрессирующая хлоропластная форма гена, расположенного в хромосоме 3 (nadf-me, Gene ID: 542233), который имеет в составе 4925 нуклеотидов и содержит 20 экзонов.
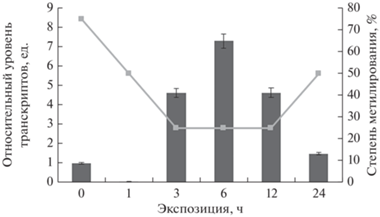
Проведенный анализ уровня транскриптов генов, кодирующих исследуемые энзимы, выявил корреляцию с изменениями их ферментативной активности. Однако в варианте НАД+-зависимого малик-энзима наблюдалось, по-видимому, характерное разделение этапов адаптации. Наибольший вклад в общую активность декарбоксилирующих малатдегидрогеназ, вероятно, вносил изофермент малик-энзима 2, который кодируется геном nad-me2. Было установлено, что экспрессия этого гена, кодирующего данную изоформу, к 6 часу экспозиции увеличивается более, чем в 7 раз, в то время как увеличение экспрессии гена nad-me1 было выражено в меньшей степени. При этом возрастание составляло 1.7 раза по сравнению с контролем (рис. 5). Стоит также отметить, что для первой изоформы (МЭ1) было характерно увеличение экспрессии в первый час солевого стресса. Анализ полученных данных позволяет заключить, что изменение функционирования генов является одним из факторов регуляции активности НАД-малик-энзимов. Ранее было показано, что регуляция функционирования ключевых ферментов цикла Кребса в растениях, культивируемых в условиях солевого стресса, осуществлялась с помощью регуляции экспрессии генов исследуемых ферментов (Епринцев и др., 2021). Сообщается, что их активность коррелирует с так называемой индукцией “солевого дыхания”.
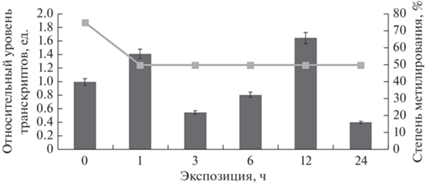
Рис. 5.
Экспрессия nad-mе1 в листьях кукурузы в условиях засоления и степень метилирования CpG-островков.
Исследование нуклеотидной последовательности промоторов генов, кодирующих малик-энзимы, показало, что в их составе содержатся CpG-островки. В составе промотора гена nad-me1 и nadf-me обнаружено по 2 островка размером 291 и 134 п.н. для НАД+-зависимого фермента и 142 и 430 для НАДФ+-зависимого. В промоторах генов nad-me2 обнаружен один островок размером 312 нуклеотидов.
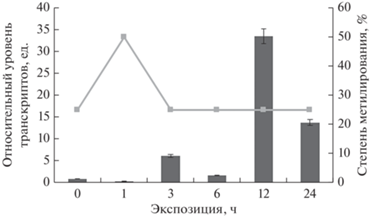
Наличие CpG-островков в промоторной области может говорить о возможном механизме регуляции интенсивности экспрессии исследуемых генов посредством изменения степени метилирования цитозинов в промоторах (Ступак, Вафина, 2021). Анализ полученных данных свидетельствует, что обнаружена обратная корреляция между экспрессией гена nad-me2 и величиной метильного статуса цитозина CpG-островков промотора (рис. 6). Так, при повышении уровня относительных транскриптов с 3 по 12 ч экспозиции кукурузы в условиях солевого стресса степень метилирования промотора снизилась до 25%, что, по-нашему мнению, служило механизмом активации экспрессии гена nad-me2. Такое увеличение активности nad-me2 приводило к интенсификации цикла трикарбоновых кислот, утилизирующего пируват через ацетил КоА (Igamberdiev, Bykova, 2018). Как видно из результатов, приведенных на рис. 5 и 6, для регуляции экспрессии генов nad-me1 и nadf-me (рис. 7) статус метилирования промоторов этих генов не имеет значения. По-видимому, уровень концентрации транскриптов исследуемых генов определяется другими механизмами регуляции.
ЗАКЛЮЧЕНИЕ
Увеличение активности малик-энзима 1 в условиях засоления, по-видимому, необходимо клеточному метаболизму растения для поддержания равновесного уровня рН в митохондриях. Увеличение активности НАДФ+-зависимой декарбоксилирующей МДГ в условиях солевого стресса позволяет этому энзиму участвовать в компенсации ингибирования цикла Кальвина и таким образом избегать большого количества восстанавливающих эквивалентов, поставляя их для НАДФ+-галактозо-1-дегидрогеназы и рибоза-1-дегидрогеназы. Кроме того, принимать участие в обеспечении снижения интенсивности путей аскорбата-глутатиона и ослаблять повышенный синтез осмолитов, в частности, пролина.
Таким образом, в условиях солевого стресса изоферменты малик-энзимов могут участвовать в осуществлении адаптивных реакций, в основном, за счет продуцирования малата (МЭ2) или окислительно-восстановительных эквивалентов (МЭ1). Интересно отметить, что экспрессия гена nad-me2, сильно возрастающая при засолении, регулируется эпигенетическим механизмом, т.е. наблюдается обратно-пропорциональная зависимость между интенсивностью экспрессии и величиной статуса метилирования CpG-островков промотора гена. Эпигенетический способ регуляции nad-me1 и nadf-me не обнаружен, что позволяет предположить другие молекулярные механизмы увеличения их экспрессии и активности соответствующих ферментов.
Cоблюдение этических стандартов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов.
Конфликт интересов. Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Гааль Э., Медьеши Г., Верецкеи Л. Электрофорез в разделении биологических макромолекул. М.: Мир, 1982. 446 с.
Епринцев А.Т., Гатауллина М.О. Кинетические свойства НАДФ+-зависимой декарбоксилирующей малатдегидрогеназы из листьев кукурузы // Прикладная биохимия и микробиология. 2021. Т. 57. № 1. С. 54–58.
Епринцев А.Т., Федорин Д.Н., Анохина Г.Б., Гатауллина М.О. Роль эпигенетических механизмов в регуляции активности 2-ОГДГ и МДГ в листьях кукурузы (Zea mays L.) при гипоксии //Физиология растений. 2021. Т. 68. № 2. С. 187–193.
Лакин Г.Ф. Биометрия. М.: Высш. шк. 1990. 351 с.
Полевой В.В. Физиология растений. Москва: Высшая школа. 1989. 464 с.
Селиванова Н.В., Федорин Д.Н., Епринцев А.Т. Биохимические методы исследования ферментов глиоксилатного цикла и ЦТК. Изд. дом Воронежского гос. унив-та 2014. 40 с.
Ступак Е.Э., Вафина Г.Х. Метилирование ДНК в зародышах и проростках растений // Экобиотех. 2021. Т. 4. № 1. С. 1–5.
Aceituno F.F., Moseyko N., Rhee S.Y., Gutiérrez R.A. The rules of gene expression in plants: organ identity and gene body methylation are key factors for regulation of gene expression in Arabidopsis thaliana // BMC genomics. 2008. V. 9. № 1. P. 1–14.
Badia M.B., Mans R., Lis A.V., Tronconi M.A., Arias C.L., Maurino V.G., Andreo C.S., Drincovich M.F., Maris A.J.A., Gerrard Wheeler M.C. Specific Arabidopsis thaliana malic enzyme isoforms can provide anaplerotic pyruvate carboxylation function in Saccharomyces cerevisiae // FEBS J. 2017. V. 284. № 4. P. 654–665.
Chen Q., Wang B., Ding H., Zhang J., Li S. The role of NADP-malic enzyme in plants under stress // Plant Sci. 2019. V. 281. P. 206–212.
Chomczynski P., Sacchi N. Single-step method of RNA isolation by acid guanidiniumthiocyanate-phenol-chloroform extraction // Anal. Biochem. 1987. V. 162. P. 156–159.
Davies D.D. The. central role of phosphoenolpyruvate in plant metabolism // Ann. Rev. Plant Physiol. 1979. V. 30. № 1. P. 131–158.
Emami P., Razi H., Dastfal M. Effect of salt stress on NADP-Malic enzyme activity, proline and ionic contents of durum wheat genotypes // Biol. Forum – An Intern. J. 2016. V. 8. № 2. P. 112–119.
Eprintsev A.T., Fedorin D.N., Dobychina M.A., Igamberdiev A.U. Expression and promoter methylation of succinate dehydrogenase and fumarase genes in maize under anoxic conditions // J. Plant Physiol. 2017. V. 216. P. 197–201.
Eprintsev A.T. Fedorin D.N., Dobychina M.A., Igamberdiev A.U. Regulation of expression of the mitochondrial and peroxisomal forms of citrate synthase in maize during germination and in response to light // Plant Science. 2018. V. 272. P. 157–163.
Eprintsev A.T., Fedorin D.N., Cherkasskikh M.V., Igamberdiev A.U. Regulation of expression of the mitochondrial and cytosolic forms of aconitase in maize leaves via phytochrome // Plant Physiol. Biochem. 2020a. V. 146. P. 157–162.
Eprintsev A.T., Fedorin D.N., Gataullina M.O., Igamberdiev A.U. Two forms of NAD-malic enzyme in maize leaves are regulated by light in opposite ways via promoter methylation // J. Plant Physiology. 2020b. V. 251. P. 153–193.
Eprintsev A.T., Fedorin D.N., Cherkasskikh M.V., Igamberdiev A.U. Effect of salt stress on the expression and promoter methylation of the genes encoding the mitochondrial and cytosolic forms of aconitase and fumarase in maize // Intern. J. Mol. Sci. 2021.
Hill S., Winning, B., Jenner H., Knorpp C., Leaver C. Role of NAD+-dependent ‘malic’enzyme and pyruvate dehydrogenase complex in leaf metabolism // Biochem. Soc. Transactions. 1996. V. 24. № 3. P. 743–746.
Hsieh C.L. Evidence that protein binding specifies sites of DNA demethylation // Mol. Cell Biol. 1999. V. 19. P. 46–56.
Igamberdiev A.U., Bykova N.V. Role of organic acids in the integration of cellular redox metabolism and mediation of redox signalling in photosynthetic tissues of higher plants // Free Rad. Biol. Med. 2018. V. 122. P. 74–85.
Igamberdiev A.U., Eprintsev A.T. Organic acids: the pools of fixed carbon involved in redox regulation and energy balance in higher plants // Frontiers in Plant Science. 2016. V. 7. P. 1042.
Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using real-time quantitative PCR and the 2–ΔΔCt method // Methods. 2001. V. 25. P. 402–408.
Mayer B.F., Ali-Benali M.A., Demone J., Bertrand A., Charron J.B. Cold acclimation induces distinctive changes in the chromatin state and transcript levels of COR genes in Cannabis sativa varieties with contrasting cold acclimation capacities // Physiologia Plantarum. 2015. V. 155. № 3. P. 281–295.
Nicot N., Hausman J.F., Hoffmann L., Evers D. Housekeeping gene selection for real-time RT-PCR normalization in potato during biotic and abiotic stress // J. Exp. Bot. 2005. V. 56. P. 2907–2914.
Sun X., Han G., Meng Z., Lin L., Sui N. Roles of malic enzymes in plant development and stress responses // Plant signaling and behavior. 2019. V. 14. № 10. P. e1644596.
Weimberg R. Effect of sodium chloride on the activity of a soluble malate dehydrogenase from pea seeds // J. Biological Chemistry. 1967. V. 242. № 12. P. 3000–3006.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая